| Скачать .docx | Скачать .pdf |
Реферат: Влияние производных тормозных аминокислот на рецепторную функцию двенадцатиперстой кишки
УДК 612.386
Влияние производных тормозных аминокислот на рецепторную функцию двенадцатиперстой кишки
К.М. Люзина, А.Г.Чумак
Белорусский государственный университет, Минск, Беларусь
ГНУ «Институт физиологии НАН Беларуси», Минск, Беларусь
Введение
Известно, что в инициации рефлекторно вызываемой тошноты у человека и животных лежит раздражение волокон блуждающего нерва, локализованных в слизистой оболочке органов верхних отделов желудочно-кишечного тракта [1]. Эти волокна укомплектованы рецепторами, обладающими механо- и хемочувствительностью. Она не является постоянной величиной и может меняться в зависимости от текущего состояния органа. Процессы рецепции в кишке регулируются разнообразными механизмами, до конца еще не установленными.
Сенситизация или десенситизация рецепторов может происходить и при действии лекарственных препаратов, в том числе обладающих ноотропной активностью. Как указывается в руководствах по фармакологии, они относятся к группе очень востребованных лекарственных средств в неврологии и психиатрии, а также используются в других сферах амбулаторной и госпитальной фармакотерапии [2,3]. Их назначают и практически здоровым лицам для профилактики некоторых состояний, например, тошноты при укачивании. Фенибут, являющийся по химической структуре фенильным производным гамма-аминомасляной кислоты (ГАМК), относится к указанной группе лекарственных средств [4].
По мнению некоторых авторов, ГАМК-ергические процессы играют весомую роль среди прочих медиаторов в интрамуральной нервной системе кишечника [5-7]. Эти данные позволяют предполагать, что препараты с ГАМК-ергическим механизмом действия могут оказывать действие на процессы, протекающие в кишке. Целью настоящей работы явился анализ действия фенибута на рецепторную функцию кишки.
Методы исследования
Эксперименты выполнены в острых опытах на наркотизированных (30 мг/кг нембутала и 500 мг/кг уретана, внутрибрюшинно) крысах массой 240 – 350 г с применением подходов и принципов, предусмотренных представлениями о гуманном отношении к лабораторным животным [8]. Регистрирующие биполярные подвесные электроды из хлорированного серебра располагались на перерезанных и взятых на лигатуры вентральных поддиафрагмальных ветвях блуждающего нерва или филаментах брыжеечного нерва, отходящего от двенадцатиперстной кишки. Раствор фенибута РУП «Белмедпрепараты» готовили на 0,9%-ном NaCl, вводили в полость двенадцатиперстной кишки (10 мг/0,5 мл). Контролем служил раствор NaCl (0,9 %-ный), вводимый в соответствующем объеме вместо тестируемых растворов.
Регистрация и обработка электрических сигналов выполнялись на компьютеризированной электрофизиологической установке с использованием программы, разработанной в Институте физиологии НАН Беларуси [9]. Для оценки достоверности обнаруженных эффектов применен парный t -критерий сравнения средних Стьюдента. В иллюстрациях разброс данных указан как среднее квадратичное отклонение.
Результаты и обсуждение
В опытах первой серии было установлено, что инъекция в двенадцатиперстную кишку раствора фенибута в дозе 10 мг/0,5 мл регулярно сопровождалась достоверным понижением частоты афферентных импульсов в блуждающем нерве (рис. 1, 2).

Рис. 1. Действие фенибута (10 мг/0,5 мл внутрикишечно) и ГАМК (10 мг/0,5 мл) на активность афферентных волокон блуждающего нерва. p <0,05. n =9
Минимум частоты импульсации зарегистрирован на 15-20-й минуте после введения, он составил 12,26±3,41 имп/с, при фоновом значении 25,38±1,03 имп/с. После достижения минимума регистрируемая активность сохранялась на низком уровне до 35-й минуты наблюдения.

Рис. 2. Изменение частоты тонической импульсации n . vagus (1, 2) и n . mesentericus (3, 4) до (1, 3) и после (2, 4) внутрикишечного введения фенибута 10 мг/0,5 мл.
Аналогичные по направленности реакции получены при регистрации импульсации в брыжеечном нерве (рис. 1, 2). Отмечен ее минимум на 15-20-й минуте. Реакция на введение раствора фенибута составила 13,48±4,52 имп/с (фон 31,88±1,13 ипм/с).
Таким образом, в опытах было установлено тормозное влияние фенибута на тоническую импульсацию афферентных волокон кишки, следующих в блуждающих и брыжеечных нервах.
В фармакологических справочниках указывается, что фенибут хорошо всасывается в желудочно-кишечном тракте, поступает в системный кровоток, затем разлагается в печени и выводится системой выделения. Пик концентрации в крови наблюдается через 1-2 часа Период полувыведения составляет 18-21 ч [4]. Высокая скорость всасывания фенибута при пероральном введении связана, как полагают, с высокой степенью его липофильности. Действие препарата на афферентные окончания блуждающего нерва наступает быстро (не более 5 мин) после проникновения его во внутреннюю среду из просвета кишки. Инфузия в люминальное пространство кишки раствора нативной ГАМК сопровождалось полностью идентичными эффектами. Так, частота импульсации в афферентных волокнах вагуса, державшаяся до воздействия аминокислоты на уровне 24,9±0,8 имп/с, после начала действя ГАМК в подслизистом пространстве кишки снизилась до 20,2±1,7 имп/с, p <0,05, n =5. Длительность эффекта составила 80 мин. Приведенные данные не противоречат сведениям из литературы, согласно которым тормозные аминокислоты оказывают влияние на активность центральных и периферических нервных клеток, являющихся афферентными [10], если принять во внимание, что фенибут является естественным агонистом рецепторов ГАМК.
Было обнаружено снижение амплитуды медленноволновой составляющей основного электрического ритма (рис. 3), увеличение частоты пиковых потенциалов гладких мышц после внутрикишечного введения фенибута.
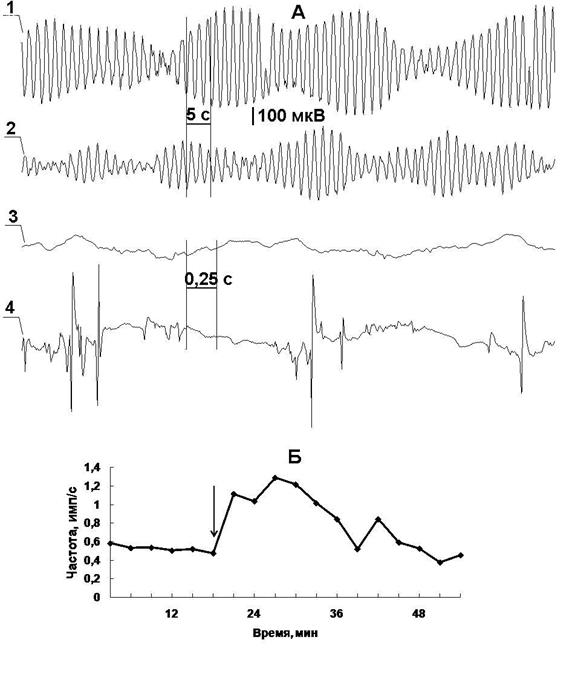
Рис. 3. Действие фенибута (10 мг/0,5 мл) на электрическую активность двенадцатиперстной кишки. А – основной электрический ритм до (1) и после (2) инъекции препарата, 3 и 4 соответственно потенциалы действия двенадцатиперстной кишки до и через 5 минут после инфузии фенибута. Б – график изменений частоты быстрых потенциалов после введения препарата.
Изменения по амплитуде составили 580±60 маш. ед., при фоновом значении 820±40 маш. ед. Динамика изменений электрической активности кишки совпадала по времени с эффектами, наблюдаемыми в нервных проводниках. Однако на фоне роста быстроволновой компоненты электромиограммы центростремительная сигнализация в вагусе оказывалась уменьшенной. Усиление сократительной активности, о чем свидетельствует рост частоты пиковых потенциалов, не сопровождалось, как это бывает в интактных условиях, подъемом рецепторной активности.
Известно, что суммарные быстрые пиковые потенциалы гладких мышц кишки отражают процессы сокращения гладких мышц кишечника. Усиление сократительной активности кишки вызывает возбуждение кишечных механорецепторов [11,12]. На основании того факта, что центростремительная сигнализация от кишки после применения фенибута оказалась сниженной, несмотря на усиление моторики, можно сделать вывод о десенситизации механорецепторов тонкой кишки в созданных экспериментальных условиях.
Выводы
Полученные в работе данные могут служить аргументом в пользу представления о том, что искусственный агонист ГАМК рецепторов, фенибут, оказывает выраженное действие на рецепторную функцию тонкой кишки. Это действие опосредуется, по всей вероятности, интрамуральными нейронными сетями (поскольку меняется электрическая активность гладких мышц кишки), а также рецепторами вагусных и брыжеечных афферентных проводников.
Список литературы
1. Солтанов В.В. Механизмы саморегуляции вегетативных функций в норме и патологии. Мн.: Наука и техника, 1994.
2. Lapin I. // CNS Drug Rev. 2001. Vol. 7. №4. P. 471-481.
3. Ziablintseva EA, Pavlova IV. // Ross Fiziol Zh Im I M Sechenova. 2009. Vol. 95. №9. P. 907-918.
4. Трухачева Т.В. Лекарственные средства РУП «Белмедпрепараты» (3-е справочное издание). Минск. 2007. С. 466-467.
5. Fletcher EL, Clark MJ, Furness JB. // Cell Tissue Res. 2002. Vol. 308. №3. P. 339-346.
6. Zizzo MG, Mulè F, Serio R. // Neuropharmacology. 2007. Vol. 52. №8. P. 1685-1690.
7. Люзина К.М. // Новости мед.-биол. Наук. 2010. Том 1. № 1. С. 13-17.
8. Руткевич С.А. Шухно Т.П. // Сборник трудов научно-практического семинара «Гуманное обучение специалистов медико-биологического профиля». Минск. 2006. С.76–77.
9. Солтанов В.В., Бурко В.Е.// Новости медико-биологических наук. 2005. №1. С.90-96.
10. Saitou S, Tanaka K, Inoue S, Takamura Y, Niijima A. // Neurosci Lett. 1993. Vol. 149. №1. P. 12-14.
11. Сергеев В. А., Солтанов В. В. // Новости медико-биологических наук. 2008. № 1-2. С. 46-49.
12. Солтанов В. В. Механизмы саморегуляции вегетативных функций. Мн.: Наука и техника, 1989. 272 с.
УДК 612.386
Люзина К.М. Влияние производных тормозных аминокислот на рецепторную функцию двенадцатиперстой кишки // Труды Белорусского государственного университета. Серия «Физиологические, биохимические и молекулярные основы функционирования биосистем». – 2010.
Крысам внутрикишечно вводили фенибут и регистрировали кишечную активность и афферентную импульсацию в ветвях n. vagus, n. mesentericus. При действии фенибута на кишечную стенку повышалась электрическая активность кишки и снижалась центростремительная импульсация в нервах. Сделан вывод о значимости ГАМК-ергических механизмов для реализации рецепторной функции кишки.
Ил. 3. Библиограф. – 12.
Summary
Phenibut effect on the receptor function of the duodenum
K.M. Liuzina
Belarusian State University, Minsk, Belarus
The Insti tute of Philosophy National Academy of Sciences of Belarus
n.vagus, n.mesentericus afferent fibers impuls activity and electrical activity of the intestine before and after phenibut infusion in intestine were examined by electrophysiological techinque.
GABA agonist injection into duodenum resulted in afferent fibers impuls activity decrease and contractile activity of the intestine increase. The findings suggest about phenibut effects on enteric mechanoreceptors.
Key words: phenibut, intestinal infusion, impulse activity, n. vagus, n.mesentericus .