| Скачать .docx | Скачать .pdf |
Дипломная работа: Свободно-радикальные процессы при экспериментальной ишемии головного мозга
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Пензенский государственный педагогический университет
имени В. Г. Белинского
Факультет Кафедра
| Естественно-географический | Биохимии |
ДИПЛОМНАЯ РАБОТА НА ТЕМУ:
Свободно-радикальные процессы
при экспериментальной ишемии головного мозга
Студент________________________________________Заварзина В. А.
Руководитель___________________________________Фирстова Н. В.
____________________Левашова О. А.
К защите допустить. Протокол № от «_____» ____________2008 г.
Зав. кафедрой ____________________________________Генгин М. Т.
Пенза, 2008 год
СОДЕРЖАНИЕ
СПИСОК СОКРАЩЕНИЙ
ВВЕДЕНИЕ
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ
1.1. Этиология и патогенез ишемии мозга
1.2. Свободно-радикальное окисление и антиоксидантная защита при патологии головного мозга
1.2.1.Свободно-радикальное окисление: общие сведения
1.2.2.Продукты перекисного окисления липидов(диеновые коньюгаты, ТБК-реактанты, шиффовы основания)
1.2.3.Процессы свободно-радикального окисления липидов в развитии и течении острых нарушений мозгового кровообращения
1.2.3.1. Малоновый диальдегид (МДА) как интегральный показатель процессов свободно-радикального окисления
1.2.3.2. Биохемилюминесценция как метод оценки состояния свободно-радикальных процессов при ишемическом инсульте мозга
1.2.4.Антиоксидантная система: контроль за процессами перекисного окисления липидов при ишемии мозга
1.3. Модели ишемии
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ
2.1. Материалы исследования
2.2. Методы исследования
2.2.1. Моделирование неполной ишемии у крыс
2.2.2. Метод определения концентрации малонового диальдегида в сыворотке крови
2.2.3. Метод люминолзависимой хемилюминисценции в цельной крови
2.3. Статистическая обработка результатов исследования
ГЛАВА 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
3.1. Свободнорадикальные процессы при ишемическом инсульте
3.2. Исследование активности хемилюминесценции цельной крови и концентрации МДА в сыворотке крови при экспериментальной ишемии головного мозга
3.2.1 Показатели свободнорадикального окисления при моделировании ишемии головного мозга
3.2.1.1. Исследование динамики ТБК-активных продуктов при моделировании ишемии головного мозга
3.2.1.2. Исследование динамики показателей хемилюминесценции при моделировании ишемии
ГЛАВА 4. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ
ВЫВОДЫ
ЛИТЕРАТУРА
ПРИЛОЖЕНИЕ
СПИСОК СОКРАЩЕНИЙ
АО – антиоксидантная система
АОЗ – антиоксидантная защита
АФК – активные формы кислорода
ДК – диеновые конъюгаты
DAG – диацилглицерол
ЛХЛМ – люминолзависимая хемилюминесценция
МДА – малоновый диальдегид
НК – нуклеиновые кислоты
ОНМК – острая недостаточность (нарушения) мозгового кровообращения
ПОЛ – перекисное окисление липидов
СМА – средняя мозговая артерия
СОД – супероксиддисмутаза
СР – свободные радикалы
СРБ – С-реактивный белок
СРО – свободно-радикальное окисление
ТБК – тиобарбитуровая кислота
ХМЛ – хемилюминесценция
ВВЕДЕНИЕ
В последние годы новейшие достижения в биохимии создали необходимые предпосылки для успеха в смежных областях и в первую очередь в медицине. В этой связи неизмеримо возросло значение патологической биохимии как отрасли науки, изучающей молекулярные основы различных форм болезней.
К наиболее распространенным заболеваниям зрелого‚ пожилого, а в последние десятилетия и молодого возраста относятся острые нарушения мозгового кровообращения (ОНМК). Летальность в острый период инсульта достигает 35 %, увеличиваясь почти на 15 % к концу первого года заболевания. Соотношение геморрагических и ишемических нарушений мозгового кровообращения составляет 1:4-5. Риск повторного инсульта оценивается в 8-20 %. Постинсультная инвалидизация занимает первое место среди всех возможных причин утраты трудоспособности, к прежней работе возвращаются лишь около 20 % лиц, перенесших инсульт, при этом одна треть больных - люди социально активного возраста [52]. В последние десять лет в России ежегодно регистрируется около 400000 инсультов, из них чаще (70-80 %) встречаются ишемические инсульты, более редко (20-30 % и 5 % соответственно) кровоизлияние в мозг и субарахноидальное кровоизлияние [19]. Исследования последних лет доказали, что гибель нервной ткани при ишемии происходит в результате каскада патобиохимических и патофизиологических процессов [20, 21].
Активация свободнорадикальных процессов при ишемии мозга приводит к развитию оксидантного стресса, являющегося одним из универсальных механизмов повреждения тканей. В связи с этим представляет интерес исследование процессов свободнорадикального окисления (СРО) в крови.
Современным методом для изучения интенсивности свободно-радикальных процессов, в частности перекисного окисления липидов (ПОЛ) является регистрация индуцированной биохемилюминесценции биологических объектов. Этот метод применяется для диагностики нарушений липидного обмена, воспалительных, инфекционных и онкологических заболеваний. В клинических условиях хемилюминесцентный показатель может быть применен для определения остроты процесса, степени тяжести по динамике значений хемилюминесценции.
Интенсивность процессов ПОЛ может быть‚ в частности‚ исследована при определении количества образующегося при физиологических и патологических процессах вторичного продукта ПОЛ – малонового диальдегида [57]. Увеличение концентрации малонового диальдегида является свидетельством усиления ПОЛ и срыва антиоксидантной защиты [2].
Известно, что решению медико-социальных проблем, возникающих в связи с распространенностью инсульта, способствует изучение механизмов заболевания на различных экспериментальных моделях [65].
Целью нашей работы было исследование процессов свободно-радикального окисления в цельной кровии сыворотке на экспериментальной модели неполной ишемии головного мозга крыс.
При выполнении данной работы были поставлены следующие задачи:
1. Провести исследование концентрации ТБК-АП (МДА) в сыворотке крови при окклюзионном повреждении мозга в динамике экспериментальной острой ишемии мозга (модель неполной ишемии).
2. Провести исследование концентрации ТБК-АП (МДА) в сыворотке крови при реперфузионном повреждении мозга в динамике экспериментальной острой ишемии мозга (модель неполной ишемии).
3. Провести исследование показателей хемилюминесценции цельной крови при окклюзионном повреждении мозга в динамике экспериментальной острой ишемии мозга (модель неполной ишемии).
4. Провести исследование показателей хемилюминесценции цельной крови при реперфузионном повреждении мозга в динамике экспериментальной острой ишемии мозга (модель неполной ишемии).
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ
1.1. Этиология и патогенез ишемии мозга
Острые нарушения мозгового кровообращения – наиболее распространенные заболевания головного мозга в зрелом и пожилом возрасте. Преобладающими нарушениями церебрального кровотока является очаговая ишемия мозга, которая развивается в 4 раза чаще, чем кровоизлияние в мозг [8, 14, 20, 51, 68]. Ишемия представляет собой ухудшение (неполная) или полное прекращение (тотальная) всех трех функций локального кровоснабжения: доставки кислорода в ткань, доставки пластических веществ – субстратов окисления и удаление продуктов метаболизма [3].
Развитие ишемического инсульта, является наиболее серьезным осложнением ишемической болезни мозга. Среди этиологических факторов наибольшее значение имеют атеросклероз и гипертоническая болезнь как наиболее значимые сосудистые заболеваниям. Не следует забывать об экстравазальных компрессиях, особенно компрессиях позвоночных артерий в области шеи при дегенеративных изменениях в позвоночнике. В результате компрессий возникает редукция мозгового кровотока, которая вызывает развитие последующей ишемии мозга. Среди основных причин кардиогенных эмболий – мерцательная аритмия различной этиологии, инфаркт миокарда и его последствия, эндокардит, кардиомиопатия. Эти факторы наиболее угрожаемы для развития инсульта и именно мерцательная аритмия является самым значимым фактором риска развития ишемического инсульта [61].
Исследования последних лет позволили по-новому взглянуть на динамику процессов повреждения нервной ткани при церебральной ишемии, которая подразумевает каскадность метаболических изменений [20, 31]. На ранней стадии ишемии повреждение мозгового вещества может быть обратимым, что подчеркивает важность и необходимость комплексных исследований биохимических процессов.
В настоящее время выделяют 4 патогенетических варианта
ишемического инсульта: атеротромбический, эмболический, гемодинамический и микроциркуляторный. Атеротромбический инсульт составляет примерно 20-30 % и вызван тромбозом, развивающимся обычно на месте атеросклеротической бляшки. Прецеребральные артерии (позвоночные, сонные), крупные и средние церебральные артерии поражаются атероматозными бляшками. Увеличение атеротромботической бляшки может привести к сужению просвета артерии и её полной закупорке. Снижение кровотока возникает при гемодинамически значимом стенозе – сужении просвета сосудов до 70-75%.
Эмболический инсульт является причиной 20-25 % ишемических инсультов и чаще обусловлен кардиогенной эмболией (кардиоэмболический инсульт) или эмболией из аорты и крупных вне- или внутричерепных артерий (артерио-артериальная эмболия).
Лакунарные инсульты, обусловленные поражением мелких внутримозговых сосудов, часто вследствие артериальной гипертензии, составляют 20-25 % всех острых церебральных ишемий. Значительно меньший удельный вес имеет инсульт, развивающийся по механизму гемореологической окклюзии [8, 9, 14, 32, 68].
Многолетнее изучение механизмов формирования острой недостаточности мозгового кровообращения позволило выделить 4 группы основных патогенетических факторов [5,7, 17, 18, 66].
1)морфологические изменения сосудов, кровоснабжающих головной мозг (окклюзирующие поражения, аномалии развития и т.д.);
2) расстройства общей и церебральной гемодинамики, которые способствуют снижению кровотока до критического уровня с формированием сосудисто-мозговой недостаточности;
3) изменение физико-химических свойств крови, в частности, её свёртываемости, агрегации форменных элементов, вязкости, других реологических свойств:
4) индивидуальные и возрастные особенности метаболизма мозга, вариабельность которых обусловливает различия реакций на локальное ограничение мозгового кровотока.
Независимо от причины, которая привела к ишемии мозга, развивается каскад патобиохимических изменений, которые в итоге завершаются повреждением нервной ткани по механизмам некроза и апоптоза.
Одним из важных механизмов в запуске указанного каскада является снижение мозгового кровотока. В норме, когда оптимальный объём мозгового кровотока составляет 50-60 мл/100 г/мин, мозг получает необходимую энергию в результате окисления глюкозы и образования АТФ, причём окисление одной молекулы глюкозы даёт 38 молекул АТФ. При ишемии вследствие недостатка кислорода возникает анаэробный путь расщепления глюкозы, и из одной её молекулы образуется только 2 молекулы АТФ.
При снижении уровня кровотока менее 55-50 мл на 100 г в 1 мин возникает первый критический уровень в виде торможения белкового синтеза. Дальнейшее снижение кровотока, до 35 мл на 100 г в 1 мин – второй критический уровень – приводит к активации анаэробного гликолиза и увеличению концентрации лактата, развитию лактат-ацидоза и тканевого цитотоксического отёка. Продолжающееся снижение кровотока до 20 мл на100 г в 1 мин – третий критический уровень – приводит к снижению синтеза АТФ, формированию энергетической недостаточности, к дисфункции каналов активного ионного транспорта (выходу К+ из клетки и перемещению Na+ и Са2+ в клетку), дестабилизации клеточных мембран и избыточному выбросу возбуждающих нейромедиаторов – глутамата и аспартата (возникает так называемая "глутаматная эксайтотоксичность"). Перевозбуждение НМДА-рецепторов (N-метил-Д-аспартат) приводит к раскрытию новых кальциевых каналов, вследствие чего обеспечивается дополнительный приток Са2+ в нейроны. Когда мозговой кровоток достигает 20% от нормальной величины (10-15 мл на 100 г в 1 мин), развивается аноксическая деполяризация мембран, которая считается главным критерием необратимого поражения клеток [20, 51].
В развитии каскада патобиохимических и патофизиологических
процессов
выделяют три основные этапа: индукции (запуск), амплификации (усиление повреждающего потенциала) иэкспрессии (конечные реакции каскада) [20].
Этап индукции . Дефицит макроэргических субстратов в мозге приводит к «обесточиванию» Na+ - K+ - АТФ-азной ферментной системы, которая управляет энергозависимым ионным транспортом. Нарушение активного ионного транспорта обусловливает пассивный отток К+ из клеток, приток Са2+ , что приводит к деполяризации клеточных мембран. Внутриклеточное накопление ионов Са2+ при мозговой ишемии вызывает перегрузку митохондрий с разобщением окислительного фосфорилирования и усилением катаболических процессов; оно сопровождается переходом Са2+ в активную форму посредством соединения с внутриклеточным рецептором кальмодулином, что ведёт к активации кальмодулинзависимых протеинкиназ, липаз и эндонуклеаз, фрагментации дезоксирибонуклеиновых кислот (ДНК), гибели клетки [21].
Таким образом, уже на самых начальных этапах патобиохимического каскада, запущенного дефицитом макроэргов, начинается процесс внутриклеточного накопления кальция, являющийся одним из ключевых механизмов запуска как некротической, так и программированной смерти нейрона [21].
Важным путём поступления кальция в клетку являются агонистзависимые кальциевые каналы, особенно те, которые контролируются рецепторами, активирующимися возбуждающими аминоацидергическими медиаторами – глутаматом и аспартатом. Повышение их включает компенсаторные механизмы: обратный захват нейронами и астроцитами избытков из межклеточного пространства, пресинаптическое торможение выброса медиаторов, метаболическую утилизацию и др. Однако в условиях ишемии нарушается высокоселективная система транспорта глутамата и аспартата из синаптической щели в астроглию за счёт дисфункции каналов активного ионного транспорта и астроцитоза, изменяется система путей преобразования медиаторов; это приводит к тому, что абсолютная концентрация и время пребывания глутамата и аспартата в синаптической щели превышают допустимые пределы, и процесс деполяризации мембран нейронов приобретает необратимый характер [21].
Этап амплификации связан с продолжающимся увеличением внутриклеточной концентрации ионов кальция. Нарастание внутриклеточной концентрации кальция в сочетании с повышением содержания диацилглицерола (DAG) изменяет активность ферментов, модифицирующих мембранные белки, в том числе и глутаматные рецепторы. В результате увеличивается чувствительность нейронов к возбуждающим сигналам. Замыкается «порочный круг»: повышенная возбудимость может способствовать дальнейшему накоплению кальция и усилению выделения глутамата из нервных окончаний. Согласно экспериментальным данным, в областях мозга с плотно прилегающими нейронами, содержащими глутаматные рецепторы, одна массивно деполяризованная клетка индуцирует такое высвобождение глутамата, что возбуждает соседние нейроны. В результате вступает в силу «механизм домино» – последовательное распространение метаболических нарушений от нейрона к нейрону. Таким образом, события, происходящие на этапе амплификации, не только увеличивают накопление кальция, но и усугубляют токсичное возбуждение окружающих нейронов [21].
Этап амплификации создаёт условия для третьего этапа – экспрессии , на котором происходят необратимые изменения, приводящие к клеточной смерти. Механизмы, непосредственно повреждающие нейроны и глию, изучены наиболее полно [21].
Избыточное внутриклеточное накопление ионов Са2+ активирует внутриклеточные энзимы: липазы, протеазы, эндонуклеазы и запускает каскадный механизм ферментативных реакций, приводящих к катаболическому повреждению нейрона. Особенно разрушителен распад фосфолипидов в наружной клеточной мембране и в мембранах внутриклеточных органелл [21].
Таким образом‚ схема последовательных этапов «ишемического каскада» на основе причинно-следственных связей может иметь вид:
1) снижение мозгового кровотока;
2) глутаматная «эксайтотоксичность»;
3) внутриклеточное накопление ионов кальция;
4) активация внутриклеточных ферментов;
5) повышение синтеза оксида азота и развитие оксидантного стресса;
6) экспрессия генов раннего реагирования;
7) отдаленные последствия ишемии (реакции местного воспаления,
микрососудистые нарушения, повреждения гематоэнцефалического
барьера);
8) апоптоз [45].
Ведущим патогенетическим механизмом ишемической смерти нейронов является избыточная активация глутаматных рецепторов. При этом происходящие в мозге эксайтотоксические процессы неразрывно связаны с параллельно протекающими реакциями образования оксида азота, свободнорадикального окисления, воспаления.
1.2. Свободнорадикальное окисление и антиоксидантная защита
при патологии головного мозга
Свободнорадикальное окисление (СРО) – важный и многогранный
биохимический процесс превращений кислорода, липидов, нуклеиновых
кислот, белков и других соединений под действием свободных радикалов (СР), а перекисное окисление липидов (ПОЛ) – одно из его последствий [16].
1.2.1. Свободнорадикальное окисление: общие сведения
Свободные радикалы представляют собой соединения, имеющие неспаренный электрон на наружной орбитали и обладающие высокой реакционной способностью. К числу первичных свободных радикалов относятся супероксидный анион-радикал, окись азота, а вторичными свободными радикалами являются гидроксильный радикал, синклетный кислород, перекись водорода, пероксинитрит. Образование свободных радикалов тесно связано, с одной стороны, с появлением свободных электронов при нарушениях процессов окисления в дыхательной цепи, превращении ксантина, синтезе лейкотриенов и простагландинов. Эти реакции зависят от активности ксантиноксидазы, дегидротатдегидрогеназы, альдегидоксидазы‚ холестериноксидазы, ферментов цитохрома Р-450. Синтез супероксид-аниона инициируется ангиотензином II, который образуется из ангиотензина I под действием ангиотензинпревращающего фермента [16].
Супероксид-анион может восстанавливать Fe3+ в Fe2+ , при взаимодействии которого с перекисью водорода, перекисями липидов и гипохлоритом образуются высокотоксичные вторичные радикалы. Из всех свободных радикалов наибольшей активностью обладают гидроксильный радикал и пероксинитрит.
Активность свободных радикалов ограничивается антиоксидантами, которые разрывают цепи молекул при реакциях СРО, разрушают молекулыперекисей.
К числу ферментных антиоксидантов относятся супероксиддисмутаза (СОД), глютатионпероксидаза, каталаза, находящиеся в клеточных структурах. Неферментные антиоксиданты – витамины Е, К, С, убихиноны, триптофан, фенилаланин, церулоплазмин, трансферрин, гаптоглобин, глюкоза, каротиноиды – блокируют активность свободных радикалов в крови. Изменения структуры и функции субстратов, на которые действуют свободные радикалы, зависит, в конечном счете, от соотношения активности СР и антиоксидантов.
Свободнорадикальное окисление необходимо для нормального функционирования организма. Об этом свидетельствует, в частности, потребление более 5 % кислорода на образование супероксидного анион-радикала. СРО способствует уничтожению отживших клеток, элиминации ксенобиотиков, предупреждает злокачественную трансформацию клеток, моделирует энергетические процессы за счет активности дыхательной цепи в митохондриях, пролиферацию и дифференциацию клеток, транспорт ионов, участвует в регуляции проницаемости клеточных мембран, в разрушении поврежденных хромосом, в обеспечении действия инсулина. СРО генерирует внутриклеточные бактерицидные и вирусоцидные факторы, особенно в клеточном ядре [1, 22,49].
Снижение поступления в нейроны молекулярного кислорода и повышение уровня восстановленности компонентов дыхательной цепи стимулируют восстановление кислорода по одноэлектронному пути с образованием свободных радикалов (супероксид-аниона, пероксильного и гидроксильного радикалов), а также оксидантов нерадикальной природы (пероксида водорода и аниона гипохлорита), поскольку (О2 )- легко реагирует с промежуточными компонентами дыхательной цепи в восстановленном состоянии. Высокореакционноспособные радикалы кислорода вызывают окисление биомакромолекул, а также инициируют цепные процессы перекисного окисления мембранных липидах (ПОЛ), прямое окислительное повреждение нуклеиновых кислот (НК) и белков.
Образующееся в процессе ПОЛ гидроперекиси неустойчивы, их распад приводит к появлению разнообразных вторичных и конечных продуктов ПОЛ, представляющих собой высокотоксичные соединения (диеновые коньюгаты, шиффовы основания и др.), которые оказывают повреждающее действие на мембраны и клеточные структуры. Как следствие образуются сшивки биополимеров, определяются набуханием митохондрий и разобщение окислительного фосфорилирования, инактивация тиоловых ферментов, участвующих в дыхании и гликолизе, дальнейшее разрушение липидной основы мембран [21].
1.2.2. Продукты перекисного окисления липидов
К первичным продуктам ПОЛ относятся циклические эндоперекиси и алифатические моно- и гидроперекиси, так называемые липопероксиды и диеновые конъюгаты [30].
Диеновые конъюгаты (ДК) являются первичными продуктами ПОЛ. При свободнорадикальном окислении арахидоновой кислоты происходит отрыв водорода в α-положении по отношению к двойной связи, что приводит к перемещению этой двойной связи с образованием ДК [64]. Диеновые конъюгаты, являющиеся первичными продуктами ПОЛ, относятся к токсическим метаболитам, которые оказывают повреждающее действие на липопротеиды, белки, ферменты и нуклеиновые кислоты [54].
Липопероксиды являются весьма нестойкими и подвергаются дальнейшей окислительной дегенерации. При этом накапливаются вторичные продукты окисления, наиболее важными из которых являются ненасыщенные альдегиды (малоновый диальдегид). Продуктами взаимодействия малонового диальдегида с аминосодержащими соединениями являются шиффовы основания [30].
Шиффовы основания, органические соединения общей формулы RR¢C=NR¢¢ где R и R¢ - водород, алкил или арил, R¢¢ - алкил или арил (в последнем случае Ш. о. называют также анилами). Шиффовы основания – кристаллические или маслообразные вещества, нерастворимые в воде, растворимые в органических растворителях. Слабые основания, в безводной среде образуют соли с кислотами, в водных растворах кислот гидролизуются до амина и альдегида, в щелочных растворах большинство Ш. о. устойчиво. Гидрируются до вторичных аминов (RR¢CH - NHR¢¢), присоединяют многие соединения, содержащие подвижный водород, например b-дикарбонильные соединения, кетоны, имины. Образуются шиффовы основания в результате обратимой реакции между карбонильной группой альдегида или кетона со свободной аминогруппой [67]. Непрерывное накопление оснований Шиффа дестабилизирует мембраны и способствует деструкции клеток [54].
ТБК-реактанты (МДА) – вторичные продукты ПОЛ. Как известно, малоновый диальдегид (МДА) образуется только из жирных кислот с тремя и более двойными связями. МДА принадлежит важная роль в синтезе простагландинов, прогестерона и других стероидов [54]. Отрицательная роль малонового диальдегида заключается в том, что он сшивает молекулы липидов и понижает текучесть мембраны. Вследствие этого мембрана становится более хрупкой. Нарушаются процессы связанные с изменением поверхности мембраны: фагоцитоз, пиноцитоз, клеточная миграция и др. [54].
Гидроперекиси, ненасыщенные альдегиды, являются мутагенами и обладают выраженной цитотоксичностью. Они подавляют активность гликолиза и окислительного фосфорилирования, ингибируют синтез белка и нуклеиновых кислот, нарушают секрецию триглицеридов гепатоцитами, ингибируют различные мембранносвязанные ферменты [30].
Накопление в организме продуктов ПОЛ (диеновых коньюгатов, ТБК-реактантов, шиффовых оснований) [6] и развитие эндотоксикоза приводит к стимуляции монооксигеназной системы, изменениям реакции липидного, гормонального, иммунного, микроэлементного, нейромедиаторного статусов, числа мест связывания и сродства рецепторов к лигандам, истощению антиоксидантной системы [71].
1.2.3. Процессы свободно-радикального окисления липидов в развитии и течении острых нарушений мозгового кровообращения
В развитии и течении острых нарушений мозгового кровообращения е особое значение придается усилению процессов свободнорадикального окисления липидов. Прежде всего, по причине повышенной чувствительности головного мозга к действию свободных радикалов (50% сухого вещества мозга составляют ненасыщенные жирные кислоты – основной субстрат свободно-радикального окисления.) Хотя немалую роль играет и антиоксидантная система, наделенная функциями контроля за процессами перекисного окисления липидов, при недостаточности антиоксидантной системы процессы пероксидации усиливаются, происходит избыточное образование первичных (свободных перекисных радикалов и гидроперекисей липидов) и конечных (альдегидов и кетонов) продуктов свободнорадикального окисления. И те, и другие, действуя на внешние и внутренние клеточные мембраны, вызывают возникновение мембранной патологии и энергетического дефицита. Однако более опасными считаются свободные перекисные радикалы и гидроперекиси липидов, которые оказывают не только мембраноповреждающее действие, но и обеспечивают аутокаталитический характер перекисного окисления липидов [35].
Согласно бытующему мнению, резкое увеличение продукции свободных радикалов приходится на постишемический период, на стадию восстановления мозгового кровообращения. Вместе с тем некоторые исследователи не исключают возможность образования свободных радикалов даже при понижении парциального давления кислорода в тканях с нарушенным кровоснабжением, поскольку повышение степени восстановленности митохондриальной дыхательной цепи позволяет кислороду в период острой ишемии взаимодействовать с промежуточными компонентами этой цепи – убихинонами – с образованием супероксиданиона [35].
При острой мозговой ишемии на фоне дисбаланса оксидантно-антиоксидантной системы происходит активация процессов перекисного окисления липидов, что «в совокупности вызывает развитие дистрофических и деструктивных изменений нейрональных мембран и формирование неврологического дефицита» [35].
1.2.3.1. Малоновый диальдегид как интегральный показатель
процессов свободнорадикального окисления
Как правило процессы перекисного окисления липидов (ПОЛ) оцениваются по скорости и количеству образования одного из конечных продуктов окисления – малонового диальдегида (МДА).
Малоновый диальдегид (β-диальдегид):
Н – С – СН2 – С – Н
║ ║
О О
Активность малонового диальдегида поддерживается на определенном уровне при участии ферментов антиоксидантной защиты (АОЗ), что позволяет говорить о перекисном гомеостазе. Нормальная концентрация в крови – 2,5-6,0 мкМ/л. Увеличение концентрации – свидетельство усиленного ПОЛ и срыва антиоксидантной защиты [2].
Определение количества образующегося малонового диальдегида с помощью тиобарбитуровой кислоты (ТБ-К) может быть одним из методов оценки интенсивности процессов перекисного окисления липидов [48, 57].В основе метода лежит реакция между малоновым диальдегидом (МДА) и тиобарбитуровой кислотой, которая при высокой температуре и кислом значении рН протекает с образованием окрашенного триметинового комплекса, содержащего одну молекулу МДА и две молекулы тиобарбитуровой кислоты. Максимум поглощения комплекса приходится на 532 нм [41].
При ишемии мозга в большей степени повышаются вторичные продукты ПОЛ (МДА), а при реперфузии – первичные [4, 36].
Исследование вторичных продуктов ПОЛ, реагирующих с тиобарбитуровой кислотой, подтверждает роль перекисного окисления в механизмах развития острой фокальной ишемии мозга и формирования инфарктных повреждений.
1.2.3.2. Биохемилюминесценция как метод оценки состояния свободнорадикальных процессов при ишемическом инсульте головного мозга
Одним из методов оценки свободнорадикальных процессов при ишемии головного мозга является хемилюминесценция.Хемилюминесценцией (ХЛМ) называется свечение, сопровождающее химические реакции. Она наблюдается в том случае, если в реакции происходит выделение большого количества энергии, например в реакции взаимодействия двух радикалов или в реакциях с участием перекисей. Собственное ("сверхслабое") свечение клеток и тканей животных и человека обусловлено реакциями свободных радикалов: радикалов липидов и кислорода, а также окиси азота, – соединениями, играющими огромную роль в жизни организма, а при определенных условиях – и развитии ряда патологических состояний[12].
Регистрация индуцированной биохемилюминесценции биологических объектов является современным методом для изучения интенсивности свободнорадикальных процессов, в частности перекисного окисления липидов. Он применяется для диагностики нарушений липидного обмена, воспалительных, инфекционных и онкологических заболеваний. В клинических условиях хемилюминесцентный показатель может быть применен для определения остроты процесса, степени тяжести по динамике значений хемилюминесценции.
Метод хемилюминесценции применяется также для определения фагоцитарной активности клеток крови. Он основан на регистрации активных форм кислорода, образующихся в процессе фагоцитоза, и связан с их фагоцитарной активностью [63].
Метод люминолзависимой хемилюминесценции (ХЛМ) характеризует интенсивность «респираторного взрыва», то есть генерации O2 • , O2 и ОН• лейкоцитами при активации клеток[24].
ЛХЛ цельной крови можно наблюдать в течение 10-12 часов, причем при её разведении физиологическим раствором или раствором Хенкса интенсивность ХЛМ увеличивается [13].
Метод люминолзависимой хемилюминисценции можно применять как метод оценки состояния свободнорадикальных процессов при ишемическом инсульте головного мозга.
Известно‚ что на первые сутки заболевания у всех больных независимо от тяжести инсульта интенсивность – как спонтанной, так и индуцированной – хемилюминесценции сыворотки крови возрастает по сравнению с контрольной группой, что указывает на активацию процессов свободнорадикального окисления [38]. В этот же период резко увеличивается амплитуда «быстрой» вспышки (т. е. интенсивность свечения в момент введения индуктора), отражающая состояние оксидантной системы, и достоверно увеличивается коэффициент затухания (т. е. отношение максимальной амплитуды свечения к минимальной), что косвенно свидетельствует о дисбалансе оксидантно-антиоксидантной системы.
В дальнейшем, на седьмые сутки, картина меняется. В сравнении с началом заболевания у всех больных уменьшается амплитуда «быстрой» вспышки и достоверно увеличивается коэффициент затухания. Вместе с тем у больных с ишемическим инсультом легкой степени тяжести продолжается незначительное нарастание процессов пероксидации. У больных с инсультом средней тяжести снижение индуцированной хемилюминесценции сопровождается достоверным повышением спонтанной хемилюминесценции в сравнении с первыми сутками заболевания [35].
У больных перенесших повторные нарушения мозгового кровообращения, напряжены обе системы – и оксидантная, и антиоксидантная. У больных с одним или несколькими инсультами в анамнезе дела обстоят иначе: у них активация оксидантной системы сочетается с истощением антиоксидантной системы, что ведет к более активной деструкции мозговой ткани при гипоксии головного мозга [35].
1.2.4. Антиоксидантная система: контроль за процессами перекисного окисления липидов при ишемии мозга
Окисление и продукция свободных радикалов является неотъемлемой частью метаболизма живых организмов. Активные формы кислорода (АФК) генерируются в различных биологических системах в ходе нормального аэробного дыхания митохондрий. Экзогенными источниками АФК является ультрафиолетовая радиация, инфекционные агенты (вирусы, бактерии), провоспалительные цитокины, окислительный стресс. В норме свободные радикалы участвуют в выполнении важнейших физиологических процессов в организме: поддержании сосудистого тонуса, в механизмах памяти, реакциях воспаления, регуляции клеточного роста. Контроль продукции АФК осуществляет антиоксидантная система, регулирующая баланс образования и устранения свободных радикалов. В состав этой системы входят ферменты (супероксиддисмутаза, каталаза и др.), белки (ферритин, трансферрин, альбумин и др.) и многочисленные низкомолекулярные антиоксиданты (витамин Е, убихинол, каратиноиды, витамин С и др.).
Для мозга характерна низкая антиоксидантная защита. Именно дефицит антиоксидантной системы в мозговой ткани объясняет ее особую чувствительность к продукции свободных радикалов. Составляя всего 2% от общей массы тела, мозг утилизирует 20-25% получаемого организмом кислорода, поэтому переход в свободнорадикальную форму даже 0,1% метаболизируемого нейронами кислорода окажется токсичным для мозговой ткани [27].
В нормальных условиях процесс перекисного окисления липидов находится под строгим контролем ферментативных и неферментативных систем клетки, от чего скорость его невелика.Возникающие нарушения метаболизма при острой ишемии головного мозга ведут к повышению уровня свободных радикалов и способствуют накоплению веществ, катализирующих ПОЛ, что, в конечном итоге, и приводит к ускорению свободнорадикальных реакций, тем более что в условиях гипоксии проницаемость мембран для кислорода значительно увеличивается [44, 70]. В процессе ишемии соотношение продуктов СРО и концентрации антиоксидантов в нейрональных клетках нарушается. В связи с этим создаются "благоприятные" условия для интенсификации ПОЛ и накопления токсических липидных перекисей, которые активно разрушают структуру мембран нейронов, инактивируют ферменты и усугубляют деструктивные процессы в ткани мозга [46].
Ксантиноксидаза играет главенствующую роль в генерации АФК, вследствие чего происходит увеличение уровня свободного железа в плазме крови путем мобилизации железа с ферритином в печени. Гипоксантиокидантную реакцию можно считать одним из основных источников образования АФК, а также основной причиной СРО в ишемизированом органе [50].
Существующая в организме физиологическая антиоксидантная (АО)система представляет собой совокупную иерархию защитных механизмов клеток, тканей, органов и систем, направленных на сохранение и поддержание в пределах нормы реакций организма, в том числе в условиях ишемии. Она включает внутриклеточные антиокислительные ферментные системы, противодействующие окислительному стрессу и обезвреживающие АФК. К антиокислительным внутриклеточным ферментам относятся, прежде всего, супероксиддисмутаза (СОД), осуществляющая инактивацию супероксидного радикала, и каталаза, разлагающая перекись водорода [43, 73].
Однако регуляция интенсификации ПОЛ осуществляется не только системой СОД–каталаза. Детоксикация в фосфолипидных структурах происходит главным образом с помощью ферментов системы глутатиона, и, прежде всего, глутатионредуктазой, глутатионпероксидазой и глутатионтрансферазой [43, 55].
Особую роль в регуляции ПОЛ играют металлы переменной валентности: Fe²![]() , Cu²
, Cu²![]() , Mn²
, Mn²![]() , Co²
, Co²![]() , из которых основным прооксидантом в ткани мозга является железо [20, 25]. Так, в условиях церебральной патологии ишемического генеза из клеточного депо выходит железо, находившееся там в трехвалентном состоянии в комплексе с ферритином. Под действием супероксид-радикала железо восстанавливается до Fe2+. Далее по реакции Фентона (Н2О2+ Fe2+→ОН+ОН- + Fe3+) двухвалентное железо разлагает перекись водорода с образованием гидроксильного радикала, являясь наиболее долгоживущим, высокореакционным и токсическим для тканевого метаболизма, что в конечном итоге приводит к гибели нейронов в условиях окислительного стресса на фоне ишемии [34].
, из которых основным прооксидантом в ткани мозга является железо [20, 25]. Так, в условиях церебральной патологии ишемического генеза из клеточного депо выходит железо, находившееся там в трехвалентном состоянии в комплексе с ферритином. Под действием супероксид-радикала железо восстанавливается до Fe2+. Далее по реакции Фентона (Н2О2+ Fe2+→ОН+ОН- + Fe3+) двухвалентное железо разлагает перекись водорода с образованием гидроксильного радикала, являясь наиболее долгоживущим, высокореакционным и токсическим для тканевого метаболизма, что в конечном итоге приводит к гибели нейронов в условиях окислительного стресса на фоне ишемии [34].
Итак, обобщая существующие современные представления, следует подчеркнуть, что усиление СРО играет важнейшую роль в патогенезе ишемии головного мозга. В первые минуты ишемии за счет остаточного кислорода продукты липопероксидации особенно энергично накапливаются после восстановления кровоснабжения. АФК атакуют мембранные структуры клеток и их органелл, вызывая их деструкцию, деэнергизацию и гибель нейронов, что, безусловно, требует рациональной фармакологической коррекции [39].
1.3. Модели ишемии головного мозга
Существует 5 основных методик моделирования ишемии головного мозга у крыс. Метод, предложенный в работе SmrĉkaM. и др. [74], заключается во введении монофиламентного волокна через разрез бифуркации аорты во внутреннюю сонную артерию, а затем интракраниально. В методе эмболизации [72] используют введение предварительно изготовленного сгустка гепаринизированной крови через катетер во внутренней сонной артерии. При использовании метода, описанного в работе GillR. и др. [69] производят лигирование средней мозговой артерии (СМА) через трепанационное отверстие, выполненное в том месте, где артерия пересекает носовую расщелину. Метод по Tamura [56] заключается в перевязке СМА через трепанационное отверстие в области между овальным отверстием и отверстием зрительного нерва. Метод по Розвадовскому [42] заключается в лигировании общих сонных и подключичных артерий, дистальнее отхождения внутренних грудных артерий и проксимальнее отхождения позвоночных артерий.
По мнению авторов [28] наиболее эффективным методом является метод по Tamura, поскольку он позволяет более точно смоделировать патологические процессы, возникающие при развитии ишемического инсульта у людей. Однако этот метод, как и метод, описанный в работе SmrĉkaM. является достаточно сложным в исполнении. Метод эмболизации и метод, описанный в работе GillR. являются близкими по эффективности к методу по Tamura, однако также сложны и отличаются высокой себестоимостью. Метод по Розвадовскому наиболее прост в использовании, обладает низкой себестоимостью. Главным его недостатком является возникновение ишемии не только в бассейне СМА, но и в других отделах головного мозга [28].
При моделировании острой неполной ишемии головного мозга у крыс в тканях серого вещества наблюдается возрастание процесса пероксидации и антиагрегационной активности и снижение активности супероксидисмутазы. При постишемической реперфузии головного мозга в нем остается усиленным перекисное окисление липидов, возрастает активность антиоксидантных ферментов, нормализуются тромбоцитоактивирующие и прокоагулянтные свойства. Изменения указанных реакций в тканях мозга приводили к нормализации агрегации тромбоцитов и свертывания крови. У больных с различными нарушениями мозгового кровообращения (ишемический и геморрагический инсульт) в тканях мозга резко активируются реакции перекисного окисления липидов, гемостаза и ингибируется фибринолиз. В крови таких больных снижаются антиоксидантные и увеличиваются гемостатические функции с ингибированием на этом фоне реакций фибринолиза.
Использование витаминов-антиоксидантов (А, Е, С, Р) в экспериментальных условиях у крыс возвращает тромбоцитоактивирующие и прокоагулянтные свойства его тканей к уровню, наблюдаемому у интактных животных. Применение на этом фоне ингибиторов агрегации тромбоцитов (аспирина, индометацина, тиклида) приводило к разным реакциям. Аспирин не предотвращал усиления агрегационных свойств тканей головного мозга, вызванных его ишемией (по-видимому, как ингибитор простациклина). Индометацин, и особенно, тиклид в этом отношении действовали более благоприятно, снижая агрегационные свойства тканей мозга.
Ткани мозга оказывают регулирующее воздействие на процессы перекисного окисления липидов и состояние антиоксидантной системы, гемостаза и фибринолиза, что имеет важное значение для течения упомянутых выше реакций не только местно (в головном мозгу), но и в общем кровотоке в условиях нормы и патологии [37].
При моделировании транзиторной фокальной ишемии головного мозга у крыс, производят перевязку средней мозговой артерии.
В опытах на крысах линии Вистар, у которых моделировали неполную глобальную ишемию мозга путем двусторонней перевязки сонных артерий, обнаружено двукратное увеличение генерации оксида азота (NO) и умеренное повышение содержания вторичных продуктов перекисного окисления липидов в коре мозга, при этом выявлена высокая степень корреляции между содержанием NO и выраженностью неврологического дефицита у ишемизированных животных [58].
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ
2.1. Материалы исследования
Объектом исследования служили цельная кровь и сыворотка крови 56 половозрелых самцов крыс линии Вистар массой 221,2±30,9 г. Животных содержали в стандартных условиях вивария со свободным доступом к воде и пище [3].
В эксперименте воспроизводились неполная ишемия головного мозга и механизм реперфузионного повреждения головного мозга [3].
Все процедуры эксперимента соответствовали требованиям Международных правил гуманного отношения к животным, отраженным в Санитарных правилах по оборудованию и содержанию экспериментально-биологических клиник (вивариев) [3].
Выбор объекта эксперимента был обусловлен сходством ангиоархитектоники головного мозга крыс и человека, а также близостью основных гемодинамических параметров [3].
Животных декапитировали под эфирным наркозом (предварительно оценив состояние неврологической сферы по шкале McGraw‚ 1977) и производили забор крови. Для получения сыворотки кровь центрифугировали при 1000 об/мин в течении 15 мин. Из эксперимента исключалась гемолизированная сыворотка. Сыворотка использовалась в качестве источника МДА [3].
В работе были использованы семь групп животных (табл.1).
Таблица 1. Группы экспериментальных животных.
| Группа животных (n=58) | Тип вмешательства |
| 1 серия (n=8 ) | 2-часовая окклюзия |
| 2 серия (n=8) | 1 сутки после 2-часовой окклюзии |
| 3 серия (n=8 ) | 3 суток после 2-часовой окклюзии |
| 4 серия (n=8 ) | 2-часовая окклюзия + 2-часовая реперфузия |
| 5 серия (n=8 ) | 1 сутки после 2-часовой окклюзии + реперфузии |
| 6 серия (n=8 ) | 3 суток после 2-часовй окклюзии + реперфузии |
| 7 серия (n=8) | Контрольная группа животных (ложнооперированные) |
2.2. Методы исследования
2.2.1. Моделирование неполной ишемии у крыс
В эксперименте воспроизводились неполная ишемия головного мозга и механизм реперфузионного повреждения головного мозга. С этой целью в нижней трети шеи производился кожный разрез, с обеих сторон выделялся сосудисто-нервный пучок и на общие сонные артерии после их препаровки накладывалась лигатура.
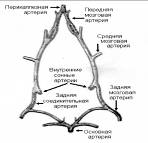 |
Рис 1. Строение виллизиевого круга крысы (по И. В. Ганнушкиной)
Ишемия головного мозга осуществлялась полной перевязкой обеих сонных артерий. Для создания реперфузионной модели ишемического повреждения на обе общие сонные артерии на 1 час накладывались клипсы, после чего кровоток по общим сонным артериям восстанавливали, добиваясь реперфузии ранее ишемизированной ткани.
Контрольную группу составляло 8 животных аналогичного пола и массы. У животных контрольной группы воспроизводилась наркотизация, кожный разрез и выделение артерий без последующей перевязки сосудов. Все хирургические процедуры проводили под наркозом (внутрибрюшное введение тиопентала натрия в дозе 40-50 мг/кг, растворенного в 1 мл физиологического раствора).
О тяжести ишемического повреждения судили по степени неврологического дефицита, оцениваемого по шкале Stroke-indexMс Graw в модификации НИИ неврологии РАМН через 2 часа после оперативного вмешательства и по динамике неврологического дефицита на 1-е и 3-и сутки (Приложение 1. табл.1).
2.2.2. Метод определения концентрации малонового диальдегида в
сыворотке крови
Концентрацию малонового диальдегида определяли по методу UchiyamaM., MiharaM. [75]. К 3 мл 1,4 % ортофосфорной кислоты добавляли 0,25 мл сыворотки крови, затем приливали 1 мл 0,5 % раствора тиобарбитуровой кислоты и помещали в кипящую водяную баню на 45 минут. Пробы охлаждали, добавляли 4 мл бутанола и встряхивали в течение 1 мин до образования суспензии.
После центрифугирования супернатант, фотометрировали при двух длинах волн λ=535 нм и λ=570 нм против холостой пробы в кювете с длинной оптического пути 1 см. расчет содержания ТБК-активных продуктов проводили по формуле С=(D535 -D 570 )/0,156 х 16, где С – концентрация ТБК-активных продуктов в опытной пробе; D535 - оптическая плотность пробы при 535 нм; D570 – оптическая плотность при 570 нм; 0,156 – коэффициент молярной экстинкции комплекса малоновый диальдегид-ТБК в л/мкмоль/см; 16 – коэффициент разведения сыворотки.
2.2.3. Метод люминолзависимой хемилюминесценции в цельной крови
Хемилюминесценцию измеряли на аппарате ХЛМ-003 в соответствии с инструкцией к прибору и методическими рекомендациями авторов разработки [10, 23, 59, 60].
Перед исследованием отбирали необходимое количество рабочего раствора люминола из расчета 2 мл на одну пробу и нагревали в термостате до 37 °С. Предварительно разливали по 2 мл раствора в стаканчики для измерения хемилюминесценции, которые также помещали в термостат. В 2 мл теплого раствора люминола добавляли 0,1 мл гепаринизированной крови, тщательно перемешивали и помещали в кюветную камеру прибора, настроенного по программе КРОВЬ (термостат включен, мешалка выключена, время измерения 10 минут).
2.3. Статистическая обработка результатов исследования
Данные представлены в виде медианы и интерквартильного размаха от 25 (lowquartile) до 75 квартиля ( highquartile) [40].
Сравнение между группами было выполнено с использованием теста Манна – Уитни, при сравнении более 2 групп применялся тест Крускала – Уоллиса. Для сравнения относительных величин применялся критерий χ². Для исследования корреляционных взаимодействий выполнялся корреляционный анализ Спирмена.
Различия считались статистически значимыми при р<0,05. Все статистические расчеты проводились с помощью пакета программ "Statistica 5,5".
ГЛАВА 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
3.1. Свободнорадикальные процессы при ишемическом инсульте
Ишемия мозга сопровождается развитием сложного каскада патобиохимических реакций. Согласно современным представлениям, взаимодействие избыточных концентраций возбуждающих нейромедиаторов (глутамата) с N-метил-D-аспартатными рецепторами приводит к увеличению концентрации свободного кальция в цитоплазме нервных клеток. Содержание свободного Са2+ возрастает и в результате открытия потенциалзависимых ионных каналов при деполяризации нейронов, а также выхода кальция из внутриклеточных депо (эндоплазматического ретикулума, митохондрий). Последующая активация кальцийзависимых ферментов, в т.ч. и конститутивной NOS, приводит к усилению синтеза NO и формированию других свободных радикалов (супероксида, гидроксирадикалов, перекиси водорода).
Т.о., оксидантный стресс выступает как один из ведущих факторов повреждения мозга при ишемии. В нашей работе оценка показателей, характеризующих свободнорадикальной окисление, осуществлялась по определению концентрации ТБК-активных продуктов – малонового диальдегида (МДА), показателям люминолзависимой хемилюминесценции.
3.2. Исследование активности хемилюминесценции цельной крови и концентрации МДА в сыворотке крови при экспериментальной ишемии головного мозга
Центральное место в изучении ишемического инсульта занимают экспериментальные модели на животных [65]. Именно по результатам эксперимента сформулированы основные положения о патогенезе и морфогенезе ишемического инсульта. Хотя следует отметить, что универсальной модели, адекватно воспроизводящую ишемию человеческого мозга, на сегодня пока не существует.
Исходя из поставленных задач данного исследования, нами изучена активность хемилюминесценции цельной крови и концентрация МДА в сыворотке крови, как биохимических показателей, характеризующих свободно-радикальное окисление, на экспериментальной модели ишемии головного мозга крыс.
3.2.1 Показатели свободнорадикального окисления при моделировании ишемии головного мозга
Избыточный синтез оксида азота и оксидантный стресс являются основными звеньями последнего этапа формирования очагового некроза головного мозга – экспрессии, на котором происходят необратимые изменения. Это звено каскада характеризуется накоплением высокотоксичных соединений, приводящих к гибели клетки. Показатели оксидантного стресса в эксперименте были оценены по содержанию в сыворотке крови крыс ТБК-активных продуктов и показателям люминолзависимой хемилюминесценции цельной крови.
3.2.1.1. Исследование динамики ТБК-активных продуктов при моделировании ишемии головного мозга
Нарушения кровообращения, наступающие при ишемическом повреждении мозга, вызывают усиленную генерацию АФК, и, как следствие, усиление ПОЛ. Данные по изучению содержания ТБК-АП представлены на рис. 2 и рис. 3. (Приложение 2‚ табл. 1).
При исследовании динамики ТБК-активных продуктов выявлено достоверное увеличение (по сравнению с контрольной группой животных) концентрации МДА во всех сериях эксперимента. Достоверное повышение концентрации МДА после окклюзии отмечено во все сроки после наблюдения‚ однако наибольшие изменения (в 2‚5-3 раза) обнаруживалось через 24 и 72 часа. Реперфузионные процессы сопровождались значительным повышением (в 3 раза) концентрации МДА через 2‚ 24 и 72 часа после реперфузии.


Таким образом, изучение показателей ПОЛ при моделировании ишемии выявило активацию этого процесса. Реперфузионные процессы в мозге сопровождались наиболее значимыми изменениями со стороны изучаемого показателя.
3.2.1.2. Исследование динамики показателей хемилюминесценции при моделировании ишемии
Образование свободных радикалов является одним из механизмов, посредством которых фагоцитарные клетки проявляют свою активность. Добавление в систему люминола увеличивает квантовый выход реакции, которая адекватно отражает динамику функциональной активности лейкоцитов. Поэтому одним из перспективных методов исследования свободнорадикальных процессов является хемилюминесценция, отражающая сверхслабое биологическое свечение [59, 60].
Полученные нами данные по исследованию хемилюминесценции цельной крови приведены на рис. 4 и рис. 5 (Приложение 2‚ табл. 2).


Максимальное‚ достоверно значимое‚ повышение ХМЛ отмечено после 2-часовой окклюзии и 2-часовой реперфузии. Повышенными‚ относительно группы контрольных животных эти значения сохранялись и в последующих сроках эксперимента. Согласно полученным данным окклюзионные процессы сопровождались более значимым (в 2‚5-4 раза) повышением ХЛМ цельной крови животных. Показатели ХЛМ в группе животных с реперфузионным поражением мозга были достоверно выше показателей контрольной группы через 2 (в 4 раза) и 24 часа (В 2 раза) после операции. Через 72 часа после реперфузии показатели ХЛМ были статистически не достоверными по сравнению с контролем.
Таким образом, изучение люминолзависимой хемилюминесценции при моделировании ишемии головного мозга подтверждает роль свободнорадикальных процессов в развитии этой патологии. Наибольшие изменения были зарегистрированы после 2-х часовой окклюзии и 2-х часовой окклюзии с последующей реперфузией.
ГЛАВА 4. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ
В основе развития ишемии мозга лежит нарушение кровообращения. В связи с этим первостепенное значение приобретает изучение биохимических процессов, лежащих в основе вазомоторных реакций, возникающих в ответ на церебральную ишемию.
Многочисленные экспериментальные данные свидетельствуют об активации процессов ПОЛ у больных с ишемическими поражениями мозга [3, 19, 26, 62]. МДА можно рассматривать как биохимический маркер липопероксидации в постишемических тканях [15, 26]. Повышение концентрации ТБК-активных продуктов в спинномозговой жидкости больных ишемическим инсультом коррелировало как с тяжестью процесса, так и объемом пораженного мозга [4, 19, 26]. Изучение МДА как маркера активации ПОЛ при ишемии по данным периферической крови обусловлено большей доступностью биологического материала.
Согласно современным представлениям, усиление процессов свободнорадикального окисления играет важнейшую роль в патогенезе ишемии головного мозга. Полная окклюзионная ишемия мозга в эксперименте на животных сопровождается увеличением содержания продуктов ПОЛ уже начиная с 5-минутной ишемии [26]. Наибольшая активация процессов с участием свободных радикалов характерна для периода реперфузии [3, 4], хотя в ряде экспериментальных работ показано усиление ПОЛ и в период ограничения доступа кислорода [62].
Решению медико-социальных проблем, возникающих в связи с распространенностью инсульта, способствует изучение механизмов заболевания на различных экспериментальных моделях. Строение сосудов мозга, их топография, молекулярная и клеточная биология нервных клеток грызунов имеет высокую степень гомологии с приматами. Это и обусловило изучение активности ферментов обмена регуляторных пептидов в крови и мозговой ткани экспериментальных животных.
Использование различных экспериментальных исследований как invivo, так и invitro, показали, что в основе ишемии головного мозга лежат сложные механизмы.
В экспериментальной части исследования нами была изучена динамика показателей хемилюминисценции цельной крови и изменение концентрации МДА при окклюзии и окклюзии-реперфузии у крыс.
При моделировании фокальной ишемии, как правило, воспроизводится основной патофизиологический процесс – ишемия в определенном бассейне кровоснабжения, следствием последнего является повышение внутриклеточной концентрации свободного Са2+ , лактатацидоз, активация свободнорадикального окисления. В патогенезе ишемии мозга окислительный стресс, гиперпродукция свободных радикалов и других АФК играют роль необходимого звена в деструкции мембран и гибели нейронов. При умеренном уровне синтеза АФК действуют как специфические сигнальные молекулы.
Известно, что МДА является универсальным маркером ПОЛ. По литературным данным [26], уже с 5 минуты ишемии регистрируется повышение всех продуктов ПОЛ – первичных и вторичных. Факт резкой активации процессов ПОЛ в очаге ишемии подтверждается не только увеличением диеновых конъюгатов и МДА, но усилением хемилюминесценции гомогената. Мы проанализировали данные эксперимента по изучению МДА и показателей люминолзависимой хемилюминесценции в сыворотке крови крыс в различные сроки после окклюзии.
Активация свободнорадикальных процессов отмечалась во всех сериях эксперимента с окклюзией. Повышение (по сравнению с группой ложнооперированных животных) показателей МДА в сыворотке крови крыс после 2-часовой окклюзии свидетельствует об усилении процессов ПОЛ уже в первые часы развития заболевания. Максимальное увеличение концентрации ТБК-активных продуктов зарегистрировано в 1 сутки после 2-часовой окклюзии. У животных на 3 сутки после 2-часовой окклюзии концентрация МДА также превышала значения контрольной группы.
Изучение показателей ПОЛ при реперфузии показало, что изменения выявлены на всех этапах эксперимента, что согласуется с литературными данными об усилении СРО в данный период.
Известно‚ что у пациентов с тяжелым и крайне тяжелым вариантом ишемического инсульта выявляется активация свободнорадикальных процессов (по показателям МДА и ХЛМ) [33]. Максимальное повышение концентрации МДА у больных с ишемическим инсультом отмечается уже в первые часы и первые сутки развития заболевания, что, по мнению авторов [20, 25, 33], отражает реперфузионные процессы, происходящие в мозге и показывает зависимость процессов ПОЛ от тяжести заболевания. Особенно значимой была зависимость уровня ТБК-активных продуктов от течения заболевания: у тяжелоинвалидизированных больных прирост достигал 7,6 нмоль/мл. Нарастание концентрации ТБК-активных продуктов в сыворотке крови больных в первые часы и первые сутки развития заболевания‚ по мнению авторов‚ свидетельствуют об активизации свободнорадикальных процессов в мозговой ткани‚ а повышение уровня С-реактивного белка (СРБ) отражает развитие воспалительной реакции [33].
Таким образом изучение процессов СРО на экспериментальной модели неполной ишемии у крыс и сравнение данных, полученных при исследовании пациентов с ишемическим инсультом, показало их принципиальное сходство и их значимость в патогенезе заболевания.
Значительную роль в развитии процессов ПОЛ играют полиморфноядерные лейкоциты – нейтрофилы. В процессе их стимулирования происходит активация мембранных фосфолипаз, высвобождение арахидоновой кислоты и активация миелопероксидазной системы. Эти процессы приводят к запуску внутриклеточных реакций по типу «дыхательного взрыва» и к повышенной продукции высокоактивных форм кислорода (супероксиданиона, гидроксильного радакала, синглетного кислорода, перекиси). Добавление в систему люминола увеличивает квантовый выход реакции. Это позволяет регистрировать люминолзависимую хемилюминесценцию.
Для более подробного анализа процессов СРО изучена динамика показателей ХМЛ при моделировании ишемии головного мозга крыс. Наибольшие значения этих показателей зарегистрированы после 2-х часовой окклюзии. В других сериях эксперимента (1 и 3 сутки после 2-х окклюзии) также отмечено повышение хемилюминесценции, достоверно отличающиеся от показателей группы контроля, согласуется с данными литературы [29].
Особенно опасной для нервной ткани считается реоксигенация или реперфузия, приводящая к взрыву генерации АФК. В сериях эксперимента с моделированием этого патологического процесса нами также изучена люминолзависимая хемилюминесценция.
Результаты проведенных исследований показали, что реперфузионные процессы также сопровождаются усилением ХМЛ. В данной серии экспериментов выявлено повышение процессов ХМЛ на всех этапах. Однако наиболее выраженными они были после 2-часовой реперфузии, что согласуется с литературными данными об активации СРО в первые минуты и часы после реоксигенации.
Таким образом, изучение показателей ХМЛ показало их активацию практически на всех этапах эксперимента. Данный метод исследования процессов СРО является достаточно надежным и перспективным в силу его чувствительности и надежности. По нашему мнению‚ метод ХЛМ может быть использован при оценке СРО у больных с ишемическими поражениям головного мозга.
Изучение свободнорадикальных процессов как у больных ишемическим инсультом, так и в эксперименте показало их активацию, которая зависела от стадии процесса (окклюзия или реперфузия), тяжести заболевания.
ВЫВОДЫ
1. Окклюзионные и реперфузионные процессы при моделировании ишемии головного мозга сопровождались усилением свободнорадикальных процессов.
2. Концентрация МДА в сыворотке крови крыс значительно повышалась в первые сутки после окклюзии, а также во все периоды наблюдения после реперфузии.
3. При моделировании неполной ишемии головного мозга максимальные изменения хемилюминесценции крови экспериментальных животных наблюдались после 2-х часовой окклюзии и 2-х часовой реперфузии.
4. Показано принципиальное сходство показателей ХЛМ и уровня МДА в сыворотке крови крыс при экспериментальной ишемии и этих показателей у больных ишемическим инсультом [33].
ЛИТЕРАТУРА
1. Адамов А.К., Павлова Ю.П. Антимикробное действие системы ксантиноксидаза-ксантин на возбудителя холеры // Микробиология, эпидемиология и иммунология. 1990. №8. С. З.
2. Банкова В. В. Роль малонового диальдегида в регуляции перекисного окисления липидов в норме и патологии: Автореферат дис. ... д-ра биол. наук. М, 1990.
3. Биленко М.В. Ишемические и реперфузионные повреждения органов. М.: Медицина, 1989. 368 с.
4. Биленко М.В., Тельпухов В.И., Чураков Т.Д. Влияние ишемии и реперфузии головного мозга крыс на процессы ПОЛ и защитный эффект антиоксидантов // Бюл. эксперим. биологии и медицины. 1988. № 4. С. 394-397.
5. Боголепов Н.К. Церебральные кризы и инсульт. М.: Медицина, 1971. 392 с.
6. Болдырев А.А. Проблемы анализа эндогенных продуктов ПОЛ // Итоги науки и техники. 1986. Т.18. 134 с.
7. Верещагин Н.В. Патология вертебробазилярной системы и нарушения мозгового кровообращения. М.: Медицина, 1980. 310 с.
8. Верещагин Н.В., Моргунов В.А., Гулевская Т.С. Патология головного мозга при атеросклерозе и артериальной гипертонии. М.: Медицина, 1997.
9. Верещагин Н.В., Суслина З.А. Инсульт в зеркале медицины и общества // Вестник РАМН. 2003. № 11. С. 48-55.
10. Владимиров Ю.А. Активные формы кислорода и азота: значение для диагностики, профилактики и терапии // Биохимия. 2004. Т. 69. Вып. 1. С. 5-7.
11. Владимиров Ю.А. Свободные радикалы и антиоксиданты // Вестник РАМН. 1998. № 8. С. 43-51.
12. Владимиров Ю.А. Сверхслабые свечения при биохимических реакциях. М.: Наука, 1966.
13. Войков В.А., Новиков К.Н. Низкоинтенсивная хемилюминесценция цельной крови человека отражает её свойства как кооперативной биологической системы // Тез. II съезда биофизиков России: М, 1999. С 98-101.
14. Ворлоу Г.П., Деннис М.С., ван Гейн Ж. и др. Инсульт. Практическое руководство для ведения больных. СПб.: Политехника, 1998. 374 с.
15. Ганнушкина И.В. Мозговое кровообращение при разных видах циркуляторной гипоксии мозга // Вестник РАМН. 2000. № 9. С. 22-27.
16. Гомазков О. А. Ангиотензинпревращающий фермент в кардиологии: молекулярные и функциональные аспекты // Кардиология. 1997. № 11.
С. 58.
17. Гусев Е.И., Бурд Г.С., Боголепов Н.Н. Сосудистые заболевания головного мозга. М.: Медицина, 1979. 142 с.
18. Гусев Е.И. Ишемическая болезнь головного мозга // Актовая речьна сессии РАМН. Москва, 1992.
19.Гусев Е.И., Скворцова В.И., Мартынов М.Ю. Церебральный инсульт: проблемы и решения // Вестник РАМН. 2003. № 11. С. 44-48.
20. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. М.: Медицина, 2001. 326 с.
21. Гусев Е.И., Скворцова В.И., Коваленко А.В., Соколов М.А. Механизмы повреждения ткани мозга на фоне острой фокальной ишемии // Журнал неврологии и психиатрии им. С.С. Корсакова. 1999. № 2. С.65-70.
22. Давиденкова Е.Ф. Миелопероксидаза нейтрофилов и ее возможное участие в процессе перекисного окисления липидов // Клиническая медицина. 1989. № 6. С. 51.
23. Друх В.М., Фархутдинов Р.Р., Загидуллин Ш.З. Метод изучения хемилюминисценции лейкоцитов цельной крови // Клиническая лабораторная диагностика. 2004. № 12. С. 41-43.
24. Евдокимов Ф.А. Гемодинамически независимые эффекты ингибиторов АПФ у больных инфарктом миокарда: Автореферат дисс. … на соискан. учен. степеник.м.н.Москва, 2007. 25 с.
25. Зозуля Ю.А., Боровой В.А., Сутковой Д.А. Свободнорадикальное окисление и антиоксидантная защита при патологии головного мозга. М.: Знание-М, 2000. 344 с.
26. Зоров Д.Б., Банникова С.Ю., Белоусов и др. Друзья или враги. Активные формы кислорода и азота // Биохимия. 2005. Т. 70. Вып. 2. С. 265-272.
27. Карнеев А.Н., Соловьева Э.Ю., Федин А.И., Азизова О.А. Использование преператов α-липоевой кислоты в качестве нейропротективной терапии хронической ишемии мозга // Российский государственный медицинский университет. М.: НИИ физико-химической медицины Минздравсоцразвития России. 2006. Т. 4. № 8.
28. Ковалев Г.А., Свидко Е.Н. Современный взгляд на моделирование ишемии головного мозга у крыс. Харьков: ХНУ им. В. Н. Каразина.
29. Колпикова О.С. Состояние свободнорадикального окисления при инсульте и оценка антиокислительной активности препаратов // Автореферат дисс. … на соискан. учен. степени к.м.н. Уфа, 2003.
30. Курашвили Л.В., Косой Г.А., Захарова И.Р. Современное представление о перекисном окислении липидов и антиоксидантной системе при патологических состояниях // Методическое пособие. Пенза: Инс-т усоверш. врачей МЗ РФ, 2003. 32 с.
31. Кухтевич И.И. Ишемический инсульт. М.: Медицина, 2006. 170 с.
32. Ланкин В.З., Тихазе А.К., Беленков Ю.Н. Свободнорадикальные процессы при заболеваниях сердечно-сосудистой системы // Кардиология. 2000. № 7. С. 48-59.
33. Левашова О. А. Активность ферментов обмена регуляторных пептидов и некоторые биохимические показатели у больных ишемическим инсультом и в эксперименте: Автореферат дисс. …канд. биол. наук. Пенза, 2007. 127 с.
34. Лукьянчук В.Д., Лысенко Е.А., Савченкова Л.В., Бибик Е.Ю. // Фармакология средств, регулирующих прооксидантно-антиоксидантное состояние организма / Под ред. проф. В.Д.Лукьянчука. Луганск: Наука, 1999. 40 с.
35. Львова Л.В. Преемственность // Журнал Провизор. 2005. № 4. С. 33-41.
36. Мельникова Е.В., Скоромец А.А., Шестакова С.А. и др. Влияние нимодипина на свободнорадикальное окисление липидов при экспериментальной ишемии на фоне реноваскулярной гипертонии // Матер. IV Межд. симпозиума по транскраниальной допплерографии и электрофизиологич. мониторингу «Ишемия мозга». С.-Петербург, 1997. С. 148-150.
37. Мищенко В.П., Грицай Н.Н., Литвиненко Н.В., Мищенко И.В., Гришко Ю.М.. Регуляция тканями мозга защитных систем крови (антиоксидантной, свертывающей и фибринолитической) в условиях нормы и патологии // Архив клинической и экспериментальной медицины. Донецкий государственный медицинский университет им. М. Горького. 2001.С. 189.
38. Наврузов М. Б. Оксидантно-антиоксидантний и биоэнергетический гомеостаз в больных с ишемическим инсультом в ходе лечения: Автореф. дис... канд. мед. наук. Украина: АМН. 2005. 20 с.
39. Оглоблина В.М.Современные основы патогенеза острой церебральной ишемии. 2005. Т. 6. № 2.
http://www.infomed.com.ua/modules.php?name=Pages&go=page&pid=592
40. Платонов А.Е. Статистический анализ в медицине и биологии: задачи, терминология, логика, компьютерные методы. М.: Издательство РАМН, 2000. 52 с.
41. Рогожин В.В., Курилюк Т.Т. Повышение чувствительности метода определения концентрации малонового диальдегида с помощью тиобарбитуровой кислоты // Тезисы VII конференции «Аналитика Сибири и Дальнего Востока». Новосибирск, 2004. С. 90.
42. Розвадовский В.Д., Тренин С.О., Тельпухов В.И.. Микрохирургическая модель ишемии головного мозга // Журнал патологической физиологии и общей патологии. 1985. № 2.
43. Румянцева С.А. Комплексная антиоксидантная терапия реамбирином у больных с критическими состояниями неврологического генеза // Международный медицинский журнал. 2002. № 2. С. 129-137.
44. Самойлов М.О. Реакция нейронов мозга на гипоксию. Л.: Наука. 1985. 185с.
45. Скворцова В.И. Ишемический инсульт: патогенез ишемии, терапевтические подходы // Неврологический журнал. 2001. № 3. С. 4-9.
46. Скворцова Е.А., Гусев Е.И., Комиссарова И.А. Комплексное клинико-нейрофизиологическое изучение эффективности фармацевтического препарата глицина в остром периоде ишемического инсульта // Журнал невропатологии и психиатрии им. С.С.Корсакова. 1995. № 1. С.11-18.
47. Скулачев В.П. Кислород в живой клетке: добро и зло // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 1999. № 1. С. 12-18.
48. Стальная И.Д., Горишвили Т.Д. Метод определения малонового диальдегида с помощью тиобарбитуровой кислоты // Современные методы в биохимии. М.: Медицина, 1977. С. 66-68.
49. Стукова Н.Ю. Изменения функциональной активности кислородзависимых бактерицидных систем фагоцитов при взаимодействии с чумным микробом и его антигенами // Автореферат дисс. ... канд. мед. наук. Саратов, 1991.
50. Сумбаев В.В., Розанов А.Я. Исследования in vitro регуляции активности ксантиноксидазы печени крыс восстановителем – антиоксидантом // Украинский биохимический журнал. 1998. № 6. С.47-52.
51. Суслина З.А., Верещагин, Пирадов М.А. Подтипы ишемических нарушений мозгового кровообращения: диагностика и лечение // ConsiliumMedicum. 2001. Т. 3. №5. С. 22.
52. Суслина З.А., Максимова М.Ю., Кистенев Б.А., Федорова Т.Н. Нейропротекция при ишемическом инсульте: эффективность милдроната //Кардиология, неврология. М.: ГУ НИИ неврологии РАМН, 2005. № 13.
53.Суслина З.А., Федорова Т.Н., Максимова М.Ю. и др. Антиоксидантное действие милдроната и L-карнитина при лечении больных с сосудистыми заболеваниями головного мозга // Экспериментальная и клиническая фармакология. 2003. Т. 60. № 3. С. 32-35.
54. Тарасов Н.И., Тепляков А. Т., Малахович Е.В. и др. Состояние перекисного оксиления липидов, антиоксидантной защиты крови у больных инфарктом миокарда, отягощенным недостаточностью кровообращения // Тер. архив. 2002. № 12. C. 12-15.
55. Тимочко М.Ф., Кобильська Л.І. Вільнорадіальні реакції та їх метаболічна роль // Мед. хімія. 1999. Т. 1. № 1. С. 19-23.
56. Топчян А.В., Мирзоян Р.С., Баласанян М.Г. Лазерный доплеровский флоуметр и изучение фармакологических воздействий на микроциркуляцию коры головного мозга крыс // Методология флоуметрии. М.: Лаб. НИИ фармакологии РАМН, 1997. С. 129-136.
57. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. М.: Дрофа, 2005. С. 444-469.
58. Фадюкова О.Е., Алексеев А.А., Башкатова В.Г., Толордава И.А., Кузенков В.С., Микоян В.Д., Ванин А.Ф., Кошелев В.Б., Раевский К.С. Семакс предупреждает повышение генерации оксида азота в мозге крыс, обусловленное неполной глобальной ишемией // Эксперим. и клинич. фармакология. 2001. № 2. С. 31-34.
59. Фархутдинов Р.Р. Исследование хемилюминесценции биологического материала и оценка антиокислительной активности на приборе ХЛМ-003 // Методические рекомендации. Уфа, 2005.
60. Фархутдинов Р.Р., Лиховских В.А. Хемилюминесцентные методы исследования свободнорадикального окисления в биологии и медицине.Уфа: Изд-во БГМИ, 1995. 110 с.
61. Федин А.И. Современная концепция патогенеза и лечения острой ишемии мозга // Consilium-medicum. 2000. Т. 2. № 12. С. 6-12.
62. Федорова Т.Н., Болдырев А.А., Ганнушкина И.В. Перекисное окисление липидов при экспериментальной ишемии мозга // Биохимия. 1999. Т. 64. Вып. 1. С.94-98.
63. Федоров Г.Н., Леонов С.Д. Особенности хемилюминесценции цельной разведенной крови //Электронный математический и медико-биологический журнал. 2007. Т. 6. Вып. 4.
64. Чеснокова Н.П. Типовые патологические процессы // Саратов: Саратовский медицинский университет, 2004. С. 132-136.
65. Чехонин В.П., Лебедев С.В., Петров С.В. и др. Моделирование фокальной ишемии головного мозга // Вестник РАМН. 2004. № 3. С. 47-54.
66. Шмидт Е. В., Лунев Д. К., Верещагин Н. В. Сосудистые заболевания головного и спинного мозга. М.: Медицина, 1976. 283 с.
67. Эллиот В., Эллиот Д. Биохимия и молекулярная биология.М.: Наука 2002. 446 с.
68. Яхно Н.Н., Парфенов В.А. Ишемические острые нарушения мозгового кровообращения // ConsiliumMedicum. 2000. Т.2. № 12.
69. Gill R, Brazell C, Woodruff GN, Kemp JA. The neuroprotective action of dizocilpine (MK-801) in the rat middle cerebral artery occlusion model of focal ischemia // Br J Pharmacol. 1991. № 103. P. 2030-2036.
70. Hammerman C., Kaplan M. Ischemia and reperfusion injury. The ultimate pathophysiologic paradox // Clin. Perinatol. 1998. V. 25. № 3. Р. 757-777.
71. Mori T., Asano T., Matsui T., Muramatsu H. Intraluminal increase of superoxide anion follow transient focal cerebral ischemia in rats // Brain Res. 1999. V. 8. № 2. P. 350-357.
72. Overgaard K., Sereghy T., Boysen G., Pedersen H. Reduction of infarct volume and mortality by thrombolysis in rat embolic stroke model // Stroke. 1992. № 23. P. 1167-1173.
73. Sheng H., Bart R.D. Oury T.D. Mice overexpressing extracellular superoxide dismutase have increased resistance to focal cerebral ischemia Pearlstein R.D. // Neuroscience. 1999. V.88. № 1. Р. 185-191.
74. Smrcka M., Otevrel F., Kuchtickova S., Horky M., Juran V., Duba M., Graterol I. Experimental model of reversible focal ischemia in the rat // Scripta medica (BRNO). 2001. № 74. P. 391-398
75. Uchiyama M., Mihara M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test // Analyt. Biochemia. 1978. V. 86. P. 271-278.
ПРИЛОЖЕНИЕ
Приложение 1
Таблица1.
Оценка тяжести неврологической симптоматики при ишемии головного мозга у крыс (McGraw, 1977).
| Неврологические симптомы | Stroke-index |
| Вялость‚ замедленность движений | 0,5 |
| Тремор | 1,0 |
| Односторонний полуптоз | 1,0 |
| Двусторонний полуптоз | 1,5 |
| Слабость конечностей | 1,5 |
| Односторонний птоз | 1,5 |
| Манежные движения по кругу | 1,5 |
| Двусторонний птоз | 2,0 |
| Парез 1-4 конечностей | 2,0-5,0 |
| Паралич 1-4 конечностей | 3,0-6,0 |
| Коматозное состояние | 7,0 |
| Смерть | 10,0 |
Приложение 2
Таблица 1.
Динамика концентрации ТБК-АП (МДА) в сыворотке крови при моделировании ишемии головного мозга (мкмоль/л)
| Воздействие на мозг | Время после ишемии | Контроль | ||
| 2 часа | 1 сутки | 3 сутки | ||
| Окклюзия | 1,99* (1,23-2,76) |
3,0* (2,43-3,58) |
2,6* (1,84-2,7) |
1,12 (1,1-1,2) |
| Реперфузия | 3,9* (2,46-5,4) |
3,1* (2,46-3,7) |
3,1* (2,46-3,48) |
|
* - достоверно по сравнению с контролем, p <0,05
Таблица 2.
Динамика показателей ХМЛ цельной крови при моделировании ишемии головного мозга крыс (в отн. ед.)
| Воздействие на мозг | Время после ишемии | Контроль | ||
| 2 часа | 1 сутки | 3 сутки | ||
| Окклюзия | 3,18* (2,37-5,8) |
1,8* (1,5-2,1) |
1,8* (1,53-1,9) |
0,72 (0,32-1,28) |
| Реперфузия | 2,86* (2,63-3,0) |
1,58* (1,33-1,66) |
1,74 (0,86-1,96) |
|
*- достоверно по сравнению с группой контроля, p<0,05.