| Скачать .docx | Скачать .pdf |
Реферат: Предмет, задачи и методы физиологии растений
Содержание
1. Предмет, задачи и методы физиологии растений
15. Нуклеиновые кислоты, их структура. Функциональные группы нуклеиновых кислот.
31. Понятие об осмотическом давлении. Осмотическое давление разных клеток и тканей растения.
57. Роль пигментов в жизни растений
68. Биосинтез углеводов, ферменты углеводного обмена. Различия между ассимиляционным и запасным крахмалом.
85. Дыхание как совокупность последовательных окислительно-восстановительных процессов
96. Структура АТФ, ее синтез. Роль АТФ в обмене веществ.
Список литературы
1. Предмет, задачи и методы физиологии растений
Физиология растений — наука, которая изучает процессы жизнедеятельности и функции растительного организма. Слово «физиология» греческого происхождения; оно состоит из двух слов: physis — природа и logos — понятие, учение. Физиология растений является наиболее развитой отраслью экспериментальной ботаники, которая в XIX в. выделилась в самостоятельную науку. Она тесно связана с химией, физикой, биохимией, биофизикой, микробиологией, молекулярной биологией.
Перед научными работниками, физиологами растений поставлены такие задачи : изучить обмен веществ и энергии в растительном организме, фотосинтез, хемосинтез, биологическую фиксацию азота из атмосферы и корневое питание растений; разработать методы повышения использования растениями солнечной энергии и питательных веществ почвы, обогащения почвы азотом; создать новые, более эффективные формы удобрений и разработать методы их применения; исследовать действие биологически активных веществ с целью использования их в растениеводстве; разработать методы более продуктивного использования воды растением. Без решения этих вопросов невозможно решение и ряда других проблем земледелия и растениеводства, направленных на повышение урожайности.
Интенсивное применение минеральных удобрений, гербицидов, физиологически активных веществ, химических препаратов для защиты растений от болезней и вредителей требует глубокого и всестороннего изучения их влияния на рост и обмен веществ растительных организмов с целью значительного повышения продуктивности сельскохозяйственных растений.
Решение поставленных задач имеет большое значение для разработки проблем ускорения научно-технического прогресса в растениеводстве и дальнейшего развития сельского хозяйства нашей страны.
Основной метод познания процессов , явлений в физиологии — эксперимент, опыт. Следовательно, физиология растений — наука экспериментальная.
Для изучений физико-химической сути функций, процессов в физиологии растений широко применяют методы: лабораторно-аналитический, вегетационный, полевой, меченых атомов, электронной микроскопии, электрофореза, хроматографического анализа, ультрафиолетовой и люминесцентной микроскопии, спектрофотометрии и др. Кроме того, используют фитотроны и лаборатории искусственного климата, в которых выращивают растения и проводят опыты в условиях определенного состава воздуха, нужной температуры и освещения. Применяя эти методы, физиологи исследуют растения на молекулярном, субклеточном, клеточном и организменном (интактное растение) уровнях.
Сейчас в биологических исследованиях широко применяют электронные микроскопы просвечивающего типа с разрешающей способностью 0,15—0,5 нм, в которых объект рассматривают в электронных лучах, проходящих через него. Значительное увеличение разрешающей способности электронных микроскопов по сравнению со световыми обусловливается меньшей длиной волны электронов (на пять порядков меньшей, чем длина волны ультрафиолетовых лучей).
Кроме того, для биологических исследований применяют так называемые растровые электронные микроскопы, в которых изображение создается по принципу телевизионных. Разрешающая способность растровых микроскопов равна 20—40 нм, с их помощью изучают строение поверхности пыльцы, эпидермального слоя клеток, формы клеток и др. Применение электронной микроскопии в биологии имеет большое значение для развития биологической науки и физиологии растений в частности.
Исследование ультраструктуры органоидов растительной клетки (хлоропластов, митохондрий, рибосом, мембранных структур) дало возможность раскрыть суть процессов фотосинтеза и дыхания, которые определяют возможность самой жизни на нашей планете. Изучение строения клеточных оболочек, открытие цитоплазматических мембранных структур способствовали выяснению процессов обмена веществ и энергии в клетке, изучению структуры и функции органоидов растительной клетки. Большое принципиальное значение имеет электронно-микроскопическое исследование строения РНК и ДНК, локализации их на структурных компонентах клетки. Результаты этих исследований легли в основу раскрытия генетической роли ядра и проблемы наследственности.
15. Нуклеиновые кислоты, их структура. Функциональные группы нуклеиновых кислот
Нуклеиновые кислоты (НК) представляют собой гетерополимеры, мономерами которых являются нуклеотиды. Нуклеотид состоит из азотистого основания, связанного с ним пятиуглеродного сахара и остатка ортофосфорной кислоты (Р). В НК присутствуют азотистые основания двух типов — производные пурина (пуриновые) и производные пиримидина (пиримидиновые). К пуриновым основаниям относятся аденин (А), гуанин (Г), к пиримидиновым — цитозин (Ц), урацил (У) и тимин (Т).

Каждый нуклеотид получает название по входящему в него азотистому основанию, например адениловая кислота (или аденозинмонофосфат — АМФ): аденин — рибоза — Р.
АМФ может фосфорилироваться с образованием аденозиндифосфата — АДФ (аденин—рибоза—Р ~ Р); фосфорилирование последнего приводит к образованию аденозинтрифосфата (АТФ):

При гидролитическом отщеплении остатка фосфорной кислоты от АМФ высвобождается 12,6 кДж, гидролиз же второй или третьей фосфатной связи в АТФ дает около 33,6 кДж. Универсальным энергетическим аккумулятором в клетке является АТФ. Присоединение остатка фосфорной кислоты к АДФ с использованием энергии окисления (при дыхании) или света (при фотосинтезе) представляет «зарядку». Отщепление фосфата от АТФ с образованием АДФ сопровождается выходом энергии — «разрядка»:
АДФ + Фнеорг + энергия →АТФ + Н2 О — «зарядка»;
АТФ + Н2 О → АДФ + Фнеорг + энергия — «разрядка».
Энергия макроэргической связи АТФ расходуется в клетке на самые разные виды работ.
Не только АТФ, но и другие трифосфатнуклеотиды (ГТФ, ЦТФ, УТФ, ТТФ) являются макроэргическими соединениями, способными при гидролизе концевой фосфатной связи освобождать большое количество энергии.
При образовании НК нуклеотиды соединяются друг с другом с помощью фосфорно-эфирной связи, возникающей между остатком фосфорной кислоты у пятого атома рибозы или дезоксирибозы и гидроксилом третьего атома сахара следующего нуклеотида:

Образующаяся полинуклеотидная цепочка имеет два конца — 5', где расположена несвязанная фосфатная группа, и 3', у которой находится свободная группа ОН при третьем атоме пентозы.
НК подразделяют на рибонуклеиновые (РНК) и дезоксирибо-нуклеиновые (ДНК). Их состав различен. В РНК входят нуклеотиды с А, Г, Ц, У, сахар — рибоза. ДНК содержит А, Г, Ц, Т, сахар — дезоксирибоза. Последовательность нуклеотидов определяет первичную структуру НК.
Как и белки, НК имеют сложную специфическую структуру, в основе которой лежит принцип комплементарности. Комплементарность проявляется в том, что азотистые основания взаимодействуют друг с другом посредством образования водородных связей строго попарно — А с Т или У, а Г с Ц. Между комплементарными основаниями возникают две или три водородные связи (…..):
![]()
Трехмерная структура ядерной ДНК представляет собой двойную спираль: две правозакрученные спирали переплетены друг с другом, при этом 3' — конец одной из них соответствует 5' — концу другой. Структура двойной спирали стабилизируется водородными связями между комплементарными нуклеотидами. Молекула ДНК хлоропластов и митохондрий (как и ДНК прокариот) замкнута в кольцо.
В интерфазе клеточного деления ДНК входит в состав особого ядерного вещества — хроматина, в котором также присутствуют белки — основные (гистоны) и неосновные, а также небольшое количество РНК и липидов. Основой структуры хроматина являются нуклеосомы, которые представляют собой белковые диски из 8 молекул гистонов, по окружности которых намотана часть ДНК (140 пар оснований). Нуклеосомы соединяются участками ДНК (линкерами), состоящими приблизительно из 60 нуклеотидных пар. Нуклеосомная укладка ДНК способствует ее компактизации, степень которой увеличивается в митотическом ядре. В период митоза хроматин формирует хромосомы, число и форма которых являются важнейшим критерием вида. При образовании хромосомы 8—10 нуклеосом объединяются в виде глобул. В дальнейшем уплотненная таким образом структура образует петли. Сближаясь между собой, они формируют толстые (0,1—0,2 мкм) хромосомные нити (хромонемы), которые, в свою очередь, образуют видимые в микроскоп хромосомы. Все это обеспечивает концентрацию в небольшом ядре Огромного количества наследственной информации, а также облегчает абсолютно точное ее распределение между дочерними клетками. Структура молекул РНК достаточно разнообразна, что связано с многообразием их функций. Так, матричная (информационная) РНК представляет собой одинарную спираль, для транспортной РНК характерно сочетание одинарных и спаренных участков, рибосомальная РНК имеет более сложную структуру.
31. Понятие об осмотическом давлении. Осмотическое давление разных клеток и тканей растения
Когда раствор отделен от воды полупроницаемой мембраной, которая пропускает только растворитель и непроницаема для растворенных веществ, возникает односторонний ток воды по градиенту ее активности в направлении раствора. Этот процесс называется осмосом, а дополнительное давление, которое должно быть приложено к раствору, чтобы воспрепятствовать одностороннему току воды, — осмотическим давлением .
Таким образом, осмотический потенциал раствора, отделенного полупроницаемой мембраной от чистого растворителя, реализуется в равном по величине и обратном по знаку осмотическом давлении. Растворы с одинаковым давлением называются изотоническими, между ними нет направленного водообмена. Раствор, имеющий большее осмотическое давление, называется гипертоническим, меньшее — гипотоническим. При разделении полупроницаемой мембраной транспорт воды идет по направлению к гипертоническому раствору.
Клетка, а также все органеллы, окруженные мембранами (хлоропласты, митохондрии и др.), представляют собой осмотические системы. Поскольку мембраны обладают избирательной проницаемостью и вода проходит через них значительно легче, чем растворенные вещества, допускают, что мембраны полупроницаемы, т. е. проницаемы только для воды. Всю цитоплазму обычно рассматривают как единый полупроницаемый барьер.
В зрелых растительных клетках главным «осмотическим пространством» является вакуоль. Именно клеточный сок, содержащий растворенные в воде различные соли, сахара, органические кислоты, аминокислоты и другие соединения, представляет собой осмотический актив клетки. Суммарная концентрация растворенных веществ в клеточном соке варьирует от 0,2 до 0,8 М. Осмотический потенциал клеточного сока измеряется сотнями и достигает тысяч кПа.
В проводящих элементах стебля и корня, как правило, отрицательная величина осмотического потенциала очень низка. В листьях осмотический потенциал колеблется от 10 до 18 бар.
Осмотический потенциал различен у разных жизненных форм. У древесных пород он более отрицателен, чем у кустарников, а у кустарников более отрицателен, чем у травянистой растительности. У светолюбивых растений осмотический потенциал более отрицателен, чем у тенелюбивых.
57. Роль пигментов в жизни растений
Хлорофиллы
Важную роль в процессе фотосинтеза играет зеленый пигмент — хлорофилл. Французские ученые Пелетье и Кавенту (1818) выделили из листьев зеленое вещество и назвали его хлорофиллом (от греч. «хлорос» — зеленый и «филлон» — лист).
У всех высших зеленых растений содержатся хлорофиллы а и б. Хлорофилл с содержится в диатомовых водорослях, хлорофилл д— в красных. Известны четыре бактериохлорофилла (а, б, с, д) ,содержащиеся в клетках фотосинтезирующих бактерий.
Основными пигментами, без которых фотосинтез не идет, являются хлорофилл а для зеленых растений и бактериохлорофилл для бактерий.
У низших растений и некоторых голосеменных (у хвойных) хлорофилл может образовываться в темноте. Почти у всех видов хвойных при прорастании семян в темноте семядоли зеленеют. По мере роста проростков в темноте образовавшийся хлорофилл разрушается, и на 35—40-й день проростки при отсутствии света погибают. Проростки хвойных, выращенные из изолированных зародышей в темноте, хлорофилла не образуют, однако достаточно присутствия даже небольшого эндосперма, чтобы проростки начали зеленеть.
Фикобилины
Сине-зеленые водоросли (цианобактерии), красные морские водоросли и некоторые морские криптомонады помимо хлорофилла а и каротиноидов содержат пигменты фикобилины. Наиболее известные представители фикобилинов — фикоэритробилины и фикоцианобилины. Первые преобладают у красных водорослей, вторые — у сине-зеленых.
Значение фикобилинов — поглощать лучи определенного участка спектра. Максимумы поглощения света у фикобилинов находятся между двумя максимумами поглощения у хлорофилла: в оранжевой, желтой и зеленой частях спектра. Значение такого распределения максимумов поглощения становится понятным, если вспомнить оптические свойства воды, которая поглощает прежде всего длинноволновые лучи. На глубине 34 м в морях и океанах полностью исчезают красные лучи, на глубине 177 м — желтые, на глубине 322 м — зеленые и, наконец, на глубине свыше 500 м не проникают даже синие и фиолетовые лучи. В связи с этим изменением качественного состава света в верхних слоях морей и океанов обитают преимущественно зеленые водоросли, глубже сине-зеленые и еще глубже водоросли с красной окраской. Такое явление В. Т. Энгельман назвал хроматической комплементарной адаптацией водорослей.
У водорослей фикобилины — дополнительные пигменты, выполняющие вместо хлорофилла б функции светособирающего комплекса. Около 90% энергии света, поглощенного фикобилинами, передается на хлорофилл а. Кроме фикобилинов, участвующих в фотосинтезе у водорослей, у всех растений имеется другой фикобилин — фитохром, являющийся фиторецептором для восприятия красного и дальнего красного света и выполняющий регуляторные функции.
Каротиноиды
Это большая группа пигментов желтого, оранжевого и красного цвета. Каротиноиды широко распространены в природе: их обнаружено больше трехсот. Однако в фотосинтезе участвуют лишь некоторые из них.
Поглощение света каротиноидами, а следовательно, их окраска обусловлены наличием конъюгированных двойных связей. β-каротин имеет два максимума поглощения, соответствующие длинам волн 482 и 452 нм. Красные лучи, поглощаемые хлорофиллами, каротиноидами не поглощаются. Каротиноиды в отличие их от хлорофилла не обладают способностью к флюоресценции. Подобно хлорофиллу, каротиноиды в хлоропластах вступают во взаимодействие с белками.
Каротиноиды принимают участие в процессе фотосинтеза, но их роль вспомогательная. Они поглощают определенные участки спектра света и передают энергию на хлорофилл, одновременно защищая молекулу хлорофилла от необратимого фотоокисления. Возможно, каротиноиды принимают участие в кислородном обмене при фотосинтезе. У высших растений, мхов, зеленых и бурых водорослей осуществляется светозависимое взаимопревращение ксантофиллов. Примером может служить виолаксантиновый цикл.

Значение виолаксантинового цикла остается невыясненным. Возможно, он служит для устранения излишков кислорода.
Производные каротиноидов — витамин А, ксантоксин, действующий подобно АБК. Хромопротеин родопсин, обнаруженный у некоторых галофитных бактерий, поглощая свет, функционирует в качестве Н+ -помпы. Хромофорной группой бактериородопсина является ретиональ-альдегидная форма витамина А.
68. Биосинтез углеводов, ферменты углеводного обмена. Различия между ассимиляционным и запасным крахмалом
В растениях в процессе фотосинтеза образуются не только фосфорные эфиры сахаров или простые сахара, но и более сложные формы углеводов — сахароза, крахмал, клетчатка. Распад сложных форм углеводов до простых протекает тоже очень быстро. Это наблюдается, например, при прорастании семян, старении вегетативных органов и др. Образующиеся при распаде простые сахара или их фосфорные эфиры оттекают в репродуктивные органы, где из них вновь синтезируются сложные углеводы. И, наконец, в растениях очень легко идут процессы взаимных превращений углеводов.
Взаимопревращение моносахаридов проходит через фосфорные эфиры сахаров или их уридиндифосфатпроизводные (УДФ-производные). УДФ-производные сахаров представляют собой тот или иной сахар, соединенный через два остатка фосфорной кислоты с уридином, например:

Уридиндифосфатглюкоза
Примеры взаимных превращений сахаров могут быть представлены в виде следующей схемы.
Схема взаимопревращений сахаров
| Фруктоза | Глюкоза | |||
| ↑↓ | ДФ-глюкоза | |||
| фруктозо-6-фосфат | глюкозо-6-фосфат | |||
| ↑↓ | ||||
| маннозо-6-фосфат | глюкозо-1-фосфат | АДФ-глюкоза | ||
| ↑↓ | ↑↓ | |||
| манноза | УДФ-глюкоза | ↔ | УДФ-глюкоза | |
| ↓ | ||||
| глюкуронат-1 -фосфат | ↔ | УДФ-глюкуроновая | ↔ | УДФ-галактуро- новая кислота |
| кислота | ||||
| ↓ | ↓ | ↓ | ||
| глюкуроновая кислота | УДФ-ксилоза | галактуронат-1- | ||
| ↓ | ↓ | фосфат | ||
| гулоновая кислота | УДФ-арабиноза | ↓ | ||
| ↓ | ↓ | галактуроновая | ||
| гулонолактон | арабинозо-1 -фосфат | кислота | ||
| ↓ | ↓ | |||
| аскорбиновая кислота | арабиноза | |||
Синтез сахарозы. Сахароза наиболее распространенный дисахарид. В растениях он образуется из глюкозы и фруктозы. На первом этапе идетфосфорилирование глюкозы:
Глюкоза + АТФ → глюкоза-6-фосфат + АДФ,
затем глюкозо-6-фосфат изолируется в глюкозо-1-фосфат. Глюкозо-1-фосфат соединяется с УТФ, в результате чегоотщепляется пирофосфатная кислота и образуется соединение глюкозы с уридиндифосфорной кислотой (УДФ) — уридиндифосфатглюкоза.
Одновременно идет фосфорилирование фруктозы под действием фермента фруктокиназы с участием АТФ:
фруктоза + АТФ → фруктозо-6-фосфат + АДФ.
После этого происходит взаимодействие УДФ-глюкозы с фруктозо-6-фосфатом с участием фермента сахарозофосфат-УДФ-глюкозилтрансферазы. Наконец, образовавшийся сахарозо-6-фосфат под действием фермента фосфатазы гидролизуется с образованием свободной сахарозы.
Таким образом, для биосинтеза одной молекулы сахарозы необходимы 3 макроэргические фосфатные связи, эта реакция необратима.
В нефотосинтезирующих тканях некоторых растений, например, в корнеплодах сахарной свеклы, клубнях картофеля и других сахароза может образоваться из свободной фруктозы:
УДФ-глюкоза + фруктоза ↔ сахароза + УДФ.
Реакция катализируется ферментом сахарозо-УДФ-глюкозилтрансферазой и в зависимости от условий может быть направлена как в сторону синтеза, так и в сторону расщепления сахарозы.
Синтез крахмала. Крахмал состоит из амилозы, представляющей собой неразветвленную цепь остатков ос-глюкозы, соединенных α(1-4)-связями, и амилопектина — разветвленной молекулы, в которой наряду с α(1-4)- имеются и α(1-6)-связи. В строении этих двух сахаров, входящих в крахмал, имеются существенные различия, поэтому механизмы их биосинтеза различны.
Донором глюкозных остатков при биосинтезе амилозы может служить уридиндифосфатглюкоза-(УДФК). Для ее образования в реакционной среде необходимо наличие затравки, в качестве которой могут служить полисахариды, построенные всего лишь из 3—4 остатков глюкозы, соединенных α(1-4)-связями.
Остатки глюкозы переносятся на акцептор (затравку), где и происходит удлинение цепи. Реакция идет по схеме:
УДФГ + акцептор (Г)к —— УДФ + акцептор (Г)к + 1,
где Г — остатки глюкозы.
Фермент, катализирующий эту реакцию, называется УДФГ-крахмалглюкозилтрансферазой.
У большинства растений активным донором глюкозы является не УДФ-глюкоза, а аденозиндифосфатглкжозα(АДФГ). Реакция присоединения глюкозных остатков от АДФГ к низкомолекулярному акцептору идет аналогичным путем и катализируется ферментом АДФГ-крахмал-глюкозилтрансферазой.
Синтез разветвленной молекулы амилопектина, имеющей α (1-6)-связи, происходит при помощи фермента α-глюкантрансферазы (Q-фермент).
В синтезе крахмала участвуют и Д-фермент или глюкозилтрансфераза, образующий α(1-4)-связи и участвующий в образовании затравки.
Распад крахмала происходит при участии двух процессов - гидролиза и фосфоролиза.
Гидролитический распад крахмала осуществляется под действием четырех ферментов класса гидролиз α-амилаза, катализирует расщепление α(1-4)-связи, причем связи разрываются беспорядочно. Конечный продукт такого распада — мальтоза, глюкоза, декстрины. Под действием β-амилазы происходит расщепление α (1-4)-связей с образованием остатков мальтозы. Фермент глюкоамилазы катализирует последовательное отщепление остатков глюкозы от молекулы крахмала. Амилопектин-1,6-глюкозидаза или R-фермент катализирует расщепление α(1-6)-связей в молекуле амилопектина, т. е. действует на точки ветвления.
Фосфоролиз — это присоединение фосфорной кислоты по месту разрыва глюкозидной связи между остатками моносахаридов в цепи полисахарида, при этом происходит образование глюкозо-1-фосфата. Эта реакция катализируется ферментомаглюконфосфорилазой, относящимся к классу трансфераз. Крахмал в растении может подвергаться очень быстрому распаду, так как ферменты распада находятся во всех органах растения.
Синтез целлюлозы. Целлюлоза построена из остатков β-глюкозы. В биосинтезе целлюлозы принимает участие не свободная глюкоза, а ее ГДФ-производное — гуанозиндифосфатглюкоза при участии фермента целлюлозосинтетазы по схеме:
ГДФ — глюкоза + (глюкоза) к→ ГДФ + (глюкоза)к + 1
Распад целлюлозы идет преимущественно гидролитическим путем под действием фермента целлюлазы до дисахарида целлобиозы.
Транспорт углеводов осуществляется в виде сахарозы. В процессе фотосинтеза образуется много углеводов, и в этой связи большое значение имеет отток ассимилятов в другие части клетки из хлоропластов. Проникновение через мембрану хлоропластов фосфорилированных гексоз и сахарозы затруднено, наиболее легко через мембраны хлоропластов проникают триозофосфаты (ФГА и ФДА). Предполагается, что образующиеся сложные углеводы распадаются на триозофосфаты и в таком виде передвигаются в цитоплазму, где могут служить материалом для ресинтеза гексоз, сахарозы, крахмала.
Межклеточный паренхимный транспорт осуществляется двумя путями — по плазмодесмам (симпласту) или по свободному пространству (аппопласту). Сахароза, образовавшаяся в клетках мезофилла листа, десорбируется в аппопласт. Выходя из паренхимных клеток в аппопласт, сахароза расщепляется инвертазой на гексозы. Гексозы передвигаются по аппопласту к передаточным клеткам проводящих пучков по градиенту концентраций. При соприкосновении с передаточными клетками флоэмы они снова превращаются в сахарозу. Далее происходит загрузка ситовидных трубок, сахароза поступает против градиента концентраций, и требуется расход энергии (АТФ).
Предполагается, что сахароза преодолевает мембрану с помощью переносчика в комплексе с протоном. При этом благодаря работе Н+ -АТФ-азы ионы Н+ выкачиваются из клеток флоэмы, а затем поступают обратно по градиенту рН, увлекая за собой сахарозу против градиента ее концентрации. Основной транспортной формой углеводов по флоэме служит сахароза (С12 Н22 О11 ). У некоторых видов наряду с сахарозой транспортной формой углеводов служат олигосахара (рафиноза, стахиоза), а также некоторые спирты.
85. Дыхание как совокупность последовательных окислительно-восстановительных процессов
В процессе дыхания участвует сложная цепь окислительно-восстановительных превращений углеводов и жиров. Под окислением какого-либо соединения понимают процесс потери им электрона (протона), под восстановлением — их присоединения, протекающие по одному из следующих путей.
Непосредственное присоединение к веществу кислорода, например, в процессе образования воды:
2Н2 + O2 → 2Н2 О.
Нередко процесс отдачи электрона может происходить без участия кислорода:
![]()
Одновалентная медь служит донором электрона и окисляется до Сu2+ . В обратной реакции Сu2+ — акцептор электронов восстанавливается до Сu .
Перенос электронов во многих окислительно-восстановительных реакциях сопровождается одновременным переносом протонов, как при окислении янтарной кислоты в фумаровую:

Для непрерывного протекания этой реакции необходимо наличие в системе акцептора водорода.
Способность вещества к окислению сильно возрастает, если оно предварительно гидратируется:

В живых системах окисление одного соединения всегда сопряжено с восстановлением другого. Любая окислительно-восстановительная система может функционировать как окислитель или как восстановитель в зависимости от соотношения величины ее собственного потенциала и потенциала системы, с которой она взаимодействует. Максимальную величину потенциала в клетке имеет кислород, благодаря чему он служит универсальным окислителем.
96. Структура АТФ, ее синтез. Роль АТФ в обмене веществ
Аденозинтрифосфорная кислота (АТФ) состоит из органического основания аденина (I), углевода рибозы (II) и трех остатков фосфорной кислоты (III). Соединение аденина и рибозы называется аденозином. Пирофосфатные группы имеют макроэргические связи, обозначенные значком ~. Разложение одной молекулы АТФ с участием воды сопровождается отщеплением одной молекулы фосфорной кислоты и выделением свободной энергии, которая равна 33—42 кДж/моль. Все реакции с участием АТФ регулируются ферментными системами.
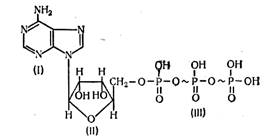
Аденозинтрифосфорная кислота (АТФ)
Синтез АТФ происходит в мембранах митохондрий в процессе дыхания, поэтому все ферменты и кофакторы дыхательной цепи, все ферменты окислительного фосфорилирования локализованы в данных органеллах.
Синтез АТФ происходит таким образом, что два иона Н+ отщепляются от АДФ и фосфата (Р) с правой стороны мембраны, компенсируя потерю двух Н+ при восстановлении вещества В. Один из кислородных атомов фосфата переносится на другую сторону мембраны и, присоединив два иона Н+ из левого отсека, образует Н2 О. Остаток фосфорила присоединяется к АДФ, образуя АТФ.

Схема окисления и синтеза АТФ в митохондриальных мембранах.
В клетках организмов изучено много биосинтетических реакций, использующих энергию, заключенную в АТФ, в ходе которых происходят процессы карбоксилирования и декарбоксилирования, синтеза амидных связей, образования макроэргических соединений, способных переносить энергию от АТФ к анаболическим реакциям синтеза веществ. Эти реакции играют важную роль в процессах обмена веществ растительных организмов.
С участием АТФ и других макроэргических нуклеозидполифосфатов (ГТФ, ЦТФ, УГФ) может происходить активирование молекул моносахаридов, аминокислот, азотистых оснований, ацилглицеринов путем синтеза активных промежуточных соединений, являющихся производными нуклеотидов. Так, например, в процессе синтеза крахмала с участием фермента АДФ-глюкозо-пирофосфорилазы образуется активированная форма глюкозы — аденозиндифосфатглюкоза, которая легко становится донором глюкозных остатков при формировании структуры молекул этого полисахарида.
Список литературы
1. Лебедев С.И. Физиология растений. — М.: Колос, 1982.—463 с, ил.
2. Физиология и биохимия сельскохозяйственных растений /Н. Н. Третьяков, Е. И. Кошкин, Н. М. Макрушин и др.; под ред. Н. Н. Третьякова. — М.: Колос, 2000 — 640 с: ил.
3. Кириллов Ю. И., Кокин Г. А. Физиология растений: Учебное пособие. Курган, издательство «Зауралье», 1998, 304 с. ил.