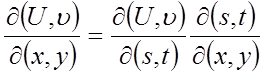| Скачать .docx |
Реферат: Изучение некоторых вопросов термодинамики
ГЗОГЯН В. М.
ИЗУЧЕНИЕ НЕКОТОРЫХ ВОПРОСОВ ТЕРМОДИНАМИКИ
Пособие для студентов физических специальностей
Применяется метод решения задач, основанный на использовании якобианов, который позволяет легко перейти от недоступных измерению величин к доступным.
Приведены примеры решения подобных задач, для которых получены общие дифференциальные соотношения, позволяющие анализировать полученные выражения для идеальных и реальных систем. Показано, что одно и то же значение частной производной, при постоянном значении выбранного параметра, можно получить несколькими способами, в зависимости от выбора промежуточных переменных. Это даёт возможность, с одной стороны, проверить правильность полученных соотношений, а с другой, ввести в рассмотрение такие новые якобианы, тождественно равные единице, которые относительно быстро приводят к решению задачи.
Пособие может быть рекомендовано студентам физических специальностей высших учебных заведений, желающих углубить свои знания в данной области, и использовано ими в учебно-исследовательской работе при составлении и решении новых задач и интерпретации полученных соотношений.
КРАТКОЕ ВВЕДЕНИЕ
Перестройка программы высших учебных заведений по общей и теоретической физике предполагает усовершенствование методов изучения отдельных вопросов и разделов, а также и методов решения задач. Это усовершенствование должно позволить студентам не только глубже усвоить физическое содержание рассматриваемого вопроса, но и видеть взаимосвязь между изучаемыми явлениями.
При изучении ряда вопросов и решении части задач термодинамики часто приходится производить преобразование термодинамических величин, например, преобразования переменных, поддерживаемых постоянными в ходе процесса, другими. Такие преобразования нужно совершать по общим правилам замены переменных при дифференцировании функций по нескольким переменным. [1].
Один и з спос обов п ре образован ия те рмодинамических величин при веден в [1] . Однако преобразования вели чин целес ообразно производить методом якоби анов, но для этого не обходимо ознакомить с туден тов с якобиан ами и их свой ствами [ 2].
Якобианом называется определитель

причем такой символ сле дуе т рассматривать как единый, а U и υ – как функци и Х и У .
Якобиан обладает следующим и важ ными свой ствами :
1. 
2. 
4. 
Если система может быть описана тре мя независимыми пе ре мен ными , н апример, в случае си стемы с перемен ным коли чеством в ещес тва, то целесообразн о использовать якоби ан вида:
 ,
,
который раскрывается как определитель третьего порядка. Для систем с четырьмя независимыми переменными, якобиан раскрывается как определитель четвертого порядка и т. д.
Таким образом, в термодинамике, согласно [3], существует такое множество соотношений, что н е имеет смысла их запомин ать. Лучше запомн ить лишь термоди намичес кое тождество, объединяющее первое и второе начала, определения термодинам ических потенциалов и как ое -н ибудь правило преобраз ования одного набора переменных в другой, что легко осуществить составлен ием дет ер мин антов Якоби.
Применение якобианов, с одной стороны, позволяет устанавливать связь между термодинамическими величинами (коэффициентами) наи более простым способом, а с другой – даёт возможнос ть легко перейти от недоступных измерению величин к доступным.
ТЕРМОДИ НАМИЧ ЕСКИЕ КОЭФФИЦИЕНТЫ И УСТАНОВЛЕНИЕ СВЯЗИ МЕЖДУ НИМИ.
Согласно [4],
термодинамическими коэффициентами н
азыва
ютс
я выражения вида  ,
где символами l, m, n обозначены р
, V
, Т
, S
. Эти коэффициенты характеризуют определённые свойства системы.
,
где символами l, m, n обозначены р
, V
, Т
, S
. Эти коэффициенты характеризуют определённые свойства системы.
 Составим таблицу те
рмодинамичес
ких коэффи
циен
тов так, чтобы первая с
трока не
содержала S
,
вторая – Р,
третья – V
и четвертая – Т
:
Составим таблицу те
рмодинамичес
ких коэффи
циен
тов так, чтобы первая с
трока не
содержала S
,
вторая – Р,
третья – V
и четвертая – Т
:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Можно показать, что если четыре из них, подчеркнутых в таблице, выбрать в качестве независимых коэффициентов, то остальные восемь могут быть выражены через них. Действительно, нетрудно заметить, что произведение коэффициентов, стоящих в одной строке данной таблицы, равно минус единице. Например, для первой строки

Разделив обе части данного выражения на  , получим
, получим
 (2.2)
(2.2)
 (2.3)
(2.3)
 (2.4)
(2.4)
 (2.5)
(2.5)
 Ещё четыре соотношения между те
рмодинамичес
кими коэффициентами можно получить из выражений для дифференциалов термодинамических функций
Ещё четыре соотношения между те
рмодинамичес
кими коэффициентами можно получить из выражений для дифференциалов термодинамических функций
dU = TdS – pdV
![]() dF = – SdT – pdV
dF = – SdT – pdV
dI = TdS + Vdp
dФ = – SdT + Vdp
или же путем пре образован ия основного термодинамического тождества, справедливого для всех функций, с помощью введения новых якобианов, равных единице.
Поскольку термодинамические функции являются функциями состояния, то правые части выражений (2.6) должны удовлетворять требованиям
 (2.7)
(2.7)
 (2.8)
(2.8)
 (2.9)
(2.9)
 (2.10)
(2.10)
Основное термодинамическое тождество можно получить из этих выражений. Действительно, из (2.7) имеем

откуда
 (2.11)
(2.11)
Из сказанного с ле дует также, что выражения (2 .7)—(2.10) могут быть получены из основного тождества (2.11).
После того, как записаны основные уравнения, в принципе, мы могли бы, как это сделано в [4], выбрать в (2.1) три независимых коэффициента и с помощью этих уравнений выразить оставшиеся коэффициенты через выбранные. Однако, при решении некоторых задач, такой подход оказывается менее целесообразным, так как соответствующие выражения оказываются громоздкими. Более того, мы можем принимать во внимание то обстоятельство, что если известно уравнение состояния системы, то можно легко вычислить и третий коэффициент первой строки в (2.1). Поскольку при решении большинства задач уравнение состояния системы известно, то, практически, в (2.1) можно выбрать в качестве независимых пять коэффициентов. Такой подход много упрощает решение задач.
Выразим теперь одни коэффициенты через другие с учетом вышесказанного. Во второй строке известен один коэффициент, но с помощью (2.8) найдем второй. Тогда на основании (2.8) и (2.3) найдем третий
 (2.12)
(2.12)
В третьей строке (2.1) известен один коэффициент. Второй коэффициент можно получить, используя свойство якобианов
 (2.13)
(2.13)
где было учтено выражен ие (2.10). Тогда на основании (2.4) и (2 .13) н айде м третий
 (2.14)
(2.14)
что непосредственно вытекает также из (2.10). Первый коэффициент четвертой строки легко можно найти с помощью выражений (2.9) и (2.13), или же используя свойство якобианов
 (2.15)
(2.15)
Из (2.7) с учетом (2.12) получим второй коэффициент
 (2.16)
(2.16)
Наконец, последний коэффициент можно получить из (2.5) с учетом выражений (2.15) , (2.16) и (2.2)
 (2.17)
(2.17)
Отметим, что, в дальнейшем, при рассмотрении тех или иных вопросов, будем получать общие дифференциальные соотношения, которые позволят, зная уравнения состояния системы, обобщить их для идеальных и реальных систем.
ВЫВОД УРАВНЕНИЯ АДИАБАТИЧЕСКОГО ПРОЦЕССА ДЛЯ ИДЕАЛЬНОГО И РЕАЛЬНОГО ГАЗОВ.
Процесс, протекающий при постоянной энтропии называется адиабатическим или изоэнтропным

Отме
ти
м, что поскольку![]() , то
, то Таким образом, адиабатический процесс мы свели к изотермическому, который для идеального газа можно представить в виде:
Таким образом, адиабатический процесс мы свели к изотермическому, который для идеального газа можно представить в виде:![]() Учитывая, что для данного газа
Учитывая, что для данного газа  , получим:
, получим:

или после разделения переменных и интегрирования
 ;
; 
откуда ![]()
Уравнение адиабатического процесса для газа Ван-дер-Ваальса целесообразно найти из выражения

Для получения этого выражения было использовано известное в термодинамике соотношение, которое, также, легко получить с помощью якобианов
 (3.1)
(3.1)
гд
е использовано
соотношение (2.12). Принимая во внимание, что для адиабатического процесса![]() , причём постоянную интегрирования
, причём постоянную интегрирования![]() , можно принять равной нулю, получим
, можно принять равной нулю, получим![]()
или
которое для переменных P и V принимает вид:

ВЫВОД УРАВНЕНИЯ ДЛЯ ВЫЧИСЛЕНИЯ СКОРОСТИ РАСПРОСТРАНЕНИЯ ЗВУКА В СРЕДЕ.
Найдем выражение для вычисления скорости распространения звука в среде, являющееся адиабатическим процессом.

где r – плотность среды, S -энтропия, являющаяся функцией параметров P, V и T состояния системы. Этой формулой удобно пользоваться при нахождении скорости звука в газообразн ой среде. В частности, скорос ть звука в воздухе, при норм альн ых условиях можно найти, при мен яя уравнение состоян ия идеального газа, для которого
![]()
После подстановки этого выражения в исходную формулу получим:

откуда ![]()
Подставляя в эту формулу численные значения g , р и r для скорости звука получим U»333 м/с.
Для определения скорости звука в жидких и твёрдых телах необходимо в выражение
![]()
подставить значения g
,
r
и ![]() из таблиц. Например, для воды U»1400 м/с. Здесь уместно отметить, что скорость звука в морской воде, согласно [5], зависит от температуры, солёности и гидростатического давления. Необходимо также подчеркнуть, что скорость звука – важная величина, во многом характеризующая физические свойства тел. Зная скорость звука, можно определить упругие постоянные твердых тел, их зависимость от температуры, сжимаемость, отношение теплоемкостей для жидкостей и твердых тел.
из таблиц. Например, для воды U»1400 м/с. Здесь уместно отметить, что скорость звука в морской воде, согласно [5], зависит от температуры, солёности и гидростатического давления. Необходимо также подчеркнуть, что скорость звука – важная величина, во многом характеризующая физические свойства тел. Зная скорость звука, можно определить упругие постоянные твердых тел, их зависимость от температуры, сжимаемость, отношение теплоемкостей для жидкостей и твердых тел.
СПОСОБ ОПРЕДЕЛЕНИЯ СV ДЛЯ ИДЕАЛЬНОГО ГАЗА.
Теплое
мкость газа при постоянном объёме опре
деляется выражением![]() Найдём связь между изменениями внутренней энергии системы и её температуры при постоянном значении р
.
Найдём связь между изменениями внутренней энергии системы и её температуры при постоянном значении р
.
 (5.1)
(5.1)
где учтены соотношения (3.1) и (2.2).
Найдём также связь между изменениями внутренней энергии системы и её температуры при адиабатическом процессе.
 (5.2)
(5.2)
где использовано соотношение, объединяющее первое и второе начала термодинамики и выражение (2.12).
Отвлекаясь от процессов, протекающих в системе, можно показать, что для идеального газа

Такое же заключение для ,
,
но с помощью статистического метода сделано в [6]. Читателям представляем возможность дать удовлетворите льное, с точки зрен ия законов термодинамики, объясн ение равенс тва выражени й (5.3).
Отметим, что для реального газа, подчиняющегося уравнению Ван-дер-Ваальса после подстановки соответствующих частных производных, при замене давления его значением, найдём

ОБ ИЗМЕНЕНИЯХ ВНУТРЕННЕЙ ЭНЕРГИИ ПРИ ДРУГИХ ИЗОПРОЦЕССАХ.
Найдём связь между изменениями энтропии и внутренней энергии
при постоянных значениях других параметров системы.
 , (6.1)
, (6.1)
где использовано (5.1).
 (6.2)
(6.2)
где применены формулы (3.1) и (2.8).
Из выражения (6.1) вытекает, что для идеального газа
 (6.3)
(6.3)
| (6.3) |
Сравнивая это значение с
 (6.4)
(6.4)
придём к выводу, что при изохорическом и изобарическом процессах одинаковому изменению энтропии соответствует неодинаковое изменение внутренней энергии. Нетрудно также заметить, что для идеального газа, согласно (6.2), изменение энтропии, связанное или с изменением объёма, или же давления, не приводят к изменению внутренней энергии.
Найдём связь между изменениями давления и внутренней энергии системы при адиабатическом, изотермическом и изохорическом процессах.
 (6.5)
(6.5)
 (6.6)
(6.6)
 (6.7)
(6.7)
В случае идеального газа формулы (6.5) и (6.7) дают

откуда  (6.8)
(6.8)
Это соотношение показывает, что при изохорическом м адиабатическом процессах одинаковому изменению давления соответствуют неодинаковые изменения внутренней энергии. Читателям представляем возможность самим выяснить физическую сущность различия этих величи н. Мы только отметим, что при изохорическом процесс е сис тема не совершает работы, а изменение дав лени я может происходить за счёт подводимого к системе или отводимого от системы количества теплоты. При адиабатическом же процессе изменение давления может быть обусловлено либо работой системы, против сил, за счет её внутренней энергии, либо же работой, совершенной над системой.
Найдём связь между изменениями объёма системы и её внутренней энергией при изобарическом процессе.
 (6.9)
(6.9)
где были учтены (6.1), (2.15) и (2.2).
Для идеального газа выражение (6.9) даёт
 (6.10)
(6.10)
Сравним это значение с ранее полученным (3.1) и выражением
 (6.11)
(6.11)
Для идеального газа, на основании (3.1),

Из (6.10) и (6.11) следует:

откуда
 (6.12)
(6.12)
Объяснение причин различия значений этих величин должно быть подобно объяснению различия величин (6.8). Только в полученном выражении изменения объёма системы и её внутренней энергии при адиабатическом процессе имеют противоположные знаки, а при изобарическом – одинаковые.
ВЫВОД НЕКОТОРЫХ ПОЛЕЗНЫХ ТЕРМОДИНАМИЧЕСКИХ СООТНОШЕНИЙ.
1. Найдём разность теплоёмкостей СР и СV .

откуда
 (7.1)
(7.1)
Отметим, что поскольку соответствующие частные производные в выражении (7.1) имеют положительные знаки, то при температурах выше абсолютного нуля СР > CV , а при температурах, близких к абсолютному нулю

поэтому СР = С V , и так как при тех же температурах
![]()
то СР =С V =0.
2. Найдём связь между изменениями давления и энтропии при постоянном значении внутренней энергии системы
 (7.2)
(7.2)
где использованы соотношения (2.7), (2.12), (2.17) и значения соответствующих частных производных от внутренней энергии. Нетрудно заметить, что для газов, при постоянном значении внутренней энергии, увеличение давления сопровождается уменьшением энтропии. Это и понятно, так как энтропия связана с вероятностью, а при увеличении давления уменьшается вероятность состояния системы.
3. Найдём связь между изменениями отдельных параметров системы при постоянном значении внутренней энергии.
 (7.3)
(7.3)
В случае идеального газа имеем:
 (7.4)
(7.4)
Этого и следовало ожидать, поскольку внутренняя энергия идеального газа зависит от температуры. Поэтому условию U=const соответствует T=const. Для реальных газов условие (7.4) не выполняется.
 (7.5)
(7.5)
| Гч /-• ^ .6 |
 (7.6)
(7.6)
 (7.7)
(7.7)
Нетрудно убедиться, что для идеального газа
 (7.8)
(7.8)
Найдём связь между изменениями отдельных параметров системы и её теплосодержанием.
 (7.9)
(7.9)
 (7.10)
(7.10)
 (7.11)
(7.11)
 (7.12)
(7.12)
Однако это значение частной производной можно определить и более простым способом, если учесть, что I=U+pV и dI=dU+d(pV). Тогда

Важно подчеркнуть, что одно и то же значение частной производной, при постоянном значении выбранного параметра, можно получить несколькими способами в зависимости от выбора промежуточных переменных. Учитывая это, при решении задач, можно ввести такие якобианы, тождественно равные единице, которые относительно быстро приведут к цели. Покажем это на одном примере.
a)  (7.13)
(7.13)
где были использованы (3.1) и (2.2).
b)  (7.14)
(7.14)
Аналогичное значение, но с помощью введения переменных S и p было получено ранее в выражении (6.9).
Приведённый пример показывает, что для проверки правильности нахождения одной и той же термодинамической величины можно использовать несколько вариантов, хотя и в данном примере использованы не все.
СПОСОБЫ ОПРЕДЕЛЕНИЯ CP ДЛЯ ИДЕАЛЬНОГО ГАЗА.
Из объединённого выражения обоих начал термодинамики следует, что если подвод теплоты к системе осуществляется при изобарическом процессе, то TdS=CP
dT, или
Однако, теплоемкость Cp для идеального газа можно определить как частную производную от тепловой функции по температуре. Действительно, при изобарическом процессе
 (8.1)
(8.1)
Это соотношение нетрудно понять, поскольку при р=const
dI=TdS+Vdp=TdS=Cp dT.
Найдём связь между изменениями температуры и тепловой функции при изохорическом процессе.
 (8.2)
(8.2)
где учтено выражение (7.11).
В случае адиабатического процесса изменения тех же величин дают:
 (8.3)
(8.3)
где использованы соотношения (2.2), (2.8), (7.10) и (8.2).
Непосредственной проверкой нетрудно убедиться, что для идеального газа
 (8.4)
(8.4)
Читателям представляется возможность найти удовлетворительное, с точки зрения законов термодинамики, объяснение выражений (8.4).
По аналогии с вышеприведенными примерами, можно решить большое количество задач, связанных со свободной энергией, энтальпией и термодинамическим потенциалом Гиббса.
Вышеприведенные примеры убедительно доказывают преимущество такого подхода к решению задач термодинамики. Этим способом, в основном, решаются и задачи, связанные с термодинамикой стержней, диэлектриков и магнетиков, примеры которых приведены в [4] и [7], для которых можно учесть электро- и магнитострикционные явления, пьезоэлектрический и пьезомагнитный эффекты, а также и задачи, связанные с химическим потенциалом, когда количество вещества в системе изменяется .
Применение якобианов, особенно после изучения свойств термодинамических функций и их дифференциалов, позволяет более доступным способом решить ту или иную задачу, и, что очень важно, даёт возможность, даже при решении одной задачи, охватывать большой материал, предусмотренный программой. Преимущество такого подхода к рассмотрению отдельных, или группы, вопросов, как показали наши наблюдения, не вызывает сомнений как с точки зрения корректности математических выражений, так и логичности и взаимосвязи явлений термодинамики.
СОСТАВЛЕНИЕ ДЕТЕРМИНАНТОВ ЯКОБИ И ТАБЛИЦЫ ТЕРМОДИНАМИЧЕСКИХ КОЭФФИЦИЕНТОВ ДЛЯ СИСТЕМ, ОПИСЫВАЕМЫХ БОЛЬШИМ ЧИСЛОМ ПЕРЕМЕННЫХ.
В качестве примера рассмотрим систему, описываемую тремя независимыми переменными, например, систему с переменным количеством вещества. В этом случае дифференциалы термодинамических функций имеют вид:
dU=TdS-pdV+mdN, (9.1)
dF=-SdT-pdV+mdN, (9.2)
dI=TdS+Vdp+mdN, (9.3)
dФ=-SdT+Vdp+mdN (9.4)
где dN – изменение числа молей вещества , а m – химический потенциал, имеющий размерность энергии в расчете на количество молей.
Из выражения (9.1) получим следующие соотношения:
 (9.5)
(9.5)
 (9.6)
(9.6)
 (9.7)
(9.7)
Формула (9.5) даёт:

откуда
 (9.8)
(9.8)
Из (9.6) и (9.7), аналогичным способом, получаем:
 (9.9)
(9.9)
 (9.10)
(9.10)
При рассмотрении дифференциалов свободной энергии (9.2) и энтальпии (9.3) получим, соответственно, следующие, новые, соотношения:
 (9.11)
(9.11)
 (9.12)
(9.12)
Уместно отметить, что рассмотрение дифференциала термодинамического потенциала Гиббса (9.4) не приводит к установлению нового соотношения. Раскрывая якобианы (9.8) – (9.12) получим:
 (9.13)
(9.13)
 (9.14)
(9.14)
 (9.15)
(9.15)
 (9.16)
(9.16)
 (9.17)
(9.17)
Все коэффициенты выражения (9.13) нами уже определены. Из формул (9.14)–(9.17) составим таблицу термодинамических коэффициентов так, чтобы первая строка не содержала S и р , вторая- S и V , третья- V и Т , четвертая- Т и р .
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Устанавливая соответствующую связь между коэффициентами данной таблицы, мы окажемся в состоянии решить все задачи, связанные с однокомпонентной системой, с переменным количеством вещества.
Аналогичным образом составляется таблица коэффициентов для систем, описываемых четырьмя и большим числом независимых переменных, например, для двух- или трёхкомпонентной термодинамической системы.
Если процессы, протекающие в многокомпонентной системе таковы, что
dp=dV=dT=dS=0 (9.19)
| (9.20) |
и
![]() (9.20)
(9.20)
то будем иметь дело с системой, для которой
dU=dF=dI=dФ=0 (9.21)
При выполнении условия (9.19) можно рассматривать только один термодинамический потенциал, при этом неважно выполняется условие (9.20) или нет.
Полезно заметить, что в реальных условиях возможны состояния, при которых условия (9.19)–(9.21) не соблюдаются и тем не менее при неизменных р и Т или V и V мы в течение длительного времени не наблюдаем изменения равновесия системы. Такое равновесие называется ложным (об этом более подробно см. в [8]). При условии
![]() (9.22)
(9.22)
возможен самопроизвольный процесс в прямом направлении в любой гомогенной или гетерогенной системе (например, переход отдельных компонент из одной фазы в другую, возможность протекания химических реакций между различными компонентами и т. д.).
Отметим, что переход данного компонента может происходить самопроизвольно только из фазы, для которой его химический потенциал больше, в фазу, для которой он меньше. Такой переход сопровождается уменьшением химического потенциала компонента в первой фазе и увеличением его во второй. В результате этого разность между химическими потенциалами данного компонента в этих двух фазах уменьшается и когда значения химического потенциала компонент в обеих фазах выравниваются, достигается состояние равновесия.
ЛИТЕРАТУРА
1. В.Г.Левич, Курс теоретической физики, t.1, стр. 446, "Наука", 1969.
2. В.И.Смирнов, Курс высшей математики, т.3, ч.2, "Наука", 1974.
3. Д. Тер Хаар, Г.Вергеланд, Элементарная термодинамика, "Мир", 1968.
4. Ю.Б.Румер, М.Ш.Рыбкин, Термодинамика, статистическая физика и кинетика, "Наука",1977.
5. В.И.Тюлин, Введение в теорию излучения и распространения звука, стр.17, "Наука", 1976.
6. Ч.Киттель, Статистическая термодинамика, стр.147, "Наука",1977.
7. Р.Кубо, Термодинамика, "Мир" , 1970.
8. Л.В.Радушкевич, Курс термодинамики, стр.192, "Просвещение", 1971.
СОДЕРЖАНИЕ
Краткое введение ................………………..………………………………………….. 3
Термодинамические коэффициенты и установление связи между ними…………. 6
Вывод уравнения адиабатического процесса для идеального и реального газов .... 11
Вывод уравнения для вычисления скорости распространения звука в среде………. 13
Способы определения СV для идеального газа ………………………………………... 15
Об изменениях внутренней энергии при других изопроцессах……………………… 17
Вывод некоторых полезных термодинамических соотношений……………………. 21
Способы определения СР для идеального газа………………………………………… 26
Составление детерминантов Якоби и таблицы термодинамических коэффициентов для систем, описываемых большим числом переменных………………………………….. 28
Литература………………………………………………………………………………… 33