| Скачать .docx |
Реферат: Современное состояние нефтехимического синтеза Основные продукты и технологии
Тема: Современное состояние нефтехимического синтеза. Основные продукты и технологии
Введение
1. Альтернативные виды топлива, сырьевые ресурсы
1.1 Диметиловый эфир
1.2 Синтетический бензин
1.3 Спиртовые топлива
1.4 Топливо из биомассы
2. Технологии
2.1 Синтез ДМЭ из природного газа (через метанол)
2.2 Одностадийный синтез ДМЭ из синтез-газа и синтез бензина (через ДМЭ)
2.3 Нетрадиционные процессы и технологии получения моторных топлив
2.3.1 Технология БИМТ
2.3.2 Технология БИМТ-2
2.3.3 Процесс БИЦИКЛАР
Заключение
Литература
Введение
На развитие топливной отрасли определяющим образом влияет ряд факторов. Рост затрат на поиск, добычу и доставку к местам массового потребления нефтяного сырья в конечном итоге привел к удорожанию топлива, получаемого из нефти. Повышение требований экологов к качеству производимого моторного топлива также вызывает удорожание переработки исходных нефтяных фракций.
Еще один важный фактор, определяющий траекторию изменений в топливном секторе энергетики, обусловлен необходимостью сокращения выбросов в атмосферу диоксида углерода, являющегося основным "парниковым" газом. С позиций эколога ни один из существующих сейчас видов топлива нельзя считать приемлемым. Все, что используется на транспорте для производства энергии, - это соединения углерода. При их сгорании в двигателе автомобиля или в топке энергоустановки (завода или электростанции) образуется (в оптимальном варианте) диоксид углерода, поступающий в атмосферу. Будущее автомобильного транспорта и крупных энергоустановок, как правило, связывают с использованием электрической энергии и водорода, производимыми на базе возобновляемых источников энергии методами, которые, как сейчас кажется, не нанесут ущерба природе. Осуществление этих амбициозных проектов связано со множеством технических проблем, на решение которых уйдет довольно много времени даже при условии мобилизации глобального научно-технического потенциала.
В настоящее время на фоне удорожания нефти и методов ее переработки, растущей автомобилизации и возрастающей потребности цивилизации в высококачественном топливе химики обращают свое внимание в сторону не нефтяных источников для производства новых композиций углеводородных топлив, ставших привычными для потребителя-автомобилиста.
В настоящее время единственным экономически приемлемым путем повышения экологичности автотранспорта является перевод его на альтернативные топлива, обеспечивающие сокращение вредных выбросов в окружающую среду двигателями автомобилей до уровня, отвечающего жестким европейским нормам. Европейская комиссия планирует разработку масштабной программы внедрения альтернативных видов моторного топлива. До 2020 года свыше 1/5 объема топлива на базе нефти должно быть заменено на такие альтернативные продукты, как биотопливо, природный газ и водород.
1. Альтернативные виды топлива, сырьевые ресурсы
1.1 Диметиловый эфир
Синтез диметилового эфира (ДМЭ) и бензина через диметиловый эфир – одно из новых направлений в области переработки природного газа и других источников углерода (уголь, древесные остатки и т.п.). Основные пути переработки метана в моторные топлива показаны на схеме 1. Как видно из схемы, синтез ДМЭ вписывается в схему переработки природного газа как путь, альтернативный синтезу метанола.

|
1.2 Синтетический бензин
Сырьем для производства синтетического ненефтяного бензина могут быть уголь, природный и попутный нефтяной газы, биомасса, сланцы и т.д. Наиболее перспективным источником для производства альтернативных моторных топлив является природный газ, а также получаемый из него синтез-газ (смесь СО и Н2 в различных соотношениях). Там, где природный газ легко извлекается, можно использовать его в сжатом и сжиженном состояниях в качестве моторного топлива для двигателей внутреннего сгорания. Сжижение природного газа по сравнению со сжатием имеет то преимущество, что позволяет уменьшить объем системы его хранения почти в три раза.
Использование альтернативных топлив, полученных из природного газа, обеспечивает снижение содержания токсичных компонентов в выхлопных газах автотранспорта.
1.3 Спиртовые топлива
Существенным недостатком этого вида топлива остается его высокая стоимость – в зависимости от технологии получения спиртовые топлива в 1,8-3,7 раза дороже нефтяных. Среди различных спиртов и их смесей наибольшее распространение в качестве моторного топлива получили метанол и этанол. В настоящее время для производства метанола применяют синтез-газ, но для крупномасштабных процессов более предпочтительным сырьем является природный газ. С энергетической точки зрения достоинство спиртов заключается главным образом в их высокой детонационной стойкости, что определяет преимущественное использование спиртов в двигателях внутреннего сгорания с искровым зажиганием. Их основными недостатками являются пониженная теплота сгорания, высокая теплота испарения и низкое давление насыщенных паров.
Этанол в целом по эксплуатационным характеристикам лучше метанола. Стоимость этанола в среднем гораздо выше себестоимости бензина. В настоящее время метанол как моторное топливо используется в ограниченных количествах. Его в основном применяют для получения синтетических жидких топлив, в качестве высокооктановой добавки к топливу и как сырье для производства антидетонационной добавки – метил-трет-бутилового эфира.
Одной из наиболее серьезных проблем, затрудняющих применение добавок метанола, является низкая стабильность бензино-метанольных смесей и чувствительность их к присутствию воды. Различие плотностей бензина и метанола и высокая растворимость последнего в воде приводят к тому, что попадание даже небольших количеств воды в смесь вызывает ее немедленное расслоение, причем склонность к расслоению усиливается с понижением температуры, увеличением концентрации воды и уменьшением содержания ароматических соединений в бензине. Для стабилизации бензино-метанольных смесей используют присадки – пропанол, изопропанол, изобутанол и другие спирты.
1.4 Топливо из биомассы
Весьма перспективным возобновляемым сырьем является биомасса. Она может быть использована для получения этанола в качестве альтернативного топлива. Подсчитано, что ежегодно выращивается и вырастает в дикой природе столько биомассы, что из нее можно вырабатывать энергии в восемь раз больше, чем в настоящее время дает все топливо из ископаемого сырья. Исследования, направленные на создание производства жидких топлив из возобновляемого сырья растительного происхождения, в последние годы расширяются.
Биоэтанол и биобутанол получают ферментационным путем. В качестве сырья для ферментации может быть использован широкий набор углеводных материалов: сахара, крахмал, целлюлоза и др. Основу производства биоэтанола из крахмала составляют две стадии: гидролиз крахмала до глюкозы под действием ферментов и ферментация глюкозы до этанола. Существенный недостаток этой технологии связан с тем, что при повышении концентрации этанола в реакционной смеси выше определенного уровня он начинает оказывать ингибирующее действие на процесс ферментации. Кроме того, ферментация обычно приводит к образованию ряда метаболитов, которые при повышенных концентрациях также снижают эффективность процесса.
Современные исследования по совершенствованию существующих процессов получения биоэтанола ведутся в основном по двум направлениям: разработка ферментационных систем, работающих в непрерывном режиме, и повышение производительности методов извлечения и очистки этанола с целью снижения энергозатрат на производство топливного спирта.
2. Технологии
2.1 Синтез диметилового эфира из природного газа (через метанол)
Природный газ является наиболее простым и доступным сырьем для синтеза диметилового эфира и, соответственно, процесс получения ДМЭ на базе природного газа имеет наилучшие экономические показатели. В настоящее время промышленное производство ДМЭ (наполнитель для аэрозолей) составляет ок. 150 тыс. т. в год и базируется на переработке метанола. Упрощенно схему производства ДМЭ на основе природного газа через синтез и последующую дегидратацию метанола можно представить в виде схемы 2.

Схема 2 Схема синтеза ДМЭ из природного газа через стадии синтеза и дегидратации метанола
Рассмотрим отдельные стадии этого синтеза.
Конверсия метана.
Конверсия метана (риформинг) в синтез-газ – это высокотемпературный процесс, который может быть осуществлен по разным реакциям (с участием различных реагентов). Среди них:
· паровая конверсия CH4+H2O=CO+3H2 (1)
· углекислотная конверсия CH4+CO2+2CO+2H2 (2)
· неполное окисление CH4+1/2O2=CO+2H2 (3)
Реакции (1) и (2) сильно эндотермичны, поэтому получил распространение автотермический риформинг – паровой риформинг в присутствии кислорода. К протекающим в условиях автотермического риформинга реакциям (1) и (3) добавляются сильно экзотермические реакции полного окисления:
CH4+2O2=CO2+2H2O (4)
H2+1/2O2=H2O (5)
CO+1/2O2=CO2 (6)
Эти процессы обеспечивают компенсацию потерь тепла в реакции (1), но приводят к дополнительным затратам сырья.
Синтез-газ представляет собой смесь СО и водорода с небольшим количеством СО2, в котором также может присутствовать азот. Важнейшей характеристикой синтез-газа является соотношение концентраций Н2:СО. Для синтеза метанола это отношение должно быть больше двух, что делает неизбежным использование парового риформинга (реакция 1).
Условия проведения риформинга являются результатом компромисса между требованиями термодинамики (повышение температуры и снижение давления для увеличения равновесной конверсии метана), экономики и материаловедения. При высокой температуре (800-900 ºС) и не слишком высокой давлении (1-3 МПа) термодинамика процесса благоприятна, что позволяет довести реакцию до превращения, близкого к полному. Достигнутый компромисс приводит к тому, что в процессе синтеза метанола стадия риформинга требует примерно 2/3 капитальных вложений и более половины эксплуатационных расходов. Это обстоятельство обусловило поиск новых путей превращения природного газа в синтез-газ.
Прямое газофазное селективное окисление метана в СО и Н2, т.е. в синтез-газ (реакция 3), явилось бы наиболее простым из альтернативных методов, однако селективность этого процесса в удобных для практики условиях низка (на уровне 50%). Высокая селективность может быть достигнута при высоких температурах (ок. 1500 К), когда равновесие благоприятно именно для образования синтез-газа. Однако проведение процесса при таких температурах сопряжено с рядом трудностей, обусловленных очень жесткими требованиями к материалу реактора, контактирующего с коррозийно активной средой при высокой температуре, и сложностью управления процессом, поскольку закономерности горения "богатых" смесей относительно мало изучены.
Возникает также вопрос, что использовать в качестве окислителя. Если окислять метан чистым кислородом, возрастают капиталовложения и стоимость синтез-газа, а если использовать воздух, то получается "бедный" синтез-газ низкого качества с большим содержанием азота (не менее 50-60% об.).
В последние годы появилось несколько отечественных разработок, в которых предлагаются новые решения аппаратурного оформления процесса высокотемпературного селективного окисления природного газа в синтез-газ.
Синтез метанола.
Промышленный синтез метанола из синтез-газа до 60-х гг. прошлого века базировался на цинкхромовых катализаторах, несмотря на относительно низкую селективность и довольно жесткие условия процесса (температура 400 ºС и давление 30 МПа). Промышленное применение высокоселективных медьсодержащих катализаторов задержалось из-за их повышенной чувствительности к отравлению соединениями серы и стало возможным лишь после развития методов сероочистки. Начиная с 1960-х гг., технология высокоселективного синтеза метанола с использованием медьсодержащих катализаторов, в первую очередь Cu-Zn-Al-оксидных, введенных в промышленную практику фирмой ICI и "HaldorTopsoe", в СССР – СНМ.
Современные катализаторы синтеза метанола близки к идеалу, если не считать постепенной из дезактивации в ходе эксплуатации и высокой чувствительности к каталитическим ядам. Они позволяют осуществлять процесс при относительно низкой температуре (220-280 ºС) и умеренном давлении (5-10 МПа) и обеспечивают высокую селективность – содержание суммы примесей в метаноле обычно не превышает 0,1 %.
Новые перспективы совершенствования технологии производства метанола выявились в результате исследований механизма процесса и последующего перехода к теоретическим кинетическим моделям, базирующимся на механизме реакции. Первый принципиальный шаг в этом направлении был сделан более четверти века назад, в 1975 г., когда независимо кинетическим и изотопным методами было доказано, что метанол на медьсодержащих катализаторах образуется путем гидрирования СО2, но не СО. Было установлено, что общепринятая к тому времени реакция:
СО+2Н2=СН3ОН (7)
на этих катализаторах вообще не протекает, а в условиях синтеза метанола основную роль играют две реакции:
собственно синтез метанола
СО2+3Н2=СН3ОН+Н2О (8)
и конверсия СО водой (реакция водяного пара)
СО+Н2О=СО2+Н2 (9)
Аналогичный механизм процесса образования метанола реализуется на цинкхромовых катализаторах.
На железных катализаторах (и, вероятно, на палладиевых) ситуация противоположная: почти весь метанол образуется за счет гидрирования СО и лишь 0,2 % - за счет гидрирования СО2.
Дегидратация метанола в диметиловый эфир.
Кинетика дегидратации метанола в диметиловый эфир:
2СН3ОН=СН3ОСН3+Н2О
изучалась в ряде работ, однако предложенные кинетические уравнения фактически давали лишь эмпирическое описание процесса. Важная информация о механизме реакции дегидратации метанола следует из данных работы В.А. Махлина и С.И. Иванова. Ниже приведены результаты, полученные ими в очень простом эксперименте при подаче в проточный реактор импульсов метанола в потоке гелия на слой катализатора γ-Al2O3, содержащий прочно адсорбированную воду (табл. 1).
Таблица 1 Результаты исследования реакции дегидратации метанола в диметиловый эфир на γ-Al2O3 импульсным методом
| Количество метанола в импульсе, ммоль | Количество продуктов на выходе из реактора, ммоль ДМЭ метанол вода | ||
| 0,052 | --------- | --------- | 0,098 |
| 0,062 | --------- | 0,001 | 0,042 |
| 0,050 | 0,013 | 0,003 | 0,026 |
| 0,055 | 0,017 | 0,003 | 0013 |
| 0,053 | 0,010 | 0,004 | 0,013 |
| 0,162 | 0,179 | 0,017 | 0,038 |
Как видно, первый импульс метанола не приводит к образованию ДМЭ. В газовой фазе появляются лишь две молекулы воды на каждую молекулу поглощенного метанола. Близкая картина наблюдается при пуске второго импульса, хотя количество выделяющейся воды снижается. При подаче последующих трех импульсов образуется небольшое количество ДМЭ и выделяется столь же небольшое количество воды, при этом метанола на выходе из реактора (слой катализатора) не обнаруживается, он постепенно накапливается на поверхности сорбента. Наконец, при шестом импульсе концентрация метанола резко увеличивается в газовой фазе вплоть до выхода его из реактора.
Проведенный опыт привел к принципиально важному результату: количество полученного диметилового эфира намного превышает количество поданного в импульсе метанола. Более того, практически весь метанол, оставшийся на поверхности сорбента в ходе предыдущих импульсов, превращается в ДМЭ. При этом количество выделяющейся воды невелико и намного меньше, чем это следовало бы согласно стехиометрии реакции.
2.2 Одностадийный синтез ДМЭ из синтез-газа и синтез бензина (через ДМЭ)
Рассмотренную выше схему 2 нельзя считать полностью оптимальным решением. Синтез метанола характеризуется неблагоприятной термодинамикой, что резко ухудшает технико-экономические показатели процесса по схеме 2. Напрашивается решение – объединить процессы синтеза метанола и его дегидратации, выводя таким образом метанол из зоны реакции. В этом случае протекают три экзотермические реакции:
синтез метанола
СО2+3Н2=СН3ОН+Н2О (+49,8 кДж/моль) (8)
дегидратация метанола
2СН3ОН=(СН3)2О+Н2О (+23,4 кДж/моль) (9)
конверсия СО водой (реакция водяного пара)
СО+Н2О=СО2+Н2 (+40,9 кДж/моль) (10)
Ключевой реакцией в приведенной совокупности (8) – (10) является синтез метанола. Образующийся в реакции (8) метанол и вода превращаются в двух последующих реакциях. В противоположность синтезу метанола, равновесие двух последних реакций сдвинуто вправо. Именно поэтому сочетание указанных трех реакций в едином реакционном пространстве оказывается исключительно благоприятным, во всяком случае для газофазного процесса, и позволяет на порядок повысить производительность катализатора синтеза метанола. Удаление воды из зоны реакции благоприятно с позиций не только термодинамики, но и кинетики процесса, так как вода тормозит синтез метанола.
Указанный подход позволяет получить оптимизированную схему переработки природного газа в ДМЭ, включающую прямой синтез ДМЭ из синтез-газа (схема 3).

Схема 3 Двухстадийный синтез диметилового эфира из природного газа
2.3 Нетрадиционные процессы и технологии получения моторных топлив
В Институте катализа СО РАН разработан ряд нетрадиционных процессов и технологий получения высококачественных бензинов и дизельных топлив на основе различных углеводородных фракций – средних нефтяных дистиллятов, газовых конденсатов, широкой фракции легких углеводородов и легких углеводородных газов.
2.3.1 Технология БИМТ (Боресков Институт Моторные Топлива) –одностадийная переработка средних нефтяных дистиллятов и газовых конденсатов
Данная технология позволяет получать высокооктановые бензины, зимнее дизельное топливо и сжиженный газ С3-С4. Процесс проводится на цеолитном катализаторе ИК-30-БИМТ, не содержащем благородных металлов, в реакторах со стационарным слоем катализатора при температуре 350-450 ºС и давлении до 20 атм. Сырьем могут быть прямогонные нефтяные фракции (начало кипения 35-350ºС) или нестабильные газовые конденсаты без предварительной их разгонки. Содержание общей серы в сырье не лимитируется. Длительность межрегенерационного пробега катализатора в режиме подъема температуры составляет 150-280 ч в зависимости от рабочих параметров процесса и состава получаемых продуктов.
Данная технология имеет ряд существенных преимуществ перед стандартной технологией переработки нефти. По стандартной схеме нефть поступает в блок первичной перегонки, где она разделяется на бензиновую, керосиновую, дизельную фракции, тяжелый вакуумный газойль и гудрон. Каждая из этих фракций далее подвергается облагораживанию по своей технологической схеме. Так, например, для производства высокооктанового бензина (схема 4) прямогонный бензин подается на гидроочистку и далее одна часть направляется на риформинг для получения рафината (концентрат ароматических углеводородов), а другая часть – на стадию алкилирования. Путем компаундирования получают высокооктановый бензин. В случае получения зимнего дизельного топлива прямогонная дизельная фракция должна пройти стадии гидроочистки и депарафинизации.
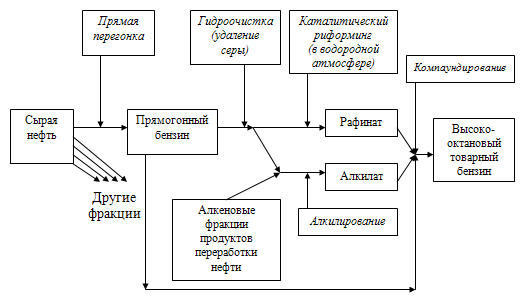
Схема 4 Традиционная технологическая схема переработки нефти
По предлагаемой новой технологии (схема 5) из нефти выделяется широкая фракция (начало кипения 35º - конец кипения 360ºС, т.е. весь атмосферный погон), которая направляется на процесс БИМТ – одностадийную каталитическую переработку этой фракции. Далее продукт переработки разделяется методом ректификации на товарные моторные топлива – высокооктановый бензин, зимнее дизельное топливо и сжиженный газ С3 - С4. Полученные топлива не требуют какой-либо доработки или введения каких-либо добавок для достижения соответствия продуктов существующим ГОСТам.

Схема 5 Схема переработки нефти по технологии БИМТ
В случае использования в качестве сырья тяжелых газовых конденсатов на процесс БИМТ можно направлять весь газовый конденсат без его предварительной разгонки на бензиновую и дизельную фракции. Полученный продукт далее подвергается ректификации с выделением товарного высокооктанового бензина и высокоцетанового дизельного топлива зимнего сорта. Согласно расчетам энергозатрат, эффективность предлагаемой технологии переработки нефтяных фракций в высокосортные моторные топлива за счет сокращения значительного количества используемых процессов минимум в четыре раза превышает эффективность существующих технологий получения этих продуктов.
Основные достоинства технологии БИМТ:
· Значительное упрощение и удешевление процессов нефтепереработки – не требуется стадий гидроочистки, риформинга, алкилирования, депарафинизации.
· Содержание общей серы в сырье не лимитируется.
· При переработке газовых конденсатов выход бензина увеличивается до 20-25 % по сравнению со стандартной технологией.
· Выход жидких фракций составляет не менее 80-85 % (90-93 % масс при циркуляции образующегося газа). Соотношение между бензиновой и дизельной фракциями зависит от состава исходного сырья и режима проведения процесса.
· Свойства получаемых бензинов: октановое число от 80 до 95 (по исследовательскому методу), содержание серы менее 0,001% (масс.), содержание бензола менее 1% при общем содержании ароматических углеводородов не выше 30-40 %.
· Свойства получаемого дизельного топлива: температура замерзания
· от -35ºС до -60ºС, цетановое число не ниже 50-55, содержание серы менее 0,05% (масс.).
2.3.2 Технология БИМТ-2 – одностадийная переработка средних нефтяных дистиллятов
Данная технология предназначается для переработки нефтяных фракций с высоким содержанием сернистых соединений тиофенового ряда. Существующие процессы гидрооблагораживания таких нефтяных фракций обычно требуют жестких условий для разложения полициклических сернистых соединений. Технология БИМТ-2 позволяет в мягких условиях и без использования водорода получать из указанных дистиллятов высокосортные моторные топлива, соответствующие современным мировым стандартам. Процесс осуществляется на цеолитном катализаторе ИК-30-БИМТ-2 – катализаторе процесса БИМТ, дополнительно модифицированном некоторыми добавками, придающими ему свойства катализаторов гидроочистки. Данная технология реализуется только в варианте с рециркуляцией образующегося газа.
2.3.3 Процесс БИЦИКЛАР
С использованием нового подхода к дизайну катализаторов процессов ароматизации легких парафинов в лабораторном масштабе разработан процесс БИЦИКЛАР совместной конверсии легких углеводородных газов. Процесс проводится в проточных реакторах на модифицированных цеолитных катализаторах при условиях: температура 450-550 ºС, атмосферное или небольшое избыточное давление, объемные скорости подачи газовой смеси 300-3000 ![]() . Сырьем может служить природный газ в смеси с попутным нефтяным газом, пропан-бутановой фракцией, пропаном, бутаном или изобутаном, допускается наличие олефинов.
. Сырьем может служить природный газ в смеси с попутным нефтяным газом, пропан-бутановой фракцией, пропаном, бутаном или изобутаном, допускается наличие олефинов.
Продуктом процесса является концентрат ароматических углеводородов. Данный процесс обеспечивает большой выход ароматических соединений и особенно нафталинов, которые, как известно, являются ценным сырьем для процессов органического синтеза. В целом выход ароматических углеводородов в расчете на превращенное сырье (за вычетом метана) увеличивается в 2,5 раза. Существенно, что в процессе БИЦИКЛАР используется стационарный слой катализатора.
Заключение
В последние десятилетия мировая нефтеперерабатывающая промышленность развивается под сильным влиянием требований новых стандартов на моторные топлива, предусматривающих повышение их экологической чистоты. Новые требования к моторным топливам настолько существенны, что вынуждают пересматривать компонентный состав топлив, получаемых в традиционных способах нефтепереработки. Экологические требования предъявляются как к самим топливам, так и к продуктам их сгорания.
Помимо экологической проблемы на пути развития автомобильного транспорта встают экономические трудности, связанные со снижением мировых ресурсов нефти. Начало XXI века многие специалисты характеризуют как окончание эры дешевой нефти. Сокращение запасов нефти пригодной для производства современных моторных топлив вследствие уменьшения в ней содержания водорода, находит отражение в наблюдавшейся тенденции удорожания нефтяных топлив. Поэтому экономические проблемы, связанные с использованием в двигателях транспортных средств традиционных моторных топлив, актуальны для всех промышленно развитых стран.
В настоящее время во многих странах проводятся исследовательские работы по созданию новых видов моторных топлив. В рамках этих работ вырабатываются концепции производства и использования альтернативных моторных топлив и создаются соответствующие двигатели. Использование ненефтяного сырья не только расширяет ресурсы топлив, но часто позволяет улучшить их экологические характеристики.
Литература
1. Волков В.В., А.Г. Фадеев, В.С. Хотимский и др. Рос. хим. ж., 2003, т. XLVII, №6.
2. Данилов А.М., Каминский Э.Ф., Хавкин В.А. Рос. хим. ж., 2003, т. XLVII, №6.
3. Ечевский Г.В. Рос. хим. ж., 2003, т. XLVII, №6.
4. Нефтепереработка и нефтехимия, №8, 2002.
5. Розовский А.Я. Рос. хим. ж., 2003, т. XLVII, №6.
6. Собянин В.А. Рос. хим. ж., 2003, т. XLVII, №6.
7. Третьяков В.Ф., Бурдейная Т.Н. Рос. хим. ж., 2003, т. XLVII, №6.