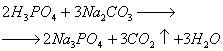| Скачать .docx |
Реферат: Фосфор и его соединения 2
Невинномысский Технологический Институт
(филиал) государственного образовательного
учреждения высшего профессионального
образования “Северо – Кавказкий государственный
технологический университет”
Факультет ИЭ
Группа ЭУП-101
Реферат на тему:
«Фосфор и его соединения»
Выполнила студентка
Коробейник Оксана
Проверила: Коволева Е.А.
Невинномысск
2010
Содержание:| Введение.............................. | 3 |
| История открытия фосфора........................ | 3 |
| Природные соединения и получение фосфора................ | 4 |
| Химические свойства........................ | 5 |
| Аллотропные изменения......................... | 6 |
| а) белый............................... | 7 |
| б) красный.............................. | 8 |
| в) черный.............................. | 8 |
| Оксиды фосфора.......................... | 9 |
| Ортофосфорная кислота......................... | 10 |
| Ортофосфаты............................ | 12 |
| Фосфор в организме человека...................... | 13 |
| Спички............................... | 14 |
| Фосфорные удобрения......................... | 14 |
| Заключение............................. | 17 |
| 1. Значение фосфора.......................... | 17 |
| 2. Применение фосфора....................... | 17 |
| Список используемой литературы..................... | 20 |
История открытия фосфора
По иронии судьбы фосфор открывался несколько раз. Причем всякий раз получалиего из . мочи. Есть упоминания о том, что арабский алхимик Альхильд Бехиль(XII век) открыл фосфор при перегонке мочи в смеси с глиной, известью иуглем. Однако датой открытия фосфора считается 1669 год. Гамбургский алхимик-любитель Хеннинг Бранд, разорившийся купец, мечтавший с помощью алхимиипоправить свои дела, подвергал обработке самые разнообразные продукты.Предполагая, что физиологические продукты могут содержать «первичнуюматерию», считавшейся основой философского камня, Бранд заинтересовалсячеловеческой мочей.Он собрал около тонны мочи из солдатских казарм и выпаривал ее до образованиясиропообразной жидкости. Эту жидкость он вновь дистиллировал и получилтяжелое красное «уринное масло», которое перегонялось с образованиемтвердого остатка. Нагревая последний, без доступа воздуха, он заметилобразование белого дыма, оседавшего на стенках сосуда и ярко светившего втемноте. Бранд назвал полученное им вещество фосфором, что в переводе сгреческого означает «светоносец».Несколько лет «рецепт приготовления» фосфора хранился в строжайшем секрете ибыл известен лишь нескольким алхимикам. В третий раз фосфор открыл Р.Бойль в1680 году.В несколько модифицированном виде старинный метод получения фосфора использовалии в XVIII столетии: нагреванию подвергали смесь мочи с оксидом свинца (PbO),поваренной солью (NaCl), поташом (K2 CO3 ) и углем (C).Лишь 1777 году К.В.Шееле заработал способ получения фосфора из рога и костейживотных.Природные соединения и получение фосфора
По распространенности в земной коре фосфор опережает азот, серу и хлор. Вотличие от азота фосфор, из-за большой химической активности встречается вприроде только в виде соединений. Наиболее важные минералы фосфора - апатит Са5 Х(РО4 )3 (Х - фтор, реже хлор и гидрооксильнаягруппа) и фосфорит основой которого является Са3 (РО4 )2 . Крупнейшее месторождение апатитов находится на Кольском полуострове, врайоне Хибинских гор. Залежи фосфоритов находятся в районе гор Каратау, вМосковской, Калужской, Брянской областях и в других местах. Фосфор входит всостав некоторых белковых веществ, содержащихся в генеративных органахрастений, в нервных и костных тканях организмов животных и человека. Особеннобогаты фосфором мозговые клетки.В наши дни фосфор производят в электрических печах, восстанавливая апатитуглем в присутствии кремнезема:Ca3 (PO4 )2 +3SiO2 +5C®3CaSiO3 +5CO+P2 . Пары фосфора при этой температуре почти полностью состоят из молекул Р2 , которые при охлаждении конденсируются в молекулы Р4 .Химические свойства
Электронная конфигурация атома фосфора1S2 2S2 2P6 3S2 3P3 3d0 Наружный электронный слой содержит 5 электронов. Наличием трех неспаренныхэлектронов на внешнем энергетическом уровне объясняет то, что в нормальном,невозбужденном состоянии валентность фосфора равна 3.Но на третьем энергетическом уровне имеются вакантные ячейки d-орбиталей,поэтому при переходе в возбужденное состояние 3S-электроны будутразъединяться, переходить на d подуровень, что приводит к образованию 5-тинеспаренных элементов.Таким образом, валентность фосфора в возбужденном состоянии равна 5.В соединениях фосфор обычно проявляет степень окисления +5, реже +3, -3.1. Реакции с кислородом:4P0 + 5O2Аллотропные изменения
В свободном состоянии фосфор образует несколько аллотропных видоизменений.Это объясняется тем, что атомы фосфора способны, взаимно соединяясь,образовывать кристаллические решетки различного типа. Таблица 1 Физические свойства фосфора| Аллотропная модификация | Плотность, г/см3 |
tпл , 0 C |
Tкип , 0 C |
Внешний вид и характерные признаки |
| Белый | 1,73 | 44,1 | 280,5 | Белый кристаллический порошок, ядовит, самовозгорается на воздухе. При 280—300°С переходит в красный |
| Красный | 2,3 | 590 | Возгоняется около 400°С | Красный кристаллический или аморфный порошок, неядовит. При 220°С и 12 × 108 Па переходит в черный фосфор. Загорается на воздухе только при поджигании |
| Черный | 2,7 | При нагревании переходит в красный фосфор | Графитоподобная структура. При нормальных условиях — полупроводник, под давлением проводит электрический ток как металл | |
 Белая модификация фосфора
, получающаяся при конденсации паров, имеет молекулярную кристаллическуюрешетку, в узлах которой дислоцированы молекулы Р4
(рис.1). Из-заслабости межмолекулярных сил белый фосфор летуч, легкоплавок, режется ножом ирастворяется в неполярных растворителях, например в сероуглероде. Белыйфосфор весьма реакционноспособное вещество. Он энергично взаимодействует скислородом, галогенами, серой и металлами. Окисление фосфора на воздухесопровождается разогреванием и свечением. Поэтому белый фосфор хранят подводой, с которой он не реагирует. Белый фосфор очень токсичен.Около 80% от всего производства белого фосфора идет на синтез чистойортофосфорной кислоты. Она в свою очередь используется для полученияполифосфатов натрия (их применяют для снижения жесткости питьевой воды) ипищевых фосфатов. Оставшаяся часть белого фосфора расходуется для созданиядымообразующих веществ и зажигательных смесей.Техника безопасности
. В производстве фосфора и его соединений требуетсясоблюдение особых мер предосторожности, т.к. белый фосфор – сильный яд.Продолжительная работа в атмосфере белого фосфора может привести к заболеваниюкостных тканей, выпадению зубов, омертвению участков челюстей. Воспламеняясь,белый фосфор вызывает болезненные, долго не заживающие ожоги. Хранить белыйфосфор следует под водой, в герметичных сосудах. Горящий фосфор тушат двуокисьюуглерода, раствором CuSO4
или песком. Обоженную кожу следует промытьраствором KmnO4
или CuSO4
. Противоядием при отравлениифосфором является 2%-ый раствор CuSO4
.
Белая модификация фосфора
, получающаяся при конденсации паров, имеет молекулярную кристаллическуюрешетку, в узлах которой дислоцированы молекулы Р4
(рис.1). Из-заслабости межмолекулярных сил белый фосфор летуч, легкоплавок, режется ножом ирастворяется в неполярных растворителях, например в сероуглероде. Белыйфосфор весьма реакционноспособное вещество. Он энергично взаимодействует скислородом, галогенами, серой и металлами. Окисление фосфора на воздухесопровождается разогреванием и свечением. Поэтому белый фосфор хранят подводой, с которой он не реагирует. Белый фосфор очень токсичен.Около 80% от всего производства белого фосфора идет на синтез чистойортофосфорной кислоты. Она в свою очередь используется для полученияполифосфатов натрия (их применяют для снижения жесткости питьевой воды) ипищевых фосфатов. Оставшаяся часть белого фосфора расходуется для созданиядымообразующих веществ и зажигательных смесей.Техника безопасности
. В производстве фосфора и его соединений требуетсясоблюдение особых мер предосторожности, т.к. белый фосфор – сильный яд.Продолжительная работа в атмосфере белого фосфора может привести к заболеваниюкостных тканей, выпадению зубов, омертвению участков челюстей. Воспламеняясь,белый фосфор вызывает болезненные, долго не заживающие ожоги. Хранить белыйфосфор следует под водой, в герметичных сосудах. Горящий фосфор тушат двуокисьюуглерода, раствором CuSO4
или песком. Обоженную кожу следует промытьраствором KmnO4
или CuSO4
. Противоядием при отравлениифосфором является 2%-ый раствор CuSO4
. При длительном хранении, атакже при нагревании белый фосфор переходит в красную модификацию
(впервые его получили лишь 1847 году). Название красный фосфор относится сразу кнескольким модификациям, различающихся по плотности и окраске: она колеблетсяот оранжевой до темно-красной и даже фиолетовой. Все разновидности красногофосфора нерастворимы в органических растворителях, и по сравнению с белымфосфором они менее реакционноспособны и имеют полимерное строение: этотетраэдры Р4
, связанные друг с другом в бесконечные цепи (рис.2).Красный фосфор находит применение в металлургии, производствеполупроводниковых материалов и ламп накаливания, используется в спичечномпроизводстве.
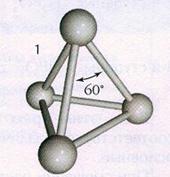
При длительном хранении, атакже при нагревании белый фосфор переходит в красную модификацию
(впервые его получили лишь 1847 году). Название красный фосфор относится сразу кнескольким модификациям, различающихся по плотности и окраске: она колеблетсяот оранжевой до темно-красной и даже фиолетовой. Все разновидности красногофосфора нерастворимы в органических растворителях, и по сравнению с белымфосфором они менее реакционноспособны и имеют полимерное строение: этотетраэдры Р4
, связанные друг с другом в бесконечные цепи (рис.2).Красный фосфор находит применение в металлургии, производствеполупроводниковых материалов и ламп накаливания, используется в спичечномпроизводстве.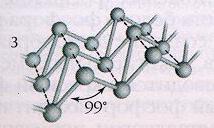 Наиболее стабильноймодификацией фосфора является черный фосфор
. Его получают аллотропнымпревращением белого фосфора при t=2200
C и повышенным давлением. Повнешнему виду он напоминает графит. Кристаллическая структура черного фосфораслоистая, состоящая из гофрированных слоев (рис.3). Черный фосфор – этонаименее активная модификация фосфора. При нагревании без доступа воздуха он,как и красный, переходит в пар, из которого конденсируется в белый фосфор.
Наиболее стабильноймодификацией фосфора является черный фосфор
. Его получают аллотропнымпревращением белого фосфора при t=2200
C и повышенным давлением. Повнешнему виду он напоминает графит. Кристаллическая структура черного фосфораслоистая, состоящая из гофрированных слоев (рис.3). Черный фосфор – этонаименее активная модификация фосфора. При нагревании без доступа воздуха он,как и красный, переходит в пар, из которого конденсируется в белый фосфор.Оксид фосфора (V)
| Фосфор образует несколько оксидов. Важнейшим из них является оксид фосфора (V) P4 O10 (Рис.4). Часто его формулу пишут в упрощенном виде – P2 O5 . В структуре этого оксида сохраняется тетраэдрическое расположение атомов фосфора. | 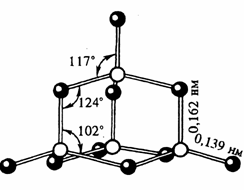 |
P2+5O5 Фосфорный ангидрид (оксид фосфора (V))
Белые кристаллы, t0 пл. = 5700 С, t0 кип. = 6000 C, r = 2,7 г/см3 . Имеет несколькомодификаций. В парах состоит из молекул P4 H10 , оченьгигроскопичен (используется как осушитель газов и жидкостей).Получение
4P + 5O2 ® 2P2 O5Химические свойства
Все химические свойства кислотных оксидов: реагирует с водой, основнымиоксидами и щелочами1) P2 O5 + H2 O ®2HPO3 (метафосфорная кислота) P2 O5 + 2H2 O ® H4 P2 O7 (пирофосфорная кислота) P2 O5 + 3H2 O ® 2H3 PO4 (ортофосфорная кислота) 2) P2 O5 + 3BaO ® Ba3 (PO4 )2 В зависимости от избытка щелочи образует средние и кислые соли: Ортофосфорная кислота.
Известно несколько кислот, содержащих фосфор. Важнейшая из них — ортофосфорнаякислота Н3
РО4
(Рис.5).Безводная ортофосфорная кислота представляет собой светлые прозрачные кристаллы,при комнатной температуре расплывающиеся на воздухе. Температура плавления42,350
С. С водой фосфорная кислота образует растворы любыхконцентраций.Ортофосфорной кислоте соответствует следующая структурная формула:
Ортофосфорная кислота.
Известно несколько кислот, содержащих фосфор. Важнейшая из них — ортофосфорнаякислота Н3
РО4
(Рис.5).Безводная ортофосфорная кислота представляет собой светлые прозрачные кристаллы,при комнатной температуре расплывающиеся на воздухе. Температура плавления42,350
С. С водой фосфорная кислота образует растворы любыхконцентраций.Ортофосфорной кислоте соответствует следующая структурная формула:| Общие с другими кислотами | Специфические |
1. Водный раствор кислоты изменяет окраску индикаторов. Диссоциация происходит ступенчато:
Легче всего идет диссоциация по первой ступени и труднее всего – по третьей 2. Реагирует с металлами, расположенными в вытеснительном ряду до водорода:
3. Реагирует с основными оксидами:
4. Реагирует с основаниями и аммиаком; если кислота взята в избытке, то образуются кислые соли:
гидрофосфат натрия
дигидрофосфат натрия
5. Реагирует с солями слабых кислот:
|
1. При нагревании постепенно превращается в метафосфорную кислоту:
двуфосфорная кислота
2. При действии раствора нитрата серебра (I) появляется желтый осадок:
желтый осадок
3. Ортофосфорная кислота играет большую роль в жизнедеятельности животных и растений. Ее остатки входят в состав аденозинтрифосфорной кислоты АТФ. При разложении АТФ выделяется большое количество энергии. |
| одновалентные | двухвалентные | трехвалентные |
| Ме3 РО4 | Ортофосфаты Ме3 (РО4 )2 |
Ме3 РО4 |
| Ме2 НРО4 | Гидроортофосфаты МеНРО4 |
Ме2 (НРО4 )3 |
| МеН2 РО4 | Дигидроортофосфаты Ме(Н2 РО4 )2 |
Ме(Н2 РО4 )3 |
Фосфор в организме человека
В теле человека массой 70 кг. Содержится около 780 г. фосфора. В видефосфатов кальция фосфор присутствует в костях человека и животных. Входит они в состав белков, фосфолипидов, нуклеиновых кислот; соединения фосфораучаствуют в энергетическом обмене (аденизинтрифосфорная кислота, АТФ).Ежедневная потребность человеческого организма в фосфоре составляет 1,2 г.Основное его количество мы потребляем с молоком и хлебом (в 100 г. хлебасодержится примерно 200 мг. фосфора). Наиболее богаты фосфором рыба, фасоль инекоторые виды сыра.Интересно, что для правильного питания необходимо соблюдать баланс междуколичеством потребляемого фосфора и кальцием: оптимальное соотношение в этихэлементах пищи составляет 1,5¸1. Избыток богатой фосфором пищи приводит квымыванию кальция из костей, а при избытке кальция развивается мочекаменнаяболезнь.Спички
Зажигательная поверхность спичечного коробка покрыта смесью красного фосфора ипорошка стекла. В состав спичечной головки входят окислители (PbO2 ,KСlO3 , BaCrO4 ) и восстановители (S, Sb2 S3 ). При трении от зажигательной поверхности смесь, нанесенная на спичку,воспламеняется:Фосфорные удобрения
Минеральные удобрения – источник различных питательных элементов для растенийи свойств почвы, в первую очередь азота, фосфора и калия, а затем кальция,магния, серы, железа.Фосфор входит в состав многих органических соединений в растениях. Фосфорноепитание регулирует рост и развитие растений.Сырьем для производства фосфорных удобрений, фосфора и всех фосфорных соединенийслужат апатитовые и фосфоритовые руды. Состав апатитов чаще всего выражаетсяформулой Са5 (РО4 )3 F (фторапатит). Фосфоритыотличаются от фторапатитов тем, что в них вместо ионов F- содержатся ионы ОН- или| Название удобрения | Химический состав |
| Простые | |
| Суперфосфат двойной | |
| Суперфосфат простой | |
| Фосфоритная мука | |
| Костяная мука | |
| Преципитат | |
| Шлак мартеновский печей | Сложный состав. Содержит P,Ca, Si, C, Fe и др. элементы |
| Комплексные | |
| Аммофос | |
| Аммофоска | |
| Нитроаммофос | |