| Скачать .docx |
Курсовая работа: Теоретичні основи спектральних методів аналізу
МІНІСТЕРСТВО ОСВІТИ ТА НАУКИ УКРАЇНИ
ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ
ХІМІЧНИЙ ФАКУЛЬТЕТ
КАФЕДРА АНАЛІТИЧНОЇ ХІМІЇ
Курсова робота на тему:
"Теоретичні основи спектральних методів аналізу"
Виконав:
студент 4 курсу
хімічного факультету
Бушкін Ю.В.
Науковий керівник:
Доцент, к.х.н. Оресь Я.П.
Донецьк - 2005
План
Вступ
1 Природа електромагнітного випромінювання
2 Будова атома та походження атомних спектрів
3 Будова молекул та походження молекулярних спектрів
4 Класифікація спектроскопічних методів аналізу
5 Оптичні методи аналізу
6 Спостерігання та реєстрація спектроскопічних сигналів
Література
Вступ
Оптичні та спектрометричні методи аналізу ґрунтуються на взаємодії електромагнітного випромінювання з речовиною. Ця взаємодія супроводжується явищами, з яких найбільш важливі випускання, поглинання та розсіювання випромінювання. Сигнали, що виникають при цьому, несуть якісну та кількісну інформацію про речовину. Якісну інформацію несе частота (довжина хвилі) сигналу, пов’язана з природою речовини, кількісну – інтенсивність сигналу, яка залежить від кількості речовини.
За допомогою оптичних та спектрометричних методів розв’язуються задачі атомного, ізотопного, молекулярного, функціонального (структурно–групового) та фазового аналізу.
Разом з хроматографічними, оптичні методи аналізу є найбільш важливими та розповсюдженими в практиці хімічного аналізу різноманітних об’єктів, наприклад, металургійних, геологічних, об’єктів фармацевтичної промисловості, тощо.
Загальна мета вивчення оптичних та спектрометричних методів аналізу: вміти інтерпретувати принципи оптичних та спектрометричних методів та застосовувати їх для контролю якості лікарських засобів.
Досягнення загальної мети забезпечується конкретними цілями:
1. Інтерпретувати основні закономірності спектральних методів аналізу.
2. Проводити ідентифікацію речовин за допомогою спектральних методів.
3. Проводити визначення кількісного вмісту речовин.
4. Користуватися приладами для вимірювання оптичної густини розчинів, коефіцієнта пропускання, показника заломлення, кута обертання площини поляризації, інтенсивності флуоресценції та ін.
Щоб зрозуміти, як виникає спектроскопічний сигнал, і як він пов'язаний з природою та кількістю речовини, розглянемо природу електромагнітного випромінювання та структуру речовини.
1 . Природа електромагнітного випромінювання
Електромагнітне поле, створене електричними та магнітними силами (так само, як і інші фізичні поля), є одним з видів матерії. Для нього, як і для звичайних матеріальних (хімічних) тіл, справедливі загальні закони збереження матерії та енергії. Але фізичні поля мають і суттєві відмінності від матеріальних тіл. Якщо звичайно матеріальні тіла дискретні (корпускулярні), то матерія фізичного поля неперервна. У той же час, у певних умовах матеріальні тіла можуть проявляти неперервний характер, а фізичні поля – дискретну структуру. Одні види матерії можуть переходити в інші. Так, матерія електрона може переходити в матерію електромагнітного поля і навпаки.
Одна з властивостей матерії – рух, мірою якого є енергія. Так, коливальні рухи електромагнітного поля – один з видів енергії, що має назву електромагнітного випромінювання або світла . Так само, як і матерія, один вид енергії може в певних умовах переходити в інший.
Експериментальні факти привели до уявлень про подвійну природу електромагнітного випромінювання, яке в одних проявах виявляє хвильову природу, тобто має поведінку фізичного поля з неперервними властивостями, а в інших – корпускулярну, тобто представляє собою потік дискретних частинок (фотонів). Якщо на шляху електромагнітного випромінювання зустрічаються матеріальні тіла, то спостерігаються такі явища, як заломлення, інтерференція, дифракція, відбивання, розсіювання, що описуються на основі хвильової природи випромінювання. У той же час, такі явища, як відхилення під дією тяжіння або поглинання та випускання атомами та молекулами, описуються на основі корпускулярної природи випромінювання.
Хвильові властивості . Електромагнітну хвилю можна уявити у вигляді двох перемінних полів, перпендикулярних одне до одного і до напрямку руху хвилі (рис. 1).
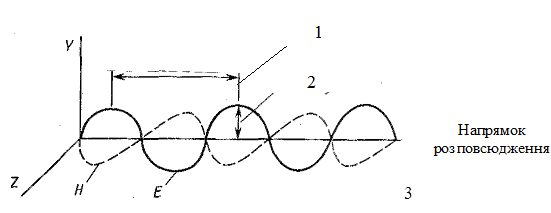
Рис. 1. Електромагнітна хвиля: 1- довжина хвилі; 2 – амплітуда; 3 – напрямок розповсюдження; Н – магнітна складова; Е – електрична складова
Електромагнітну хвилю можна охарактеризувати кількома параметрами.
Частота ν – число коливань електричного поля в секунду, см-1 .
Довжина хвилі λ – відстань між двома максимумами, нм.
Хвильове число ύ – число хвиль в 1 см.
Швидкість сі – швидкість розповсюдження випромінювання у певному середовищі, у вакуумі вона максимальна (с = 2,99792 × 1010 см·с-1 ≈ 300 000 км·с-1 ). У будь-якому іншому середовищі сі = с / п, де п – показник заломлення.
Інтенсивність І – енергія випромінювання в 1 с, що приходиться на одиницю тілесного кута; вона пропорційна квадрату амплітуди (на практиці часто за інтенсивність приймають значення аналітичного сигналу у вільних одиницях, наприклад, число поділок шкали пристрою).
Площина поляризації – площина ХY , в якій коливається електричне поле. Світловий потік, що складається з багатьох плоскостей поляризації, називають неполяризованим, а світловий потік, в якому всі електричні поля лежать в одній плоскості, – плоскополяризованим.
Довжина хвилі, частота та швидкість випромінювання пов’язані співвідношенням:
ν = сі /λ
Частота залежить від довжини хвилі та не залежить від швидкості сі .
Корпускулярні властивості. Випромінювання складається з потоку дискретних частинок (квантів світла, або фотонів), що рухаються зі швидкістю світла. Фотон – матеріальна частинка з певними масою та імпульсом, що відхиляється від прямолінійного шляху під дією сили тяжіння, але, на відміну від інших матеріальних тіл, рухається тільки зі швидкістю світла. Кожен фотон має енергію, пов’язану з його масою та частотою або довжиною хвилі співвідношеннями:
Е = тс2 = hν або Е = hс / λ,
де h – постійна Планка, що дорівнює 6,62·10-34 Дж·с = 4,1·10-15 еВ·с.
Отже, кожен фотон можна за необхідності охарактеризувати частотою або енергією.
Подвійна (хвильова та корпускулярна) природа властива усім матеріальним тілам та фізичним полям. Між масою, швидкістю та довжиною хвилі будь-якого тіла існують такі ж співвідношення, як і для фотона:
Е = тν2 = hν = hυ / λ,
де υ – швидкість руху тіла. Звідси
λ = h / тυ2
В залежності від маси та швидкості тіла домінує хвильова або корпускулярна властивість. При великих масах та малих швидкостях (набагато менших швидкостях світла) довжини хвиль матеріальних тіл настільки малі, що їх хвильові властивості не можна виявити за допомогою сучасної вимірювальної техніки. При швидкостях, близьких до швидкості світла, та при дуже малих масах матеріальних тіл (електрон, позитрон) проявляється їх хвильова природа. При взаємодії потоку фотонів, тобто електромагнітного випромінювання, зі всією речовиною (заломлення на границі двох середовищ, відбиття від поверхні, дифракція) домінує хвильова природа, при взаємодії з окремими атомами або молекулами – корпускулярна.
Спектр електромагнітного випромінювання. Сукупність всіх частот (довжин хвиль) електромагнітного випромінювання називають електромагнітним спектром. Інтервал довжин хвиль від 10-10 до 10-1 м розбивають на області (схема 1): ультрафіолетова (УФ) область займає діапазон ~10 – 380 нм; інфрачервона (ІЧ) область 750 – 105 нм; видиме світло, що використовується у найбільш розповсюджених методах аналізу, займає вузьку область 380 – 750 нм.
Схема 1
Області електромагнітного спектру
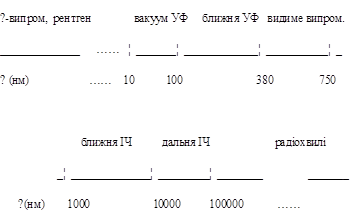
Потік фотонів з однаковою частотою має назву монохроматичного, з різними частотами – поліхроматичного. Звичайний потік випромінювання, що спостерігають від розпалених тіл, зокрема сонячне світло, є поліхроматичним.
2 . Будова атома та походження атомних спектрів
Атом – дискретна частинка речовини розміром ~ 10-8 см, що складається з позитивно зарядженого ядра з радіусом ~ 10-12 см та негативно заряджених електронів, що рухаються навколо нього. Швидкість електрона настільки велика, що в атомі домінують його хвильові властивості. Довжину хвилі електрона, що рухається (~10-8 см), можна порівняти з атомними розмірами, тому електрон не представляють у вигляді дискретного об’єкту, як це робиться в класичній фізиці, наприклад при русі електронів в газорозрядній трубці. Електрон начебто розмазаний по атому у вигляді хвилі, і можна говорити лише про можливість його перебування у якійсь точці в середині атому або про розподіл густини негативного заряду навколо ядра, який може бути достатньо складним.
Області з максимальною густиною заряду називають електронними орбіталями або енергетичними рівнями, оскільки кожна орбіталь характеризується певною енергією. Енергетичний стан всього атому визначається в основному енергією електронних орбіталей.
Кожен електрон і атом, а отже, енергетичний рівень описують набором чотирьох квантових чисел: головного, побічного, магнітного та спінового.
Головне квантове число п характеризує віддаленість електрона від ядра та приймає значення 1, 2, 3,… Чим більше п , тим далі від ядра знаходиться електронна орбіталь.
Побічне квантове число l визначає форму орбіталі та приймає значення 0, 1, 2, 3, …, котрі позначають буквами s, p, d, f ,… . Електрон, що рухається, має момент кількості руху. При l = 0 момент кількості руху дорівнює нулю, і електричний заряд розмазаний по сфері, при l = 1 орбіталь має форму гантелі.
Магнітне квантове число т характеризує положення орбіталі в просторі та приймає значення від – l до l. При l = 0 магнітне квантове число дорівнює нулю, при l = 1 воно приймає значення -1, 0, +1; і орбіталі, що мають форму гантелі, розташовуються вздовж осей прямокутної системи координат.
Спінове квантове число тs , що дорівнює -1/2 та +1/2, відображає власний момент імпульсу електрона.
За принципом Паулі в атомі не може бути двох електронів з однаковим набором квантових чисел (хоча б одне число повинне відрізнятися). В іншому разі сили відштовхування "виштовхнули" б один з них на іншу орбіталь. Тому багатоелектронний атом має складну структуру: електрони з однаковими головними квантовими числами утворюють електронні шари-оболонки (рівні), що позначаються буквами K, L, M, … для п = 1, 2, 3, … відповідно, а електрони з однаковими побічними квантовими числами – підоболонки (підрівні) у межах однієї оболонки. Електрони з різними значеннями l та m та з однаковим п можуть бути рівними за енергією (виродженими), однак при дії будь-якого навколишнього поля (електричного, магнітного та ін.) виродження знімається.
Походження атомних спектрів. При зміні хоча б одного квантового числа атом отримує або віддає енергію. Це може трапитися при взаємодії атома з електромагнітним полем, при безпосередньому обміні енергією з іншими атомами або молекулами, наприклад, при зіткненні або при хімічних реакціях. При відсутності зовнішніх дій атом знаходиться в основному стані, тобто має найменшу енергію.
При отриманні енергії зовні швидкість електронів збільшується – атом збуджується.
Атом не може отримати або віддати довільну кількість енергії; енергетичний обмін здійснюється тільки кінцевими порціями, зокрема квантами електромагнітного випромінювання (фотонами). Іншими словами, атом може знаходитися тільки в певних енергетичних станах, що відрізняються один від одного на кінцеву величину.
На рис. 2 енергетичні стани відображені горизонтальними лініями, з яких нижча відповідає основному рівню, а інші – збудженим; переходи від одного стану в інший позначені стрілками.
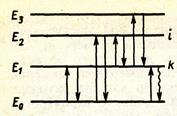
Рис. 1.1.2. Енергетичні переходи в атомі
Один атом за один акт поглинає або випускає тільки один фотон з певною енергією (частотою). Хімічний елемент складається з багатьох однакових атомів, що можуть переходити на різні енергетичні рівні, випускаючи або поглинаючи фотони різних частот. Сукупність усіх фотонів однієї частоти складає спектральну лінію , при поглинанні її називають абсорбційною, при випусканні – емісійною. Сукупність всіх абсорбційних або всіх емісійних ліній називають абсорбційним (поглинання) або емісійним (випускання) спектром речовини.
Спектр поглинання отримують при розташуванні досліджуваної речовини в полі електромагнітного випромінювання (наприклад, на шляху світлового потоку), а для отримання спектру випускання попередньо переводять атоми речовини у збуджений стан, що досягається підведенням будь-якого виду енергії (теплової, хімічної, електричного заряду, електромагнітного випромінювання та ін.); після збудження атоми через 10-9 – 10-7 с повертаються в основний стан, випускаючи фотони або теплоту. В останньому випадку перехід буде відбуватися без випромінювання; на рис. 2 він зображений хвилястою стрілкою.
Частота випромінювання, що випускається або поглинається, визначається різницею енергії між електронними орбіталями ΔЕ :
ν = ΔЕ / h
Абсолютна енергія квантових станів невідома, і через це її відраховують від якогось рівня, умовно прийнятого за нульовий, а саме від енергії іонізації, тобто повного відриву електрону від атому.
Енергія атомних орбіталей дуже відрізняється. Так, для збудження електрону з ближньої до ядра орбіталі (головне квантове число п = 1) необхідно більш ніж 6·104 кДж·моль-1 (фотони, що випускаються, мають частоту рентгенівського випромінювання), а для збудження зовнішніх електронів достатньо 150–600 кДж·моль-1 (випромінювання ультрафіолетової та видимої областей). Зі збільшенням головного квантового числа енергія збудження ΔЕ та частота випромінювання зменшуються.
Найбільш вірогідні переходи з першого збудженого рівня на основний Е0 ; відповідні їм спектральні лінії називають резонансними . Електрон може перейти і в більш високий енергетичний стан (Е2, Е3 , і т.д.). Повернення його на рівень Е0 може проходити через ряд проміжних ступенів.
Зовнішні електрони, що легко збуджуються, називають оптичними , переходи за їх участю дають оптичний спектр. Енергія збудження зовнішніх електронів різних елементів неоднакова. Наприклад, для отримання резонансної лінії лужних металів (перехід Е1 → Е0 ) потребується порівняно невисока енергія (~ 2 еВ, довжини хвиль лежать у видимій області), для неметалів ця енергія суттєво більше (~ 5 еВ, довжини хвиль лежать в УФ–області). Чим більше зовнішніх електронів, тим більше можливостей має атом для енергетичних переходів, через це спектри металів типу ферума складаються з тисяч ліній, а спектри лужних металів бідні на них.
Не всі оптичні переходи рівно вірогідні. Співпадання енергії переходу електрона та енергії поглинутого фотону – основна, проте не єдина умова зміни енергетичного стану атому. Переходи, вірогідність яких велика, називаються дозволеними , а вірогідність яких мала – забороненими . Вірогідність енергетичних змін диктується правилами відбору, заснованими на квантово-механічних уявленнях. Заборонений перехід більше ніж одного електрону, а також перехід зі зміною спіну та зміною побічного квантового числа більш ніж на одиницю (тобто дозволені переходи з s- на p- орбіталь або з p- на d- орбіталь і т.п., але не з s- на d- або з p- на f- орбіталь).
Лінії в спектрі обумовлені різними переходами багатьох однакових атомів. В одиницю часу речовина поглинає або випускає багато фотонів з енергією дозволених та мало з енергією заборонених переходів. Оскільки інтенсивність лінії пропорційна числу фотонів в секунду, то більш частішим переходам відповідає інтенсивна лінія, а рідшим – менш інтенсивна. Найбільш інтенсивні резонансні лінії, бо вірогідність переходу Е1 → Е0 велика.
Число фотонів z , що випускаються речовиною при переході електронів з рівня і на рівень k , пов’язано з числом атомів в стані і (Ni ) відношенням
z = Aik Ni ,
де Aik – коефіцієнт Ейнштейна, рівний числу переходів і → k в 1 с (Aik = 107 - 109 ); якщо Aik = 0, то перехід заборонений.
Енергія одного фотону дорівнює hνik , отже, інтенсивність емісійної лінії I , рівну сумарній енергії всіх фотонів, можна виразити так:
I = hνik Aik Ni
Інтенсивність абсорбційної лінії залежить як від числа поглинаючих атомів і вірогідності поглинання фотона, так і від числа фотонів, що поглинають:
I = пhνkі Вkі Nk ,
де п – число фотонів з частотою νkі ; Вkі – коефіцієнт Ейнштейна, що показує можливість переходу від стану k в стан і ; Nk – число атомів в стані k, що поглинають.
Випускання – спонтанний процес, тому що атом завжди намагається перейти з нестабільного збудженого стану в більш стабільний стан з меншою енергією. Навпаки, поглинання – вимушений процес, що збільшує енергію атому за рахунок поглинутого фотона.
Якщо передати атому високу енергію (103 – 105 еВ) (наприклад, опромінити речовину потоком швидких електронів або рентгенівським випромінюванням), то можливо збудження внутрішнього електрону та вилучення його з орбіталей K, L і т.д. В цьому випадку на вільне місце може перейти електрон з більш віддаленої орбіталі (наприклад, з L на К -орбіталь, з М на L -орбіталь, з М на К -орбіталь). При цьому випускається квант рентгенівського випромінювання.
3 . Будова молекул та походження молекулярних спектрів
Молекули складаються з двох чи більше атомів, з’єднаних між собою в певному порядку хімічними зв’язками, які утворені при взаємодії зовнішніх електронів. При цьому атоми зближаються, але так, що їх завершені оболонки не торкаються. Енергетична будова молекули складніша, ніж у атома. Наряду з рухом електронів відбувається коливальний рух самих атомів, точніше їх ядер, та обертання молекули як цілого. Отже, в будь-якому стаціонарному стані енергія молекули складається з електронної, коливальної та обертальної енергій:
Е = Еел + Екол + Еоб
Найбільший вклад в повну енергію вносить енергія електронів, найменший – енергія обертання молекули:
Еел >>Екол >> Еоб
Обертання молекул проявляється у речовин лише в стані газу, в конденсованих станах (рідкому та твердому) обертання ускладнено.
Так само як і атом, молекула може існувати лише в певних енергетичних станах, що називаються енергетичними рівнями (орбіталями). Кожному електронному стану відповідають коливальні рівні, а кожному коливальному рівню – обертальні. Будь-який рівень, окрім головного, побічного, магнітного та спінового, характеризується коливальним та обертальним квантовими числами.
Походження молекулярних спектрів. При отриманні енергії ззовні чи при втраті її молекула переходить з одного енергетичного рівня на інший. У молекул, так само як і у атомів, найбільш збудливими є зовнішні (оптичні) електрони. Енергія збудження зовнішніх електронів молекул приблизно така сама, як в атомах (150 – 600 кДж·моль-1 ), що відповідає випромінюванню в видимій та УФ – ділянках спектру. Переходи між коливальними рівнями в межах одного електронного стану відповідають меншим енергіям (0,4 – 150 кДж·моль-1 , випромінювання в ІЧ-області), переходи між обертальними рівнями характеризуються ще меншою енергією (0,01 – 0,4 кДж·моль-1 , випромінювання в далекій інфрачервоній та мікрохвильовій областях).
Переходи між енергетичними рівнями зі зміною головного квантового числа є електронними, між коливальними рівнями – коливальними, між обертальними рівнями – обертальними (відповідно спектри називають електронними, коливальними та обертальними ). Чистих електронних та коливальних спектрів не існує. Електронний перехід обов’язково супроводжується зміною коливального та обертального станів, а коливальний перехід призводить до змін обертального стану.
В спектроскопії частіше використовують збудження молекули під дією електромагнітного поля. При цьому молекула поглинає фотони з енергією, рівною різниці енергій її орбіталей. Сукупність всіх поглинутих частот складає спектр поглинання молекули (молекулярний абсорбційний спектр ). Збудження молекул іншими видами енергій, наприклад в плазмі, не викор
истовують, бо більшість речовин в цих умовах розпадається. Число енергетичних станів молекул велике, а енергії окремих переходів бувають настільки близькими, що розрізнити їх неможливо. Тому в молекулярних спектрах спектральні лінії з близькими частотами зливаються в одну смугу поглинання .
В молекулах, як і в атомах, не всі енергетичні зміни рівно вірогідні. Так, заборонені переходи більше ніж одного електрону за один акт, переходи зі зміною побічного квантового числа більш ніж на одиницю, переходи зі зміною спіну. Проте вірогідність заборонених енергетичних змін в молекулах трохи вище, ніж в атомах, наприклад зміна спіну.
Вірогідність поглинання фотонів визначає інтенсивність спектральних ліній, що складають смугу поглинання. Максимум смуги відповідає лінії з найбільшою інтенсивністю.
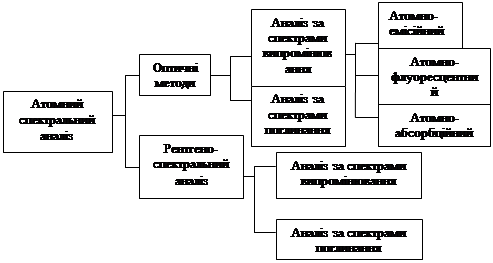
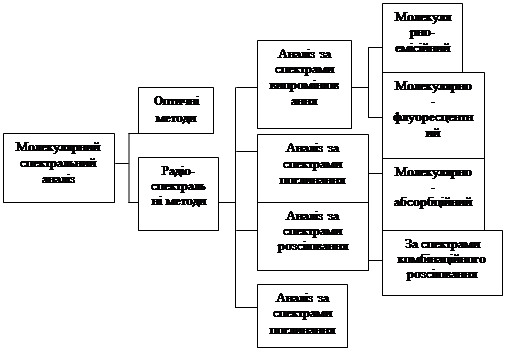
4 . Класифікація спектроскопічних методів аналізу
Методи спектроскопії можна класифікувати за рядом ознак.
1. За типом оптичних явищ розрізняють спектроскопію випускання, поглинання та розсіяння. Спектроскопію випускання, в свою чергу, поділяють на емісійну та люмінесцентну.
2. У відповідності до діапазонів енергії електромагнітного випромінювання спектроскопію поділяють на наступні основні види: γ–спектроскопію, рентгенівську спектроскопію, оптичну спектроскопію (до неї включають спектроскопію в УФ та видимій областях, а також ІЧ – спектроскопію), радіоспектроскопію (до неї включають мікрохвильову спектроскопію та власне радіочастотну спектроскопію).
3. За об’єктами, що вивчають, спектроскопію поділяють на ядерну, атомну та молекулярну, до ядерної спектроскопії (що включає, власно кажучи, α –, β – та γ – спектроскопію) належить аналітична месбауеровська спектроскопія. До атомної спектроскопії відносять атомно–емісійну, атомно–флуоресцентну, атомно–абсорбційну, рентгенофлуоресцентну, ЕПР та ЯМР – спектроскопію. До молекулярної спектроскопії належать електронна молекулярна абсорбційна спектроскопія (в УФ та видимій областях спектра), ІЧ– спектроскопія, спектроскопія комбінаційного розсіяння, мікрохвильова та люмінесцентна спектроскопія.
Класифікація спектроскопічних методів аналізу представлена на схемі 2.
5 . Оптичні методи аналізу
У фармацевтичній практиці найбільш уживаними є оптичні методи аналізу.
До оптичного діапазону відносять електромагнітні хвилі з довжиною λ від 100 до 10 000 нм (схема 1). Його розділяють на три ділянки:
- ультрафіолетову (УФ) — (100–380 нм);
- видиму — (380–760 нм);
- інфрачервону (ІЧ) — (760–10 000 нм).
Залежно від характеру взаємодії речовини з електромагнітним випромінюванням оптичні методи аналізу поділяють на:
— абсорбційні – побудовані на вимірюванні поглинання речовиною світлового випромінювання. До них відносять колориметрію, фотоколориметрію, спектрофотометрію, атомно-абсорбційні методи;
— емісійні – побудовані на вимірюванні інтенсивності світла, що випромінює речовина. До них відносять флуориметрію, емісійний спектральний аналіз та полуменеву фотометрію.
Схема 2 Класифікація методів спектрального аналізу
В табл. 1 наведено види спектроскопії, що використовуються в аналітичній хімії.
Таблиця 1 Електромагнітний спектр та методи аналізу
| Переходи |
Випромінювання |
Довжина хвилі |
Частота, Гц |
Енергія |
Метод аналізу |
| Ядерні |
γ-випромінювання |
3 нм |
1·1020 |
40 МДж/моль |
Нейтроно-активаційний |
| Внутрішні електрони |
рентгенівське |
До 30 нм |
До 1·1016 |
До 4 МДж/моль |
Рентгенівська спектроскопія: емісійна, абсорбційна, флуоресцентна |
| Зовнішні електрони |
Далеке УФ Ближнє УФ видиме |
> 200 нм 200-400 нм 400-800 нм |
> 1,5·1015 > 7,5·1014 > 3,75·1014 |
> 600 кДж/моль 600-300 кДж/моль 300-150 кДж/моль |
Абсорбційна та емісійна спектроскопія в УФ - та видимій областях (спектрофотометрія та люмінесценція) |
| Молекулярні коливання |
Ближнє ІЧ Далеке ІЧ |
До 2,5 мкм > 40 мкм |
> 1,2·1014 > 7,5·1012 |
До 50 кДж/моль > 3 кДж/моль |
Абсорбційна ІЧ-спектроскопія |
| Молекулярні обертання |
Мікрохвильове |
> 3 см |
> 1·1010 |
> 4 Дж/моль |
Мікрохвильова спектроскопія, ЕПР |
| Ядерно-спінові |
Ядерний магніт. резонанс |
> 3 мкм |
> 1·105 |
>40 мкДж/моль |
ЯМР |
Методи, пов'язані із взаємодією світлового випромінювання із суспензіями поділяють на:
— турбідиметрію , що ґрунтується побудована на вимірюванні інтенсивності світла, яке поглинається незабарвленою суспензією;
— нефелометрію , що ґрунтується на вимірюванні інтенсивності світла, яке відбивається або розсіюється забарвленою або незабарвленою суспензією.
Методи, що використовують явище поляризації молекул під дією світлового випромінювання, розділяють на:
—рефрактометрію , що ґрунтується на вимірюванні показника заломлення;
— поляриметрію , що ґрунтується на вимірюванні кута обертання площини поляризації поляризованого променя світла, що пройшов через оптично активне середовище;
— інтерферометрію , що ґрунтується на вимірюванні зсуву інтерференції світлових променів при проходженні їх крізь кювети з розчином речовини.
Оптичні методи аналізу нерозривно пов'язані з використанням сучасних приладів різної складності, що підвищує вартість аналізу, але дає ряд переваг у порівнянні з класичними хімічними методами: експресність, нерухомість зразків, простоту методики, використання невеликих кількостей речовин для аналізу, можливість аналізувати сполуки будь-якої природи, проведення експрес-аналізу багатокомпонентних сумішей. Крім того, вони підвищують чутливість, точність і відтворюваність результатів кількісних визначень.
6 . Спостерігання та реєстрація спектроскопічних сигналів
Спектральні сигнали спостерігають та реєструють за допомогою спектральних пристроїв.
Сигнали, що виникають при поглинанні чи випусканні видимого випромінювання, можна спостерігати візуально, наприклад, жовте світло, що випускається збудженими атомами натрію в полум’ї, або світіння солей урану після опромінення їх УФ-світлом. Візуальні способи спостереження сигналу мають обмежене застосування, їх використовують для якісного знаходження деяких елементів та їх напівкількісного визначення в польових умовах. Для спостереження всього діапазону електромагнітного випромінювання ці способи непридатні.
Спектральні пристрої різноманітні, проте всі вони мають декілька загальних основних вузлів: джерело випромінювання, пристрій для виділення пучка фотонів з однаковою частотою, відділення для установки досліджуваного зразка, приймач випромінювання (детектор), перетворювач сигналу. Окрім цього, кожен спектральний прилад має лінзи, дзеркала, щілини та інші оптичні деталі; багато приладів мають електронні пристрої та комп’ютери. Опишемо деякі загальні деталі, що входять практично в кожен спектральний прибор, а саме пристрої для отримання монохроматичного випромінювання та приймачі випромінювання.
Монохроматизація випромінювання. В ідеальному випадку для отримання аналітичного сигналу від одного єдиного переходу потрібно опромінити речовину монохроматичним потоком (в абсорбційних методах) або затримати випромінювання всіх випускаючих частот, окрім потрібного (в емісійних методах).
На практиці світлові потоки поліхроматичні, тобто складаються з випромінювання багатьох довжин хвиль. Вилучити абсолютно монохроматичне випромінювання неможливо. Отримують потік випромінювання більш чи менш вузького інтервалу довжин хвиль, що досягається бездисперсійними (за допомогою світлофільтрів) або дисперсійними (за допомогою монохроматорів) способами.
Світлофільтри бувають абсорбційними та інтерференційними.
Абсорбційний світлофільтр – це кольорове скло, що пропускає випромінювання обмеженого (20–40 нм) інтервалу довжин хвиль та поглинає випромінювання всіх інших. Кожен світлофільтр характеризується певною кривою пропускання. Довжину хвилі, при якій пропускання максимальне, називають ефективною довжиною хвилі та вказують в паспорті світлофільтра. Інша характеристика світлофільтра – на півширина пропускання, тобто інтервал довжин хвиль при пропусканні, рівному половині максимального.
Замість забарвлених стекол можна використовувати дві скляні пластинки, між якими наливають розчин забарвленої сполуки.
Більш вузьку смугу пропускання (до кількох нанометрів) отримують за допомогою інтерференційного світлофільтра, більш складного за своєю будовою.
Монохроматор складається з диспергуючого елементу, вхідної та вихідної щілин та деяких оптичних елементів. Диспергуючими елементами є призми та дифракційні решітки.
Розкладання світла призмою базується на його заломленні на межі поділу двох матеріалів, наприклад повітря та кварцу або повітря та скла. Випромінювання від джерела фокусується на вхідну щілину, зводиться в паралельний потік, що колимирується лінзою, та потрапляє на призму. Промені світлового потоку, потрапляючи на грань призми, відхиляються від прямолінійного шляху під кутом, що залежить від довжини хвилі (рис. 3).
При виході з призми промені знову заломлюються та виходять під різними кутами. Це явище називають розкладанням світла (дисперсією). Розкладене випромінювання фокусують та спрямовують на вихідну щілину. Випромінювання, що виходить, має форму вихідної щілини, наприклад, вузької смуги. Щоб отримати випромінювання потрібного інтервалу довжин хвиль, призму повертають навколо осі за допомогою спеціального механічного пристрою. При цьому чим вужча щілина, тим менше інтервал довжин хвиль, що виходять з неї.
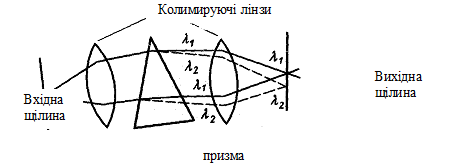
Рис. 3. Призмовий монохроматор
Розкладання світла дифракційними решітками базується на явищах дифракції та інтерференції. Дифракційні решітки бувають пропускаючими та відбиваючими. Пропускаюча решітка являє собою пластинку з прозорого матеріалу, наприклад, скла, на яку вручну або спеціальною машиною наносять паралельні штрихи. Випромінювання проходить крізь прозорі смуги та розкладається на промені різних довжин хвиль, що інтерферують між собою. Відбиваючу решітку виготовляють з металевої пластини, на якій нарізають канавки певного профілю. Промені, потрапляючи на виступи решітки, відбиваються та інтерферують. В результаті відбувається розкладання світла на складові промені різних довжин хвиль.
Приймачі випромінювання. Для детектування випромінювання використовують фотохімічні реакції (фотографію), явище фотоефекту та безпосередньо підрахунок фотонів.
Фотографія заснована на відомій фотохімічній реакції – виділення металічного аргентума з його солей під дією фотонів. Сіль аргентума (звичайно хлорид) закріплюють на скляній пластині. Почорніння смуги пропорційно інтенсивності падаючого на фотопластинку випромінювання. Фотографію використовують в емісійних методах.
Фотоелектричні методи основані на явищі фотоефекту – відриву електрону від поверхні, на яку падає фотон (зовнішній фотоефект), або на збільшення електричної провідності провідника під дією світла (внутрішній фотоефект). Пристрої, в яких використовують явища фотоефекту, називають фотоелементами.
Фотоелементи з внутрішнім фотоефектом мають просту конструкцію, але малочуттєві та швидконасичувані ("насичуваність" - послаблення сигналу при тривалому освітленні). Ці фотоелементи використовують для вимірювань достатньо інтенсивних світлових потоків в видимій області.
Фотоелемент із зовнішнім фотоефектом складається з фотокатоду та аноду, розміщених в скляному балоні, з якого викачане повітря. Фотокатод покривається шаром сполуки лужного металу (Cs2 O, Cs3 Sb, K2 CsSb та ін.), що випускає електрони при попаданні на нього фотонів. Якщо до катоду та аноду прикласти зовнішню напругу ~ 90 В, то виникає електричний струм, який вимірюють гальванометром. В різних областях спектру використовують різні фотоелементи: киснево-цезієвий (650 – 100 нм) та сурм'яно-цезієвий (185 – 650 нм). В фотоелементах із зовнішнім ефектом навіть за відсутності випромінювання протікає електричний струм (він називається темновим ), який вимірюється за допомогою спеціального потенціометра.
Найчастіше для прийому випромінювання використовують фотопомножувачі, що складаються з фотокатоду та кілька додаткових електродів (динодів), з’єднаних між собою (рис. 4). На кожен динод подається напруга на 90 В більша, ніж на попередній. Електрон, що вибитий з фотокатоду під дією фотону, потрапляє на перший динод та викликає випускання п електронів, які направляються до другого диноду та знову викликають емісію п електронів і т. д. Електрони, що випускаються динодами, називають вторинними. Загальна кількість електронів дорівнює пт , де т – число динодів. Нехай п = 4 та число динодів рівне 12, тоді загальна кількість електронів, що отримуються при попаданні на фотокатод одного-єдиного фотону, дорівнює 17·106 , що складає струм ~ 0,5 мА.
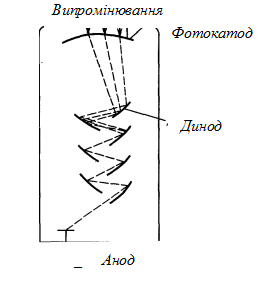
Рис. 4. Схема фотопомножувача
Якщо інтенсивність падаючого потоку мала, то можна зафіксувати та порахувати сигнали від окремих фотонів за допомогою спеціальних електронних пристроїв – лічильників фотонів .
Література
1. Бабко А.К, Пятницкий И.В. Количественный анализ. М.: Высшая школа, 1968. 494 с.
2. Багатоядерний ЯМР: навч. посібник / Г. Шредер, В. Гєрчик, Й. Опейда та ін. – Донецьк: Юго-восток, 2003. – 111 с.
3. Барковский В.Ф., Городенцева Т.Б., Тодорова Н.Б. Основы физико-химических методов анализа / Под ред. В.Ф. Барковского. – М.: Высш. шк., 1983.- 247 с.
4. Брицке М.Э. Атомно-абсорбционный спектрохимический анализ. М.: Химия, 1982. 250 с.
5. Дорохова Е. Н., Прохорова Г. В. Задачи и вопросы по аналитической химии.— М.: Мир., 2001.— 267 с.
6. Збірник задач і вправ з аналітичної хімії / А.С. Середа, Р.Л. Галаган; За ред. А.С. Середи. – К.: ЦУЛ, 2002. – 427 с.
7. Коренман И. М. Методы количественного химического анализа.— М.: Химия, 1989.- 124 с