| Скачать .docx |
Реферат: Комплексы меди и золота в лечении ревматоидного артрита
Комплексы Cu и Au в лечении
ревматоидного артрита
Ревматоидный артрит – заболевание, для которого хризотерапия используется во всем мире. Ревматоидный артрит является воспалительным повреждением, которое приводит к постепенной эрозии суставного хряща. Сначала воспаление происходит в синовиальной оболочке, которая окружает суставы, а затем перемещается в синовиальную полость между костями. Повреждаются также лизосомальные ферменты коллагеназы и других протеаз, которые находятся возле пораженной области. В результате разрушения здоровой ткани, клетки и фрагменты тканей, которые стимулируют дальнейшее воспаление, обеспечивают миграцию иммунных клеток - макрофагов в воспаленную область. Таким образом, цикл деградации и последующего уничтожения воспалительных фрагментов является налаженным.
Хризотерапия эффективна у 70% пациентов, которые получают соответствующее лечение. Другие пациенты не получают эффективных веществ из препаратов золота или страдают от побочных эффектов, с связи с которыми необходимо прекращение лечения. Большинство побочных эффектов являются умеренными, некоторые из них только косметические (например, сыпь на коже). Иногда встречаются опасные для жизни последствия (около 1 на 10000 пациентов) такие как: торможение формирования красных и белых клеток крови в костном мозге. Пациенты, как правило, еженедельно или ежемесячно сдают анализ крови на содержание золота, для того чтобы следить за содержанием золота в крови и при необходимости свести к минимуму накопление золота в клетках. Препараты золота хорошо подтверждают противовоспалительную активность, которую они разделяют со многими органическими лекарства, такими как аспирин и ибупрофен. Препараты золота имеют более глубокое воздействие на разрушение сустава, простые противовоспалительных средства не могут так воздействовать. Некоторые пациенты после хризотерапии могут получить длительные ремиссии заболевания. Много механизмов было предложено для хризотерапии, одной из проблем в изучении механизмов было то, что комплексы золота на самом деле являются про-лекарствами.
В дальнейшем удачным было бы создать новые (третьего поколения) препараты, которые сочетают эффективность (первое поколение) инъекционных препаратов золота (I) с безопасностью препаратов на основе ауранофина (второе поколение препаратов). CHAPTER 3Gold complexes with Anti- arthritic, Anti-tumour and Anti-HIV Activity
ГЛАВА 1. ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ НА ОСНОВЕ КОМПЛЕКСОВ ЗОЛОТА
Первые сведения о применении золота для лечения болезней содержатся в древней китайской медицине и относятся к 2500 г. до н. э. В средние века некоторые соединения золота считались целебными против проказы. Систематические исследования соединений золота в качестве лекарственных препаратов начались с работ Коха, который в 1890 г. обнаружил, что цианиды золота ингибируют рост туберкулезных палочек и других патогенных организмов. В 1917 г. для лечения туберкулеза начали применять комплекс золота с тиоглюкозой, который имеет практическое значение и до настоящего времени, но уже используется для лечения ревматоидного артрита. В 1927 г. обнаружено, что во время лечения туберкулеза соединениями золота у 6ольных, страдающих ревматизмом, уменьшаются боли в суставах.
В современной химиотерапии соединения золота употребляются в основном для лечения ревматоидного артрита наряду с другими противовоспалительными препаратами.
Коллоидальное золото188 Аи аккумулируется в клетках Купфера и ретикулоэндотелиальных, на чем основано его использование в диагностике болезней печени
На ранней стадии развития хризотерапии испытывались противовоспалительные свойства АиС13 , коллоидальных Аи (0) и Аи2 S3 . Предполагалось, что в организме они превращаются в активно действующие вещества. Современный список тестированных на противоартритную активность препаратов золота включает в основном соединения золота (I), содержащие молекулы с донорными атомами серы и фосфора. Делаются попытки найти активные соединения среди комплексов золота с азотсодержащими лигандами. Соединения золота (III) в современной хризотерапии не применяются, так как являются сильными окислителями.
Противовоспалительные свойства золотосодержащих препаратов исследуются сейчас на животных с экспериментальным артритом и на некоторых других моделях. Экспериментальные артриты пригодны для тестирования препаратов золота, вводимых орально, например фосфорсодержащих соединений. Удовлетворительных моделей для испытаний тиолов золота пока не найдено.
1.1 Серосодержащие соединения золота
Биологические свойства золота зависят от состояния, в котором находится металл, и от природы его окружения. В этом отношении золото отличается от щелочных и щелочноземельных элементов, которые в биосистемах действуют как ионы и фармакологические свойства которых слабо зависят от формы их введения в организм.
В водных растворах соединения золота (I), за исключением Аи(CN)2 - , неустойчивы и разлагаются на элементарное золото и комплексы Аи (III). Неустойчивое состояние Аи (I), однако, стабилизируется «мягкими» серосодержащими лигандами. Тиосоединения золота (I) устойчивы и легко образуются при действии тиолов и на коллоидоидальное золото (0), и на соединения золота (III).
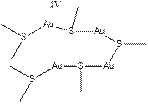
В современной клинической хризотерапии наиболее широко используются соединения золота с тиомалоновой кислотой и тиоглюкозой. В меньшей степени применяются тиосульфат и тиопептиды золота. Исследование структуры тиолов Аи (I) показало, что в водном растворе они представляют собой полимеры. По данным измерений молекулярной массы, ИК-спектров и спектров ПМР на ядрах 13 С тиомалат золота содержит кластеры из четырех атомов золота и семи тиомалонатных анионов, связанных с металлом через атомы серы. Изучение тиомалата золота (I) в водном растворе доказало существование при высокой ионной силе чувствительных к действию кислот координированных тиомалонатных анионов трех типов. Необходимо отметить легкость замещения тиола в соединениях золота, чем, возможно, и объясняются распределение миокризина в организме и некоторые из его побочных эффектов. Методом рентгеноструктурного анализа установлено строение ауротиосульфата:

Химия ауродетоксина неизвестна. Он представляет собой определенную фракцию протеинов, полученную из волос человека или других источников, которая содержит 13% золота.
Все лекарственные препараты золота, в которых металл связан только с атомами серы, обладают лечебным действием при парэнтеральном применении (в основном путем внутримышечных инъекций). Санокризин можно вводить и внутривенно. При пероральном использовании тиосоединения золота не эффективны.
1.2 Фосфорсодержащие соединения золота
Обычно при внутримышечных инъекциях тиолы золота назначаются в сравнительно высоких количествах.
В поиске менее токсичных препаратов, чем тиолы золота, синтезированы комплексы золота (I) с фосфинами и фосфитами. Комплексы, содержащие в качестве донорных атомов фосфор, оказались активными противоартритными агентами для перорального применения. Их можно вводить меньшими дозами (0,5—10 мг). Они хорошо всасываются, если применяются в виде таблеток или капсул, и сравнительно легко выводятся из организма.
При изучении фосфорсодержащих препаратов типа К3 РАuХ (X =Сl- , SCN- ) установлено, что природа фосфина влияет на биологическую активность золота (I) в значительно большей степени, чем природа X. С увеличением объема заместителя R в фосфине противоартритное действие препарата уменьшается. Самым активным оказался комплекс с триэтилфосфином (С2 Н5 )3 РАuСl. При пероральном введении он вызывает такой же эффект, как и Na2 Аu [SС2 Н3 (СООН)2 при внутримышечном.
1.3 Азотсодержащие соединения золота
Первым из испытанных на противоартритную активность веществом, в котором золото (I) связано только с донорными атомами азота, является натрий-бис-(N-метилгидантоинато)-золото (I).

Строение его установлено методом рентгеноструктурного анализа 1315]. Биологические испытания показали, однако, что оно не удовлетворяет требования противоартритных тестов [326].
Примерами комплексов золота с азотсодержащими лигандами, пригодными для перорального введения, являются соли бис-(пиридин)-золота (I)

1.4 Соединения золота с разными донорными атомами
Возможность снижения токсичности золотосодержащих препаратов путем применения активно действующих агентов, вводимых перорально, стимулировала развитие работ по синтезу и исследованию противоартритной активности соединений золота с разными донорными атомами.
Синтезированы комплексы золота, пригодные для использования в виде таблеток. Согласно рентгеноструктурным данным образуются десятичленные хелаты, в которых атомы золота, серы и фосфора не компланарны:

Для перорального введения синтезированы соединения золота с пиридином и фосфинами типа

и комплексы золота с производными тиомочевины. Серию комплексов составляют фосфорсодержащие илиды линейного строения и циклический комплекс:

1.5 Побочное действие комплексов золота
Эффективность лечения ревматоидных артритов соединениями золота осложняется их токсичностью, которая может быть очень высокой. Степень токсичности зависит от схемы лечения, скорости накопления и выведения препарата, а также от других факторов. Схемы лечения препаратами золота окончательно не установлены и находятся на стадии разработок.
Независимо от способа применения препараты золота быстро проникают в плазму крови и концентрируются в ней, достигая через несколько часов наивысшего содержания. Затем количество золота в крови немного снижается, выходя па постоянный и довольно высокий уровень, который сохраняется длительное время.
Аккумуляция золота происходит в разных органах, следствием чего являются всевозможные патологии (нарушение функции почек, гепатиты, колиты, дерматиты, стоматиты, фарингиты, гастриты и др.). Естественно, что при наличии перечисленных заболеваний хризотерапия противопоказана.
Как уже упоминалось, преимущество перорально вводимых препаратов золота заключается в их меньшей токсичности. Например, ауронофин по сравнению с миокризином и солганолом незначительно повреждает почки и печень, так как накапливается в них в небольшой концентрации. Основное количество золота после употребления ауронофина выводится из организма через пять недель, а после применения тиопроизводных — через несколько месяцев. При лечении ауронофином не наблюдаются стоматиты, дерматиты и другие осложнения.
Для ослабления побочных эффектов хризотерапию начинают с малых доз, постепенно их увеличивая. В случае необходимости для ослабления токсичности используют детоксиканты (антагонисты). Токсичность препаратов золота обусловлена их взаимодействием с различными реакционно способными группами (НО- , =С=О, - SH, - S – S - , - NH2, =NH и др.) биомолекул, играющими важную роль в нормальных физиологических процессах. Антагонисты токсичности хризотерапии должны обладать способностью реагировать с соединениями золота с образованием прочных комплексов, т. е. предотвращать связывание золота с биомолекулами организма и исключать его из биопроцессов.
1.6 Механизм действия препаратов золота
Ревматоидные артриты — хронические воспалительные заболевания системы соединительной ткани, сопровождающиеся нарушением процессов иммуногенеза и белково-ферментативного обмена. Первопричиной болезни, по-видимому, является высвобождение содержащихся в лизосомах гидролитических ферментов — гликозидаз и протеаз, которые вызывают распаривание сульфгидрильных групп, а затем образование дисульфидных связей между протеинами. В результате высвобождения ферментов происходит деструкция тканей, денатурация белков и превращение их в макроглобулы, что приводит к включению иммунной системы. Агенты, подавляющие образование активных сульф-гидрильных групп способны ингибировать воспалительные процессы. К таким агентам и относятся соединения золота.
Золото, распределяясь по всему организму, избирательно концентрируется в воспаленных синовиальных тканях. Содержание его в болезненных суставах в два раза выше, чем в здоровых. В суставах, не подвергшихся воспалению, золота очень мало или совсем нет.
Механизм действия препаратов золота при лечении ревматоидных артритов окончательно не установлен. Известно, что золото накапливается внутри макрофагов, а затем переходит в лизосомы (которые называются ауросомами).
Так как золото накапливается в лизосомах, то, вероятно, оно ингибирует гидролитические ферменты. Такое же действие на ткани, как и гидролитические фермелты, могут, оказывать супероксид-ион О2 - или гидроксильные радикалы. Метаболизм О2 - контролируется дисмутазами, и такие ферменты тестировались на клиническую активность при лечении ревматоидного артрита. Полученные данные дали возможность предположить, что препараты золота могут действовать как супероксиддисмутаза или пероксидаза, предохраняя ткани от разрушения О2 - .
При ревматоидных артритах, как и при других воспалительных реакциях, в плазме, и сыворотке крови повышается количество медь-содержащего фермента — церулоплазмина.
Препараты золота могут влиять на тиол-дисульфидное равновесие:
![]()
У больных ревматоидным артритом в плазме крови отмечается повышенное содержание свободных тиольных групп и образуется макроглобулин. Препараты золота увеличивают содержание свободных тиолов и уменьшают ревматоидный фактор, связанный с макроглобулином. Возможно, соединения золота взаимодействуют с тиольными группами, инициирующими денатурацию гамма-глобулина, и тем самым подавляют образование его агрегатов в синовиальной жидкости, что приводит к восстановлению концентрации свободных тиолов в крови.
Большинство биохимических реакций, протекающих при использовании препаратов золота, не подтверждено сведениями о химических свойствах этих соединений. Исследования реакций, моделирующих поведение соединений золота в биосистемах, крайне ограниченны. Конечно, химия золота in vivo и in vitro различна, так как дли неt крайне важны форма исходных реагентов и условия проведения реакции. В то же время эти различия касаются деталей, но не сущности химических свойств.
1.6.1Электростатическое связывание анионов золота с белками
Плоскоквадратные комплексы золота (III) имеют тенденции к ковалентному связыванию с мягкими белковыми лигандами путем замещения галогенид-ионов. Тем не менее электростатическое связывание анионов золота также наблюдается достаточно часто.
Электростатическое связывание комплексных ионов золота в отличие от ковалентного оказывается не селективным по отношению к металлу — аналогичные по заряду и стереохимии, ионы других металлов связываются в одних и тех же участках белка. Не селективным оказывается ван-дер-ваальсовое взаимодействие иодида золота АuI4 с миоглобином.
Известно, что комплексы золота (I) не связываются с L-метионином [Isab, 1988]. В литературе приводится до неточно данных об аминокислотных комплексах многих металле в, а сведения о золоте ограничиваются только данными об образовании комплекса золота (I) с цистеином.
В работе [Lewis, Shaw, 1986] методом рамановской и 13 С-ЯМР спектроскопии получены доказательства образования в растворе смешанно-лигандного комплекса RSAuCN- при замещении цистеином цианида из комплекса Au(CN)2 - . Это свидетельствует о том, что сродство цистеина к золоту (I) очень высоко.
Помимо белков, комплексные соединения золота способны взаимодействовать с другими биологическими макромолекулами. Оказалось, что ионы золота (III), подобно своим стереохимическим аналогам Рt (II) и Рd(П), могут образовывать тройные комплексы белок - металл — нуклеиновая кислота благодаря селективному взаимодействию между аминокислотными остатками, металлом и нуклеотидным основанием [Kasselouri et al., 1987]. Считается, что подобное химическое взаимодействие является основным механизмом возникновения антиракового эффекта при действии соединений этих металлов.
Золото, проникающее в клетку, также накапливается в металлотионеинах, и по-видимому, этот процесс накопления является важнейшим биохимическим механизмом трансформации золота в клетке. При введении в организм золота (I) или золота (III) в печени и почках обнаруживаются смешанно-металлические тионеины. Содержащие золото, медь, цинк или кадмий в различных соотношениях в зависимости от экспериментальных условий [Laib, Shaw, 1985]. Тио малат золота (I) взаимодействует с нативным Zn, Cd - тионеином, замещая в первую очередь цинк, а когда Аu добавлен в избытке, в равновесной реакции замещается и кадмий.
Возможны различные модели связывания золота:



Изоморфное замещение Cd 2+ и Zn 2+ приводит к координации Аu (I) S4 (модель I). Модель II описывает монодентатную координацию золота с одним цистеиновым остатком и удерживанием при этом тиомалатного лиганда. Модель III представляет собой бидентатное хелатирование двумя сульфгидрильными группами. Модель IV, основанная на данных Мёссбауэровской спектроскопии и методе анализа тонкой структуры рентгеновских спектров [Laib et al, 1985]. представляет собой кластер золота, содержащий цистеиновые лиганды и золото (I) в соотношении 1:1.
Вообще трех- и четырехкоординированное золото(1) обнаружено пока только в фосфиновых комплексах, тогда как золото(1)-тиольные комплексы всегда двухкоординированные. Как уже указывалось, замещение золотом металлов в Zn, Cd - тионеинах происходит селективно — сначала замещаются ионы цинка, а затем кадмия и при этом наблюдается минимальное изменение конформации белка (по оценке белкового радиуса Стокса). При избытке тиомалата золота обнаружена монодентатная координация (модель II), что аналогично описанному нами ранее связыванию Аu с единственной сульфгидрильной группой сывороточного альмубина Цис-34.
Таким образом, золототионеины — первый пример белка, в котором достоверно установлено, что один ион металла может находиться в металлотионеине в различном координационном окружении. Золото также является первым обнаруженным металлом, находящимся в кластере не в тетраэдрическом окружении, что отражает тенденцию золота(1) к двухкоординационной геометрии.
Другим белком, претендующим на роль переносчика и накопителя золота, является белок печени, связывающий жирные кислоты (БСЖК) с молекулярной массой равной примерно 14000 (сходной с металлотионеином). БСЖК принадлежит к новому суперсемейству некаталитических белков и имеет многочисленные физиологические функции [Spener еt а1, 1983]. Хотя БСЖК имеет только одну сульфгидрильную группу и поэтому связывает меньшее количество золота, концентрация его в печени почти в 30 раз больше, чем металлотионеина, что позволяет серьезно рассматривать возможность его участия в транспорте и накоплении золота [Shaw et al, 1988].
1.6.2Ковалентное связывание золота с белками
Стереохимия мягких ионов связана с числом d-электронов на внешней оболочке. Например, d8 ионы Рt(П) и Аu (III) обычно имеют плоскоквадратную конфигурацию (РtС14 2- , Рt(СN)4 2- , АuС14 - , АuI4 - и др.). Часто эти ионы акцептируют еще один или два лиганда, давая квадратно-пирамидальную или октаэдрическую координацию. Естественно, что образующиеся связи с пятым или шестым лигандом являются более слабыми. Такие взаимодействия играют главнейшую роль при первичном связывании комплексных ионов золота и других благородных металлов с белками.
Отрицательно заряженные комплексы (АuС14 - , АuВг4 - , АuI4 - ) не взаимодействуют с анионными группами белка, как например R – S- , но неплохо реагируют с нейтральными нуклеофилами, такими как S - Н-группами цистеина, имидазолом гистидина и концевыми лизиновыми аминогруппами.
Вероятно в связи с бурным развитием химии золота в ближайшем будущем следует ожидать появления новых интересных соединений золота, а создание новых фармакологических препаратов и успешное применение их в медицине будет стимулировать интенсификацию исследований биохимических механизмов действия золота.
ГЛАВА 2. КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ МЕДИ В ЛЕЧЕНИИ РЕВМАТОИДНОГО АРТРИТА
Издавна народная медицина рекомендовала для лечения разных болезней, главным образом воспалительного типа, богатые медью вещества — моллюски, орехи, винный уксус, медьсодержащие материалы. Медные браслеты и кольца на протяжении более 5000 лет используются не только как украшения, но и как средства, помогающие при артритах. В 40-х годах нашего столетия способность меди облегчать различные типы ревматоидных заболеваний отметил Хангартен после анализа степени поражения этими болезнями лиц, занятых в различных областях промышленности Финляндии. Оказалось, что работающие на медных рудниках подвержены им в значительно меньшей степени, чем работающие в других областях промышленности, причем гнойные инфекции, возникающие спонтанно или в результате повреждений, у первых встречаются реже, чем у вторых.
Терапевтические свойства соединений меди сопоставимы с таковыми соединении золота (хризотерапия) и отличаются меньшим числом побочных явлений. Поэтому в качестве эффективных лекарств были предложены следующие медьсодержащие соединения: купрален, дикупрен или купримил, морруат меди, пермалон. Они активны при лечении острых и хронических артритов, хронической полисуставной подагры, анкилозного и рассеянного спондилитов, ревматоидной лихорадки, эритемы. Однако в 50-х годах нашего столётия соединёния меди были вытеснены гормональными препаратами, несмотря на отсутствие желудочно-кишечных побочных явлении при нспользовании соединений меди.
2.1 Состояние меди в живом организме
Исключительная роль меди для жизнедеятельности человека установлена в 1928 г. Недостаток ее приводит к анемии, повышенное содержание — к болезни Вильсона (наследственной гепатолентикулярной дегенерации). Недостаточность меди в организме животных вызывает уменьшение всасывания и использования железа, что, в свою очередь, ведет к микроцитарной и гипохромной анемии; ослабление функции ферментов, в том числе цитохромоксидазы; нарушения биосинтеза фосфолипидов (демиелинизацию), остеогенеза (изменения скелета, аналогичные таковым при рахите); аномалии в образовании кератина и пигмента, сопровождающиеся возникновением дефектов шерстного покрова у животных. Повышенное содержание (отравление мелью) способствует появлению у экспериментальных животных сложного синдрома, включающего анемию, заболевание печени, болезнь Вильсона — Коновалова.
Содержание меди в тканях человека (0,2 г на 70 кг массы) колеблется от 5 мг на 100 г сухой массы печени до 0,7 мг на 100 г сухой массы кости, а в жидкостях — от 100 мкг на 100 мл крови до 10 мкг на 100 мл спинномозговой жидкости. Как правило, в женском организме меди больше, чем в мужском. В детском организме меди содержится в три раза больше, чем во взрослом, что определяется большей интенсивностью процессов метаболизма в детском организме. Оказалось, что медь необходима для нормального метаболизма всех, тканей и жидкостей организма, но для одних тканей требуется больше, чем для других.
Вследствие сродства меди к координирующим лигандам свободные ионы ее практически отсутствуют даже в наиболее богатых медью тканях и жидкостях (концентрация ионной меди в плазме крови, например, составляет 10-11 —10-18 моль/л). Поэтому преимущественной формой существования меди в организме являются ее комплексные соединения в основном с низкомолекулярными лигандами типа аминокислот, а также белками типа сывороточного альбумина (мол. масса ~ 67 000) и церулоплазмина. В первых медь связана не столь прочно, как во вторых. Металлопротеин — церулоплазмин — представляет собой макроглобулин и содержит более 90 % меди, находящейся в плазме крови.
Наиболее важные медьсодержащие ферменты и белки, выделенные в настоящее время, ответственны за многочисленные жизненно важные реакции организма: способствуют синтезу гемоглобина, росту, кератинизации, пигментации, скелетообразованию, развитию и функции центральной и периферической нервной системы, сердечной функции клеточному дыханию, разрушению супероксид-ионов, образованию сверхклеточной соединительной ткани, умственному и физическому развитию, васкуляризации, зрению, регулированию концентрации моноаминов. Кроме того медьсодержащие ферменты необходимы для модулирования синтеза простагландинов и гистаминной активности. Медь из них не удаляется в результате длительного диализа при нейтральном рН, остается связанной с белком в процессе его выделения и, вероятно, представляет собой простетический активный участок.
Распределение меди после приема ее с пищей показано на схеме:
![]() СuL2
СuL2
![]() СuL2
+ СuL2
a
+ СuL2
b
+ СuL2
c
+ …(I)
СuL2
+ СuL2
a
+ СuL2
b
+ СuL2
c
+ …(I)
СuL2 + СuL2 a + СuL2 b + СuL2 c + СuL2 d +…(II)
Она предусматривает превращение попадающих с пищей комплексов СuL2 (L — обобщенный однозарядный лиганд) на этапе пищеварения (I) и поглощения кишечника (II) в результате обмена лигандами в различные другие комплексы меди с лигандами La , Lb , Lc , Ld и т.д. При этом не обязательно расходование всего комплекса СuL2 . Образующиеся новые, скорее всего низкомолекулярные, комплексы СuL2 a ,СuL2 b , СuL2 c и т. д. вместе с неразложивщимся СuL2 попадают в кровь и циркулируют ко всем тканям и жидкостям организма, в результате чего частично утилизируются тканями и при последующем обмене лигандами с апоэнзимами и апопротеинами превращаются в металлоэнзимы и металлопротеины; частично захватываются печенью и запасаются ею при последующем"обмене с тиопротеином, в виде комплекса медь-тионеин; частично выводятся желчью или мочой. Медь из печени снова может быть перенесена в кровь для удовлетворения нормального физиологического метаболизма и поддержания необходимого уровня металла во всех тканях. При острых заболеваниях из печени в кровь поступает в два-три раза больше меди, чем при нормальном состоянии.
Из печени медь переносится в кровь, в форме энзима — церулоплазмина, содержащего шесть — восемь атомов прочносвязанной меди, а также в виде аминокислотных и альбуминных комплексов меди.
Медь в плазме существует преимущественно в виде следующих
комплексов: отрицательно заряженного медь(гистидинатцистината)-
и нейтральных медь(гистидинатцистината)водорода0
, медь(гистидината)2
0
, медь(гистидинаттреонината)0
. Именно в форме циркулирующей группы таких низкомолекулярных комплексов медь внедряется в ткани, причем клеточные мембраны проницаемы только для нейтральных комплексов, поскольку последние растворимы в липопротеновых матрицах.
Повышение концентрации церулоплазмина в_крови рассматривается как компенсаторная реакция больного организма, направленная на катализируемое церулоплазмином_разрушение субстратов — медиаторов заболевания.
Многие лекарственные вещества представляют собой потенциальные лиганды, способные конкурировать с цедулоплазмином, равно как и с другими медьсодержащими белками и ферментами, за медь и образовывать с ней низкомолекулярные координационные соединения. Лиганды, дающие с медью координационные соединения, подавляют или активируют функции практически всех медьсодержащих ферментов. Действие таких лигандов определяется числом и типом связей их с атомом меди, стерической доступностью участка локализации меди и степенью ее окисления. Наиболее сильно влияет на ферменты цианид-ион Дезактивирующее действие его обусловлено не только высокой координирующей способностью — образованием соединений высокой устойчивости, но и малым размером, разрешающим ему быстрее других лигандов подходить к атому меди фермента и прочно связывать его.
Низкомолекулярные координационные соединения меди, полученные из меди ферментов и лекарственных веществ-лигандов, могут обладать и самостоятельным терапевтическим действием.
Предпочтительнее своих высокомолекулярных аналогов соединения медь-лиганд способны проникать через биологические мембраны к пораженному участку и оказывать целебное действие.
2.2. Свойства церулоплазмина
Церулоплазмин (ЦПЛ) — медьсодержащий сывороточный α-2-гликопротеин — синтезируется в печени и затем поступает в сыворотку и плазму крови. Медь, попадающая с пищей, всасывается в кишечнике, образуя соединения с альбумином и аминокислотами. Через систему воротной вены медь направляется в печень и встраивается в синтезируемый в печени апо-ЦПЛ. Она выделяется через желчевыводящие пути и кишечник.
Исходным материалом для получения ЦПЛ служат сыворотка или
плазма крови, а также отдельные фракции последней.
Число атомов меди в молекуле ЦПЛ окончательно не выяснено. Их может быть шесть, семь или восемь. Эти атомы относятся к трем типам:
Тип I — «голубая медь», интенсивное поглощение на 610 нм объясняется изменением симметрии ионов меди (II) от обычной квадратно-планарной до искаженной тетраэдрической;
тип II — обычная медь (два парамагнитных атома), слабое поглощение на 650 нм обусловлено d-переходами в кристаллическом поле. Параметры спектров ЭПР аналогичны параметрам обычных комплексов меди (II). Ионы меди типа II прочно связаны с белком и более других ответственны за энзиматические свойства ЦПЛ;
тнп III — непарамагнитная, ЭПР-недетектируемая медь (2—4 атома меди). Отсутствие парамагнетизма вызвано обменным взаимодействием в димерах с металл-металлической связью Си (II) —Си (II).
Ион меди связан, по крайней мере, с четырьмя группами отдельных или смежных пептидных цепей. Два координационных места из возможных шести доступны для выполнения каталитической функции. Не исключено также, что ионы меди связаны с глюкозой, маннозой или ксилозой, обнаруженными в ЦПЛ, хотя известно, что Си (II) легче образует комплексы с большинством аминокислот, чем с указанными моносахаридами. Удаление и последующее встраивание меди в ходе реакции
![]()
![]() ЦПЛ апо-ЦПЛ + nСи2+
ЦПЛ апо-ЦПЛ + nСи2+
сопровождаются обратимым исчезновением и появлением ферментативной активности ЦПЛ/
ЦПЛ проявляет эизиматическую оксидазную активность по отношению к различным субстратам типа ароматических диаминов и дифенолов и лекарствам фенотиазинового класса: адреналину, катехолу, n-фенилендиамину, норадреналину, серотонину, пирогаллолу, аскорбиновой кислоте, цитохрому-с, железу (II) и др.
Функция ЦПЛ состоит в поддержании баланса меди в организме и специфическом переносе ее к конечному ферменту дыхательной цепи — цитохром-с-оксидазе. ЦПЛ — молекулярное звено между метаболизмом меди и железа, повышающее подвижность железа. Перенос осуществляется путем образования фермент-субстратного комплекса, в котором медь белка способна давать активный комплекс с π-электронами ароматического кольца, а также неактивный комплекс с NН2 -группами субстрата. Эти группы могут взаимодействовать и с железом, предотвращая появление неактивного комплекса медь(ЦПЛ) — NН2 -субстрат.
Таким образом, ЦПЛ служит регулирующим фактором в кроветворной системе, ускоряющим потребление и накопление железа, т. е. участвует в биосинтезе гемоглобина.
ЦПЛ ингибирует индуцированную аскорбиновой кислотой деполимеризацию гиалуроновой кислоты - активного агента синовиальной жидкости — в норме находящейся в ней в полимеризованной форме, а в патологических случаях (например, при ревматоидных артритах) — в деполимеризованной. В проявлении оксидазной активности ЦПЛ важную роль играет сохранение его вторичной и третичной структур.
Следовательно, физиологические функции ЦПЛ состоят в его ферментативной оксидазной и феррооксидазной активности, участии в обмене железа и меди в организме, включающем транспорт меди в жидкости и ткани.
Большинство лекарств представляет собой органические кислоты или основания, способные образовывать координационные соединения с медью.
2.3. Комплексы меди с противовоспалительными соединениями
Индометацин относится к группе НПВС и является мощным противовоспалительным препаратом, который используется при тяжелых воспалительных заболеваниях, однако очень токсичен в отношении желучно-кишечного тракта. Токсичность связана с ингибированием простагландинов Комплексы индометацина с медью усилили фармакологический эффект и снизили токсичность. Чаще всего препарат используется в ветеренарии. [NMR Spectroscopic Characterization of Copper(II) and Zinc(II) Complexes of Indomethacin, Determination of the Structures of Antiinflammatory Copper(II) Dimers of Indomethacin by Multiple-Scattering Analyses of X-ray Absorption Fine Structure Data]
Для восстановления пораженных воспалением тканей требуется большое число—медьзамещенных энзимов — цитохром-с-оксидазы, ЦПЛ, лизилосидазы, суперокзиддисмутазы, тирозиназы и допамин-β-гидроксилазы. При воспалительных процессах содержание меди в сыворотке и плазме крови и в синовиальной жидкости больных выше, чем у здоровых людей (главным образом за счет ЦПЛ — своеобразный «сигнал» о воспалении), и возвращается к норме при ремиссии, наступающей в частности, при использовании НПВС в результате их взаимодействия с энзимами и белками.
Эффективность комплекса зависит от природы лиганда. Комплекты меди, синтезированные вне организма, фармакологически менее активны, чем составляющие их противовоспалительные лекарства.
2.4. Комплексы меди (II) с салициловой кислотой и ее производными
Лечение комплексами меди с производными салициловой кислоты более эффективно, чем кислотами.
Пермалонотерапия (внутривенное введение небольших доз пермалона) чрезвычайно эффективна. По действию ее можно сравнить с лечением массивными оральными дозами салициловой кислоты, но она не вызывает токсических побочных явлений (функциональных желудочно-кишечных повреждений, наблюдаемых даже при использовании относительно малых доз салициловой кислоты; патологических изменений в крови, печени и других органах) и оказывает более быстрое действие. Пермалон оказался эффективным лекарством против острых воспалений брюшной мышцы и при мышечных болях. Результаты лечения пермалоном, салициловой кислотой и ее производными, другими нестероидными противовоспалительными соединениями кислой природы, солями золота и антималярийными препаратами свидетельствуют о великолепных лечебных свойствах пермалона. Лечение пермалоном на протяжении 20 лет привело к выздоровлению 89 % пациентов (из 1140 подвергавшихся лечению), причем средняя продолжительность ремиссии после лечения превышала 3 года.
Рассмотрение механизма действия противовоспалительных комплексов меди основывается на ингибирования ими синтеза способствующих воспалению простагландинов и инициировании супероксиддисмутазной активности. Супероксиддисмутаза (СОД) обладает противовоспалительной и противоартритной активностью. Аналогичная активность характерна и для низкомолекулярных комплексов меди. СОД и каталаза предохраняют ткани от деградации, вызванной токсическими пероксидными, гидроксидными или другими кислородсодержащими радикалами, которые ответственны за развитие воспалительных процессов.
2.5. Комплексы меди с антраниловой кислотой и ее производными
Противовоспалительными свойствами обладают не антраниловая кислота, а ее производные — N-фенилантраниловая кислота с различными заместителями в N-фенильном кольце. На комплексах меди (II) с этой группой НПВС полнее, чем на комплексах с другими лекарственными веществами, прослежена зависимость между физико-химическими параметрами комплексообразования, реакционной способностью и физиологической активностью.
Терапевтическая активность экзогенных комплексов меди с производными фенилантраниловой кислоты зависит не только от их способности действовать как низкомолекулярные метаболиты — активные лекарственные формы, но и от степени их диссоциации до ионных форм, ответственных за регулирование некоторых окислительно-восстановительных реакций.
2.6. Комплексы меди с белками
В последнее десятилетие увеличился интерес к комплексам меди, связывающихся с белками и пептидами в естественных условиях. В следствие чего наблюдалось хелатообразование, которое приводило к снижению воспаления при приеме препаратов меди при лечении ревматоидного артрита. Для перорального и парентерального введения, однако, нужно увеличить биодоступность комплексов в естественных условиях (скоординированному комплексу с хвостом из белка трудно проникать через мембраны клеток). Главное требование для таких комплексов: они должны образовывать электрически нейтральные комплексы при физиологическом pH, для того чтобы не задерживаться в печени [Copper chelating anti-inflammatory agents; N1 -(2-aminoethyl)-N2 -(pyridin-2-ylmethyl)-ethane-1,2-diamine and N-(2-(2-aminoethylamino)ethyl)picolinamide: An in vitro and in vivo study].