| Похожие рефераты | Скачать .docx |
Реферат: Понятие химических реакций и их классификация
Содержание
Введение
1. Понятие о химических реакциях
2. Классификация химических реакций по различным признакам
Заключение
Список используемой литературы
Введение
Вещества, взаимодействуя друг с другом, подвергаются различным изменениям и превращениям. Например, бериллий взаимодействуя с кислородом воздуха при температуре свыше 500о С, превращается в оксид бериллия; уголь, сгорая, образует углекислый газ, и т.п.
Явления, при которых одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами, и при этом не происходит изменения состава ядер атомов, называются химическими.
Окисление на воздухе, горение, получение металлов из руд, ржавление железа – все это химические явления. Иначе их называют химическими превращениями, химическими реакциями или химическими взаимодействиями.
Целью данной работы является изучение особенностей химических реакций и их классификацию.
Работа состоит из введения, двух глав, заключения и списка литературы. Общий объем работы 17 страниц.
1. Понятие о химических реакциях
Химические свойства веществ выявляются в разнообразных химических реакциях. Превращения веществ, сопровождающиеся изменением их состава и (или) строения и называются химическими реакциями .
Часто встречается и такое определение: химической реакцией называется процесс превращения исходных веществ (реагентов) в конечные вещества (продукты).
Реагенты - вещества, вступающие в химическую реакцию.
Продукты - вещества, образующиеся в результате химической реакции.
Реагенты → Продукты
В переводе с латыни «реакция» означает «противодействие, отпор, ответное действие». Следовательно термин химическая реакция можно понимать как ответное действие вещества на воздействие извне других веществ и физических факторов – тепла, давления, излучения. Но под такое определение подпадают и физические процессы: плавление, кипение, замерзание и другие. Поэтому следует уточнить, что химическая реакция — это такое изменение веществ, при котором разрываются старые и образуются новые химические связи между частицами (атомами, ионами), из которых построены вещества.
«Движущая сила» реакции зависит не только от природы реагентов и образующихся веществ (их состава, строения), но и от концентрации веществ, температуры, давления, влияния растворителей, соединений, способных образовывать комплексы с реагентами и продуктами.
Химические реакции всегда сопровождаются физическими эффектами - поглощением или выделением теплоты, изменениями агрегатного состояния и окраски веществ; по наличию этих эффектов часто судят о протекании реакций (рис.1).
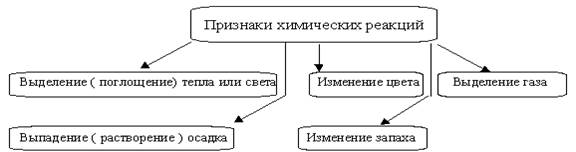
Рисунок 1 – Признаки химических реакций
Химические реакции следует отличать от физических процессов , изменяющих только внешнюю форму или агрегатное состояние вещества (но не его состав). Условия, которые должны выполняться, чтобы произошла химическая реакция:
1. Необходимо, чтобы реагирующие вещества соприкоснулись и чем больше площадь их соприкосновения, тем быстрее произойдет химическая реакция.
2. Некоторые реакции идут без нагревания, для некоторых реакций оно необходимо.
3. Некоторые реакции протекают под действием электрического тока и света
Химические реакции записываются посредством химических уравнений , содержащих формулы исходных веществ и продуктов реакции, например:
| H2 + Cl2 | = | 2HCl |
| исходные вещества | продукт реакции |
Химические уравнения могут содержать дополнительные сведения об особенностях протекания реакции. Если химическая реакция протекает под влиянием внешних воздействий (температура, давление, излучение и т.д.), это указывается соответствующим символом, как правило, над (или «под») знаком равенства. В уравнениях реакций с участием органических соединений (органических реакциях) знак равенства заменяется стрелкой (т.к. символ равенства "=" совпадает с символом двойной связи):
CH4 + Cl2 CH3 Cl + HCl
CH2 =CH2 + Br2 CH2 Br-CH2 Br
В левой части уравнения пишутся формулы исходных веществ (реагентов), в правой части - веществ, получаемых в результате протекания химической реакции (продуктов реакции, конечных веществ). Знак равенства, связывающий левую и правую часть, указывает, что общее количество атомов веществ, участвующих в реакции, остается постоянным. Это достигается расстановкой перед формулами целочисленных стехиометрических коэффициентов, показывающих количественные соотношения между реагентами и продуктами реакции.
Химические реакции весьма разнообразны, вследствие этого возникает необходимость в их классификации, что мы и рассмотрим в следующей главе.
2. Классификация химических реакций по различным признакам
Разнообразие химических реакций, количество которых не поддается подсчетам, невозможно охватить единой универсальной классификацией, поэтому их разделяют по определенным общим признакам. Под любой из таких признаков могут быть отнесены реакции, как между неорганическими, так и между органическими веществами.
Во-первых, это реакции без изменения состава вещества и реакции с изменением состава.
Реакции, идущие без изменения состава веществ:
3 О2 = 2 О3
AlCl3,t
СН3-СН2-СН2-СН3 → СН3-СН-СН3
|
C Н3
Реакции, идущие с изменением состава веществ:
6 СО2 + 6 Н2О = С6Н12О6 + 6 О2
В органической химии к этому типу реакций относятся реакции изомеризации. Так, изомеризацию алканов проводят для получения бензина с большим октановым числом.
Для химических процессов, происходящих между неорганическими реагентами, наиболее часто используются такие классификации:
1. Число и состав исходных веществ и продуктов реакции.
2. Агрегатное состояние реагентов и продуктов реакции.
3. Число фаз, в которых находятся участники реакции.
4. Природа переносимых частиц.
5. Возможность протекания реакции в прямом и обратном направлении.
6. Знак теплового эффекта
Различные способы классификации часто сочетаются друг с другом (рис.1).
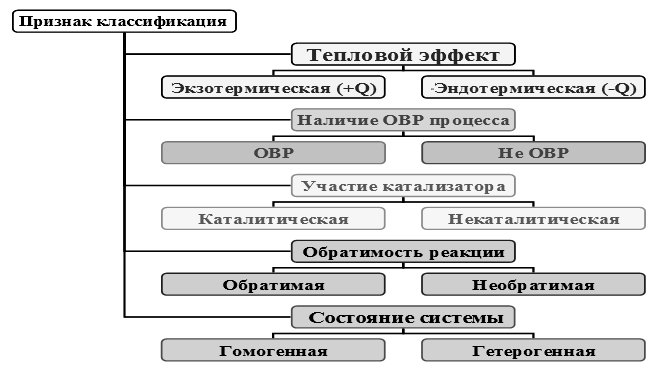
Рисунок 1 – Признак классификации химических реакций
Рассмотрим более подробно каждый из типов химических реакций.
1. Классификация по числу и составу реагентов и конечных веществ (табл.1).
Таблица 1 - Типы химических реакций и их механизмы
| Химические реакции соединения | Химические реакции разложения | Химические реакции замещения | Химические реакции ионного обмена |
| A + B = AB Из нескольких простых или сложных веществ образуется одно сложное | AB = A + B Из сложного вещества образуется несколько простых или сложных веществ | A + BC =AC + B Атом простого вещества замещает один из атомов сложного | AB+CD = AD+CB Сложные вещества обмениваются своими составными частями |
1. Реакции соединения. Д.И.Менделеев определял соединение как реакцию, «при которой из двух веществ происходит одно. Итак, при реакциях соединения из нескольких реагирующих веществ относительно простого состава получается одно вещество более сложного состава
A + B + C = D
К реакциям соединения относят процессы горения простых веществ (серы, фосфора, углерода) на воздухе. Например, углерод горит на воздухе С+О2 =СО2 (конечно эта реакция протекает постепенно, сначала образуется угарный газ СО). Как правило, эти реакции сопровождаются выделением тепла, т.е. приводят к образованию более устойчивых и менее богатых энергией соединений - являются экзотермическими.
Реакции соединения простых веществ всегда носят окислительно-восстановительный характер. Реакции соединения, протекающие между сложными веществами, могут происходить как без изменения валентности
СаСО3 + СО2 + Н2О = Са (НСО3)2
так и относиться к числу окислительно-восстановительных
2FеСl2 + Сl2 = 2FеСl3.
2. Реакции разложения. Химические реакции разложения, по Менделееву, «составляют случаи, обратные соединению, то есть такие, при которых одно вещество даёт два, или, вообще, данное число веществ — большее их число.
Реакции разложения приводят к образованию нескольких соединений из одного сложного вещества
А = В + С + D
Продуктами разложения сложного вещества могут быть как простые, так и сложные вещества. Примером реакции разложение может служить химическая реакция разложения мела (или известняка под воздействием температуры): СаСО3 =СаО+СО2 . Для проведения реакции разложения, как правило, требуется нагревание. Такие процессы — эндотермические, т.е. протекают с поглощением теплоты. Из реакций разложения, протекающих без изменения валентных состояний, следует отметить разложение кристаллогидратов, оснований, кислот и солей кислородсодержащих кислот
to
CuSO4 5H2O = CuSO4 + 5H2O,
to
Cu(OH)2 = CuO + H2O,
to
H2SiO3 = SiO2 + H2O.
К реакциям разложения окислительно-восстановительного характера относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления
to
2SO3 = 2SO2 + O2,
to
4HNO3 = 2H2O + 4NO2O + O2O,
2AgNO3 = 2Ag + 2NO2 + O2,
(NH4) 2Cr2O7 = Cr2O3 + N2 + 4H2O.
Особенно характерны окислительно-восстановительные реакции разложения для солей азотной кислоты.
Реакции разложения в органической химии, в отличие от реакций разложения в неорганической химии, имеют свою специфику. Их можно рассматривать как процессы, обратные присоединению, поскольку в результате чаще всего образуются кратные связи или циклы.
Реакции разложения в органической химии носят название крекинга
С18H38 = С9H18 + С9H20
или дегидрирования C4H10 = C4H6 + 2H2.
В реакциях двух других типов число реагентов равно числу продуктов.
3. Реакции замещения. Их отличительный признак — взаимодействие простого вещества со сложным. Такие реакции есть и в органической химии. Однако понятие «замещение» в органике шире, чем в неорганической химии. Если в молекуле исходного вещества какой-либо атом или функциональная группа заменяются на другой атом или группу, это тоже реакции замещения, хотя с точки зрения неорганической химии процесс выглядит как реакция обмена.
При реакциях замещения обычно простое вещество взаимодействует со сложным, образуя другое простое вещество и другое сложное А + ВС = АВ + С
Например, опустив стальной гвоздь в раствор медного купороса получаем железный купорос (железо вытеснило медь из её соли) Fe+CuSO4 = FeSO4 +Cu.
Эти реакции в подавляющем большинстве принадлежат к окислительно-восстановительным
2Аl + Fe2O3 = 2Fе + Аl2О3,
Zn + 2НСl = ZnСl2 + Н2,
2КВr + Сl2 = 2КСl + Вr2,
2КСlO3 + l2 = 2KlO3 + Сl2.
Примеры реакций замещения, не сопровождающихся изменением валентных состояний атомов, крайне немногочисленны.
Следует отметить реакцию двуокиси кремния с солями кислородсодержащих кислот, которым отвечают газообразные или летучие ангидриды
СаСО3+ SiO2 = СаSiO3 + СО2,
Са3(РО4)2 + ЗSiO2 = ЗСаSiO3 + Р2О5.
Иногда эти реакции рассматривают как реакции обмена
СН4 + Сl2 = СН3Сl + НСl.
4. Реакции обмена (в том числе и нейтрализации). Реакциями обмена называют реакции между двумя соединениями, которые обмениваются между собой своими составными частями
АВ + СD = АD + СВ
Большое их число протекает в водных растворах. Примером химической реакции обмена может служить нейтрализация кислоты щёлочью
NaOH+HCl=NaCl+Н2 О.
Здесь в реагентах (веществах, стоящих слева) ион водорода из соединения HCl обменивается с ионом натрия из соединения NaOH, в результате чего образуется раствор поваренной соли в воде.
Если при реакциях замещения протекают окислительно-восстановительные процессы, то реакции обмена всегда происходят без изменения валентного состояния атомов. Это наиболее распространенная группа реакций между сложными веществами - оксидами, основаниями, кислотами и солями
ZnO + Н2SО4 = ZnSО4 + Н2О,
AgNО3 + КВr = АgВr + КNО3,
СrСl3 + ЗNаОН = Сr(ОН)3 + ЗNаСl.
Частный случай этих реакций обмена - реакции нейтрализации
НСl + КОН = КСl + Н2О.
Обычно эти реакции подчиняются законам химического равновесия и протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного, летучего вещества, осадка или малодиссоциирующего (для растворов) соединения
NаНСО3 + НСl = NаСl + Н2О + СО2↑,
Са(НСО3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О,
СН3СООNа + Н3РО4 = СН3СООН + NаН2РО4.
Однако очень многие реакции не укладываются в приведённую простую схему. Например, химическая реакция между перманганатом калия (марганцовкой) и иодидом натрия не может быть отнесена ни к одному из указанных типов. Такие реакции, обычно, называют окислительно- восстановительные, например
2KMnO4 +10NaI+8H2 SO4 =2MnSO4 +K2 SO4 +5Na2 SO4 +5I2 +8H2 O.
К окислительно-восстановительным в неорганической химии относятся все реакции замещения и те реакции разложения и соединения, в которых участвует хотя бы одно простое вещество. В более обобщенном варианте (уже с учетом и органической химии), все реакции с участием простых веществ. И, наоборот, к реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.
2. Классификация реакций по фазовым признакам
В зависимости от агрегатного состояния реагирующих веществ различают следующие реакции:
1. Газовые реакции:
to
H2 + Cl2= 2HCl.
2. Реакции в растворах:
NaОН(р-р) + НСl(p-p) = NaСl(p-p) + Н2О(ж).
3. Реакции между твердыми веществами:
to
СаО(тв) +SiO2(тв) = СаSiO3(тв).
3. Классификация реакций по числу фаз
Под фазой понимают совокупность однородных частей системы с одинаковыми физическими и химическими свойствами и отделенных друг от друга поверхностью раздела.
Все многообразие реакций с этой точки зрения можно разделить на два класса.
1. Гомогенные (однофазные) реакции . К ним относят реакции, протекающие в газовой фазе, и целый ряд реакций, протекающих в растворах.
2. Гетерогенные (многофазные) реакции . К ним относят реакции, в которых реагенты и продукты реакции находятся в разных фазах. Например:
газожидкофазные реакции
CO2(г) + NaOH(p-p) = NaHCO3(p-p),
газотвердофазные реакции
СO2(г) + СаО (тв) = СаСO3(тв),
жидкотвердофазные реакции
Na2SO4(р-р) + ВаСl3(р-р) = ВаSО4(тв)↓ + 2NaСl(p-p),
жидкогазотвердофазные реакции
Са(НСО3)2(р-р) + Н2SО4(р-р) = СО2(г)↑ +Н2О(ж) + СаSО4(тв)↓.
4. Классификация реакций по типу переносимых частиц
1. Протолитические реакц ии
К протолитическим реакциям относят химические процессы, суть которых заключается в переносе протона от одних реагирующих веществ к другим.
В основе этой классификации лежит протолитическая теория кислот и оснований, в соответствии с которой кислотой считают любое вещество, отдающее протон, а основанием - вещество, способное присоединять протон, например
CH3COOH+ H2O = CH3COO- + H3O+
кислотаI основаниеI основаниеII кислотаII,
NH3 + H2O = NH4+ + OH-
основаниеI кислотаII кислотаII основаниеII.
К протолитическим реакциям относят реакции нейтрализации и гидролиза.
2. Окислительно-восстановительные реакции.
К таковым относят реакции, в которых реагирующие вещества обмениваются электронами, изменяя при этом степени окисления атомов элементов, входящих в состав реагирующих веществ. Например:
Zn + 2H+ → Zn2+ + H2↑,
FeS2 + 8HNO3(конц) = Fe(NO3)3 + 5NO↑ + 2H2SO4 + 2H2O.
3. Лиганднообменные реакции
К таковым относят реакции, в ходе которых происходит перенос электронной пары с образованием ковалентной связи по донорно-акцепторному механизму. Например:
Cu(NO3)2 + 4NH3 = [Cu(NH3)4](NO3)2,
Fe + 5CO = [Fe(CO)5],
Al(OH)3 + NaOH = [NaAl(OH)4].
Характерной особенностью лиганднообменных реакций является то, что образование новых соединений, называемых комплексными, происходит без изменения степени окисления.
4. Реакции атомно-молекулярного обмена.
К данному типу реакций относятся многие из изучаемых в органической химии реакций замещения, протекающие по радикальному, электрофильному или нуклеофильному механизму.
5. Обратимые и необратимые химические реакции
Обратимыми называют такие химические процессы, продукты которых способны реагировать друг с другом в тех же условиях, в которых они получены, с образованием исходных веществ.
Для обратимых реакций уравнение принято записывать следующим образом А + В АВ.
Две противоположно направленные стрелки указывают на то, что при одних и тех же условиях одновременно протекает как прямая, так и обратная реакция, например
СН3СООН + С2Н5ОН СН3СООС2Н5 + Н2О.
Необратимыми называют такие химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ. Примерами необратимых реакций может служить разложение бертолетовой соли при нагревании
2КСlО3 → 2КСl + ЗО2↑,
или окисление глюкозы кислородом воздуха
С6Н12О6 + 6О2 → 6СО2 + 6Н2О.
6. Знак теплового эффекта
Знак теплового эффекта разделяет все реакции на: экзотермические реакции, протекающие с экзо-эффектом - выделение энергии в форме теплоты (Q>0, ∆H <0):
С +О2 = СО2 + Q
и эндотермические реакции, протекающие с эндо-эффектом - поглощением энергии в форме теплоты (Q<0, ∆H>0):
N2 +О2 = 2NО - Q.
Такие реакции относят к термохимическим.
Заключение
Химическая реакция - это процесс превращения одних веществ в другие, отличающиеся от них по составу и (или) строению. При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Признаки химических реакций: выделяется газ, выпадет осадок, происходит изменение окраски веществ, выделяется или поглощается тепло, свет и др.
Химические реакции записываются посредством химических уравнений, содержащих формулы исходных веществ и продуктов реакции. Уравнение химической реакции - это представление химического процесса с помощью знаков, химических формул и коэффициентов перед ними.
Огромное число химических реакций может быть сгруппировано в несколько типов реакций, которым присущи вполне определенные признаки. В работе рассмотрена следующая классификация химических реакций.
I. По числу и составу исходных веществ и продуктов реакции:
1) Реакции соединения - это реакции, в ходе которых из двух или нескольких веществ образуется одно вещество более сложного состава. Реакции соединения простых веществ всегда являются окислительно-восстановительными реакциями. В реакциях соединения могут участвовать и сложные вещества.
2) Реакции разложения - реакции, при протекании которых из одного сложного вещества образуются два или несколько более простых веществ. Продуктами разложения исходного вещества могут быть как простые, так и сложные вещества. Реакции разложения обычно протекают при нагревании веществ и являются эндотермическими реакциями. Как и реакции соединения, реакции разложения могут протекать с изменением или без изменения степеней окисления элементов;
3) Реакции замещения - это реакции между простыми и сложными веществами, при протекании которых атомы простого вещества замещают атомы одного из элементов в молекуле сложного вещества. В результате реакции замещения образуются новое простое и новое сложное вещество. Эти реакции почти всегда являются окислительно-восстановительными реакциями.
4) Реакции обмена - это реакции между двумя сложными веществами, молекулы которых обмениваются своими составными частями. Реакции обмена всегда протекают без переноса электронов, т. е. не являются окислительно-восстановительными реакциями. В результате реакций обмена обычно образуются: осадок, газ, слабый, электролит (вода).
II. По признаку изменения степени окисления
1) Реакции, которые идут без изменения степени окисления - реакции нейтрализации.
III. В зависимости от присутствия катализатора
1) Некаталитические (идут без присутствия катализатора)
2) Каталитические (идут с присутствием катализатора)
IV. По признаку теплового эффекта
1) Экзотермические (с выделением теплоты)
2) Эндотермические (с поглощением теплоты)
V. По признаку обратимости
1) Необратимые (протекают только в одном направлении)
2) Обратимые (протекающие одновременно в прямом и обратном направлении)
VI. По признаку однородности
1) Гомогенные (протекающие в однородной системе)
2) Гетерогенные (протекающие в неоднородной системе)
Список используемой литературы
1. Габриелян О.С. Химия. 11 класс: Учебник для общеобразовательных учреждений / О.С.Габриелян. - М.: Дрофа.- 304 с.
2. Иванова Р.Г. Химия. Учебник для 10 кл. общеобразовательных учреждений / Р.Г.Иванова, А.А.Каверина. – М.: Просвещение, 2001. – 287 с.
3. Кузнецова Н.Е. Химия. Учебник. 8 класс / Н.Е.Кузнецова, И.М.Титова, Н.Н.Гара, А.Ю.Жегин М.: Вентана-Граф, 2005. – 224 с.
4. Мануйлов А.В. Основы химии. Электронный учебник / А.В.Мануйлов, В.И.Родионов. [Электронный ресурс]. Режим доступа: http://www.hemi.nsu.ru/
5. Химия. 8-9 класс: Поурочные планы / Авт. сост. С.Ю.Дибленко, Е.А.Смирнова, С.М.Колмыкова. – Волгоград: Учитель, 2005. – 169 с.
Похожие рефераты:
Развитие, становление и основные аспекты фармации
Программа для поступающих в вузы (ответы)
Методы анализа лекарственных препаратов
Химический эксперимент по неорганической химии в системе проблемного обучения
Основные теоретические положения органической химии. Насыщенные (предельные) углеводороды
Классификация химических реакций
Сравнительный анализ: методы получения синтез-газа