| Похожие рефераты | Скачать .docx |
Дипломная работа: Получение диметилового эфира дегидратацией метанола на АlPO4 +SiO2 катализаторах
Министерство образования Российской Федерации
Московская государственная академия тонкой химической
технологии им. М.В. Ломоносова
Кафедра Технологии нефтехимического синтеза и искусственного жидкого топлива
АТТЕСТАЦИОННАЯ РАБОТА
на соискание степени бакалавра по направлению
550800 «Химическая технология и биотехнология»
Тема: Получение диметилового эфира дегидратацией метанола на А lPO 4 + SiO 2 катализаторах.
Заведующий кафедрой, д.х.н., проф. Третьяков В.Ф.
Руководитель, ст. преп., к.т.н. Антонюк С.Н.
Дипломант, студент группы ХТ-406 Овчинников М.А.
Москва 2003 г
Оглавление
ВВЕДЕНИЕ
1. Сырье для топлива
2. Получение метанола
3. Использование метанола
4. Получение диметилового эфира дегидратацией метанола
5. Направления использования продуктов разложения метанола
5.1. Направления использования водорода
5.2. Направления использования оксидов углерода
5.3. Направления использования диметилового эфира
6. Использование диметилового эфира в качестве моторного топлива дизельных двигателей
7. Физико-химические показатели и свойства ДМЭ
8. Транспортировка ДМЭ, разгрузка, хранение
9. Производство ДМЭ из метанола
10. Производство ДМЭ из природного газа
10.1. Рентабельность производства
10.2. Перспектива ДМЭ
10.3. Выбор технологии переработки
11. Производство ДМЭ из угля
12. Каталитические системы на основе алюмофосфатов цеолитного типа
13. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
13.1. Методика проведения эксперимента
13.2. Методика анализа жидких продуктов
13.3. Методика анализа газообразных продуктов
13.4. Методика определения удельной поверхности
13.5. Методика приготовления катализаторов
14. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
СПИСОК ЛИТЕРАТУРЫ
Введение
Автомобильный парк города насчитывает более 2,3 млн. автомобилей, потребляющих в год 4 млн.тонн бензина и дизельного топлива.
Стремительный рост автомобильного транспорта в Москве привел к значительному увеличению объемов выбросов загрязняющих веществ в воздушную среду города. В виде отработавших газов, продуктов испарения бензина и других вредных примесей в атмосферу ежегодно выбрасывается более 1 млн. тонн загрязняющих веществ.
Наряду с Программой оснащения муниципального автотранспорта каталитическими нейтрализаторами, в ходе выполнения которой на автобусы и грузовые автомобили установлено более 23 тысяч нейтрализаторов, использование альтернативных экологически более чистых видов моторного топлива является одним из основных путей снижения негативного влияния автомобиля на экологию города.
Интенсивные работы в этом направлении ведутся во всех развитых странах мира. Ведущие мировые автомобильные концерны инвестируют миллиарды долларов в развитие транспорта и технологий альтернативных видов моторного топлива и источников энергии.
В России наиболее предпочтительным представляется частичное замещение традиционных видов моторного топлива на синтетические жидкие углеводороды, получаемые из природного газа, в силу низкой себестоимости и практической неограниченности этого ресурса в стране.
Использование в качестве моторного топлива диметилового эфира, пропан-бутана, метана позволяет уменьшить выбросы в атмосферу окиси углерода, углеводородов и окиси азота на 30-70% по сравнению с обычными жидкими моторными топливами.
Достижения Московских нефтехимических научно-исследовательских институтов и предприятий позволяют впервые в стране приступить к целенаправленным работам по практическому внедрению диметилового эфира в качестве альтернативы дизельному топливу и начиная с 2005 года начать эксплуатацию дизельного автотранспорта на этом экологически чистом виде моторного топлива с использованием для их заправки пропан-бутановых заправочных комплексов.
В перспективе ставится задача создания экологически безопасного для окружающей среды транспортного средства, автомобиля с "нулевым выбросом", энергетической установкой которого является топливный элемент на водородном топливе.
Общегородские экологические программы, выполненные в Москве в 1994-2000 гг., в том числе и по экологии транспорта, позволили решить ряд научно-технических проблем, осуществить практические меры по использованию природного газа метана и сжиженного газа пропан-бутана в качестве моторного топлива, создать условия для привлечения внебюджетных инвестиций. В ближайшие три года перевод автотранспорта города на эти виды газового топлива будет основным фактором, способствующим сокращению выбросов вредных веществ в атмосферу города.
В марте 2002 г. Правительство Москвы приняло Постановление «О Городской целевой программе использования альтернативных видов моторного топлива на автомобильном транспорте города на 2002-2004 годы» и утвердило эту Программу.
Целью Программы является разработка и введение в действие правовых, административных и экономических мер, обеспечивающих снижение уровня вредного воздействия автотранспорта на окружающую среду и здоровье населения, устойчивый рост объемов замещения традиционных моторных топлив альтернативными, создание условий для привлечения внебюджетных инвесторов.
К основным задачам, предусмотренным Программой, относятся:
проведение государственной политики, направленной на повышение экологической безопасности автомобильного транспорта;
осуществление первоочередных мер, гарантирующих экологическую безопасность транспорта;
научно-техническое обеспечение решения проблем в этой области;
расширение масштабов внедрения в городской транспорт альтернативных источников энергии и моторных топлив;
сокращение объемов потребления традиционных жидких топлив.
Система программных мероприятий предусматривает:
Применение эфира в качестве моторного топлива дизельных двигателей.
Расширение использования сжиженного углеводородного газа (пропан-бутана) как альтернативы бензиновому топливу.
Создание транспортных средств с энергоустановками на основе электрохимических генераторов с водородно-воздушными топливными элементами.
Применение природного газа (метана) вместо бензина и дизельного топлива.
Разработку транспортных средств с комбинированными энергоустановками.
Программа реализуется в один этап (2002-2004 гг.), объем финансирования намеченных мероприятий составляет около 1750 млн. руб. Основным источником финансирования являются средства инвесторов (примерно 1650 млн. руб.) и средства Минатома РФ (30 млн. руб.); кроме того, из бюджета города выделяются средства на НИОКР — свыше 60 млн. руб.
Ожидаемые результаты
В результате выполнения мероприятий Программы к концу 2004 г. в столице будут созданы основы для проведения экологически ориентированной транспортной политики и административные механизмы стимулирования производства и эксплуатации усовершенствованных автотранспортных средств и альтернативных видов топлива с более высокими экологическими характеристиками.
В техническом отношении реализация Программы должна привести к:
улучшению экологических характеристик автотранспортных средств, переводимых на альтернативные топлива и источники энергии;
увеличению парка автотранспортных средств, работающих на сжиженном нефтяном газе (до 300 тыс. единиц) и на природном газе (до 3 тыс. единиц);
созданию образцов автотранспортных средств:
использующих диметиловый эфир (вместо дизельного топлива);
с высокоэкономичными гибридными силовыми установками;
с энергетическими установками на основе электрохимических генераторов с «нулевым» выбросом (на водородном топливе).
Главным итогом реализации Программы станет улучшение состояния воздушного бассейна города благодаря снижению к концу 2004 г. суммарных атмосферных выбросов от автотранспорта более чем на 60 тыс. т, а ежегодный предотвращенный за счет этого экологический ущерб достигнет на конец 2004 г. почти 320 млн. руб. [1]
Таким образом, исследование новых катализаторов в процессе получения ДМЭ имеет сейчас огромное значение и любые работы и исследования, проводимые в данной области не останутся без внимания.
1. Сырье для топлива
Основным сырьем для производства топлива является нефть. Качество топлива зависит от исходного сырья и от технологии переработки.
Состав топлива должен быть подобран так, чтобы оно обладало свойствами, которые обеспечивают легкий запуск двигателя, полное сгорание, максимальное использование энергии топлива, отсутствие чрезмерного износа отдельных элементов двигателя, стабильность в ходе хранения. Критериями оценки качества топлива в общем случае являются следующие физико-химические параметры: цетановые или октановое число, фракционный состав, вязкость, содержание серы, остаток после коксования, остаток после озоления, температура воспламенения, кислотность, низкотемпературные свойства, содержание воды и механических загрязнений, а часто также плотность и теплотворная способность[2].
Главной проблемой применения дизельных топлив является эмиссия оксидов азота и специфических веществ, в первую очередь сажи. Эмиссия оксидов азота особенно не желательна. Она приводит к выпадению кислотных дождей, образованию приземного слоя озона в городских зонах и истощению озонового слоя атмосферы.
По содержанию оксидов азота, монооксида углерода, углеводородов и сажи в выхлопных двигателей внутреннего сгорания предъявляются жесткие требования. К настоящему времени технологически оформлено и запущено в промышленном варианте производство таких альтернативных топлив, выгодно отличающихся с экологической точки зрения от современного топлива, как метанол, этанол, сжиженный газ, синтетическое жидкое топливо на основе метанола, диметиловый эфир [3].
2. Получение метанола
Метанол является одним из важнейших по значению и масштабам производства органическим продуктом, выпускаемым химической промышленностью. Способы его получения могут быть различны: сухая перегонка древесины, каталитическое неполное окисление метана, каталитическое гидрирование моно- и диоксида углерода, термическое разложение формиатов, гидрирование метилформиата, омыление метилхлорида и др.
До промышленного освоения каталитического способа метанол получали основном сухой перегонкой древесины, в настоящее время этот метод практически не имеет промышленного значения. По причинам технического и, главным образом, экономического характера промышленное развитие получил метод синтеза метанола из монооксида углерода и водорода. Этот метод, с применением оксидов металлов или металлических катализаторов, известен давно, с начала двадцатых годов. При этом довольно быстро стало известно, что в катализаторе не должно присутствовать железо, поскольку образование углеродных отложений дезактивирует катализатор и приводит к образованию метана вместо метанола [4].
С первых лет промышленного производства и приблизительно до конца 1950-х годов лучшим катализатором считался цинк-хромовый. Реакцию проводили при давлении 250-300 атм. и температуре 300-400 С. Ещё давно отмечалось, что медьсодержащие катализаторы позволяют проводить синтез при значительно более низких давлении и температуре, однако медные катализаторы чрезвычайно чувствительны к примесям серы в исходных газах. Так, например цинк- хромовый катализатор ещё может работать при содержании сероводорода до 3. 10-3 %, тогда как для медьсодержащих катализаторов содержание сероводорода должно быть менее 1. 10-4 %. Настоящий успех в синтезе с использованием медьсодержащих катализаторов был обусловлен существенным улучшением процесса очистки синтез-газа. Современные методы очистки позволяют уменьшить содержание сероводорода до 1. 10-5 %, что гарантирует срок службы катализатора более трёх лет.
Для получения оптимальных результатов медьсодержащий катализатор требует присутствия в исходной газовой смеси около 2% СО2 [5]. Было установлено, что активным центром катализатора является одновалентная медь Сu(1) [6]. При концентрациях СО2 меньше 2% катализатор дезактивируется вследствие дальнейшего восстановления, а при более высоких концентрациях CO2 адсорбируется, что затрудняет синтез. С точки зрения энергетических затрат предпочтительнее проводить синтез с использованием Cu/Zn-катализатора при низком давлении (50-100 атм.) и температуре 220-270о С. Однако высокое давление требуется в тех случаях, когда газ загрязнён серой или другими примесями [6]. Суммарная реакция получения метанола сильно экзотермична (-90.8кДж/моль):
СО+2Н2 =СН3 ОН (1)
Максимум конверсии ограничен положением равновесия, которое определяется температурой. Проводить процесс при относительно низких температурах, предпочтительных с точки зрения равновесной конверсии, можно только с использованием высокоактивного медьцинкового катализатора.
Ещё одной каталитической системой для производства метанола из синтез-газа являются гомогенные кобальтовые или родиевые катализаторы. Однако, хотя эти контакты широко исследуются, по-видимому, в ближайшем будущем они не приобретут промышленного значения в основном вследствие того, что полученный метанол всегда содержит сопутствующие продукты, такие как метилформиат и гликолевый альдегид, а также продукты их вторичных превращений. В отличие от них гетерогенные катализаторы, напротив, высокоселективны.
Тем не менее, для выяснения механизма реакции синтеза метанола представляют интерес и гомогенные катализаторы и катализаторы на основе благородных металлов, хотя они и неконкурентоспособны со стойким к отравлению ZnO/Cr2 O3 и высокоактивным CuO/ZnO катализаторами.
3. Использование метанола
На основании лабораторных и дорожных испытаний было установлено, что метанол представляет собой перспективное «чисто» сгорающее автомобильное топливо. При работе на метаноле возникают небольшие проблемы, которые могут быть легко преодолены. Ряд автомобилей, производимых фирмой «Фольксваген» был переведен на метанол, На основании испытаний установлено, что при работе на метаноле достигалась большая мощность вследствие более высокой скрытой теплоты испарения метанола, что позволяло охлаждать горючую смесь в большей степени, чем при испарении бензина. Благодаря этому можно увеличить плотность топливно-воздушной смеси, а, следовательно, и массовый расход. Выигрыш в мощности при работе на метаноле достигает примерно 10 % [7].
При эксплуатации автомобиля на метаноле возникает необходимость в использовании вспомогательного устройства для холодного запуска, если окружающая температура ниже 8°С, однако дальнейшие испытания автомобилей на метаноле показали приемлемую способность к движению при низких температурах.
Топливная экономичность определялась наряду с анализом отработавших газов, а также исследованием способности автомобилей на метаноле к движению и определением удельного расхода топлива. В связи с тем, что энергоемкость метанола меньше чем у бензина, при работе на нем удельный расход топлива значительно больший, чем при работе на бензине. Это означает, что метанол сгорает более эффективно, чем бензин.
Эксплуатация двигателей на метаноле дает возможность снизить содержание загрязнений в отработавших газах, а, следовательно, и загрязнение окружающего воздуха. Содержание монооксида углерода в отработавших газах при работе на метаноле примерно такое же, как и при работе на бензине, но опыты на автомобилях фирмы «Фольксваген» показали возможность снижения содержания СО в отработавших газах после метанола особенно при малой частоте вращения двигателя [7].
На метаноле удаётся значительно снизить в отработавших газах содержание окислов азота (NOX ). Кроме того, в отработавших газах наблюдалась значительно меньшее содержание и несгоревших углеводородов. В выхлопах автомобилей было обнаружено всего около 10% данных загрязнителей. Таким образом, метанол как автомобильное топливо с экологической точки зрения по содержанию в отработавших газах СН вполне приемлем.
Содержание альдегидов в отработавших газах при одинаковых степенях сжатия двигателя, работающего на метаноле, значительно выше, чем на бензине. Однако содержание альдегидов может быть снижено путём увеличения степени сжатия двигателя и ограничением процесса горения путем добавления к метанолу до 10% воды.
Содержание в отработавших газах полициклических ароматических углеводородов, в том числе канцерогенных, при работе на метаноле более чем на порядок меньше, чем на бензине.
Спиртовые топлива целесообразно использовать главным образом в двигателях с искровым зажиганием. Организация работы дизеля на данном виде топлива затруднительна из-за низкого значения цетанового числа ( на уровне 10) [8].
Наиболее выгодно использовать смесь бензина с 4,75% метанола и таким же количеством сольвента, необходимого для предотвращения фазового разделения смеси в присутствии воды, в которой метанол хорошо растворим [9].
Отличная детонационная стойкость метанола дает возможность увеличить степень сжатия двигателя до 14 против 10 для бензина. При этом достигается улучшение расхода топлива и коэффициента полезного действия, а также снижение содержания в отработавших газах NOX и альдегидов.
Таким образом, спиртовые топлива превосходят бензиновые с точки зрения экологической безопасности и до настоящего времени не получили распространения лишь из-за двух основных причин: более высокой стоимости спиртов по сравнению с бензином и отсутствием технических или экономических преимуществ, компенсирующих эту высокую стоимость. К тому же метанол сильно ядовит.
Что касается дизельных двигателей, то в них можно использовать продукт разложения метанола – ДМЭ.
4. Получение диметилового эфира дегидратацией метанола
Дегидратация метанола с получением диметилового эфира-исторически первый путь проведения данного синтеза. Этому процессу ещё с 1960-х годов было посвящено множество работ советских и зарубежных учёных [10, 13 - 16]. Реакция дегидратации метанола на -АL2 О3 широко использовалась для исследования состояния поверхности катализатора в условиях реакции. Установлено [13], что основные компоненты реакционной среды - метанол, вода, ДМЭ - адсорбируются на поверхности диссоциативно с образованием метилированных и гидроксилированных центров. В связи с разработкой процесса получения компонентов моторных топлив из метанола эта реакция в последнее время приобрела промышленное значение, и вновь появился интерес к кинетике и механизму ее протекания [11, 16 - 17].
В работе [16] изучение кинетики проводилось путем варьирования объемной скорости подачи метанола. Проведенные по результатам кинетических измерений на катализаторе -А12 О3 (195-285°С) расчеты показали, что кинетика реакции (2):
2СН3 ОН = СНзОСНз + Н2 О (2)
на изученном катализаторе описывается уравнением второго порядка:
W=k*P2 CH з0 H
Постоянные уравнения Аррениуса имели следующие значения:
В=2.4*108
; Е=21800 ккал/моль (91342 кДж/моль)
На основании данных о бимолекулярности реакции, полученных в [16] и других результатов, авторы [13] провели исследование механизма дегидратации метанола методом ИК спектроскопии. В работах [13 - 14] была подробно изучена адсорбция метанола и ДМЭ на поверхности окиси алюминия в интервале температур 20-450°С, причем поверхность адсорбента в зависимости от обработки была гидратированной или дегидратированной.
На основании проведенных исследований были сделаны выводы о том, что при повышении температуры имеют место различные виды адсорбции как для ДМЭ (адсорбция на связанных водородной связью гидроксильных группах поверхности; взаимодействие с образованием координационной связи; образование структур с активацией водорода метильной группы поверхностью и образование карбонатно-карбоксилатных структур), так и для метанола (адсорбция на связанных водородной связью гидроксильных группах поверхности, адсорбция с образованием поверхностного метилата, комплекса с координационной связью и карбонатно-карбоксилатных структур).
На основании сравнения спектральных данных в совокупности с полученными ранее термодесорбционными результатами [18], авторы пришли к выводу, что протекание реакции дегидратации метилового спирта до диметилового эфира идет с образованием поверхностного метилата и комплекса с координационной связью. Карбонатно-карбоксилатные структуры не являются промежуточными соединениями при дегидратации спирта, но ответственны за протекание побочных реакций. Кроме того, авторы пришли к выводу о том, что «свободные» гидроксилы поверхности не принимают участия в адсорбции, а также что адсорбция ДМЭ на дегидратированной поверхности А12 О3 протекает с отщеплением воды, дегидратирующей поверхность практически без энергии активации.
На основании сделанных выводов авторы предположили, что каталитической дегидратации спирта до эфира предшествует хемосорбция, которая на окиси алюминия протекает с образованием метилата и координационной связи кислород спирта – алюминий решетки. Другая хемосорбционная форма, через которую протекает реакция, возникает при образовании координационной связи между атомом кислорода спирта и атомом алюминий решётки.
Реакция протекает между двумя молекулами спирта, связанными с поверхностью координационной связью. В активном четырехчленном циклическом комплексе происходит одновременный изоэнергетический разрыв и образование двух связей С-О и двух связей О-Н. Образующийся при реакции эфир остается на поверхности связанным координационной связью. Лимитирующей стадией процесса может быть как реакция на поверхности через циклический активный комплекс, так и десорбция эфира с разрывом координационной связи [13]. Помимо основной реакции дегидратации метилового спирта на -Аl2 О3 протекают побочные процессы, сопровождающиеся выделением в газовую фазу монооксида углерода, водорода и углеводородов. Эти побочные процессы являются результатом разложения карбонатно-карбоксилатных структур.
В работе [19] показано, что при пропускании над цеолитом NaX метанола, содержащего йодистый метил, интенсивность образования ДМЭ была выше, чем при пропускании чистого метанола. Авторы объясняют это тем, что галоидные алкилы склонны ионизироваться по механизму SN 1 с образованием карбоний-ионов, что существенно способствует образованию простых эфиров. При этом, даже без использования активирующей добавки выход ДМЭ на цеолите NaX выше, чем на применяемом ранее катализаторе -А12 О3 на 2-5% в интервале температур 250-400°С [12] и составляет 90% масс. при 250°С практически линейно снижаясь до 75% масс. при 400°С. Конверсия метанола как на NaX, так и на -А12 О3 изменялась от 80 до 100% масс, при варьировании температуры реакции от 250 до 400°С.
В работе [20] описаны катализаторы Cu-Hect и Cu-Bent, которые также очень активны в дегидратации метанола до диметилового эфира. Их активность возрастает с увеличением кислотности среды. Свойства этих цеолитных катализаторов очень похожи, причем Cu-Bent является природным минералом, aCu-Hect сделанным искусственно.
Кроме цеолитов разрабатывается также различные модификации катализаторов на основе -А12 03 . Носителем для катализатора может быть любое инертное вещество, но окись алюминия в ходе гидротермического процесса дегидратации за счет спекания подвергается довольно быстрому старению, что приводит к заметному снижению конверсии спирта в простой эфир уже через 200 часов работы катализатора [21]. Указанный недостаток присущ и катализатору на носителе, поскольку кремневое производное играет роль инертной подложки, служащей лишь носителем активной составляющей катализатора, на его поверхности также имеет место наличие ОН-групп, способствующих спеканию. Авторы [21] предлагают модифицировать поверхность оксида алюминия слоем двуокиси кремния в количестве 8-18% от веса катализатора. Такая модификация позволяет проводить процесс по крайней мере 500 часов без заметного снижения конверсии, которая находится в пределах 75-79 % все время работы катализатора.
5. Направления использования продуктов разложения метанола
5.1. Направления использования водорода
В химической отрасли водород главным образом используется для синтеза метанола и аммиака. Остальная доля водорода приходящаяся на эту отрасль, используется в прочих химических производствах: например, синтез углеводородов - получение моторного топлива (бензина, дизельного топлива и т.д.) и ряда ценных индивидуальных органических соединений, оксосинтез - оксидирование алкенов синтез-газом с последующим гидрированием полученных альдегидов в соответствующий спирт, гидрирование жиров - процесс насыщения водородом непредельных кислот с получением твердых жировых продуктов, которые используются в пищевой промышленности.
В процессах современной нефтепереработки водород используется в следующих процессах:
- гидроочистка от серы, кислорода и азота;
- стабилизация нефтепродуктов путем гидрирования олефинов;
- гидрогенизация ароматических углеводородов в нафтеновые;
- процесс гидроалкилирования алкилзамещенных ароматических углеводородов;
- в процессах гидрокрекинга.
Водород широко используется в металлургии как энергоноситель и восстановитель.
5.2. Направления использования оксидов углерода
Наиболее крупнотоннажными процессам использования монооксида углерода является гидроформирование олефинов, карбонилирование метанола с получением уксусной кислоты, синтез непредельных и разветвленных карбоновых кислот. Развитие процессов основанных на оксиде углерода связано с рядом причин. Основной из них является необходимость использования новых альтернативных источников сырья. Второй причиной причинной быстрого развития синтезов на основе оксидов углерода является их высокая селективность, одностадийность, простота аппаратурного оформления и высокая технологичность. Третьей причиной является возможность использования этих процессов для решения экологических проблем. Известно, что диоксид углерода в больших количествах выбрасывается в атмосферу при получении карбида кальция, при выплавке стали, в процессах окисления, с отходящими газами нефтехимических и коксохимических производств.
5.3. Направления использования диметилового эфира
Диметиловый эфир в настоящее время используется главным образом как безвредный для окружающей среды наполнитель аэрозольных баллончиков.
В нефтехимическом синтезе диметиловый эфир используется как интермедиат в синтезах:
- уксусной кислоты и ее производных;
- легких олефинов из синтез-газа;
- монометиламина (CH3
NH2
) и диметиламина ((CH3
)2
NH) при
взаимодействии с аммиаком на цеолитных катализаторах;
- метилацетата в процессе парофазного карбонилирования
диметилового эфира.
6. Использование диметилового эфира в качестве моторного топлива дизельных двигателей
В России с 1992-го, а за рубежом с 1994 г. ведутся работы по использованию ДМЭ в качестве моторного топлива для дизелей. Основными фирмами разработчиками в России является НИИ двигателей, а за рубежом Haldtr Topse A/S, Technical University of Denmark, AVL LIST Gmbh (Austria), Amoco Corp. (USA), NavistarInternationalCo (USA). ДМЭ обладает весьма высоким цитановым числом (ЦЧ=55-60), превышающим аналогичный показатель для дизельного топлива, и низкой температурой кипения (-25°С). Благодаря этим свойствам ускоряются процессы смесеобразования и сгорания, сокращается период задержки воспламенения и обеспечивается хороший пуск дизельных двигателей при любых температурах окружающей среды, а так же существенно улучшаются экологические характеристики выбросов ОГ. Высокое содержание кислорода в ДМЭ (35%) обеспечивает бездымное сгорание топлива и позволяет работать с высокой степенью рециркуляции ОГ. Основными компонентами выброса являются углекислый газ и вода. Содержание окислов азота в ОГ не превышает аналогичные показатели для дизельного топлива. Проведенные на АМО ЗИЛ испытания доработанного образца серийного двигателя на ДМЭ показали его соответствие требованиям ЕЭК ООН "Евро-2". В НИИ двигателей создан опытный образец дизельного автомобиля на ДМЭ. По оценке специалистов США и Дании, присутствовавших на испытаниях, характеристики выбросов ОГ этого автомобиля превзошли все ожидания. В конце 1997 г. в Дании организованы полупроизводственные испытания городских автобусов с дизельными двигателями, использующими в качестве моторного топлива ДМЭ. В мае-июне 1998 г. на международной конференции по альтернативным видам топлива ДМЭ был признан топливом XXI века. Себестоимость производства ДМЭ в России (при отпускных ценах на сырье - природный газ - на уровне мировых цен) составляет не более 2/3 от себестоимости производства дизельного топлива, в то время как у западных фирм - на уровне себестоимости дизельного топлива. Модернизация серийных дизельных двигателей для работы на ДМЭ сводится к повышению объемной подачи ДМЭ топливным насосом, герметизации трубопроводов и замены топливных баков на баллоны, аналогичные баллонам для сжиженного нефтяного газа. В качестве топливозаправочной инфраструктуры можно использовать сеть заправочных станций СНГ(с проведением замены уплотнительных прокладок для герметизации трубопроводов). Как в России, так и за рубежом внедрению ДМЭ активно препятствуют фирмы производители и продавцы моторного топлива, а так же государственные и муниципальные структуры, регулирующие отношения в этой сфере.
7. Физико-химические показатели и свойства ДМЭ
Физико-химические показатели ДМЭ [3]
| Молекулярная масса | 46,07 |
| Температура плавления | -138,5°С |
| Температура кипения | -24,9°С |
| Критическая температура | 127°С |
| Критическое давление | 53,7 бар |
| Давление пара при 20°С 38°С | 5,1 бар 8 бар |
| Теплота парообразования при -20°С | 410кДж/кг |
Результаты выполненных исследований различных аспектов применения ДМЭ в качестве альтернативного моторного топлива для дизелей дают основания для следующих выводов.
1. ДМЭ обладает целым рядом преимуществ по сравнению с другими альтернативными топливами и даже дизельным топливом по следующим показателям:
Химическим:
- отсутствием валентных углеродно-углеродных связей, что понижает склонность к сажеобразованию при горении,
- содержанием порядка 35% связанного кислорода, что практически полностью устраняет дымность выпускных газов,
- хорошей самовоспламеняемость в условиях цилиндра дизеля (цетановое число ЦЧ=55=60 по сравнению с ЦЧ=45-50 для дизельного топлива, не говоря уж об альтернативных топливах типа метанола и этанола, а также природных газах, имеющих плохую воспламеняемость), что делает его идеальным в качестве моторного топлива дизелей:
Физическим:
- хорошей испаряемостью, что приводит к быстрой газификации впрыскиваемых в цилиндры топливных струй, способствуя совершенствованию процесса смесеобразования и улучшению экономичности при понижении требуемого уровня давлений впрыскивания и, следовательно, повышению надежности работы топливовпрыскивающей аппаратуры и снижению ее уровня шума.
2. Результаты моторных испытаний дизелей на ДМЭ показали возможность значительного улучшения следующих характеристик:
Экологическим:
- снижение уровня выброса вредных выбросов с выпускными газами по окислам азота- в 3-4 раза при практически бездымном выхлопе на всех режимах работы;
- ДМЭ является экологически чистым продуктом, не наносящим никакого вреда окружающей среде.
Экономическим:
- сохранение или даже улучшение (до 5%) экономичности дизеля по сравнению с работой на дизельном топливе.
Эксплуатационным:
- снижение динамики цикла и давлений сгорания, что повышает надежность работы двигателей и снижает шумность на 10 дБ(А), открывая возможность конвертирование в дизели, работающие на ДМЭ, обычных карбюраторных двигателей, а также возрождения с улучшением экологических характеристик широко распространенных, например, в дорожно-строительных машинах безнаддувных дизелей.
3. Конвертирование обычных дизелей для работы на ДМЭ состоит только в модернизации их топливоподающей аппаратуры, направленной на увеличение объемной подачи топлива и уплотнения линии низкого давления для приспособления ее к работе на повышенных порядка 10-20 бар давлениях, а также в замене топливных баков на баллоны низкого давления, используемые для работы с сжиженными природными газами.
К недостаткам следует отнести пониженную вязкость ДМЭ по сравнению с дизельным топливом, что может потребовать доводки топливоподающей аппаратуры для обеспечения ее противозадирных качеств и повышения долговечности.
4. Существуют отработанный (через получение метанола), а также более эффективный новый (через получение синтез-газа) технологические способы массового производства ДМЭ на базе природного газа. ДМЭ может также производиться на базе каменного угля, углеродосодержащих продуктов (битумов), а также биомассы, что позволяет считать его возобновляемым видом топлива.
5. Технико-экономический анализ применения диметилового эфира в качестве альтернативного моторного топлива для дизелей свидетельствует о возможности сбыта его по ценам, приблизительно равным ценам на дизельное топливо.
6. Из описанных результатов исследования можно заключить, что диметиловый эфир по своим физико-химическим показателям и данным моторных испытаний может стать в XXI-м веке основным видом моторного топлива во всем мире, над внедрением которого в настоящее время интенсивно работают многие ведущие фирмы и государственные организации за рубежом.[22,23-24]
По существу, речь, по-видимому, может идти о глобальной отработке новой прогрессивной технологии преобразования природного газа (и других видов сырья), обеспечивающего только умеренный экологический эффект, в идеальное моторное топлива, отвечающее всем самым жестким экологическим и экономическим нормам наступающего века.
Результаты проведенных исследований свидетельствуют, что по целому ряду экологических, эксплуатационных и технико-экономических показателей диметиловый эфир может стать в 21-м веке одним из основных видов моторного топлива для дизелей во всем мире, что дает основание рекомендовать всемерную поддержку и развитие соответствующих НИОКР, которые должны способствовать ускорению массового внедрения в нашей стране диметилового эфира в качестве альтернативного моторного топлива.
Одним из самых важных положительных факторов использования ДМЭ в качестве моторного топлива является отсутствие необходимости строительства специальных АЗС. Так как по своим физико-химическим свойствам (за исключением цетанового числа) ДМЭ аналогичен пропан-бутану для заправки автомобильного транспорта ДМЭ можно использовать существующие АГНС.
В этом случае АГНС становится двухтопливной заправкой (пропан-бутана и ДМЭ), по аналогии с действующими АЗС (бензин + дизельное топливо).
8. Транспортировка ДМЭ, разгрузка, хранение
Диметиловый эфир физически сходен с LPG. Свойства ДМЭ сходны со свойствами пропана и бутана, двух основных компонентов LPG. Для морских перевозок могут использоваться обычные LPG танкеры. Разгрузка и хранение ДМЭ может производиться оборудованием, похожим на оборудование для LPG.
Устройства для разгрузки ДМЭ должны быть спроектированы с расчетом на танкеры с тоннажем от 35000 до 78000 м3 .ДМЭ разгружают при температуре -25°С.
Хранилища ДМЭ должны быть снабжены системой пожаротушения, включающей в себя емкости с водой. Также должна быть техническая вода, азот и резервный генератор энергии [25].
9. Производство ДМЭ из метанола
Пошел второй год, как на новомосковском "Азоте" работает единственная на территории СНГ действующая установка для получения диметилового эфира из метанола сырца. Диметиловый эфир, ценный хладагент, заменитель фреонов и дизельных топлив, является вторичным продуктом аммиачного производства.
Аммиак на Новомосковском химическом комбинате производили со дня основания предприятия - с 1933 года. Первоначально его получали из древесины. По мере разрастания предприятия были введены в эксплуатацию три новых цеха комплекса "Аммиак", с технологией получения аммиака из природного газа. Соответственно, получать аммиак из древесины стало не рентабельно. Буквально в то же время возрос спрос на метанол. На "Азоте" к тому моменту был только один цех получения метанола - "М-100", и руководство предприятия приняло решения перепрофилировать "старое" производство аммиака на производство метанола, назвав его - "Производство аммиака и метанола" (ПАМ).
В январе 1981 года на ПАМе был получен первый метанол. Поскольку страна остро нуждалась в этом продукте, средняя выработка тогда составляла ни много ни мало, 20 т/ч. Но в 1991 году спрос упал, и средняя выработка резко упала - до 10-15 т/ч.
Состав метанола-сырца, вырабатываемого на ПАМе, приведён в табл. 1 (курсивом выделены полезные составляющие метанола).
Вырабатываемый метанол передают в "М-100", где ректификат отправляют потребителю, а эфиры отдуваются и сжигаются. Ввиду того, что из всех полезных составляющих только диметиловый эфир (ДМЭ) содержится в количестве, достаточном для выделения, было принято решение организовать производство по получению ДМЭ из метанола-сырца.
И в апреле 2001 года, полтора года назад, в цехе "Синтез" ПАМ была смонтирована ректификационная колонна получения диметилового эфира из метанола-сырца.
В Новомосковске находится единственная в СНГ функционирующая установка получения диметилового эфира. Ещё две находятся в Новгороде и в Северодонецке, но они в данный момент не работают.
ДМЭ является родоначальником класса простых алифатических эфиров. Быстро деградирует в атмосфере и поэтому может применяться как хладагент - заменитель фреонов. На международном Конгрессе-выставке в г. Детройте, прошедшем весной 1995 г., ДМЭ фигурировал под названием "дизельное топливо ХХI". Хотя по энергоёмкости ДМЭ в 1,5 раза уступает традиционному дизельному топливу, по основным показателям его превосходство несомненно: цетановое число - 55-60 ед., температура воспламенения Т=235 °С.
Главное же преимущество ДМЭ как дизельного топлива - экологически чистый выхлоп. Японские исследователи показали, что при крупных масштабах производства применение ДМЭ в качестве топлива для газотурбинных установок более экономично, чем сжиженного газа. Учитывая "веяние времени", установку оснастили АСУТП на базе двухкаркасного программируемого логического контроллера "multiTREI%5B". В состав АСУТП входит несколько устройств (см. рис. 1).
АСУТП - это железо + программа. Без АСУТП установка работать не может. Конструктивно контроллер представляет собой настенный шкаф во взрывозащищённом исполнении. Технически контроллер состоит из двух процессоров (мастермодулей), модулей УСО, двух концентраторов сети (хабов). Два мастер-модуля используются для повышения надежности системы. Один мастер-модуль всегда является рабочим, а второй с частотою примерно 10 Гц считывает с рабочего всю информацию (большая частота при этом никак не влияет на стабильность системы). Переключение с основного на резервный модуль происходит автоматически при отсутствии отклика от основного в течение 1,6 сек.
Это стандартная схема резервирования, используемая во всех АСУТП на НАК "Азот". На "Азоте" кроме цеха "Синтез" автоматизированы, в частности, цеха "Аммиак-2", "Карбомид-2", "ПХВС-1", "М-100", "Аммиак-3", "Хлор" и другие; резервы еще имеются.
Сам мастер-модуль состоит из 3-х плат, на которых расположены: процессор (CPU) -промышленный IBM-AT-486-совместимый компьютер с операционной системой DOS; контроллер шины ST BUS; статическое энергонезависимое ОЗУ (SRAM 512K) и флеш-диск (Flash Disk 2 МВ) предназначены для хранения рабочих программ и промежуточной текущей информации в модуле. Модули УСО - универсальные платы ввода/вывода. Они служат для приема аналоговых и дискретных сигналов с датчиков и передачи их на мастер-модуль, а также для приёма команд и управляющих сигналов с мастермодуля и выдачи их на исполнительные механизмы. Отличительной чертой данного типа контроллеров является то, что на каждом аналоговом модуле УСО установлены по 8 съёмных панелек (мезонинов). Мезонин представляет собой миниплату, напичканную электроникой, которая крепится винтами к модулю УСО. Каждый мезонин - это один аналоговый параметр. В случае выхода из строя какого-либо мезонина остальные мезонины на модуле будут исправно работать. Кроме того, имеется возможность менять мезонины, не останавливая контроллер. Достаточно перевести в режим Stop простой переключатель, имеющийся на каждом модуле УСО, вынуть сам модуль, заменить неисправный мезонин, вставить модуль УСО и перевести переключатель в положение Run.
Контроллер позволяет подключить 160 параметров, а реально востребованы на производстве 148 параметров.
В химическом цехе - офисные компьютеры
Станции оператора - 2 обыкновенных офисных компьютера Intel Pentium III (Celeron) с 19-дюймовым монитором. На станции оператора функционирует SKADA-система "КРУГ2000" пензенских разработчиков, которая традиционно применяется на химических производствах, в нефтехимической, атомной промышленности, энергетике. Помимо названной SCADA-системы контроллер multiTREI может работать, например, со SKADA-системами TRACE MODE, INTOUCH и другими.
В свою очередь, SKADA-система "КРУГ2000", используемая на "Азоте", может работать с контроллерами Ломиконт, Ш711, TOSHIBA, MOTOROLA и другими. Разработчики контроллера TREI и SKADA-системы "КРУГ2000" ведут работы совместно, согласуя и модификации своих систем, и документацию к ним, поэтому, в частности, "Новомосковский Азот" сделал свой выбор в пользу этого сочетания. Впрочем, такого рода конвергенция типична: многие разработчики софта и оборудования согласуют свою деятельность на рынке.
SKADA-система "КРУГ2000" имеет нескольких составных частей (готовых программ): графический редактор, редактор динамики, генератор базы данных, программы реального времени, программы станции инжиниринга и другие. Сменный персонал цеха контролирует и управляет технологическим процессом с помощью единой программы. В каждой смене установку обслуживает один человек.
В системе реализована концепция разграничения доступа, т. е. каждому пользователю администратором системы присваивается определённый уровень доступа. В АСУТП ДМЭ существует два уровня доступа: "Специалист службы АСУТП" и "Оператор-технолог ДМЭ". В частности, выставлять настройки регуляторов - прерогатива специалиста службы АСУТП. Все регуляторы программные. Конфигурирование базы данных, создание контуров регулирования, выбор закона регулирования осуществляется с помощью генератора базы данных. В контроллере постоянно работает программа пользователя (ПрП), написанная на языке программирования "Кругол". "Кругол" - один из немногих "русских" языков программирования.
Вот как выглядит типичная команда на нем: Если ва5=100 {выкл тс1} Иначе {вкл тс1}. Для набора текста программы может использоваться любой текстовый редактор. А вот для компиляции, отладки и тестирования программы должна быть использована специальная программа - "Транслятор ПрП". Надо сказать, что в российских SKADA-системах используются специализированные технологические языки на кириллице, а не языки высокого уровня - российские операторы не пишут на C++ или Pascal.
Очевидно, целью в данном случае является приблизить технологическую программу к пользователям, которые в большинстве своем английским языком и профессиональными языками программирования не владеют.
 |
| Рис. 2. Схема соединений АСУТП |
Все мнемосхемы, видеокадры и переходы по видеокадрам создаются с помощью графического редактора и редактора динамики. Загрузка созданной базы данных и программы в контроллер осуществляется с помощью программы станции инжиниринга. Для внесения базы данных нужно остановить работающий контроллер, загрузить туда данные и программу и перезапустить его. Кроме того, имеется возможность делать изменения в базе данных на ходу, не перезапуская контроллер, - с помощью специальной функции программы станции инжиниринга.
Передача инфор-мации "контроллер - станция оператора" ведётся по дублиро-ванной сети Ethernet. Для этого в станции оператора установлены две сетевые платы, каждая из которых связана своим кабелем типа "витая пара" с отдельным хабом (оба хаба находятся в шкафу контроллера). Каждый из хабов соединён со своим мастер-модулем. Общая схема соединений приведена на рис.2.
Такая схема не обеспечивает работу обеих плат компьютера в режиме "горячего" резервирования, так как под управлением операционной системы DOS обе сетевые платы не могут работать одновременно, и при выходе из строя одной вторая не подхватывает передачу информации автоматически.
Из создавшейся ситуации был найден следующий выход: при разрыве сетевого соединения через заданное время специальная программа, функционирующая на станции оператора, создаёт служебный файл и перегружает компьютер. После перегрузки в файле autoxec.bat проверяется наличие этого файла, и, если он найден, загружается драйвер для другой сетевой платы. Так делается всегда при использовании операционной системы DOS. Кроме того, к контроллеру возможно "прямое" (не по сети) подключение клавиатуры, монитора и компьютера (ноутбука или IBM PC) при загрузке и отладке программ, соответствующие входы имеются на мастер-модуле контроллера.
|
Контроллер питается от источника бесперебойного питания UPS ~220 V/=24 V с аккумуляторной батареей. Станции питаются от собственных UPS со встроенными аккумуляторными батареями. При потере питания аккумуляторные батареи 20 минут питают контроллер и станции. Этого времени достаточно для остановки технологического процесса. Надо сказать, за год работы системы источники бесперебойного питания так и не были использованы по назначению, поскольку на "Азоте" практически не случается перебоев с электроснабжением.
Основными достоинствами "цифрового" комплекса являются удобство программирования, быстрота изменения контуров регулирования и отсутствие необходимости в применении каких-либо дополнительных технических средств. В настоящее время руководством цеха поставлен вопрос об оптимизации процесса получения ДМЭ и об автоматической подстройке всех контуров регулирования под соответствующий режим работы колонны. [26]
10. Производство ДМЭ из природного газа
10.1. Рентабельность процесса
По оценкам ряда зарубежных компаний (BP, Marubeni), перспективным направлением является разработка коммерческой технологии конверсии природного газа в смесь жидких углеводородов (СЖУ) или в моторное топливо, в частности диметиловый эфир (ДМЭ), который по своим физико-химическим показателям близок к смеси пропан-бутана.
СЖУ, прежде всего бензин и дизельное топливо, получаемые с применением существующих в настоящее время технологий конверсии природного газа (процессы компаний Shell, ExxonMobil и др.), нерентабельны по сравнению с аналогичными продуктами нефтепереработки, главным образом из-за многостадийности синтеза и энергоемкости промежуточной стадии получения синтез-газа. В частности газойль, получаемый по технологии Shell, может конкурировать с нефтяным газойлем только при низких ценах на используемый сырьевой природный газ (не выше $16/тыс. м3 ), производительности по СЖУ не менее 700 тыс. тонн в год и при условии, что цена на нефть превышает $120-125 за тонну.
В настоящее время как в России, так и за рубежом ведутся интенсивные работы по созданию конкурентоспособных процессов конверсии природного газа в СЖУ. Актуальность работ в данном направлении определяет, прежде всего, неизбежный в ближайшие 10-15 лет рост цен на нефть и, соответственно, моторные топлива. Если в 1999 году мировое производство СЖУ не превысило 700 тыс. тонн (при производстве автомобильного бензина и дизельного топлива соответственно 800 млн тонн и 360 млн тонн), то в случае реализации всех разрабатываемых проектов конверсии природного газа в СЖУ, производство последних уже в течение первого пятилетия будущего века может составить 17 млн. тонн в год. Наибольшую активность в данном направлении проявляют компании Shell, ExxonMobil, Sintroleum, Conoco, Sason. Проектная мощность (по продукции) уже работающих установок конверсии природного газа в СЖУ варьируется от 3,5 тыс. тонн до 600 тыс. тонн в год. Однако реальная конкуренция между СЖУ и нефтяным топливом возможна только при равной или более низкой себестоимости СЖУ и при достижении более высоких эксплуатационных и экологических характеристик. При наиболее вероятном сценарии развития мировой энергетики реализация проектов по производству СЖУ интенсивно начнется только при достижении цены на синтетическую нефть в $100-120 за тонну, что соответствует прогнозируемой на начало XXI века цене нефти сорта Brent. Основными факторами, тормозящими реализацию проектов, является серьезный финансовый риск, связанный с необходимостью крупных инвестиций и флуктуация цен на нефть.
| Цена различных видов энергоносителей на условиях СИФ, Роттердам | |
| Вид топлива | Цена,долл./тонна |
| Нефтяное дизельное топливо | 220-240 |
| Сжиженный нефтяной газ | 240-260 |
| Пропан | 380-390 |
| Сжиженный природный газ (СПГ) | 165-175 |
| ДМЭ (Прим. Производительность установки - 1.5 млн тонн/год; Цена природного газа - $45/тыс. м3 ) |
160-180 |
| Синтетическое дизельное топливо по процессу Фишера-Тропша | 280-300 |
10.2. Перспектива ДМЭ
Моторные топлива, получаемые из природного газа, не содержат ароматических углеводородов, серы и характеризуются полнотой сгорания. Согласно оценке экспертов, на сегодняшний день наиболее перспективным (альтернативным нефтяному) дизельным топливом является диметиловый эфир. Помимо уже названных преимуществ синтетических топлив, синтезированных из природного газа, ДМЭ характеризуется высоким цетановым числом (55-60 против 40-55 для нефтяного дизельного топлива), а также отсутствием сажи и оксидов азота в выхлопных газах, что особенно важно для крупных городов. Стендовые испытания ДМЭ показали, что изменений в конструкции дизельного двигателя не требуется, необходима лишь незначительная модернизация системы подачи топлива. Предварительные технико-экономические расчеты российских и зарубежных специалистов показывают, что производство ДМЭ из природного газа более выгодно, чем производство дизельного топлива по методу Фишера-Тропша.
| Физические свойства ДМЭ и других углеводородных топлив | ||||||
| Показатель | ДМЭ | Метан (СПГ) | Пропан | Метанол | Дизельное топливо | |
| Химическая формула | CH3 OCH3 | CH4 | C3 H8 | CH3 OH | - | |
| Температура кипения, 0 С | -25,1 | -161,5 | -42,0 | 64,6 | 180-370 | |
| Плотность при 200 С, г/см3 | 0,67 | 0,42* | 0,49 | 0,79 | 0,84 | |
| Давление насыщенных паров при 250 С, Мпа | 0,61 | 24,6 | 0,93 | - | - | |
| Вязкость кинематическая при 200 С, мм2 /с | 0,15 | - | 0,17 | - | 3-5 | |
| Температура воспламенения, 0 С | 235 | 650 | 504 | 470 | 250 | |
| Предел взрываемости, % | 3,4-17 | 5-15 | 2,1- 9,4 | 5,5-26 | 0,6-7,5 | |
| Цетановое число | 55-60 | 0 | 5 | 5 | 40-55 | |
| Низшая теплота сгорания, кДж/кг | 28 900 | 50 300 | 46 500 | 21 100 | 42 500 | |
| * плотность СПГ определена при температуре минус 161,50 С | ||||||
Таким образом, химическое превращение природного газа в ДМЭ непосредственно на газовом месторождении позволяет значительно сэкономить средства, связанные с транспортированием углеводородного топлива от мест добычи, и получить продукт, являющийся перспективным дизельным топливом (альтернативным нефтяному).
Из возможных направлений использования ДМЭ (топливо для бытовых нужд, моторное топливо, сырье для теплоэлектростанций) для европейского рынка наиболее вероятен транспорт. Несмотря на то, что в настоящее время ДМЭ используется исключительно в качестве пропелента и ежегодное мировое потребление не превышает 150 тыс. тонн, ожидается, что в ближайшие годы сформируется рынок ДМЭ как моторного топлива.
10.3. Выбор технологии переработки
В основе существующего процесса промышленного синтеза ДМЭ лежит экзотермическая реакция дегидратации метанола. Это относительно простой процесс, который целесообразен только для установок небольшой мощности и капиталоемкости. Синтез проводят при давлении около 1,0 МПа, температуре 290-4000С в адиабатическом реакторе в присутствии катализатора (оксид алюминия). Конверсия метанола за один проход составляет около 80%.
Рекомендовать данную технологию для крупнотоннажного производства ДМЭ нельзя, так как себестоимость ДМЭ, образующегося при дегидратации метанола, существенно (в 2 раза) выше, чем метанола.
Так как получение ДМЭ в любом случае проходит стадию образования метанола, то все предлагаемые к реализации технологии синтеза ДМЭ из природного газа являются, в общем случае, развитием метанольного производства и включают в себя ряд общих стадий: стадию риформинга природного газа в синтез-газ (смесь водорода и окиси углерода), на которую приходится до 70% общего объема затрат на процесс; стадию каталитического превращения синтез-газа в смесь метанола и ДМЭ, на которую приходится 20-25% капитальных затрат на процесс; стадию разделения метанола и ДМЭ.
В Российских академических институтах (ИНХС им. А.В.Топчиева, ИОХ им. А.Д.Зелинского) также проводятся работы по созданию технологии производства ДМЭ из природного газа. Исследования носят преимущественно академический характер, направлены на создание новых катализаторов получения ДМЭ из синтез-газа. Исследования, проводимые в ГНЦ НИФХИ им Л.Я.Карпова, направлены на разработку технологической схемы и конструктивного оформления процесса.
По-нашему мнению, ключевой стадией процесса химической конверсии природного газа в ДМЭ является стадия превращения метана в синтез-газ. Поэтому основной акцент при разработке технологий следует сделать на получение более дешевого синтез-газа по сравнению с существующими способами.
Технология "Тандем" (двухступенчатая парокислородная конверсия природного газа с трубчатым реактором), разработанная ГИАП (Россия) и фирмой Linde (Германия), в настоящее время является одной из самых эффективных технологий получения метанола из природного газа. В промышленном масштабе она реализована на ПО "Азот" (Беларусь). Производительность установки по перерабатываемому газу - 130 млн м3 /год. По данной технологии проектируется установка производства метанола на АО "Нитроферт" (Эстония) производительностью по природному газу 400 млн м3 /год.
Процесс "Тандем" имеет ряд очевидных преимуществ по сравнению с паровой конверсией природного газа в шахтном реакторе.
К ним следует отнести автотермичность процесса и замкнутый энергетический цикл, минимальный удельный расход природного газа на 1 тонну вырабатываемого продукта (расходный коэффициент получения 1 тонны метанола из природного газа составляет 85% от потенциально возможного, т.е. только 15% или 150 м3 природного газа из взятых 1 000 м3 потребляется для обеспечения энергетики процесса "Тандем"). Кроме того, обеспечивается низкий уровень выбросов вредных веществ (NOx, SO2, CO) в атмосферу.
В отличие от западных технологий конверсию синтез-газа в ДМЭ можно осуществлять без стадии ректификации. Общая рециркуляционная схема, характерная для синтеза метанола, остается без изменений. Реактор, как и в синтезе метанола, состоит из адиабатических слоев (полок), но отличается способом размещения катализатора дегидратации метанола и используемым циркулирующим агентом для охлаждения образующихся продуктов.
Конденсация состоит из трех ступеней: конденсатора влаги, конденсатора метанола и конденсатора ДМЭ. Предлагаемый способ позволяет получить ДМЭ без примесей метанола.
Процесс "Тандем" обеспечивает необходимый для последующей стадии состав синтез-газа при давлении в реакторе 30-90 атм. Это определяет благоприятные условия для создания агрегата производства ДМЭ без компрессора синтез-газа, что, безусловно, значительно повысит его технико-экономические показатели.
Предварительный анализ процесса показывает возможность создания агрегата производительностью 500-800 тыс. тонн в год по ДМЭ, оборудование которого имеет промышленные аналоги и может быть создано в однолинейном исполнении транспортабельных габаритов.
В настоящее время ВНИИГАЗ совместно с ГНЦ НИФХИ, ИВТАН, РГУНГ им. И.М.Губкина разрабатывает ТЭО по созданию завода производства ДМЭ единичной мощности 500 тыс. тонн в год. Работа проводится в рамках научно-технической подпрограммы "Прогрессивные технологии комплексного освоения топливно-энергетических ресурсов недр России" федеральной целевой научно-технической программы "Исследования и разработки по приоритетным направлениям развития науки и техники гражданского назначения" Министерства науки и технологий Российской Федерации. [27]
11. Производство ДМЭ из угля
Речь идет, прежде всего, о применении на угледобывающих предприятиях технологий и установок по переработке угля в особо ценные виды высокоэффективных и экологически чистых синтетических моторных топлив, таких например, как диметиловый эфир (ДМЭ). Тем более что именно сжиженный природный газ и синтетические моторные топлива, как известно, являются одним из приоритетов уже в только что принятой Энергетической стратегии России.
Применение этого высококачественного дизельного и энергетического топлива, альтернативного нефтяному, является настолько перспективным, что не только многие зарубежные компании и фирмы (BP, Marubeni, NKK, Air Products & Chemicals Inc.), но и ряд российских предприятий ведут работы по промышленному освоению этого весьма привлекательного в коммерческом отношении направления. Это обусловлено тем, что ДМЭ, как моторное топливо, в частности, имеет более высокое цетановое число (55-60 в отличие от 40-55 для нефтяного дизельного топлива), а при его сгорании в выхлопных газах практически отсутствуют сажа и оксиды азота.
Независимо от технологии промышленного синтеза ДМЭ получение этого топлива проходит стадию образования метанола путем риформинга природного газа в синтез-газ (смесь водорода и окиси углерода), на которую приходится почти две трети общих энергетических затрат на процесс. Последующие же стадии каталитического превращения синтез-газа в смесь метанола и ДМЭ, а затем их разделения требуют значительно более низких энергозатрат, но являются достаточно капиталоемкими.
Сегодня некоторые зарубежные фирмы (NKK, Air Products & Chemicals Inc.) уже имеют опытно-промышленные технологии и установки производства ДМЭ из угля в шламовых реакторах, работающих при соотношениях H2 /CO от 0,7 до 1. По данным корпорации NKK (Япония) установка по производству 2500 т/сут ДМЭ будет перерабатывать 4000 т угля в сутки. Синтез ДМЭ осуществляется при температуре 250-2700 С и давлении 30-70 атм., процент конверсии за один цикл прохода метанола составляет 55-60 и на выходе реактора ДМЭ составляет 95-99%. Минимальная стоимость такой установки составляет 365 млн долл. США.
Ориентировочный расчет экономической эффективности работы такой установки по специально разработанной Excel-программе, выполненный при следующих исходных данных:
- производительность установки по ДМЭ, млн. т/год - 0,83
- стоимость 1т у.т., $/т – 50
- стоимость установки, млн $ - 365
- дополнительные капиталовложения, $/т ДМЭ - 18,5
- прочие переменные издержки, $/т ДМЭ - 5,5
- транспортные расходы по доставке ДМЭ, $/т ДМЭ - 2,5
- длительность эксплуатации установки, год - 20подтверждает достаточно высокую экономическую эффективность осуществления такого проекта.
При расчетах определялись стандартные показатели, характеризующие эффективность проекта: чистый дисконтированный доход NPV = 359,85 млн $; внутренняя норма доходности IRR = 26%; индекс доходности PI = 0,95 и tд = 6 лет.
Как видим, при принятых исходных данных не все критерии эффективности, строго говоря, свидетельствуют в пользу реализации данного проекта. Так, индекс доходности проекта является несколько меньшим единицы, хотя другие показатели, такие как IRR и дисконтированный срок окупаемости являются достаточно высокими.
Ситуация в этом смысле изменяется существенным образом при изменении таких параметров, как ставка дисконтирования, цена исходного топлива, ставка налогообложения, стоимость реализации (поставки) одной тонны ДМЭ и пр. В частности, только при снижении ставки дисконтирования с 12 до 10 % индекс доходности проекта уже становится равным 1,21, а дисконтированный срок окупаемости снижается с 6 до 5 лет. Если же принять стоимость исходного топлива на уровне 30 $/т, что находится даже несколько выше существующих сегодня цен на уголь, то рассматриваемый проект становится “эффективным” по всем показателям и при ставке дисконтирования 12%.
Еще большие возможности для перспективного развития угольной промышленности открываются на путях комплексного энергохимического использования (сжигания) каменного угля, при котором в значительной мере снижаются и выбросы в окружающую среду инертного газа СО2 , являющегося, как известно (в силу парникового эффекта), своего рода барьером на пути развития угольной энергетики.[28]
12. Каталитические системы на основе алюмофосфатов цеолитного типа
Важным направлением работ в области синтеза новых адсорбентов и катализаторов является получение цеолитных структур на основе неорганических фосфатов. В последние годы пристальное внимание исследователей привлекли фосфорсодержащие цеолиты. Однако получить алюмофосфатные молекулярные сита, свободные от кремний-кислородных тетраэдров, не удавалось, поскольку синтез проводили в присутствии алюмосиликатного геля. В 1982 г., проведя гидротермальный синтез с использованием структурообразующих реагентов, получили новый класс алюмофосфатных молекулярных сит, в которых кремний-кислородные тетраэдры полностью изоморфно замещены на фосфор-кислородные. Разнообразие размеров пор и структуры в сочетании с высокой термической устойчивостью делают каталитические и адсорбционные свойства алюмофосфатных молекулярных сит уникальными.
По данным работы [29] фосфорсодержащие цеолиты обладают мягкими кислотными свойствами, а в [30, 31] указывается, что при каталитическом разложении метанола на алюмофосфатах в атмосфере азота единственным продуктом конверсии метанола при Т до 400°С был диметиловый эфир, но при дальнейшим увеличении температуры наблюдается образование формальдегида и закоксовывание катализатора. Алюмофосфаты обладают высокой удельной поверхностью, которая достигает 440 м2 /г, что является очень важным, так как их активность значительно возрастает с увеличением их удельной поверхности [32].
В литературе [31-33] представлены способы получения алюмофосфатов путем гидротермальной обработки реакционных гелей, полученных взаимодействием активного золя гидроксида алюминия с концентрированной фосфорной кислотой. Кристаллизацию гидрогеля проводят при температуре Т = 303-523 К в присутствии органических оснований или мочевины, выполняющих структурно-направляющую роль в процессе синтеза. Органические основания и мочевина, применяемые в процессе синтеза, определяют направление кристаллизации алюмофосфатного геля [33], что приводит к воспроизводимому формированию различных кристаллических структур с развитой системой микропор. Тип структуры алюмофосфатов обусловлен главным образом природой и свойствами структурообразующих реагентов. В ряде случаев алюмофосфаты цеолитного типа как по структуре, так и по способности к поглощению газов и паров подтверждают свою близость к эталонным образцам известных алюмосиликатных сит [31]. Поскольку формирование структуры алюмофосфатов происходит с заполнением микропор органическими соединениями, которые удаляются при нагревании, по завершении приготовления таких катализаторов необходимо их прокаливание с целью удаления органических составляющих, а также остатков влаги.
В [32, 34] представлен способ получения аморфных фосфатов алюминия осажденем из растворов азотнокислого алюминия и фосфорной кислоты аммиаком. Кроме того в [32] предложен способ получения гелеобразных фосфатов путем осаждения из раствора нитрата алюминия и фосфорной кислоты аммиаком с добавлением мочевины в качестве структурообразующего компонента.
Несомненным плюсом алюмофосфатов является их высокая термическая стабильность. По сравнению с алюмосиликатными молекулярными ситами, имеющими сравнительно низкий температурный предел устойчивости, в большинстве случаев 400-600°С [31], алюмофосфаты характеризуются высокой термической устойчивостью, и появление экзоэффектов, соответствующих перестройке их кристаллических структур наблюдается в области температур 900-980°С [30- 33].
Стоит заметить, что на алюмофосфатах диметиловый эфир можно получать как путем дегидратации метанола, так и путем прямого его синтеза из синтез-газа [34].
В связи с этим представляет интерес исследования каталитической активности алюмофосфатов в реакции дегидратации метанола.
На основании анализа литературного обзора можно сделать следующее заключение о том, что на протяжении уже нескольких лет интенсивно ведутся разработки процессов получения альтернативных топлив, взамен нефтяным. Это связано в первую очередь с тем, что запасы нефти с каждым годом истощаются и, кроме того, нефть является ценнейшим сырьем для нефтехимической промышленности, поэтому следует всячески снижать долю нефтепродуктов, используемых в качестве автомобильного топлива. Еще одной немаловажной причиной является экологическая ситуация, сложившаяся сегодня во многих крупных городах нашей планеты.
В настоящее время в различных странах мира проявляется значительный интерес к процессам производства диметилового эфира, который в 1995 году на Международном конгрессе и выставке в Детройте рядом крупных фирм (AmocoCo., HaldorTopsoeA/S и др.), представляющих специализацию по нефте- и газопереработке, по катализу, по двигателям и транспорту, был представлен как новое экологически чистое дизельное топливо 21 -го века.
Наиболее перспективными процессами получения ДМЭ являются газо- и жидкофазные синтезы на основе монооксида углерода и водорода. Метод получения ДМЭ дегидратацией метанола менее эффективен, однако если он происходит непосредственно в автомобильном двигателе, то решается ряд проблем с транспортировкой и хранением топлива. Недостатком является то, что данный процесс, проводимый при Т=250-300°С, атмосферном давлении и в присутствии катализатора - -оксида алюминия идет с невысокой производительностью по ДМЭ, что является проблемой для устройства такого двигателя. В связи с этим, нами предлагается процесс переработки метанола в диметиловый эфир на фосфатном катализаторе, на котором, из-за его большей активности, синтез протекает с большей скоростью, а, следовательно, при дальнейшем сжигании полученного топлива в цилиндрах двигателя выделяется больше тепловой энергии.
13. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
13.1. Методика проведения эксперимента
Эксперименты по дегидратации метанола с получением диметилового эфира проводили при атмосферном давлении на лабораторной установке, схема которой представлена на рисунке 4.
Перед началом экспериментов в кварцевый реактор (3), помещенный в каталитическую печь (6), через вентиль тонкой регулировки (13), моностат (14) и реометр (11) подавался аргон, расход которого, необходимый для нахождения количества газа, образовавшегося за время опыта, определяли по пенному расходомеру (15). Разогрев катализатора до 150-180°С проводили в токе аргона, дальнейший нагрев до реакционной температуры осуществляли в токе испаренного сырья.
Контроль температуры обогрева реактора осуществляется с помощью терморегулятора ТРМ1 (9) и реле РЭР-10М (12), с точностью + ГС. Контроль температуры в слое катализатора (5) осуществляется потенциометром ПП-63А (8) по хромель-копелевой термопаре.
При достижении температуры 150-180°С в верхнюю часть реактора (3), заполненную кварцевой насадкой (4), начинали подавать метанол из бюретки (1) с помощью перистальтического микродозатора (ДЛВ) (2). Жидкие продукты реакции на выходе из реактора охлаждались в водяном холодильнике-конденсаторе (10).
Сконденсировавшиеся продукты реакции и не прореагировавший метанол собирались в приемнике холодильника-конденсатора. Остальная часть жидких и газообразные продукты реакции проходили через низкотемпературную ловушку, охлаждаемую смесью льда и NaCl (до Т = -22°С). В ловушке конденсировались и собирались, в зависимости от используемого катализатора диметиловый эфир, метанол, метилформиат и вода, а газообразные продукты направлялись на продувку кранов-дозаторов хроматографов. Сброс газа осуществлялся в вытяжную вентиляцию.
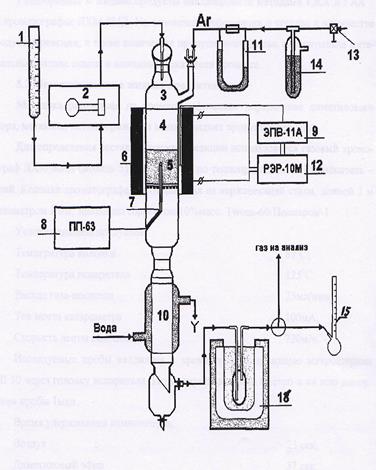
Рис.4 Схема лабораторной установки
I бюретка; 2 микродозатор; 3 кварцевый реактор; 4 кварцевая насадка; 5 слой катализатора 6 электрообогрев реактора; 7 термопара 8 потенциометр ПП-63; 9 регулятор температуры ЭПВ-11 А; 10 холодильник-конденсатор; 11 реометр; 12 электрическое реле РЭР ЮМ; 13 вентиль тонкой регулировки; 14 моностат; 15 пенный расходомер; 16 низкотемпературная ловушка.
Газообразные и жидкие продукты анализировали методами ГЖХ и ГАХ на хроматографах ЛХМ-8МД. На основании информации о составе и количестве продуктов реакции, а также количестве пропущенного сырья, рассчитывали материальный баланс опыта, и выходные показатели процесса.
13.2. Методика анализа жидких продуктов
Методика рассчитана на хроматографическое определение диметилового эфира, метанола, метилформиата и воды в жидких продуктах реакции.
Для определения состава продуктов реакции использовался газовый хроматограф ЛХМ-8МД (модель 5) с детектором по теплопроводности. Газноситель -гелий. Колонка хроматографа, изготовленная из нержавеющей стали, длиной 2 м и диаметром 2 мм, заполнена сорбентом 10%масс. Tween-60/ПолихроМ".
Условия анализа продуктов:
Температура колонки 85°С;
Температура испарителя 125°С;
Расход газа-носителя 25мл/мин;
Ток моста катарометра 100мА;
Скорость ленты самописца 720м/ч.
Исследуемые пробы вводились в хроматограф с помощью микрошприца МШ 10 через головку испарителя. Иглу шприца вводили быстро и на всю длину. Объем пробы 1мкл.
Время удерживания компонентов:
Воздух 23 сек;
Диметиловый эфир 37 сек;
Метилформиат
Метанол 2 мин. 13 сек;
Вода 4мин.51 сек.
Для количественного определения состава жидких продуктов реакции использовался метод абсолютной калибровки с учетом поправочных коэффициентов.
Поправочный коэффициент определяли как тангенс угла наклона прямой, построенной в координатах: Si /SCT =F(Gi/GCT ), где Si, Sct- площади пиков определяемого вещества и стандарта; Gi,Gct- их весовые соотношения. За стандарт принимался метанол. Поправочные коэффициенты:
Диметиловый эфир 1,2
Метанол 1
Вода 1,21
Для определения содержания компонентов рассчитывались площади соответствующих пиков по формуле:
Si=hi*bi*Mi (1)
где: hi - высота пика, мм;
bi - ширина пика на середине высоты;
Mi - масштаб записи пика.
Процентное содержание каждого компонента вычислялось по формуле:
Ci=(Si*Ki*100)/ (2)
где: Si - площадь пика компонента, мм ;
Ki - поправочный коэффициент для данного компонента.
13.3. Методика анализа газообразных продуктов
Анализ газообразных продуктов реакции, содержащих Н2 , СО, СО2 , CH4 , ДМЭ и смесь углеводородов С2 - С4 , проводили на хроматографах ЛХМ-8МД с использованием катарометров, четырех насадочных колонок и печи конверсии углеводородов. Анализируемым газом последовательно продували петли кранов-дозаторов и далее пробу газа вводили на анализ в колонки А и Г. По завершении анализа на этих колонках газ подавался на колонки Б и В.
Условия анализа ДМЭ (колонка А):
Колонка из нержавеющей стали, L=1,5м, D=2мм.
Адсорбент Порапак PQS;
Газ-носитель Не ;
Температура испарителя 125°С;
Расход газа-носителя 30 мл/мин
Ток моста 120 мА.
Условия анализа углеводородов (колонка Б):
Колонка из нержавеющей стали, L=6м, D=2мм.
Колонка из нержавеющей стали, L=l ,5м, D=2мм.
Адсорбент А12 О3 ;
Газ-носитель Аг;
Температура колонки 75°С
Расход газа-носителя 30 мл/мин
Ток моста 65 мА;
Температура печи конверсии углеводородов 900°С.
Условия анализа Аr, СО (колонка В):
Колонка из нержавеющей стали, L=4м, D=2мм.
Адсорбент молекулярные сита, 5А;
Газ-носитель Не ;
Температура колонки 75°С
Температура испарителя 125°С;
Расход газа-носителя 30 мл/мин
Ток моста 120мА.
Условия анализа Н2 , CH4 , CO2 (колонка Г):
Колонка из нержавеющей стали, L=2м, D=2мм.
Адсорбент уголь СКТ;
Газ-носитель Аr;
Температура колонки 75°С
Расход газа-носителя 30 мл/мин
Ток моста 65 мА.
Калибровочные коэффициенты определялись по площадям пиков, полученных при заколе чистых веществ на соответствующие колонки, в соответствии с уравнениями:
КДМЭ =SAr 2 / SДМЭ
KH 2 =SH 2 / SH е
KCO =SCO /SAr1
KCO2 =SCO2 /SAr2
KCH 4 =SCH 4 /SAr 1
где SH е ,SAr 1 ,SAr 2 - площади пиков чистых аргона и гелия, полученных соответственно с колонок Г, В и А. Калибровочные коэффициенты проверяются каждые два месяца, площади пиков берутся как среднее значение из трех вводов. Значения калибровочных коэффициентов представлены ниже:
КДМЭ = 0,68
KH 2 = 1,64
KCO = 0,75
KCO 2 = 2,58
KCH 4 = 0,5
Ежедневно хроматографы калибровались по аргону и гелию.
Концентрации газообразных продуктов реакции (%об.) определялись по формулам:
CДМЭ =SДМЭ *KДМЭ *MДМЭ *100/(S Ar2 *M Ar2 ) (3)
СН 2 =SH2 *MH2 *100/(KH2 *SHe *MHe ) (4)
CCO =SCO *MCO *100/(KCO *SAr1 *MAr1 ) (5) CCO2 =SCO2 *MCO2 *100/(KCO2 *SAr2 *MAr2 ) (6) CCH4 =SCH4 *MCH4 *100/(KCH4 *SAr1 *MAr1 ) (7)
где: Sдмэ= SH 2 , Sco, SCO 2 , SCH 4 - площади пиков компонентов газообразных продуктов реакции,
М - масштаб записи пика,
К - калибровочные коэффициенты.
Концентрации углеводородной смеси рассчитывались по формуле:
Ci=Si*Ki*100/(Si*Ki) (9)
где: Si- площади пиков компонентов углеводородной смеси,
Ki- количество молекул водорода в углеводороде.
Далее концентрация водорода в смеси углеводородов приравнивалась к СH 2 , полученной из уравнения (10) и соответственно пересчитывались концентрации всех углеводородов по пропорции:
CУ.В. (1) =CH 2 *CУ.В. / CH 2 У.В. (10)
где: CУ.В. (1) - концентрация углеводорода, приведенная к одинаковой концентрации водорода в составах газа, полученных по результатам разных анализов.
Полученные концентрации углеводородной и не углеводородной газовых смесей приводились к одному составу по уравнению:
Ci =Cri * 100 / ( ( Cr +( CУ.В. (1)- -( CH 2 У.В. + CCH 4 У.В. )) (11)
где: Cri - концентрация i-того компонента углеводородной или не углеводородной газовых смесей,
Сг - концентрации не углеводородной газовой смеси,
CH 2 У.В. , CCH 4 У.В концентрации водорода и метана в углеводородной газовой смеси.
Количество газа, полученное за время опыта, определялось исходя из известного количества аргона, подаваемого в реактор, и его концентрации в смеси газообразных продуктов реакции по уравнению:
Vr = (VAr /CAr )*100-VAr (12)
13.4 Методика определения удельной поверхности
Измерение удельной поверхности дисперсных пористых тел, в том числе катализаторов и сорбентов, является в настоящее время необходимым элементом научных исследований и средством контроля в соответствующих технологических процессах. Из многочисленных методов определения удельной поверхности твердых тел наиболее универсальными и широко используемыми являются методы газовой адсорбции [35].
Для определения удельной поверхности интересующих нас образцов в работе был использован метод низкотемпературной десорбции аргона. Анализ проводили на приборе ЛХМ-8МД при следующих условиях:
Ток моста катарометра92мА;
Скорость газа-носителя гелия с 10% об. Аргона 30 мл/мин.;
Температура образца катализатора - 195,8°С;
Эталон - -А12 О3 Sуд. = 160м2 /г.
Расчет удельной поверхности проводили методом сравнения площадей де-сорбционных пиков, пропорциональных поверхности образца и эталона в соответствии со следующим уравнением [35 ]:
Si уд =si *gоэт *Sэт уд (gi *sэт 0 )
где: Si- площадь десорбционного пика образца, мм ;
gi - навеска образца, г;
sэт 0 - площадь десорбционного пика эталона, мм ;
gоэт - навеска эталона, г;
Sэт уд - удельная поверхность эталона, м2 /г.
13.5 Методика приготовления катализаторов
В связи с широким применением катализаторов в промышленности основного органического синтеза производится большое количество катализаторов, различающихся как по химическому составу, так и по методу их приготовления.
Катализатор должен обладать рядом свойств, обеспечивающих рентабельность его использования, а именно:
- высокой активностью и селективностью;
- большой поверхностью активного компонента;
- достаточной устойчивостью к действию ядов и высоких температур;
- достаточной механической прочностью;
- оптимальными гидродинамическими характеристиками, которые обуславливаются размерами, формой и плотностью упаковки зерен катализатора [36].
К методам приготовления катализаторов предъявляется ряд требований; они
должны обеспечивать получение катализаторов, обладающих заданными химическим и физическим составами, высокой удельной поверхностью, а также быть малоотходными. Выбранный метод приготовления катализатора определяет степень дисперсности, пористую структуру и форму катализатора, а, следовательно, и его активность. В процессе данного исследования нами применялись катализаторы, приготовленные следующим способом:
Аморфный алюмофосфат в смеси с 10% SiO2 был получен путем осаждения из раствора азотнокислого алюминия и фосфорной кислоты аммиаком. Сначала брали определенное количество SiO2 и засыпали его в дистиллированную воду, затем добавляли нитрат алюминия, после этого к полученному раствору добавлялась 100% ортофосфорная кислота. Полученный раствор тщательно перемешивали в течение 30 мин. После чего проводилась нейтрализация полученного раствора путем постепенного добавления аммиачной воды при постоянном перемешивании. При достижении значения рН = 6 - 8 в растворе образовывался аморфный осадок, который отделяли от маточного раствора путем фильтрования и промывали дистиллированной водой. Полученную массу сушили в течении 6 ч. при Т = 110°С.
14. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В данной работе были исследованы каталитические системы на основе аморфного алюмофосфата с SiO2 в процессе дегидратации метанола до диметилового эфира.
Задачей данного исследования являлось приготовление серии образцов аморфного алюмофосфата, прокаленных при разной температуре, а также с разным содержанием SiO2 . Физико -химические характеристики, полученных образцов представлены в таблице.
Из результатов экспериментов, ранее проведенных на кафедре ТНХС и ИЖТ МИТХТ им. М.В. Ломоносова, а также на основе литературных данных [16, 71], было установлено, что оптимальными температурами для протекания процесса дегидратации метанола в присутствии различных каталитических систем является диапазон температур 250-350°С. Исходя из этого, были выбраны условия проведения эксперимента, а именно диапазон температур 200-350°С и объемной скорости 1ч' по исходному метанолу.
СПИСОК ЛИТЕРАТУРЫ
1.«Энергия» 2002, N 11. С. 42-44.
2. Бухаркин А.К., Лихтерова Н.М., Капкин В.Д. «Основы химии и технологии производства и применения транспортных энергоносителей». Москва, МИТХТ, 1997
3. John Bogild Hansen, Bodil Voss, Finn Joensen, Inga Dora Siguroardottir. «Large scale manufacture of dimethyl ether - a new alternative dieselfuel from natural gas», International Congress & Exposition, Detroit,Michigan, February 27 - March 2,1995. SACPaper 950063, 1995.
4. Караваев М.М., Леонов А. Л., Мастеров Б. П. «Промышленный синтез метанола». Москва, «Химия», 1974 г.
5. Караваев М.М. и др, «Технология синтетического метанола». Москва, «Химия», 1984 г.
6. Хенрице-Оливе Г., Оливе С., «Химия каталитическогогидрирования СО». Москва, «Мир», 1987
7. «Перспективные автомобильные топлива». Под редакцией
Черникова Я.Б., Москва, Транспорт, 1998 г.
8. Смаль Ф. В., Аксенов Е. Е., «Перспективные топлива для автомобилей». Москва, Транспорт, 1979 г.
9. Гайнуллин Ф. Г., «Природный газ как моторное топливо на транспорте». Москва, Транспорт, 1986 г
10. Simon A., Stumpf H., J. Chem. Soc. Faraday Trans. 1- 1981, V. 77, №9,P. 2209-2221.
11. Топчиева К.В., Кубасов А.А., Тыонг Ван Дао, «Дегидратацияметилового спирта на щелочных формах цеолитов X и Y», ВестникМГУ. Химия. 1972, т. 13, №6, стр. 628-632.
12. Хамагульгова Н.С., Хадишев С.Н., Кубасов А.А., «Закономерностиконверсии метанола в микрореакторе на цеолитах ультрасил»,Вестник МГУ. Химия. 1981, т. 22, №2, стр. 156-160.
13. Нефедов Б.К., Сергеева Н.С., «Влияние состава катализатора Rh -носитель и добавок различных веществ в зону реакции на карбонилирование метанола окисью углерода при атмосферном давлении», Известия АН СССР, серия Химия. 1976, №10, стр. 2271 -2276.
14. Соловьев А.А., Каденцев В.И., Чижов О.С., «Метиловык эфиры метилдезоксигексопиранозидов», Известия АН СССР, серия Химия. 1976, №11, стр. 2500-2505.
15. Герич А.П., Шмелев А.С., «Кинетика образования диметилового эфира на у-А12 О3 », «Метанол и его переработка», сборник трудов НИИТЭХИМ и ГосНИИ Метанолпроект, Москва, 1985, стр. 49 - 52.
16. Светляков Е.Б., Флид P.M., «Кинетика реакции дегидратации метанола и гидрохлорирования диметилового эфира на катализаторах парофазного синтеза хлористого метила», Журнал Физической химии. 1966, том XL., №12, стр. 3055 - 3059.
17. Физическая химия. Кинетика. 1974, Т. 3.
18. Якерсон В. И., Лафер Л. И., Рубинштейн А. М. «Термодесорбция спиртов и простых эфиров с поверхности окиси алюминия», Известия АН СССР, серия Химия. 1967, №1, стр. 200-201.
19. Нефедов Б.К., Мишин И.В., «Синтез диэтилового эфира в присутствии цеолитных катализаторов», Известия АН СССР, серия Химия. 1979, №1, стр. 196-199.
20. Tonner S. P., Christiansen J. A., Chem. Left. 1982, P. 1805 - 1808.
21. AC СССР С07С43/07, 841578, «Способ получения простых эфиров»,Виттарио Фатторе, Джовани Манара, Бруно Нотари, 1981.
22. Розовский А.Я. «Диметиловый эфир - топливо 21 века». Международная школа повышения квалификации. Инженерно - химическая наука для передовых технологий. Труды третьей сессии. Казань. Россия. 1997. Под редакцией Махлина В.Л.
23. «Доклад на совещании ИНХС РАН по новым топливно-энергетическим технологиям» 26.11.1997.
24. Розовский А.Я., Смирнова Т.Н. «Диметиловый эфир - экологически чистое моторное топливо для города Москва». Тезисы конференции «Актуальные проблемы нефтехимии». Москва, 2001 г.
25. 3RD InternationalPetroleumConference «PETROTECH-99», NewDeli,India, January 9-12, 1999
26. «TheChemicalJournal / Химический журнал» №1 сентябрь 2002г.
27. Нефтегазовая Вертикаль №9-2000
28. ЖУРНАЛ УГОЛЬ № 7-2002.
29. RastelliH., LokB. M., DuismanJ. A. etal. Can. J. Chem. Eng., 1982, v.60, p. 44
30. Семина О. В., Грязнова З. В., Нефедова А. Р. и др. «Физико-химическин и каталитические свойства алюмофосфатных цеолитов», Вестник МГУ, сер. Химия, 1987 г., т. 28, №4, С. 375-380.
31. Грязнова 3. В., Нефедова А.Р., Семина О. В., и др., «Каталитическое превращение метанола на алюмофосфатах цеолитного типа»,Журнал физической химии, 1987, том 61, №10, стр. 2624 -2629.
32. Гребенько Н.В., Ещенко Л.С., Печковский В.В. «Синтез и исследование пористых алюмфосфатов», Журнал неорг. химии,
1976,т. 21, с. 2660-2664.
33.Гребенько Н.В., Маргулец А. В., Печковский В.В., Ещенко Л.С. «Микропористые алюмофосфаты со свойствами цеолитов», Химия и химическая технология – 1987 г., вып.№1, С.27-33
34. Патент США, С07С27/00, 5753716(1998)
35. Танабе К., «Твердые кислоты и основания». Москва, «Мир», 1973.
36. Якерсон В. И., Голосман Е. 3., «Катализаторы и цементы». Москва,«Химия», 1992.
Похожие рефераты:
Автомобильные дизельные топлива
Модификация котельных топлив отходами спиртопроизводства
Программа для поступающих в вузы (ответы)
Сравнительный анализ: методы получения синтез-газа
Топливо в структуре энергетических ресурсов
Безотходные технологические процессы в химической промышленности на примере синтезе аммиака
Влияние качества топлива на работу двигателя внутреннего сгорания
Каталитическая конверсия метана водяным паром
Реализация хладоресурса углеводородных топлив в силовых и энергетических установках
Каталитический крекинг с кипящим слоем микросферического катализатора