| Скачать .docx |
Реферат: Нітроген і його сполуки
Міністерство освіти і науки України
Чернігівський національний педагогічний університет
імені Т.Г. Шевченка
Хіміко-біологічний факультет
Кафедра хімії
НІТРОГЕН ТА ЙОГО СПОЛУКИ
Курсова робота
Виконала:
студентка 2-го курсу
хіміко-біологічного факультету
групи № 21
Железняк Т. М.
Науковий керівник:
асистент кафедри хімії
Ходаченко О. М.
Чернігів – 2010
ЗМІСТ
ВСТУП …………………………………………………………………………….3
РОЗДІЛ 1. Загальна характеристика азоту …………………………………..4
1.1 Історія відкриття нітрогену………………………………………....4
1.2 Поширення нітрогену в природі…………………………………....5
1.3 Фізичні властивості нітрогену……………………………………...6
1.4 Шляхи одержання азоту…………………………………………….6
РОЗДІЛ 2. Хімічні властивості нітрогену …………………………………....7
2.1 Гідрогенвмісні сполуки азоту……………………………………....8
2.2 Оксигенвмісні сполуки азоту……………………………………...14
2.3 Сполуки з неметалами……………………………………………..20
2.4 Сполуки з металами………………………………………………..21
РОЗДІЛ 3. Методична частина ……………………………………………….22
3.1 Місце обраної теми в шкільному курсі хімії……………………..22
3.2 Плани-конспекти уроків…………………………………………...22
ВИСНОВОК ……………………………………………………………………..34
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ ……………………………….35
ДОДАТКИ ……………………………………………………………………….36
ВСТУП.
Область застосування азоту дуже велика – виробництво добрив, вибухових речовин, нашатирного спирту, який використовують у медицині. Азотні добрива є найбільш цінними. До таких добрив відноситься аміачна селітра, сечовина, аміак, натрієва селітра. Азот є невід'ємною частиною білкових молекул, тому він і необхідний рослинам для нормального росту та розвитку. Така важлива сполука азоту з воднем, як аміак, використовується в холодильних установках, аміак, циркулюючи по замкнутій системі труб, при своєму випаровуванні віднімає велику кількість теплоти. Калійна селітра йде на виробництво димного пороху, а порох використовують в мисливській зброї, для розвідки рудних копалин, що залягають під землею. Увесь димний порох отримують з піроксиліну – складного ефіру целюлози та азотної кислоти. Органічні вибухові речовини на основі азоту використовують для прокладання тунелів у горах (тротил, нітрогліцерин).
З огляду на дуже важливе значення азоту в природі та житті людини обрана мною тема є актуальною і займає значне місце в шкільному курсі хімії.
Метою даної роботи було визначення місця теми ²Азот² в шкільному курсі хімії та запропонувати сучасну розробку уроку з обраної теми.
Завданнями роботи є:
- використовуючи літературні джерела узагальнити та систематизувати відомості про нітроген та його сполуки;
- визначити місце теми ²Азот² в програмі курсу хімії для ЗОШ та для класів з поглибленим вивченням хімії;
- запропонувати розробку уроку з обраної теми в межах програми шкільного курсу хімії.
РОЗДІЛ 1. Загальна характеристика азоту.
1.1. Історія відкриття нітрогену.
Вперше азот був більш-менш вивчений Даніелем Резерфордом. Виконуючи завдання свого вчителя Д. Блека, який відкрив взаємодію двоокису вуглецю з вапняною водою, Д. Резерфорд дослідив, якої зміни зазнає повітря, після того, як в ньому жила і загинула жива істота. Відповідь на це питання свідчила: дихання тварин не тільки перетворює здорове повітря в «фіксоване повітря» (на двоокис вуглецю), але після того, як фіксується порція поглинена розчином їдкого калі, частина, що залишається, хоча і не викликає осаду з розчином гашеного вапна, гасить полум'я і губить життя. Така перша характеристика азоту, складається тільки з негативних ознак: азот протиставляється двоокису вуглецю, подібний з ним по негативних ознаках (обидва гази не підтримують горіння і дихання). Майже одночасно азот був ізольований і вивчений двома іншими видатними вченими Г. Кавендіш і К. Шеєле, обидва вони на відміну від Д. Резерфорда зрозуміли, що азот – це лише виділена з повітря, заздалегідь присутня в ньому, його складова частина. Особливо примітне повідомлення Г. Кавендіша, знайдене в його неопублікованих рукописах з позначкою: «надіслано Прістлі». «Я переводив звичайне повітря з однієї посудини через жар у іншу, потім через палаюче вугілля – до наступної посудини, поглинаючи щоразу утворене фіксоване повітря (вуглекислий газ) вапном. Виявилося, що питома вага отриманого газу лише трохи відрізняються від питомої ваги звичайного повітря: з обох газів азот дещо легше повітря. Він гасить полум'я і робить звичайне повітря нездатним порушувати горіння, так само як і фіксоване повітря (CO2 ), але в меншій мірі ». Залишалося тільки дати новому газу назву. Ніхто в ті часи не надавав такого значення номенклатурі, як А. Лавуазьє, і ніхто не зробив (вдруге) такої грубої номенклатурної помилки, як присвоєння азоту його імені «мертвий». Це найменування все ж закріпилося за азотом у французькій і російській літературі, в англосаксонських країнах вважали за краще для азоту назву Nitrogen - «що породжує селітру», німці ж дали азоту назву Stickstoff - «задушлива матерія» [1].
1.2. Поширення нітрогену в природі.
Серед всіх елементів, що утворюють земну кулю, один азот (якщо не вважати інертних газів) ніби уникає утворювати хімічні сполуки і входить до складу земної кулі переважно у вільному вигляді. А так як азот у вільному стані – газ, основна його маса зосереджена в газовій оболонці тієї складної хімічної системи, яка представляє собою земну кулю, – в його атмосфері. Вміст азоту в земній корі у вигляді сполук становить 0,01 масової частки, %. Атмосфера більш ніж на 75 масових часток, % складається з газоподібного азоту, що дорівнює ~ 4*1015 т. Зв'язаний азот утворює мінерали у формі нітратів: чилійська NaNO3 , індійська KNO3 і норвезька Ca(NO3 ) 2 селітри. Азот у формі складних органічних похідних входить до складу білків, у зв'язаному вигляді міститься в нафті (до 1,5 масової частки, %), кам'яному вугіллі (до 2,5 масової частки, %).
Молекула N2 є найбільш стійкою формою його існування, чим обумовлена так звана проблема зв'язаного азоту. Поглинання зв'язаного азоту рослинами і тваринами призводить до збіднення навколишнього середовища сполуками азоту. Цей дефіцит повинен компенсуватися штучним шляхом, оскільки природне поповнення запасів зв'язаного азоту (грози, діяльність азотобактерій і т. п.) не компенсує його втрати. Виключне значення у вирішенні проблеми зв'язаного азоту мають дві реакції: синтез аміаку і його каталітичне окислення [2].
1.3. Фізичні властивості нітрогену.
Азот – газ без кольору і запаху. Точка кипіння рідкого азоту -195,8°С, точка плавлення твердого азоту -210,5 °С. Твердий азот виходить у вигляді порошку і у вигляді льоду. Азот погано розчинний у воді і органічних розчинниках. В 1 л води при 0°С розчиняється лише 23,6 см3 азоту. 1 л азоту при нормальних умовах важить 1,2505 г [1].
1.4. Шляхи одержання азоту.
У техніці азот отримують фракційною перегонкою рідкого повітря. При цьому в першу чергу відганяються найбільш летючі речовини – азот і благородні гази. Останні не заважають у разі застосування азоту для створення інертного середовища в хімічних і інших виробництвах. Від домішків кисню (кілька відсотків) азот звільняють хімічно, пропускаючи його через систему з нагрітою міддю. При цьому практично весь кисень зв'язується в CuO.
У лабораторії азот одержують нагріванням суміші міцних розчинів хлориду амонію і нітриту натрію:
NH4 Cl + NaNO2 = N2 + 2H2 O + NaCl;
або розкладанням нітриту амонію при нагріванні:
NH4 NO2 = N2 + 2H2 O.
Найбільш чистий азот виходить при термічному розкладі азидів металів, наприклад:
2NaN3 = 2Na + 3N2 [3].
РОЗДІЛ 2. Хімічні властивості нітрогену.
Азот перебуває у верхньому правому куті періодичної системи, в якому зосереджені неметали з найбільшою спорідненістю до електрона. Тому він повинен бути мало схильним виступати як електропозитивний елемент, а як елемент електронегативний повинен поступатися в хімічній активності тільки деяким неметалам, в першу чергу правіше стоячим від нього кисню і фтору.
У атома азоту на один електрон більше, ніж у атома вуглецю; згідно з правилом Гунда, цей електрон займає останню вакантну 2р-орбіталь. Атом азоту в збудженому стані характеризується трьома виродженими 2р-електронами при наявності двох спарених електронів на 2s-орбіталі. Три неспарених електрона на 2р-орбіталі, перш за все, відповідальні за триковалентність азоту. Саме тому характерною летючою водневою сполукою є аміак, в якому атом азоту утворює три ковалентні зв'язки за обмінним механізмом з трьома атомами водню. У азоту немає можливості переходу електронів в збуджений стан, так як найближчі орбіталі при n = 3 занадто високі по енергії. Тому максимальна валентність азоту дорівнює чотирьом. При цьому три ковалентні зв'язки можуть бути утворені за обмінним механізмом, а один – за донорно-акцепторним. Проте азот в стані N+ може утворювати всі чотири зв'язки за обмінним механізмом. Азот виявляє велику різноманітність ступенів окислення: -3, -2, -1, 0, 1, 2, 3, 4 і 5. Найчастіше зустрічаються похідні від ступенів окислення -3, 5 і 3 (NH3 , HNO3 і NaNO2 ).
Тим часом хімічна характеристика азоту, як і історично перші повідомлення про нього, завжди починається не з позитивних ознак, а з негативних: з підкреслення його хімічної інертності. Перша причина хімічної інертності азоту за звичайних умов – особливо міцне зчеплення його атомів в молекулі N2 .
N2 = 2N - 711 кДж.
При кімнатній температурі азот взаємодіє тільки з літієм, з утворенням нітриду літію: N2 + 6Li = 2Li3 N, з іншими металами азот взаємодіє при нагріванні: N2 + 3Ca = Ca3 N2 . У реакціях взаємодії азоту з металами, азот проявляє окислювальні властивості, також окислювальні властивості він проявляє при взаємодії з воднем (при нагріванні, підвищеному тиску і в присутності каталізатора):N2 + 3H2 = 2NH3 . Азот також взаємодіє і з іншими неметалами, виявляючи при цьому відновні властивості:
N2 + O2 = 2NO, N2 + 3F2 =2NF3 .
Існують і інші сполуки азоту з електронегативними елементами, але вони є нестійкими, і багато з них, особливо хлористий азот і йодистий азот, вибухові [4].
2.1. Гідрогенвмісні сполуки азоту.
Летючою характерною сполукою азоту є аміак. За значущістю в неорганічній хімічній індустрії та неорганічній хімії аміак – найважливіша воднева сполука азоту. За своєю хімічною природою він представляє нітрид водню H3 N. У хімічній будові аміаку sp3 -гібридні орбіталі атома азоту утворюють три зв'язки з трьома атомами водню, які займають три вершини трохи спотвореного тетраедра. Четверта вершина тетраедра зайнята неподіленою електронною парою азоту, що забезпечує хімічну ненасиченість і реакційну здатність молекул аміаку. За звичайних умов аміак – безбарвний газ з різким запахом. Він токсичний: подразнює слизові оболонки, а гостре отруєння викликає ураження очей і запалення легенів. При охолодженні до -33 °С аміак зріджується, а при -78 °С твердне. У рідкому і твердому аміаку між молекулами діють водневі зв'язки, внаслідок чого аміак має низку екстремальних властивостей в порівнянні з іншими водневими сполуками елементів п'ятої групи головної підгрупи. Внаслідок полярності молекул і досить високою діелектричної проникності рідкий аміак є гарним неводним розчинником. У рідкому аміаку добре розчиняються лужні і лужно-земельні метали, сірка, фосфор, йод, багато солей і кислот. Речовини з функціональними полярними групами в рідкому аміаку піддаються електролітичній дисоціації [3].
За розчинністю у воді аміак перевершує будь-який інший газ: при 0 °С 1 об'єм води поглинає 1200 об¢ємів газоподібного аміаку. Прекрасна розчинність аміаку у воді обумовлена виникненням міжмолекулярних водневих зв'язків. При цьому можливі два механізми виникнення водневих зв'язків між молекулами аміаку і води.
Оскільки донорна здатність молекул аміаку виражена сильніше, ніж у води, а зв'язок О-Н більш полярний в порівнянні з полярністю зв'язку N-Н в аміаку, міжмолекулярний водневий зв'язок утворюється за першим механізмом. Фізико-хімічні процеси у водному розчині аміаку можна представити таким чином.
Виникнення гідроксид - іонів створює лужну реакцію розчину аміаку у воді. Константа іонізації невелика (рК 5). В умовах низьких температур з водних розчинів аміаку можна виділити кристалогідрати NH3 ·Н2 О (tпл = -77 °С), 2NН3 ·Н2 О (tпл = -78 °С) і NН3 ·2Н2 О (tпл = -97 °С).Кристалогідрати складаються з ланцюжків молекул аміаку і води, зшитих водневими зв'язками в тривимірну сітку, в яких відсутні структурні мотиви NН4 ОН. Це означає, що так званий гідроксид амонію не існує як хімічний індивід, так як і немає гідроксиду оксонія ОН3 ОН і гідроксиду фторонія FН2 ОН. Таким чином, водні розчини аміаку володіють основними властивостями не за рахунок утворення уявної сполуки NН4 ОН, а внаслідок виключно вираженої донорної активності атома азоту в NН3 [5].
Рівновагу у водному розчині аміаку можна змістити вправо додаванням кислоти. При цьому в розчині утворюються солі амонію. Вони виходять також при безпосередній взаємодії газоподібних речовин:
NН3 + НСl = NН4 Сl .
Сам іон амонію і більшість його солей безбарвні. В твердому стані солі амонію утворюють структури, характерні для речовин із значною часткою іонної складової зв'язку. Тому вони добре розчиняються у воді, майже сповна піддаються електролітичній іонізації. Структура іона NН4 + – тетраедрична, в якій всі вершини тетраедра зайняті атомами водню, а азот знаходиться в його центрі. Позитивний заряд рівномірно розподілений між усіма атомами водню. За властивостями солі амонію схожі на солі калію внаслідок близькості іонних радіусів NН4 + (0,142 нм) і К+ (0,133 нм). Істотна різниця полягає лише в тому, що солі калію, утворені сильними кислотами, не схильні до гідролізу, а солі амонію у водних розчинах гідролізують внаслідок слабко виражених основних властивостей аміаку [1].
Солі амонію відрізняються невисокою термічною стійкістю. Природа кінцевих продуктів термічного розкладу солей амонію в основному визначається властивостями аніону. Якщо аніон походить від кислоти – окисника, то має місце окислення аміачного азоту, наприклад:
NН4 NО3 = N2 О + 2Н2 О.
У цій реакції аміачний азот віддає 4 електрона нітратному азоту, а тому останній виступає як окисник. З іншого боку, ця реакція являє собою приклад внутрішньомолекулярного диспропорціювання. Для амонійних солей від кислот, що не є окисниками, при їх термічному розкладі виділяється аміак і кислота: (NН4 )3 РО4 = 3NН3 + Н3 РО4 .
При обробці солей амонію лугами виділяється аміак:
2NН4 Сl + Са(ОН)2 = 2NН3 + СаСl2 + 2Н2 О.
Ця реакція може слугувати простим способом отримання аміаку в лабораторії. У промисловості аміак отримують прямим синтезом з компонентів – простих речовин.
На повітрі аміак не горить, але в атмосфері кисню він окислюється до вільного азоту:
4NН3 + 3О2 = 2N2 + 6Н2 О.
При каталітичному окисленні реакція йде інакше:
4NН3 + 5О2 = 4NО + 6Н2 О.
Аміак виступає як відновник і в реакціях з іншими окисниками. Рідше аміак виступає як окисник, наприклад:
Nа + NН3 = NаNН2 + 1/2Н2 .
У цій реакції металічний натрій витісняє водень з рідкого аміаку. При цьому водень аміаку знижує свій ступінь окислення, і аміак грає роль окисника. З іншого боку, подібні реакції ілюструються проявом аміаком кислотних властивостей. Аміди металів, наприклад NаNН2 , є солями аміаку, що відповідають його кислотній функції. Цілком очевидно, що кислотна природа у аміаку виражена значно слабше, ніж у Н2 О і НF. Константа кислотної іонізації мізерно мала (рКа =35), а тому солі аміаку, як кислоти, у воді повністю гідролізуються:
NaNH2 + H2 O = NaOH + NH3 [2].
Кислотній функції аміаку відповідають не тільки аміди, а й іміди і нітриди металів. Якщо в амідах заміщений один атом водню (NаNН2 ), в імідах - два (Li2 NН), то в нітриду - всі три (AlN).
При обережному окисленні аміаку м'яким окисником, наприклад гіпохлоридом натрію, отримують іншу водневу сполуку аміаку – гідразин або диамід:
2NН3 + NаОСl = N2 Н4 + NаСl + Н2 О.
Диамід являє собою безбарвну, токсичну рідину, яка легко випаровується з високою діелектричною проникністю (Е = 52 при 25 °С)
За хімічними властивостями гідразин багато в чому схожий на аміак. У водних розчинах гідразину також виникають водневі зв'язки, як і у випадку з аміаком. При взаємодії гідразину з 1 молекулою води за участю водневого зв'язку утворюється катіон [N2 Н5 ]+ , а з двома – [N2 Н6 ]2+ .
Існування гідроксидів цих катіонів як індивідуальних речовин не встановлено, тим не менше, відомі два типи солей гідразину, наприклад N2 Н5 Сl і N2 Н6 Сl2 .
При відновленні розчину азотної кислоти атомарним воднем виходить гідроксиламін:
НNО3 + 6Н = NН2 ОН + 2Н2 О.
Гідроксиламін – безбарвні кристали (tпл = 33 °С), термічно нестійкі, вище 100 °С вибухають. Водні розчини гідроксиламіна більш стійкі. У розчині також виникають міжмолекулярні водневі зв'язки, і встановлюється динамічна рівновага [4].
Однак основна функція гідроксиламіна виражена ще слабше (рКb = 8), ніж у аміаку і гідразину. З кислотами гідроксиламін дає солі гідроксиламонія. Найбільш відомим препаратом є хлорид гідроксиламонія [NН3 ОН] Сl. Розчини солей гідроксиламонія більш стійкі, ніж тверді речовини, і мають кислу реакцію внаслідок гідролізу.
Оскільки атом азоту в гідроксиламіні має ступінь окислення -1, він може функціонувати і як окисник, і як відновник. Але для нього характерні відновні властивості, особливо в лужному середовищі.
Серед водневих сполук азоту найменший негативний ступінь окислення азоту представлений в азиді водню НN3 . У цій сполуці ступінь окислення азоту дорівнює -1/3. Надзвичайний ступінь окислення обумовлений структурною нерівноцінністю атомів азоту в цій речовині.
Водний розчин НN3 називається азотистоводневою кислотою. Її отримують окисненням гідразину азотистою кислотою:
N2 Н4 + НNО2 = НN3 + 2Н2 О.
За силою вона наближається до оцтової. У розведених розчинах азотистоводнева кислота повільно диспропорціонує:
НN3 + Н2 О = N2 + NН2 ОН.
У безводному стані вона може вибухнути не лише при нагріванні, а й від струшування:
2НN3 = 3N2 + H2 .
Суміш азотистоводневої і концентрованої соляної кислот здатна розчиняти навіть благородні метали. Солі азотистоводневої кислоти – азиди – по розчинності у воді схожі на нітрати. Так, азиди лужних металів добре розчиняються у воді, аАg N3 , Рb(N3 )2 і Нg(N3 )2 – погано. Азиди лужних та лужноземельних металів при повільному нагріванні стійкі аж до плавлення. Азиди важких металів легко вибухають при ударі: Рb(N3 )2 = Рb + 3N2 [3].
2.2. Оксигенвмісні сполуки азоту.
З киснем азот утворює ряд оксидів: N2 О і NО – безбарвні гази, N2 О3 –блакитна тверда речовина (нижче -100 °С), NО2 - бурий газ, N2 О4 – безбарвний газ, N2 О5 - безбарвні кристали.
Оксид N2 О (закис азоту, "звеселяючий газ", оскільки він володіє наркотичною дією) отримують термічним розкладом нітрату амонію або гідроксил амонію:
[НN3 ОН]NО2 = N2 О + 2Н2 О
(внутрішньомолекулярне диспропорціювання).
Оксид азоту (+1) – ендотермічна сполука. Однак при кімнатній температурі хімічно мало активний. При нагріванні його реакційна здатність сильно зростає. Він окислює водень, метали, фосфор, сірку, вугілля, органічні та інші речовини, наприклад:
Сu + N2 О = N2 + СuО.
При нагріванні N2 О вище 700 °С одночасно з реакцією розкладання протікає його диспропорціонування:
2N2 О = 2N2 + О2 ;2N2 О = 2NО + N2 .
З водою оксид азоту (+1) не взаємодіє, хоча відома кислота Н2 N2 О2 , в якій азот теж має ступінь окислення +1. Ця кислота називається азотноватистою, і їй приписується структура з двома рівноцінними атомами азоту.
Вільну азотноватисту кислоту можна отримати наступним чином:
NН2 ОН + НNО2 = Н2 N2 О2 + Н2 О.
Вона добре розчиняється у воді, але кислота слабка. Азотноватиста кислота дуже нестійка, при незначному нагріванні вибухає:
Н2 N2 О2 = N2 О + Н2 О.
Солі Н2 N2 О2 – гіпонітрити і гідрогіпонітрити – у воді значною мірою схильні до гідролізу. Більшість гіпонітритів мало розчинні у воді, набагато краще розчиняються гідрогіпонітрити [5].
Парні ступені окислення для азоту порівняно мало характерні. До числа таких сполук відноситься оксид азоту (+2). Молекула NО містить непарне число електронів і, по суті, представляє володіючий малою активністю радикал. У молекулі один ковалентний по донорно-акцепторному механізму та два π-зв'язки. Незважаючи на ендотермічність і позитивну величину енергії Гіббса утворюється NО з простих речовин, оксид азоту (+2) не розпадається на окремі елементи. Справа в тому, що, згідно з ММО, порядок зв'язку в NО досить високий і дорівнює 2,5. Молекула NО міцніша за молекулу О2 , так як у першої на розпушування МО π2р * всього один електрон, а у другої – два електрони.
У лабораторії оксид азоту (+2) найчастіше отримують дією розведеної азотної кислоти на мідні стружки:
3Сu + 8НNО3(розв.) = 3Сu(NО3 )2 + 2NО + 4Н2 О.
На повітрі оксид азоту (+2) миттєво окислюється:
2NО + О2 = 2NО2 .
Окислюється NО і галогенами (Hal), утворюючи нітрозилгалогеніди:
2NО + Hal2 = 2NОHal.
При взаємодії з відновниками NО відновлюється до N2 О, N2 , NН2 ОН, NН3 залежно від відновної здатності партнера і умов проведення процесів.
Водний розчин оксиду азоту (+2) нейтральний. Ніяких сполук з водою він не утворює, хоча відомі солі (гіпонітрати) не виділеної у вільному стані азотноватої кислоти Н2 N2 О3 , в якій азот також має ступінь окислення +2 [4].
Оксид азотуN2 О3 існує в твердому стані (нижче -100 °С). У рідкому і пароподібному станах оксид азоту (+3) в значній мірі дисоціює за рахунок диспропорціонування:
N2 О3 ↔ NО + NО2 .
Отримують N2 О3 охолодженням еквімолярних кількостей NО і NО2 . А рівномірний потік суміші потрібного складу виходить при взаємодії 50%-вої НNО3 з оксидом арсенікуму (+3):
2НNО3 + Аs2 О3 = 2НАsО3 + NО + NО2 .
Оксиду азоту (+3) відповідає відома лише у розчині нестійка азотиста кислота НNО2 . Отримати її можна розчиненням у воді рівних обсягів NО і NО2 :
NО + NО2 + Н2 О = 2НNО2 .
При зберіганні та нагріванні НNО2 диспропорціонує:
3НNО2 = НNО3 + 2NО + Н2 О.
Найбільш характерні для неї окислювальні властивості:
НNО2 + 2НI = I2 + 2NО + 2Н2 О.
Однак сильні окисники переводять азотисту кислоту в азотну:
5НNО2 + 2КМnО4 + 3Н2 SО4 = К2 SО4 + 2МnSО4 + 5НNО3 + 3Н2 О.
Оксид азоту (+4) отримують розчиненням міді в концентрованій азотній кислоті: Сu + 4НNО3 = Сu(NО3 )2 + 2NО2 + 2Н2 О.
Він є гарним окисником, в ньому горять фосфор, сірка, вугілля і деякі органічні речовини. Вище 150 °С діоксид азоту починає розкладатися:
2NО2 = 2NО + О2 .
Оскільки молекула діоксиду азоту з неспареним електроном, по суті, представляє собою радикал, вона легко димеризується:
2NО2 ↔ N2 О4 .
Димер безбарвний і діамагнітний на відміну від пофарбованого в червоно-бурий колір і парамагнітний [3].
Діоксид азоту при взаємодії з водою диспропорціонує:
2NО2 + Н2 О = НNО2 + НNО3 .
При розчиненні NО2 в гарячій воді виходить азотна кислота, бо спочатку утворена азотиста кислота диспропорціонує з виділенням оксиду азоту (+2) та утворенням азотної кислоти.
Оксид азоту (+5) має молекулярну структуру тільки в газовій фазі. В твердому стані N2 О5 має структуру, утворену іонами NО2 + і NО3 ˉ . N2 О5 – кристали, які легко перегоняються, причому випаровуються молекули. Таким чином, при сублімації оксиду азоту (+5) іони NО2 + і NО3 ˉ об'єднуються в молекули N2 О5 . Отримують оксид азоту (+5) дегідратацією азотної кислоти з допомогою Р2 О5 або окисленням NО2 озоном:
2НNО3 + Р2 О5 = 2НРО3 + N2 О5 ;
6NО2 + О3 = 3N2 О5
Оксид азоту (+5) є енергійним окисником, багато реакцій з його участю протікають досить бурхливо. При розчинення у воді дає азотну кислоту:
N2 О5 + Н2 О = 2НNО3 .
Азотна кислота – одна з найсильніших кислот. Безводна азотна кислота являє собою безбарвну летючу рідину. При зберіганні (особливо на світлі) і при нагріванні частково розкладається:
4НNО3 = 4NО2 + 2Н2 О + О2 .
Так звана "димляча" азотна кислота (червоного кольору) являє собою розчин виділяючого діоксиду азоту в концентрованій НNО3 .
У лабораторії НNО3 одержують нагріванням нітрату натрію з сірчаною кислотою:
NaNО3 + Н2 SО4 = НNО3 + NaНSО4 .
У промисловості азотну кислоту одержують з аміаку. Спочатку аміак каталітично окислюють до оксиду азоту (+2), який далі окислюється до NО2 . Потім оксид азоту (+4) розчиняють в гарячій воді і отримують азотну кислоту [1].
Азотна кислота є сильним окисником і окислює майже всі метали і неметали. Останні, як правило, переводяться нею в похідні вищого ступеня окиснення, наприклад:
S + 6НNО3 = Н2 SО4 + 6NО2 + 2Н2 О.
З металів тільки золото, платина, осмій, іридій, ніобій, тантал та вольфрам стійкі до дії азотної кислоти. Деякі метали (наприклад, залізо, алюміній, хром) пасивуються концентрованою азотною кислотою. Окисними властивостями володіють і водні розчини азотної кислоти. Зазвичай процес відновлення НNО3 протікає в декількох паралельних напрямах, і в результаті виходить суміш різних продуктів відновлення. Природа цих продуктів, їх відносний вміст в суміші залежать від сили відновника, концентрації азотної кислоти і температури.
Концентрована азотна кислота (60% та більше) реагує з металами з утворенням оксиду нітрогену (ІV):
Pb + 4HNO3( конц .) ® Pb(NO3 )2 + 2 NO2 + 2H2 O.
При реакції розчиненої (20-30%) азотної кислоти з металами утворюється оксид нітрогену (ІІ) або оксид нітрогену (І):
3Cu + 8HNO3( розв .) ® 3Cu(NO3 )2 + 2NO + 4H2 O.
4Mg + 10HNO3( розв. ) ® 4Mg(NO3 )2 + N2 O + 5H2 O.
При реакціях дуже розведеної (менше 10%) азотної кислоти з металами утворюється нітрат амонію:
4Zn + 10HNO3( сильно розв. ) ® 4Zn(NO3 )2 + NH4 NO3 + 3H2 O.
Більш сильним окисником є суміш концентрованих азотної і соляної кислот – "царська горілка". Вона розчиняє навіть золото і платину, які не розчиняються в азотній, а тим більше в соляній кислоті. Її окисна активність зумовлена зниженням редокс-потенціалу розчиняючих металів, тобто посиленням їх відновних властивостей за рахунок утворення міцних хлоридних комплексів:
Аu + НNО3 + 4НСl = Н[АuСl4 ] + NО + 2Н2 О.
Солі азотної кислоти – нітрати – відомі майже для всіх металів. Більшість з них безбарвні і добре розчиняються у воді. У кислих водних розчинах нітрати є слабшими окисниками, ніж азотна кислота, а у нейтральному середовищі взагалі не мають окисних властивостей. Сильними окисниками вони є в розплавах, коли відбувається розкладання з виділенням кисню. Оксид азоту (+5) при взаємодії з 100%-вим пероксидом водню утворює пероксоазотну (надазотну) кислоту:
N2 О5 + 2Н2 О2 = 2НNО4 + Н2 О.
Пероксоазотна кислота нестійка, легко вибухає, водою повністю гідролізує:
 + Н2
О = Н2
О2
+ НNО3
[2].
+ Н2
О = Н2
О2
+ НNО3
[2].
2.3. Сполуки з неметалами.
Відомі всі галогеніди азоту NHal3 . Трифторид NF3 отримують взаємодією фтору з аміаком:
3F2 + 4NН3 = 3NН4 F + NF3 .
Трифторид азоту – безбарвний токсичний газ, молекули якого володіють пірамідальною будовою. У основи піраміди дислоковані атоми фтору, а вершина зайнята атомом азоту з неподіленою електронною парою. До різних хімічних реагентів і до нагрівання NF3 досить стійкий.
Решта тригалогенідів азоту ендотермічні, а тому нестійкі і реакційно здатні. NCl3 утворюється при пропусканні газоподібного хлору в міцний розчин хлориду амонію:
3Cl2 + NН4 Сl = 4НСl + NCl3 .
Трихлорид азоту є легколетючою (tкип = 71°С) рідиною з різким запахом. Невеликий нагрів або удар супроводжується вибухом з виділенням великої кількості теплоти. При цьому NCl3 розпадається на окремі елементи. Тригалогеніди NBr3 і NI3 ще менш стабільні.
Похідні азоту з халькогенами дуже нестійкі внаслідок їх сильної ендотермічності. Всі вони погано вивчені, при нагріванні і ударі вибухають [3].
2.4. Сполуки з металами.
Слеутворюючі нітриди отримують прямим синтезом з металів і азоту. Водою і розведеними кислотами солеутворюючі нітриди розкладаються:
Мg3 N2 + 6N2 = 3Мg(ОН)2 + 2NH3 ;
Са3 N2 + 8НСl = 3СаСl2 + 2NH4 Сl.
Обидві реакції доводять основну природу нітридів активних металів.
Металоподібні нітриди одержують нагріванням металів в атмосфері азоту або аміаку. У якості вихідних речовин можуть застосовуватися оксиди, нітрати і гідриди перехідних металів:
2Та + N2 = 2ТаN;
Мn2 О3 + 2NH3 = 2МnN + 3Н2 О;
СrCl3 + NH3 = СrN + 3НСl;
2ТiН2 + 2NH3 = 2ТiN +5Н2 [2].
РОЗДІЛ 3. Методична частина.
3.1. Місце обраної теми в шкільному курсі хімії.
Оскільки нітроген відіграє важливе значення в природі та житті людини, тому дана тема є актуальною і займає значне місце в шкільному курсі хімії.
Отже, тема, що стосується нітрогену, вивчається в 10 класі на протязі 10 годин при вивченні загальних відомостей про неметали та їх сполуки. А класи з поглибленим вивченням хімії, розглядають дану тему на протязі 34 годин.
При вивченні теми і для кращого її засвоєння проводять семінарські заняття, демонстрації, лабораторні досліди та практичні роботи.
У школі вивчаються хімічні та фізичні властивості нітрогену та його сполук, методи добування та застосування сполук нітрогену. А оскільки нітроген та його сполуки є досить важливими, то і сфери його застосування різноманітні.
3.2. Плани-конспекти уроків.
Тема Аміак: будова молекули, одержання в лабораторії. Фізичні властивості. Хімічні властивості. Застосування.
Мета Розглянути особливості будови молекули аміаку, фізичні властивості аміаку, лабораторний спосіб його одержання; дослідити розчинність аміаку у воді і дію розчину на індикатори; навчитися визначати іон амонію в розчині; розкрити особливості взаємодії аміаку з водою і кислотами, роль аміаку в народному господарстві; дати уявлення про донорно-акцепторний механізм утворення ковалентного зв’язку на прикладі утворення іона амонію.
Обладнання Нашатирний спирт, розчин фенолфталеїну, амоній хлорид,
й матеріали кальцій гідроксид, кристалізатор з водню, газовідвідна
трубка, нагрівальний прилад.
Базові поняття Аміачна вода, амоній гідроксид, лужне середовище, іон
й терміни амонію, соліамонію.
Тип уроку Комбінований.
Структура уроку
І. Організаційний етап……………………………………..……………………………………2 хв.
ІІ. Перевірка домашнього завдання…………………………………………………………………….5 хв.
ІІІ. Актуалізація опорних знань……………………………………………………………………… 7 – 8 хв.
IV. Вивчення нового матеріалу………………………………………………………………20 – 22 хв.
1. Фізичні властивості аміаку.
2. Біологічна дія аміаку.
3. Будова молекули аміаку.
4. Хімічні властивості аміаку. Одержання аміаку.
5. Застосування аміаку.
V. Закріплення й узагальнення знань………………………………………5 хв.
VI. Домашнє завдання……………………………….……………………2 – 3 хв.
VII. Підбиття підсумків уроку……………………………………………1 – 2 хв.
ХІД УРОКУ
І. ОРГАНІЗАЦІЙНИЙ ЕТАП
ІІ. ПЕРЕВІРКА ДОМАШНЬОГО ЗАВДАННЯ
ІІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Бесіда.
1) Де в неживій природі зустрічаються азот і фосфор як прості речовини? До складу яких складних неорганічних речовин вони входять?
2) Яку роль відіграють сполуки Нітрогену і Фосфору в живій природі? Назвіть органічні сполуки, до складу яких входять ці елементи.
3) Які фізичні властивості азоту ви знаєте?
4) Назвіть алотропні модифікації Фосфору. Якими властивостями вони характеризуються?
5) Яка будова зовнішнього енергетичного рівня атомів Нітрогену і Фосфору? Складіть електронно-графічні формули атомів Нітрогену і Фосфору.
6) Напишіть структурну формулу молекули азоту. Дайте характеристику зв’язків у ній.
7) З якими речовинами взаємодіє азот?
8) Напишіть рівняння реакцій взаємодії азоту з літієм, кальцієм, киснем, воднем. Назвіть одержані речовини. За яких умов проходять зазначені реакції?
IV. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. ФІЗИЧНІ ВЛАСТИВОСТІ АМІАКУ.
Бесіда.
1) Що ви знаєте про аміак?
2) Чому нашатирний спирт має запах аміаку?
Розповідь учителя.
Аміак – це безбарвний газ з характерним різким запахом. Порівняємо середню молярну масу повітря (29 г/моль) з молярною масою аміаку (17 г/моль). Густина аміаку за повітрям: 17/29=0,59, тобто аміак майже вдвічі легший за повітря.
Запитання.
Як необхідно тримати пробірку для збору аміаку: догори чи вниз дном?
Розповідь учителя.
Про збільшенні тиску або при охолодженні аміак легко скраплюється в безбарвну рідину H2 PO4 . Аміак дуже добре розчиняється у воді (при NH3 в одному об’ємі води розчиняється до 700 об’ємів аміаку, а при
2NO2 + 2KOH= KNO3 + KNO2 + H2 O розчиняється 1200 об’ємів).
Запитання.
Чому при зниженні температури розчинність аміаку збільшується?
2. БІОЛОГІЧНА ДІЯ АМІАКУ.
Розповідь учителя.
Аміак – основний продукт природного гниття органічних залишків. Незначний вміст аміаку в атмосферному повітрі (0,5% за об’ємом) призводить до подразнення слизових оболонок. При великому вмісті його в повітрі спостерігається ураження очей і дихальних шляхів, задишка і запалення легень. Гранично допустима концентрація аміаку у повітрі – 2Si+2N2 =Si2 N4 .
Засоби першої допомоги при отруєнні аміаком: свіже повітря, промивання очей великою кількістю води, вдихання водяної пари.
3. БУДОВА МОЛЕКУЛИ АМІАКУ.
Розповідь учителя.
Фізичні і хімічні властивості аміаку визначаються будовою його молекули. Електронна формула молекули аміаку:
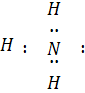
Видно, що з чотирьох електронних пар при Нітрогені три зв'язуючі й одна неподільна, а молекула аміаку має форму піраміди.
Хімічний зв'язок N—H полярний: позитивний заряд зосереджений на атомі Гідрогену, негативний – на атомі Нітрогену. Внаслідок цього між молекулами аміаку утворюються водневі зв’язки:
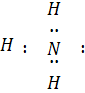
 водневий зв
¢
язок
водневий зв
¢
язок
Існуванням водневих зв’язків між молекулами NH3 пояснюються порівняно високі температури кипіння і плавлення аміаку, а також те, що він легко скраплюється і добре розчиняється у воді.
4. ХІМІЧНІ ВЛАСТИВОСТІ АМІАКУ. ОДЕРЖАННЯ АМІАКУ.
Розповідь учителя.
Нітроген в аміаку має найменший ступінь окиснення і тому виявляє тільки відновні властивості.
Окиснення аміаку. Аміак горить в атмосфері чистого кисню або в попередньо підігрітому повітрі:
4NH3 + 3O2 = 2N2 + 6H2 O
У цій реакції утворюється азот, тому що температура недостатня для взаємодії азоту з киснем. Суміші аміаку з повітрям в інтервалі від 15,5 до 27,5% за об’ємом NH3 вибухонебезпечні. У присутності каталізатора (пропущення над розпеченою платиною) аміак може окислюватися до нітроген (ІІ) оксиду:
4NH3 + 5O2 = 4NO + 6H2 O
Взаємодія з водою. Аміак взаємодіє з водою оборотньо:
![]()
Наявність відносно невеликої кількості іонів ОН- зумовлює лужне середовище розчину аміаку. Одержаний розчин називається нашатирним спиртом, або аміачною водою.
Демонстрація.
Одержання аміаку в лабораторних умовах і розчинення його у воді.
Опис експерименту наведено в підручнику [1, с. 48 - 50]. Одержати аміак можна, нагріваючи суміш кристалічних хлорид амонію і кальцій гідроксиду. Учні записують відповідне рівняння реакції.
Розповідь учителя.
Учитель звертає увагу учнів, що іониNH4 + існуютьтільки в розчині і виділити амоній гідроксид NH4 OH як самостійну сполуку неможливо. Тому в реакціях, у яких утворюється амоній гідроксид, необхідно писати не NH4 OH, а NH3 +H2 O. Приєднання водню до аміаку з утворенням іона амонію NH4 + відбувається за донорно-акцепторним механізмом [1, §11, с. 48 - 59]. Ступінь окиснення Нітрогену в іоні амонію (-3).
Аміак реагує з кислотами з утворенням солей амонію:
NНO3 + NH3 = NH4 NO3 – амоній нітрат.
Аміак – відновник. Він відновлює малоактивні метали з їх оксидів:
3CuO + 2NH3 = 3Cu + N2 + 3H2 O
5. ЗАСТОСУВАННЯ АМІАКУ.
Розповідь учителя.
Аміак у великій кількості витрачається для одержання нітратної кислоти, нітрогеновмісних солей, сечовини, соди за аміачним методом. Його застосовують у холодильній справі, тому що він легко скраплюється, а потім випаровується з поглинанням теплоти. Рідкий аміак і його водні розчини використовують як рідкі добрива.
V. ЗАКРІПЛЕННЯ Й УЗАГАЛЬНЕННЯ ЗНАНЬ
Завдання.
1) Напишіть рівняння хімічних реакцій, за допомогою яких можна здійснити такі перетворення:
N2 →NH3 →NH4 Cl→NH3 →N2 →NO→NO2 .
2) Як можна розділити суміш газів, що складаються з кисню і аміаку?
3) Укажіть, з якими з перелічених речовин реагує аміак: магній нітратом, сульфатною кислотою, бромоводнем? Напишіть рівняння реакцій.
4) Розрахуйте масову частку аміаку в розчині при 0 °С і при 20 °С. Розчинність аміаку у воді при 20 °С – в 1 об¢ємі води 700 об¢ємів аміаку, при 0 °С – 1200 об¢ємів аміаку.
VI. ДОМАШНЄ ЗАВДАННЯ
1. Вивчити §11 [1].
2. Виконати завдання 69 – 72[1, с. 51 - 52].
3. Підготуватися до практичної роботи №1, [1, с. 163].
VII. ПІДБИТТЯ ПІДСУМКІВ УРОКУ
ДОДАТКОВИЙ МАТЕРІАЛ ДО УРОКУ
ХІМІЧНІ ВЛАСТИВОСТІ АМІАКУ.
Хімічні властивості аміаку можна доповнити взаємодією
з галогенами: 2NH3 + 3Br2 = N2 + 6HBr;
з гідроген пероксидом: 2NH3 + H2 O2 = N2 + 6H2 O.
Атоми Гідрогену в аміаку здатні повністю або частково заміщуватися на атоми металів. При заміщенні в молекулі аміаку всіх трьох атомів Гідрогену утворюються нітриди, двох атомів Гідрогену – іміди, одного атома Гідрогену – аміди. Так, при пропусканні NH3 над розпеченим алюмінієм відбувається реакція:
2Al + 2NH3 = 2AlN + 3H2 .
Нітриди – здебільшого тверді речовини. Нітриди активних металів розкладаються водою:
Mg3 N2 + 6H2 O = 3Mg (OH)2 + 2NH3 .
При пропусканні сухого NH3 над нагрітимметалічним натрієм утворюється солеподібна речовина – натрій амід:
2NH3 + 2Na = 2NH2 Na + H2 .
У присутності води натрій амід гідролізується:
NaNH2 + H2 O = NaOH + NH3 .
Крім металічних похідних аміаку, відомі сполуки, що є продуктами заміщення атомів Гідрогену в аміаку атомами галогенів. Так, при взаємодії порошкоподібного іоду з концентрованим водним розчином аміаку (на холоді) утворюється темно-коричневий осад – іод нітрид (суміш NI3 з NHI2 і NH2 I), дуже нестійка сполука. Нітрид іоду в сухому вигляді вибухає від найменшого дотику.
Одержані також нітрид хлору NCl3 і нітрид флуору NF3 . Нітрид хлору – масляниста рідина жовтого кольору, пари її мають різкий запах. При нагріванні понад 90 °С чи при ударі він розкладається вибухом:
2NCl3 = N2 + 3Cl2 .
Нітрид флуору – безбарвний газ, на відміну від нітридів іоду і хлору цілком стійкий.
Відоме гідроксильне похідне аміаку – гідроксиламін NH2 OH, що утворюється при катодному відновленні нітратної кислоти:
HNO3 + 6H = NH2 OH + 2H2 O.
Гідроксиламін – безбарвна кристалічна речовина; використовується в основному як відновник:
2NH2 OH + HOCl = N2 + HCl + 3H2 O.
Важливими похідними аміаку є гідразин H2 N—NH2 . Це безбарвна рідина, легкорозчинна у воді. Утворюється при частковому окисненні аміаку:
2NH3 + NaOCl = H2 O + N2 H4 + NaCl.
Гідразин використовується як відновник. Суміш парів гідразину з повітрям згоряє з виділенням великої кількості теплоти:
N2 H4 + O2 = 2H2 O + N2 + 625 кДж/моль.
На цій властивості гідразину (а також деяких його органічних похідних) засноване його використання як реактивного палива.
Завдання.
1) Аміак – отруйний газ. Чому ж тоді його дають вдихати при непритомностях?
2) Колбу, в якій був аміак, заповнили водою. Розрахуйте масову частку аміаку в одержаному розчині. (Густину всіх рідин прийняти рівними 1 г/мл.)
3) Розрахуйте значення концентрації іонів Гідрогену в розчині аміаку з концентрацією 1,5 моль/л. Константа дисоціації амоній гідроксиду дорівнює 1,7∙10-5 .
4) Відомо, що аміак відновлює з оксидів малоактивні метали. Чи можливий цей процес з лужними металами? Напишіть рівняння реакції взаємодії калій оксиду з аміаком [7].
Тема Практична робота. Одержання аміаку і досліди з
ним.
Мета Розвивати навички учнів практично одержувати і збирати
газ; сформувати уміння складати звіт за результатами
спостережень.
Обладнання Кристалічний хлорид амонію, кальцій гідроксид, розчини
й матеріали фенолфталеїну і хлоридної кислоти; штативи з пробірками,
пробки з газовідвідними трубками, вата, нагрівальний
прилад, лакмусовий папір.
Тип уроку Урок закріплення знань.
Структура уроку
І. Організаційний етап………………………………………………….....1 – 2 хв.
ІІ. Інструктаж з техніки безпеки………………………………………….3 – 4 хв.
ІІІ. Виконання практичної роботи………………...………………………...35 хв.
ІV. Домашнє завдання………………………………………………………...2 хв.
V. Підбиття підсумків уроку………………………………..……………1 – 2 хв.
ХІД УРОКУ
І. ОРГАНІЗАЦІЙНИЙ ЕТАП
ІІ. ІНСТРУКТАЖ З ТЕХНІКИ БЕЗПЕКИ
Вчитель нагадує правила техніки безпеки під час роботи у хімічній лабораторії. Особлива увага приділяється правилам роботи з нагрівальними приладами і отруйним газом аміаком.
ІІІ. ВИКОНАННЯ ПРАКТИЧНОЇ РОБОТИ
Лабораторна робота
Порядок проведення практичної роботи №1, запитання і завдання до цієї роботи подані в підручнику [1, с. 163]. Рекомендується використовувати зошит для лабораторних і практичних робіт [4].
ІV. ДОМАШНЄ ЗАВДАННЯ
1. Повторити § 11 [1].
2. Виконати завдання 73 – 76, [1, с. 50 – 51].
3. Повторити хімічні властивості солей і властивості аміаку.
V. ПІДБИТТЯ ПІДСУМКІВ УРОКУ [8].
ВИСНОВОК.
- В ході даної роботи вивчали хімічні та фізичні властивості нітрогену та його сполук. Азот у природі тапляється переважно у вільному стані. У повітрі його обємна частка становить 78,09%. Сполуки нітрогену в невеликих кількостях є в грунті. Азот і його сполуки мають широку область застосування. Вони застосовуються в хімічній промисловості, медицині, господарстві. Нітроген знаходиться в періодичній системі в п’ятій групі головній підгрупі, тому він проявляє п’ять ступенів окиснення: +1, +2, +3, +4, +5 і тому утворює шість кисневих сполук: N2 O, NO, N2 O3 , NO2 , N2 O4 , N2 O5 . N2 Oі NO – несолетворні оксиди, а решта – солетворні. Найбільше значення мають оксиди нітрогену (ІІ) та нітрогену (ІV) як проміжні продукти у виробництві нітратної кислоти. Нтратна кислота належить до сильних кислот. Змішується з водою у будь-яких кількостях і тому може бути різної концентрації.
- Тема "Азот" вивчається в шкільному курсі хімії в 10 класі в темі "Загальні відомості про неметали та їх сполуки" на протязі 10 годин в загальноосвітніх школах, та протягом 34 годин у класах з поглибленим вивченням хімії.
- В межах програми шкільного курсу хімії мною запропоновано два уроки з даної теми. Один урок комбінований, в якому висвітлюється тема про аміак, його методи одержання, хімічні і фізичні властивості та його застосування. Інший урок – лабораторна робота, як урок по закріпленню знань про аміак, його добування і досліди з ним.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ:
1. Буринська Н.М., Величко Л.П. Хімія. 10 кл.: Підручник для загальноосвітніх навчальних закладів. – 2-ге видання, перероблене та доповнене. – К.; Ірпінь: ВТФ «Перун», 2003.
2. Глінка М.Л. Загальна хімія. Видання четверте. Видавниче об’єднання "Вища школа", К. 1978.
3. Неорганическая химия под ред. И. Н. Заозерского. М.: Высш. шк. 1963.
4. Угай Я. А. Общая и неорганическая химия: Учеб. Для студентов вузов, обучающихся по направлению и специальности "Химия". - М.: Высш. шк., 1997.
5. Ходаков Ю. В. Неорганическая химия. Издательство 4-е, переработаное. М., "Просвещение", 1972.
6. Буринська Н.М., Величко Л.П., Романова Н.В. Програма для спеціалізованих класів хіміко-технологічного профілю середньої загальноосвітньої школи. Хімія 8-11 кл. К., ²Перун²,1997.
7. Граніна Т.М., Григорович О.В. Плани-конспекти уроків. Хімія 10 кл. Харків, ²Ранок², 2004.
8. Журнал «Хімія в школі» №5(161) березень 2008.
9. Попель П.П., Крикля Л.С., Пивоваренко В.Г., Слободяник М.С. Програма для загальноосвітніх навчальних закладів. Хімія 8-11 кл. 2006.
ДОДАТКИ.
ПРОГРАМА ДЛЯЗАГАЛЬНООСВІТНІХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Загальні відомості про неметали та їх сполуки (28 год)
Місце елементів-неметалів у періодичній системі. Загальна характеристика Оксигену і Сульфуру, будова їх атомів, властивості, поширення в природі. Поняття про алотропію. Озон, його властивості, застосування. Роль озонового шару для життя організмів на Землі (1 год).
Хімічні властивості кисню і сірки: взаємодія з металами і неметалами. Застосування. Оксиди сульфуру(ІV) і сульфуру(VІ) (1год).
Сульфатна кислота. Фізичні властивості сульфатної кислоти. Хімічні властивості: взаємодія з металами, оксидами металів, основами, солями. Якісна реакція на сульфат-іон. Сульфати. Значення сульфатної кислоти і сульфатів у народному господарстві (2 год).
Розв’язування задач на надлишок (1 год).
Хімічні реакції, покладені в основу виробництва сульфатної кислоти, закономірності їх перебігу, охорона праці й довкілля (1 год).
Розв’язування задач на вихід продукту (1 год).
Тематичне оцінювання (1 год).
Нітроген і Фосфор, їх місце в періодичній системі, будова атомів. Алотропні модифікації Фосфору. Азот і фосфор як прості речовини: будова молекул, поширення в природі. Фізичні властивості азоту і фосфору. Хімічні властивості: взаємодія з металами (магній, літій), воднем, киснем. Застосування (1 год).
Аміак: будова молекули, добування в лабораторії. Фізичні властивості аміаку. Хімічні властивості: взаємодія з киснем, водою, кислотами. Застосування (1 год).
Солі амонію. Фізичні властивості солей амонію. Хімічні властивості: взаємодія з лугами, солями, розкладання під час нагрівання. Якісна реакція на йони амонію. Добування солей амонію в лабораторії (1 год).
Промисловий синтез аміаку: вибір оптимальних умов синтезу, будова і робота колони синтезу (1 год).
Тематичне оцінювання (1 год).
Оксиди нітрогену(ІІ) і нітрогену (ІV). Оксид фосфору (V). Їх фізичні й хімічні властивості (взаємодія з водою). Застосування (1 год).
Нітратна й ортофосфатна кислоти. Їх властивості. Взаємодія розбавленого і концентрованого розчинів кислоти з міддю. Застосування (2 год).
Нітрати і фосфати. Поняття про нітрати, проблема їх вмісту в продуктах харчування. Загальні відомості про азотні й фосфатні добрива. Кругообіг Нітрогену в природі (2 год).
Карбон і Силіцій, їх місце в періодичній системі, будова атомів. Алотропні модифікації Карбону. Хімічні властивості вуглецю і силіцію: взаємодія з киснем, воднем, відновні властивості (2 год).
Оксиди карбону(ІІ) у карбону(ІV). Оксид силіцію(ІV). Їх властивості, застосування. Добування оксиду карбону(ІV). Поняття про парниковий ефект (1 год).
Карбонатна кислота і карбонати. Якісна реакція на карбонат-іони. Перетворення карбонатів. Поняття про кислі солі. Поняття про твердість води. Кругообіг Карбону в природі. Силікатна кислота і силікати (2 год).
Тематичне оцінювання (1 год).
Поняття про будівельні матеріали: скло, цемент, бетон (1 год).
Розрахункові задачі . 1. Обчислення маси, об’єму, кількості речовини за відомими даними про вихідні речовини, одна з яких узята з надлишком. 2. Обчислення виходу продукту реакції.
Демонстрації . 1. Взаємодія сірки з металами. 2. Хімічні властивості розведеного розчину сульфатної кислоти. 3. Добування аміаку в лабораторних умовах і розчинення його і воді. 4. Добування хлориду амонію. 5. Взаємодія розведеного і концентрованого розчинів нітратної кислоти з міддю. 6. Добування оксиду карбону(ІV), взаємодія його з водою і розчином гідроксиду кальцію.
Лабораторні досліди. 1. Ознайомлення зі зразками сірки та її природних сполук. 2. Виявлення сульфат-іонів у розчині. 3. Виявлення йонів амонію в розчині. 4. Ознайомлення зі зразками азотних і фосфорних добрив. 5. Виявлення карбонат-іонів у розчині.
Практичні роботи. 1. Добування аміаку і досліди з ним (1 год). 2. Добування оксиду карбону(ІV). Взаємоперетворення карбонатів і гідрогенкарбонатів (1 год). 3. Розв’язування експериментальних задач (1 год) [9].
ПРОГРАМА ДЛЯ СПЕЦІАЛІЗОВАНИХ КЛАСІВ ХІМІКО-ТЕХНОЛОГІЧНОГО ПРОФІЛЮ СЕРЕДНЬОЇ ЗАГАЛЬНООСВІТНЬОЇ ШКОЛИ
Підгрупа Нітрогену (34 год)
Місце елементів підгрупи Нітрогену у періодичній системі, будова їхніх атомів. Азот, будова його молекули, фізичні й хімічні властивості (взаємодія з воднем, киснем, металами), застосування, добування (1 год).
Аміак. Молекулярна, структурна, електронна формули. Будова молекули. Фізичні властивості. Хімічні властивості: горіння в кисні, каталітичне окиснення, взаємодія з водою, кислотами. Утворення іона амонію. Поняття про донорно-акцепторний механізм утворення ковалентного зв’язку (2 год).
Солі амонію, фізичні й хімічні властивості (взаємодія з кислотами, лугами, розкладання при нагріванні). Якісна реакція на іони амонію. Застосування аміаку та його солей у народному господарстві (2 год).
Виробництво аміаку: хімічна реакція, що лежить в його основі, оптимальні умови її проведення (1 год).
Оксиди нітрогену. Властивості. Застосування і добування оксидів нітрогену (II) і (IV) (2 год).
Нітратна кислота. Будова молекули. Загальні властивості. Взаємодія концентрованої і розведеної нітратної кислоти з важкими металами, вугіллям і сіркою. Якісна реакція на нітрат-іон (3 год).
Поняття про нітритну кислоту. Нітрати і нітрити, проблема їх вмісту у продуктах харчування. Застосування нітратної кислоти і нітратів . кругообіг Нітрогену в природі (3 год).
Хімічні реакції, що лежать в основі промислового добування нітратної кислоти (1 год).
Фосфор. Алотропія Фосфору. Хімічні властивості: взаємодія з киснем, галогенами, сіркою, металами. Оксид фосфору (V), добування і властивості: взаємодія з водою та оксидами металів (2 год).
Поняття про фосфатні кислоти. Ортофосфатна кислота, добування і загальні властивості, середні і кислі солі. Застосування фосфору та його сполук у народному господарстві (3 год).
Мінеральні добрива. Найважливіші прості добрива: нітратні, фосфатні, калійні. Поняття про складні добрива: амофос і нітрофоска. Умови раціонального зберігання і використання добрив. Проблема охорони природи. Роль хімії у розв’язанні продовольчої проблеми. Альтернатива хімізації сільського господарства (4 год).
Семінарські заняття. 1. Аміак і солі амонію (1 год). 2. Оксиди нітрогену (1 год). 3. Нітратна кислота (1 год).4.Фосфор та його сполуки (1 год). 5. Розв'язування розрахункових задач (2 год).
Розрахункові задачі. 1. Обчислення виходу продукту від теоретично можливого.
Демонстрації. 1. Розчинення аміаку у воді. 2. Синтез аміаку. Горіння аміаку в кисні. 3. Добування нітратної кислоти з нітратів та ознайомлення з її властивостями: дія на індикатори, взаємодія з міддю. 4. Добування мінерального добрива (фосфату амонію).
Лабораторні досліди. 1. Взаємодія солей амонію з лугами. 2. Ознайомлення із зразками нітратних і фосфатних добрив. 3. Розкладання хлориду або фосфату амонію. 4. Ознайомлення з властивостями ортофосфатної кислоти та її солей.
Практичні заняття. 1. Добування аміаку та його водного розчину дія на фенолфталеїн (1 год). 2. Взаємодія аміаку з кислотами у газовій фазі та водному середовищі, взаємодія з бромною водою (1 год). 3. Визначення мінеральних добрив (1 год). 4. Розв'язування експериментальних задач (1 год) [6].