| Скачать .docx |
Реферат: Стадия сжигания серы в производстве серной кислоты
Содержание
1 Серная кислота: применение, свойства. 5
2.Выбор и обоснование источников сырья. 8
4. Расчет материального баланса. 18
5. Выбор и обоснование конструкции основного аппарата. 21
6. Экологическая оценка производства. 26
Серная кислота – наиболее сильная и самая дешевая кислота. Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Серная кислота не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из самых сильных кислот, в широком диапазоне температур (от –40…-20 до 260 – 336,50 С) находится в жидком состоянии. Она широко используется в производстве минеральных удобрений, различных солей и кислот, всевозможных органических продуктов, красителей, дымообразующих и взрывчатых веществ и т.д. Серная кислота находит разнообразное применение в нефтяной, металлургической, металлообрабатывающей, текстильной, кожевенной и других отраслях промышленности, используется в качестве водоотталкивающего и осушающего средства, применяется в процессах нейтрализации, травления и т.д. Наиболее важные области применения серной кислоты отражены на схеме.
Еще в XIII веке серную кислоту получали в незначительных количествах термическим разложением железного купороса FeSO4 , поэтому и сейчас один из сортов серной кислоты называется купоросным маслом, хотя уже давно серная кислота не производится из купороса.
В настоящее время серная кислота производится двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце ХIХ и начале ХХ века. Контактный способ вытесняет нитрозный (башенный). Первой стадией сернокислотного производства по любому методу является получение диоксида серы при сжигании сернистого сырья. После очистки диоксида серы (особенно в контактном методе) ее окисляют до триоксида серы, который соединяют с водой с получением серной кислоты. Окисление SO2 в SO3 в обычных условиях протекает крайне медленно. Для ускорения процесса применяют катализаторы.
В настоящее время контактным методом получают концентрированную серную кислоту, олеум и 100% серный ангидрид.
Одновременно с увеличением объема производства серной кислоты расширяется ассортимент продукции сернокислотных заводов, организуется выпуск особо чистой кислоты, 100% SO2 , высококачественного олеума и кислоты, а также увеличивается производство новых продуктов на основе SO2 . Кроме олеума, концентрированной серной кислоты и аккумуляторной кислоты, отечественные заводы выпускают также более чистую контактную кислоту улучшенного качества (для производства искусственного волокна, титановых белил и др.), чистый олеум, химически чистую и реактивную серную кислоту.
Исходным веществом для производства серной кислоты служит сернистый ангидрид SO2 , который получают обжигом различного серосодержащего сырья. Переработка сернистого ангидрида в серную кислоту заключается в его окислении и присоединении воды:
2SO2 + O2 = 2SO3 ;
SO3 + H2 O = H2 SO4 .
Скорость взаимодействия сернистого ангидрида с кислородом в обычных условиях очень мала. Поэтому в промышленности эту реакцию проводят либо в присутствии катализатора – контактный метод производства серной кислоты, – или же в качестве окислителя (передатчика кислорода) применяют нитрозу – нитрозный метод производства серной кислоты.
Основным сырьем для получения сернистого ангидрида и, следовательно, серной кислоты являются флотационный колчедан, содержащий пирит FeS2 , элементарная сера (S) и отходящие газы цветной металлургии, содержащие SO2 . Из флотационного колчедана получают 45 % серной кислоты, из серы – 25 %, из отходящих газов – 25 % и из разного сырья – 5 %.
На практике для окисления сернистого ангидрида используют контактный метод, по этому методу получают 85 % всей серной кислоты.
За последние годы в процессе производства серной кислоты внесены существенные улучшения. Широко применяется обжиг колчедана в кипящем слое и сжигание серы в циклонной печи, значительно увеличивается использование тепла, выделяющегося при обжиге сырья, и на других стадиях производства серной кислоты. Непрерывно повышается производительность башенных сернокислотных систем в результате поддержания оптимального технологического режима, разработанного на основе исследований; интенсивность башенных систем достигает 250 кг/м3 в сутки. Освоен контактно-башенный процесс производства серной кислоты, при котором расход HNO3 составляет 6 – 7 кг на 1 тонну H2 SO4 .
Целью данной работы является изучение стадии сжигания серы при производстве серной кислоты.
1 Серная кислота: применение, свойства
1.1 Применение серной кислоты и олеума
Области применения серной кислоты и олеума весьма разнообразны. Значительная часть ее используется в производстве минеральных удобрений (30 – 60%), производстве красителей (2 – 16%), химических волокон (5 – 15%), в металлургии (2 – 3%). Она применяется для различных технологических целей в текстильной, пищевой и других отраслях промышленности и народного хозяйства (рисунок 1.1).

Рисунок 1.1 – Применение серной кислоты
1.2 Физические свойства серной кислоты
Безводная серная кислота – бесцветная тяжелая, маслянистая жидкость без запаха. Очень сильная двухосновная кислота, способная вызывать ожоги кожи. Плотность при 20°С 1,84 г/см3 . Температура кристаллизации 10,37°С. Температура кипения моногидрата 296,2°С. При нагревании выше температуры кипения начинает разлагаться:
H2 SO4 → SO3 + H2 O
Смешивается с водой и SO3 во всех соотношениях, образуя гидраты H2 SO4 ·nH2 O, где n = 1, 2, 3, 4, 5 и 6. Вследствие образования гидратов при разбавлении водой происходит сильное разогревание серной кислоты.
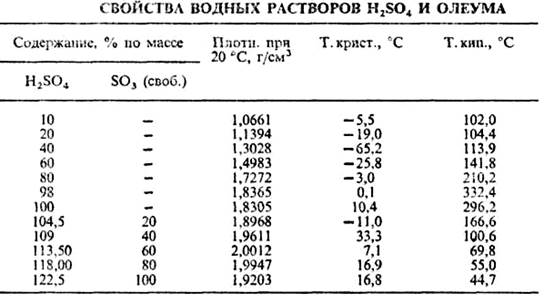
Температура кипения серной кислоты зависит от ее концентрации. С повышением концентрации водной серной кислоты температура кипения ее возрастает и достигает максимума 336,5°С при концентрации 98,3%, что соответствует азеотропному составу, после чего снижается (таблица 1.1) [1].
Таблица 1.1
1.3 Химические свойства концентрированной серной кислоты
Концентрированная серная кислота является сильным окислителем. Окисляет HI и частично НВг до свободных галогенов, углерод – до СО2 , S – до SO2 , окисляет многие металлы. Проведение окислительно-восстановтельных реакций с участием H2 SO4 обычно требует нагревания. Часто продуктом восстановления является SO2 :
S + 2 H2 SO4 = 3SO2 ↑+ 2H2 O
C + 2 H2 SO4 = 2SO2 ↑+ CO2 ↑+ 2H2 O
H2 S + H2 SO4 = SO2 ↑+ 2H2 O + S↓
Сильные восстановители превращают H2 SO4 в S или H2 S.
Концентрированная серная кислота при нагревании реагирует почти со всеми металлами (исключая Au, Pt, Be, Bi, Fe, Mg, Co, Ru, Rh, Os, Ir), например:
Cu + 2 H2 SO4 = CuSO4 + SO2 ↑+ 2H2 O
Серная кислота образует соли – сульфаты (Na2 SO4 ) и гидросульфаты (NaHSO4 ). Нерастворимы соли – PbSO4 , CaSO4, BaSO4 и др.:
H2 SO4 + BaCl2 = BaSO4 ↓ + 2HCl
Холодная серная кислота пассивирует железо, поэтому ее перевозят в железной таре. Безводная серная кислота хорошо растворяет SO3 и реагирует с ним, образуя пиросерную кислоту, получающуюся по реакции:
Н2 SO4 + SO3 =H2 S2 O7
Растворы SO3 в серной кислоте называются олеумом. Они образуют два соединения: H2 SO4 ·SO3 и H2 SO4 ·2SO3 [5].
1.4 Химические свойства разбавленной серной кислоты
Окислительные свойства для разбавленной серной кислоты нехарактерны. Разбавленная серная кислота обладает химическими свойствами, характерными для всех кислот: взаимодействует с основаниями, с основными и амфотерными оксидами, с солями:
H2 SO4 + 2NaOH = Na2 SO4 + 2H2 O
H2 SO4 + CaO = Ca SO4 + H2 O
H2 SO4 + СaCO3 = Ca SO4 + CO2 ↑+ H2 O
При взаимодействии разбавленной серной кислоты с металлами, стоящими в ряду стандартных электродных потенциалов левее водорода, образуются соли серной кислоты (сульфаты) и выделяется водород:
Zn + H2 SO4 = ZnSO4 + H2 ↑
Свинец не растворяется в разбавленной серной кислоте вследствие образования на его поверхности нерастворимого сульфата свинца [6].
2.Выбор и обоснование источников сырья
В качестве сырья для производства серной кислоты применяют элементарную серу, серный колчедан, серосодержащие промышленные отходы.
Серный колчедан содержит от 35 до 50% серы. Совместно с серным колчеданом часто залегают сульфидные руды, которые подвергаются обжигу, в результате чего образуется значительное количество сернистых газов. Их так же целесообразно использовать для производства серной кислоты.
В последнее время в качестве сернокислотного сырья используют сероводородные газы, образующиеся при переработке нефти, коксовании углей, а также получаемые при очистке природного газа.
Наиболее удобным сырьем сернокислотного производства является сера, выделяемая из самородных руд или из побочных продуктов ряда производств (газовая сера). Однако стоимость серы значительно выше, чем колчедана; кроме того, сера необходима для производства резины, спичек, сероуглерода, ядохимикатов, лекарственных препаратов и т.д. [7].
Элементарную серу получают из самородных руд (природных месторождений) или из газов, содержащих SО2 либо H2 S. Сера, полученная из газов, называется газовой серой.
Сера - ценное сырье для получения серной кислоты, так как при сжигании ее образуется концентрированный газ с высоким содержанием SО2 и кислорода. Газ этот чистый (в самородной сере содержатся незначительные количества мышьяка), при обжиге серы не остается огарка, поэтому схема переработки этого вида сырья на серную кислоту упрощается и является более экономичной. До 50% осей элементной серы в мире расходуется на производство серной кислоты. Остальные 50% потребляют сельское хозяйство, целлюлозно-бумажная и другие отрасли промышленности.
В последние годы особенно возрос объем производства серы из природных газов, содержащих сероводород (например, во Франции и Канаде).
Относительная атомная масса серы 32,064. При обычной температуре сера находится в твердом состоянии. Она существует в двух кристаллических формах — ромбической и моноклинной:
| Свойства |
Ромбическая сера |
Моноклинная сера |
| Плотность, г/см3 |
2,07 |
2,06 |
| Область устойчивости, °С |
ниже 95,4 |
95,5 -119,0 |
| Температура плавления,°С |
112,8 (при быстром нагревании) |
118,8 |
| Теплота плавлении: Дж/г кал/г |
32,0 11,9 |
38,6 9,2 |
Температура кипения серы 444,6° С. При нагревании сера плавится, плавление сопровождается увеличением объема. При 120°С расплавленная сера легкоподвижна, при 190°С это темно-коричневая вязкая масса, а при 400° С расплав становится снова легкоподвижным. Это связано с изменением структуры молекул при изменении температуры.
Получение серы из самородных руд. Природная сера встречается в залежах осадочного происхождения (о. Сицилия в Италии), вулканического происхождения о. Хоккайдо в Японии), в шляпах соляных куполов (США). Месторождения в шляпах куполов но содержанию серы превосходят месторождения осадочного и вулканического происхождении примерно в два раза: в них 27—70% серы (штаты Техас и Луизиана в США).
Обычно руды не обжигают, а выплавляют из них серу, часто используя для этого тепло горения самой серы. При этом на выплавку серы расходуется до 25% серы (следовательно, выход элементарной серы составляет 75%). В США для добывания серы используют метод Фраша, по которому серу расплавляют перегретой водой и выдавливают на поверхность сжатым воздухом. Это дешевый способ, однако выход элементной серы составляет всего 30—60%.-

Рис. 2.1.Схема получения серы из серных концентратов флотацией в автоклавах:1 - плавильник, 2 - сборники растворов флотореагентов, 3 - флотационные автоклавы
По запасам серы Россия занимает одно из первых мест в мире. Для извлечения серы из руд применяют различные методы, например метод флотации с последующей выплавкой серы из концентрата в автоклавах. Схема получения серы этим методом показана на рис. 2.1. Флотацию тонкоизмельчеиной руды производят с применением флотореагентов (жидкое стекло, керосин, спирты). Полученный концентрат, содержащий до 75% серы и обезвоженный до содержания 10—15% влаги, направляют в плавильник 1, снабженный паровым змеевиком и мешалкой. Полученная серная суспензия при 120— 130° С поступает в флотационный автоклав 3, в который из сборника 2 вводится водный раствор флотореагентов. Автоклав снабжен паровой рубашкой и мешалкой. При перемешивании жидкость дробится на мелкие капли, к которым прилипают частицы пустой породы и всплывают; расплавленная сера сливается из комической части автоклава; после слива серы спускают пустую породу. Степень извлечения серы из концентрата составляет 95—98%.
Получение газовой серы. Газовая сера является отходом процесса очистки газов цветной металлургии, нефтепереработки, попутных нефтяных и природных газов. Это дешевый вид сырья, однако в такой сере содержатся мышьяк и другие вредные для катализатора примеси, поэтому схема переработки этой серы на серную кислоту примерно такая же, как и схема переработки колчедана.
В табл. 2.1. приведена характеристика серы по сортам по ГОСТ 127.1-93
Наиболее чистая сера (газовая) выпускается нашей промышленностью в соответствии с ГОСТ 5.75—68. Она вырабатывается из сероводорода, получаемою из газов нефтепереработки. В ней отсутствуют мышьяк к органические примеси, поэтому схема переработки этой серы на серную кислоту самая экономичная. Этой сере присвоен знак качества.
Таблица 2.1
| Наименование показателя |
Норма |
||||
| Сорт 9998 |
Сорт 9995 |
Сорт 9990 |
Сорт 9950 |
Сорт 9920 |
|
| 1. Массовая доля серы, %, не менее |
99,98 |
99,95 |
99,90 |
99,50 |
99,20 |
| 2. Массовая доля золы, %. не более |
0,02 |
0,03 |
0,05 |
0,2 |
0,4 |
| 3. Массовая доля органических веществ, %, не более |
0,01 |
0,03 |
0,06 |
0,25 |
0,05 |
| 4. Массовая доля кислот в пересчете на серную кислоту, %, не более |
0,0015 |
0,003 |
0,004 |
0,01 |
0,02 |
| 5. Массовая доля мышьяка, %, не более |
0,0000 |
0,0000 |
0,000 |
0,000 |
0,03 |
| 6. Массовая доля селена, %, нe более |
0,000 |
0,000 |
0,000 |
0,000 |
0,04 |
| 7. Массовая доля воды, %, не более |
0,2 |
0,2 |
0,2 |
0,2 |
1,0 |
| 8. Механические загрязнения (бумага, дерево, песок и др.) |
Не допускается |
||||
Примечание. Кроме указанных показателей нормируется также содержание селена, железа, марганца, мели. Содержание механических примесей не допускается.
При получении обжигового газа путем сжигания серы отпадает необходимость очистки от примесей. Стадия подготовки будет включать лишь осушку газа и утилизацию кислоты. При сжигании серы протекает необратимая экзотермическая реакция:
S + O 2 = SO 2 (1)
с выделением очень большого количества теплоты: изменение Н= -362,4 кДж/моль, или в пересчете на единицу массы 362,4/32=11,325 кДж/т = 11325 кДж/кг S.
При сжигании 1 моля серы расходуется 1 моль кислорода. При этом получают 1 моль сернистого газа.
Поэтому при горении серы в воздухе, содержащем 21% кислорода, возможно (теоретически) получить 21% сернистого ангидрида. Выход сернистого ангидрида здесь выше, чем при горении колчедана и цинковой обманки. При сжигании серы в производстве серной кислоты получается наиболее выгодное соотношение SO2 и кислорода. Если сжигать серу с небольшим избытком воздуха, можно получить сернистый газ с повышенным содержанием SО2 . Однако при этом развивается температура до 1300°С, что приводит к разрушению футеровки печи; это ограничивает получение из серы газа с высокой концентрацией SO2 .
Расплавленная жидкая сера, подаваемая на сжигание, испаряется (кипит) при температуре 444,6 0 С; теплота испарения составляет 288 кДж/кг. Как видно из приведенных данных, теплоты реакции горения серы вполне достаточно для испарения исходного сырья, поэтому взаимодействие серы и кислорода происходит в газовой фазе (гомогенная реакция).
Сжигание серы в промышленности проводят следующим образом. Серу предварительно расплавляют (для этого можно использовать водяной пар, полученный при утилизации теплоты основной реакции горения серы). Так как температура плавления серы сравнительно низка, то путем отстаивания и последующей фильтрации от серы легко отделить механические примеси, не перешедшие в жидкую фазу, и получить исходное сырье достаточной степени чистоты. Для сжигания расплавленной серы используют два типа печей – форсуночные и циклонные. В них необходимо предусмотреть распыление жидкой серы для ее быстрого испарения и обеспечения надежного контакта с воздухом во всех частях аппарата.
Из печи обжиговый газ поступает в котел-утилизатор и далее в последующие аппараты.
Концентрация диоксида серы в обжиговом газе зависит от соотношения серы и воздуха, подаваемых на сжигание. Если воздух берут в стехиометрическом количестве, т.е. на каждый моль серы 1 моль кислорода, то при полном сгорании серы концентрация будет равна объемной доле кислорода в воздухе Сso 2. max =21%. Однако обычно воздух берут в избытке, так как в противном случае в печи будет слишком высокая температура.
При адиабатическом сжигании серы температура обжига для реакционной смеси стехиометрического состава составит ~ 15000 С. В практических условиях возможности повышения температуры в печи ограничены тем, что выше 13000 С быстро разрушается футеровка печи и газоходов. Обычно при сжигании серы получают обжиговый газ, содержащий 13 – 14% SO2 .
Газовая сера может содержать вредные для контактной массы примеси (например, мышьяк), поэтому технологическая схема ее переработки аналогична схеме переработки колчедана (см. рис. 3.1). Отличие заключается только в устройстве печи для обжига сырья.
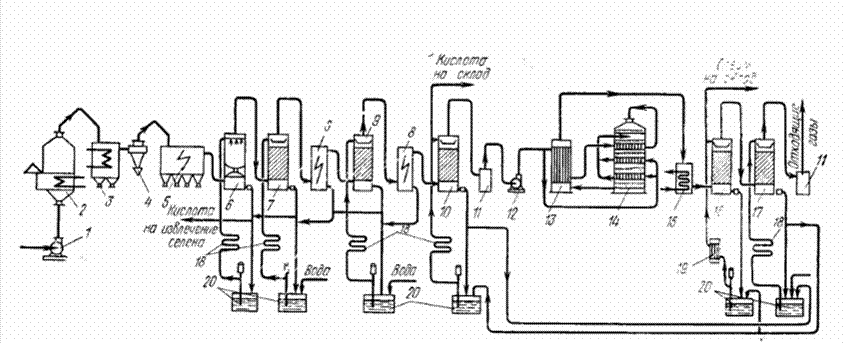
Рис. 3.1 Схема производства серной кислоты из колчедана контактным способом:
1, 12 — нагнетатели, 2 — печь КС. 3 — котел-утилизатор, 4— циклон. 5 — сухой электрофильтр, 6 —первая промывная башня. 7 — вторая промывная башня, s — мокрые электрофильтры, 9 — увлажнительная башня. 10 — сушильная башня. 11 — брызгоуловители. 13 — теплообменник. 14 — контактный аппарат. 15— ангидридный холодильник (экономайзер). 16 —абсорбер. 17— моногидратный абсорбер. 18 — оросительные холодильники, 19 — трубчатые холодильники. 20— сборники кислоты
Сырьем для получения серной кислоты может служить природная элементная сера. Она не содержит вредных для контактной массы примесей, поэтому схема ее переработки значительно упрощается. На рис. 3.2 изображена такая схема, называемая короткой схемой производства серной кислоты из природной серы.
Воздух, осушенный в сушильной башне 1 подастся в печь 7, куда одновременно распыляется через форсунки расплавленная в плавилке с отстойником 4 и отфильтрованная в фильтре 5 жидкая сера. Продолжением сер-ной печи служит котел-утилизатор (испаритель) 8 и пароперегреватель Р. Температура сернистого газа после печи снижается в котле-утилизаторе с 1100—1200 до 440—450°С. Затем газ поступает в первый слой контактной массы (второй снизу), охлаждение газа, выходящего после первого слоя, проводится в пароперегревателе Я после второго слоя (он расположен внизу контактного аппарата) газ охлаждается в теплообменнике И, после третьего и четвертого слоев — поддувом холодного осушенного воздуха. Абсорбционное отделение аналогично рассмотренному ранее, в него газ поступает через ангидридный холодильник 12.
При содержании в элементной сере битумов и керосина (остаток флотореагента) они сгорают в печи с образованием паров воды. Так как осушки газа в короткой схеме нет, в абсорбционном отделении образуется туман серной кислоты. Для уменьшения его количества проводят абсорбцию при «горячем» режиме. При этом абсорбер орошается 98,3%-ной кислотой при температуре ее на входе 80—90, на выходе 110—120° С. Повышение температуры ведет к снижению возникающего пересыщении, и туман или не образуется вообще или количество его значительно уменьшается. С этой же целью на некоторых зарубежных заводах в ангидридных холодильниках (экономайзерах) поддерживают температуру воды 120°С при 392- 104 Па (40 ат), что приводит к конденсации паров серной кислоты, образующихся из Н2 О и SO3 , до абсорбции и позволяет использовать тепло газа после контактного аппарата.
 Рис. 3.2. Схема производства серной кислоты из элементной серы:
Рис. 3.2. Схема производства серной кислоты из элементной серы:
1 - сушильная башня, 2- брызгоуловители, 3 - воздуходувка (нагнетатель), 4 –отстойник, 5 –фильтр, 6 -сборник чистой серы, 7-печь, 8-котел, 9- пароперегреватель, 10 - контактный аппарат, (I-V - слои контактной массы), 11 - теплообменник, 12 - ангидридный холодильник, 13 -олеумный абсорбер, 14 - моногидратный абсорбер, 15 — циркуляционное сборники
Приведенная на рис. 5 схема довольно распространенная, все другие существующие схемы отличаются от нее лишь некоторыми деталями оформления.
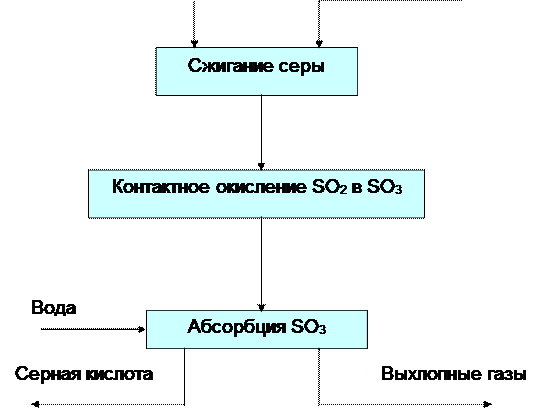
Стадии производства серной кислоты:
1. подготовка сырья : очистка и плавление серы; очистка, сушка и дозировка воздуха;
2. сжигание серы : S + O2 = SO2 (1) .Процесс ведут с избытком воздуха;
3. контактное окисление SO 2 в SO 3 : SO2 + 0,5O2 = SO3 (2).Процесс идет на ванадиевом катализаторе при температуре 420-550*С;
4. абсорбция SO3 : SO3 + H2 O = H2 SO4 (3). Абсорбционная колонна орошается 98,3% H2 SO4 . Перед отправкой на склад кислота разбавляется до ~93% H2 SO4 в соответствии с требованиями ГОСТа.
Исходные данные для расчета
| Показатель |
Значения |
| Степень превращения серы в SO2 , % |
92.0 |
| Степень превращения SO2 в SO3 , % |
99.0 |
| Степень абсорбции SO3 , % |
99.8 |
| Содержание SO2 в газе, поступающем в контактный аппарат, % (по объему) |
8.0 |
| Содержание H2 SO4 в целевом продукте, % по массе |
92.5 |
| Базис расчета, кг H2 SO4 |
2000 |
Блок-схема производства
|
||||
 |
||||
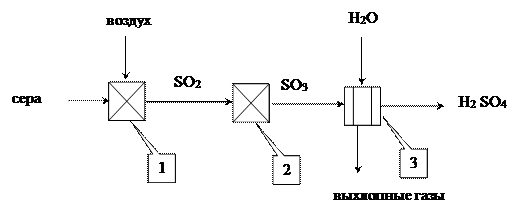 |
Операторная схема процесса
1 -серная печь, 2- контактный аппарат, 3- абсорбер
4. Расчет материального баланса
Расчет материального баланса является основным этапом. На основе материального баланса определяется целый ряд важнейших техноэкономических показателей: расход сырья и вспомогательных материалов для обеспечения заданной производительности; тепловой баланс и, соответственно, расход энергии, и теплообменную аппаратуру; экономический баланс производства, себестоимость продукции и, следовательно, рентабельность производства.
Составление уравнений по каждому узлу
1.Составляем уравнения по первому узлу:
0.92*N011 =N12 SO 2
N12 SO 2 =N12 *0.08 N011 =X1
0.92*N011 =N12 *0.08 N12 =X3
0.92* X 1 = X 3 *0.08 (1)
2. Составляем уравнения по второму узлу:
а) 0,99*N12 SO2 =N23 SO3
0.99*N12 *0.08=N23 SO3 N23 SO3 =X4
0.99* X 3 *0.08= X 4 (2)
б) N12 *(0.21-0.08)=2N23 SO 3
X *(0.21-0.08)=2 X 4 (3)
3.Составляем уравнение по третьему узлу:
а) G302 *0.925=2000 базисное уравнение G302 =X7
X7 *0.925=2000 (4)
б) 0.998*N23 SO3 =2000/Mr(H2 SO4 )
0.998*X4 =2000/98 (5)
в) N301 =N301 SO2 + N301 N2 + N301 SO3 + N301 O2
N301 SO2 =N12 SO2 *(1-0.99)=N12 SO2 *0.01=N12 *0.08*0.01
N301 N2 = 0.79*N012
N301 SO3 =N23 SO3 *(1-0.998)=0.002*N23 SO3
N301 O2 =N12 *(0.21-0.08)-1/2*N12 *(0.21-0.08)=N12 *0.13*(1-
1/2)=0.13/2*N12
N301 =N12 *0.08*0.01+0.79*N012 +0.002*N23 SO3 +0.065*N12
N301 =0.0658*N12 +0.79*N012 +0.002*N23 SO3
X 6 =0.0658* X 3 +0.79* X 2 +0.002* X 1 (6)
N012 =X2
N301 =X6
Но надо учесть , что N12 =N012 ,т.е. X 2 = X 3 (7)
6 неизвестных и 7 уравнений. Выбрасываем уравнение (3) и получаем систему уравнений:
![]() 0,92*X1
=0.08*X3
0,92*X1
=0.08*X3
0.99*0.08*X3 =X4
0.925*X7 =2000
0.998*X4 =20.41
X6 =0.0658*X3 +0.79*X2 +0.002*X4
X3 =X2
0.92*X1 -0.08*X3 =0
0.0792*X3 -X4 =0
X7 =2162.2
X4 =20.45
0.8558*X3 +0.002*X4 - X6 =0
![]() 0.92*X1
-0.08*X3
=0
0.92*X1
-0.08*X3
=0
0.0792*X3 -20.45=0
X7 =2162.2
X4 =20.45
0.8558*X3 +0.002*20.45-X6 =0
0.92*X1 -0.08*X3 =0
X3 =257.23
X7 =2162.2
X4 =20.45
0.8558*X3 +0.041-X6 =0
![]() 0.92*X1
=0.08*257.23
0.92*X1
=0.08*257.23
X3 =257.23
X7 =2162.2
X4 =20.45
0.8558*257.23+0.041-X6 =0
![]() X1
=22.37=N011
X1
=22.37=N011
X3 =257.23=X2 =N12 =N012
X7 =2162.2=G301
X4 =20.45=N23 SO3
X6 =220.18=N301
1.Количество целевого продукта:
X7 =G301 =2162.2 кг 92.5% серной кислоты
2. Расход серы:
X1 =N011 =22.37 кмоль
ms =Ns *MS =22.37*32=715.84 кг
GS нач =715,84/0,92=778,1 кг было введено в систему
3. Расход воздуха:
X2 =X3 =N012 =257.23 кмоль
Gвозд =Nвозд *Mвозд =257,23*29=7459,67 кг
4.Определение расхода кислорода и азота
GO2 =7459,67*0,21=1566,7 кг
GN2 =7459,67*0,79=5893,1 кг
5. Определяем количество SO2 , содержащегося в газе:
X3 =N12 =257.23 кмоль
N12 SO 2 =257.23*0.08=20.58 кмоль
GSO 2 =NSO 2 *MSO 2 =20.58*64=1317 кг
6. Определение SO3 , содержащегося в газе:
X4 =N23 SO3 =20.45 кмоль
GSO3 =NSO3 *MSO3 =20.45*80=1636 кг
7. Расход воды на абсорбцию:
G03 =G301 *MH2O /MH2SO4 =2162.2*18/98=397 кг
8. Выхлопные газы:
X6 =N301 =220.18 кмоль
G301 =G301 SO2 +G301 N2 +G301 SO3 +G301 O2 =1317*0.01+5893.1+
0.002*1636+0.065*7459.67=13.17+5893.1+3.27+484.88=
6394.42 кг
| Введено |
Получено |
||||
| Реагенты |
кг |
% масс |
Продукты |
кг |
%масс |
| Сера |
778,1 |
9 |
Серная кислота: |
2162,2 |
25 |
| Вода |
397 |
4,6 |
H2 SO4 |
2000 |
23,2 |
| Воздух: |
7459,67 |
86,4 |
H2 O |
162,2 |
1,8 |
| 21% О2 |
1566,7 |
18,1 |
Выхлопные газы: |
6394,42 |
74,1 |
| 79% N 2 |
5893,1 |
69,3 |
SO2 |
13,17 |
0,15 |
| N2 |
5893,1 |
68,25 |
|||
| SO3 |
3,27 |
0,06 |
|||
| O2 |
484,88 |
5,64 |
|||
| Невязка |
78,15 |
0,9 |
|||
| Всего |
8634,77 |
100 |
Всего |
8634,77 |
100 |
5. Выбор и обоснование конструкции основного аппарата
Дли сжигания серы применяют печи различных конструкции. Наиболее распространена печь для сжигания жидкой серы в распыленном состоянии — форсуночная печь. Устройство се очень простое. Она представляет собой горизонтальный стальной футерованный огнеупорным кирпичом цилиндр 1 (рис. 5.1).
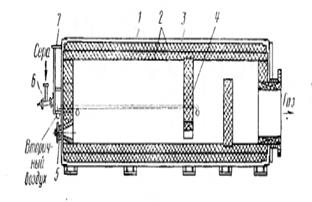
Рис. 5.1. Печь для сжигания жидкой серы и распыленном состоянии (форсуночная печь): 1 - стальной цилиндр, 2- футеровка, 3 - асбест, 4 – перегородки, 5 - форсунка для распыленны топлива, 6-форсунки для распыления серы, 7- короб для подвода воздуха в печь
Серу подают в торцевую часть печи форсунки 6. Сюда же вводится воздух для горения. Дополнительный (вторичный) воздух поступает через отверстие в корпусе печи. Сора сгорает во всем объеме печи, а для лучшего перемешивания газа внутри печи установлены перегородки 4 из огнеупорного кирпича.
Применяются также печи для сжигания расплавленной серы в параллельном потоке воздуха при движении серы сверху вниз по насадке - вертикальные форсуночные печи и печи отражательного типа, где сера в виде паров сгорает в токе воздуха между двумя сводами с раскаленными решетками, под нижним из которых находится расплавленная сера.
Плавление серы производится в отдельных плавилках, снабженных паровыми змеевиками или рубашками, которые обогреваются паром иди подогретым воздухом..
Со склада сера, предварительно раздробленная до кусков размером 40—50 мм, ленточными транспортерами подается в общий приемный бункер, из которого загружается в бункер-плавилку, обогреваемую паром. Расплавленная сера при 130 -140°С по серопроводу стенает в ванну-отстойник. Бункера-плавилки снабжены змеевиками, по которым идет пар, или рубашками, обогреваемыми также паром или подогретым воздухом.
В настоящее время для сжигания расплавленной серы широко применяются циклонные печи. Поток воздуха и жидкая сера вводятся в эти печи тангенциально (по касательной) со скоростью 100—120 м/с. Это способствует хорошим условиям массо- и теплообмена паров серы с воздухом. Скорость горения при этом повышается. Благодаря тому, что процесс сжигания ведется с небольшим избытком воздуха (а—1,15—1,2), получают газ с концентрацией 16—18% SCb-. Интенсивность таких печей в 30—40 раз выше, чем печей форсуночных. Достоинствами циклонных печей являются еще постоянство концентрации газа, простота регулирования процесса сжигания и простота схемы автоматизации его. Однако высокая температура в таких печах (1200—1400° С) создает сложности при конструировании и использовании их в промышленности. Таким образом, концентрация SO2 в газе после циклонной печи зависит от температуры газа, определяемой стойкостью футеровки.
Циклонная печь для сжигания серы (рис. 5.2) состоит из двух горизонтальных цилиндров - форкамеры 1 и- двух камер дожигания 3 и 5. Пена имеет воздушный короб (рубашку) 2 дли снижения температуры наружной обшивки печи и предупреждения утечки сернистого ангидрида. В форкамеру через две группы сопл 7 тангенциально подастся воздух, через форсунку механического типа 8 также тангенциально подается расплавленная сера.
Образующийся при сжигании жидкой серы обжиговый газ вместе с парами серы поступает через пережимное кольцо 6 из форкамеры в первую камеру дожигания 5 (диаметр 1,5 м), в которой также расположены воздушные сопла 9 и форсунки для подачи серы 10. Из нерпой камеры дожигания газ через пережимные кольца 4 поступает во вторую камеру дожигания 3, где сгорают остатки серы (между пережимными кольцами 4 к газу добавляют воздух).
Из печи обжиговый газ поступает в котел-утилизатор Н далее в последующую аппаратуру.
Циклонная печь для сжигания серы разработана в СССР и впервые была внедрена на отечественных заводах в нескольких вариантах, отличающихся числом камер, способом ввода вторичного воздуха, устройством пережимных колец и др. Общая особенность этил печен состоит в том, что как в форкамере, так и в камерах дожигания создастся вращательное движение газа, обеспечивающее хорошее перемешивание паров серы с воздухом и высокую скорость горения серы.
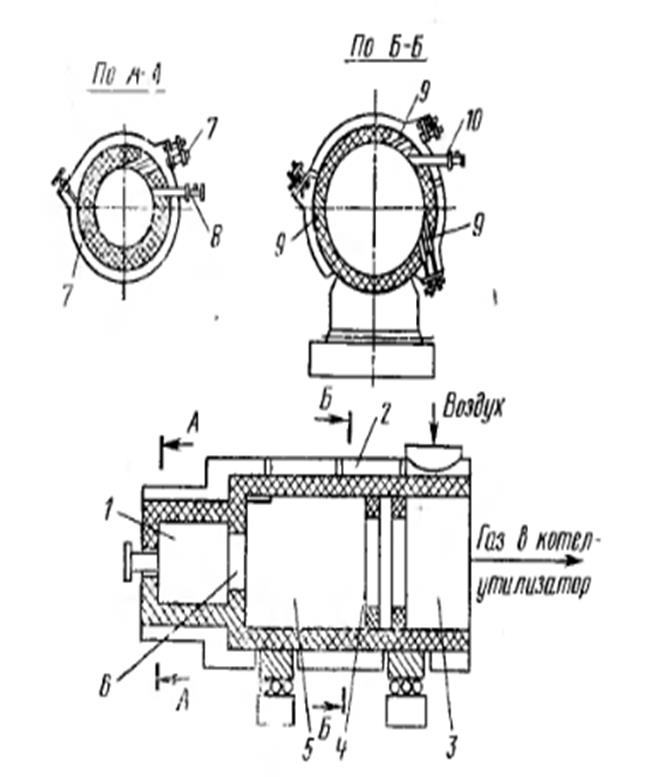
Рис. 5.2. Циклонная печь:
1-форкамера, 2 —воздушный короб, 3, 5—камеры дожигания, 4,6- пережимные кольца, 7, 9 — сопла для подачи воздуха. 8,10 — форсунки для подачи серы
В последние годы создан серный энерготехнологический агрегат циклонного типа производительностью 100 т серы в сутки, включающий циклонную топку и котел-утилизатор. Этот агрегат назван СЭТА-Ц-100.
Печи дли сжигании серы экономически более выгодны, чем печи для сжигания колчедана, так как проще ее конструкции. Кроме того, при сгорании серы не образуется огарка, удаление которого представляет трудоемкую операцию.
Содержание примесей в сере может привести к ухудшению теплопередачи в плавилках и засорению форсунок, а также к засорению контактной массы (в случае, когда серная кислота получается, но короткой схеме). Поэтому расплавленная сера отстаивается и фильтруется. За границей иногда фильтруют не серу, а газ получаемый при ее сжигании. Для этого используют пористые газовые фильтры.
В последние годы все более широко применяют очистку серы на месте ее добычи с последующей перевозкой жидкой серы (подогретой до 140° С) в цистернах и танкерах. Однако не достаточно освободиться только от твердых примесей в расплавленной сере. Содержание в сере органических примесей приводит к образованию воды при сгорании их в печи. При этом в короткой схеме, в которой газ перед контактным аппаратом не осушивается, в абсорбционном отделении образуется туман серной кислоты и абсорбция «газит». Иногда на фильтрующий слой наносятся специальные добавки, дающие возможность снизить в сере содержание органических веществ. Например, фильтрация серы через специальные вещества (палытарскит) позволяет снизить в абсорбционном отделении образование тумана[5].
6. Экологическая оценка производства
В производстве серной кислоты вредными веществами являются: серная кислота, оксиды серы, олеум. Серная кислота и олеум представляют собой агрессивные жидкости, которые действуют разрушающим образом на растительные, животные ткани и вещества, отнимая у них воду, вследствие чего они обугливаются.
Аэрозоль серной кислоты. ПДК аэрозоля серной кислоты в воздухе:
ПДКр.з. = 1,0 мг/м3 (рабочей зоны),
ПДКм.р. = 0,3 мг/м3 (максимально разовая),
ПДКс.с. = 0,1 мг/м3 (среднесуточная).
Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин). Класс опасности 2. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды серы, и выпадать в виде кислотных дождей [10].
Оксид серы (IV) и взвешенные частицы. Основной процесс, приводящий к образованию взвешенных частиц и диоксида серы, – это процесс горения, осуществляемый в печи сжигания серы. Диоксид серы – бесцветный газ. Источники те же, что и для взвешенных частиц. Вступает в каталитические или фотохимические реакции с другими загрязняющими веществами с образованием SO3 , серной кислоты и сульфатов [6].
Класс опасности (токсичности) диоксида серы 3. ПДКр.з. = 10,0 мг/м3 , ПДКм.р. = 0,5 мг/м3 , ПДКс.с. = 0,03 мг/м3 .
Частицы, образующиеся в результате сгорания – сажа, копоть, пыль, – обычно имеют размер менее 1 мкм, так что они могут легко приникать в легочные альвеолы. Они также могут содержать опасные вещества, такие как асбест, тяжелые металлы, мышьяк. Оксиды металлов являются основным классом неорганических частиц в атмосфере. Они образуются в любых процессах, связанных со сжиганием топлива, содержащего металлы.
Класс опасности сажи 3. ПДКр.з. = 4,0 мг/м3 , ПДКм.р. = 0,15 мг/м3 , ПДКс.с. = 0,05 мг/м3 .
Класс опасности нетоксичной пыли 4. ПДКр.з. = 6,0 мг/м3 , ПДКм.р. = 0,5 мг/м3 , ПДКс.с. = 0,15 мг/м3 .
В промышленных районах концентрация диоксида серы обычно достигает 0,05-0,1 мг/м3 ; в сельских районах она в несколько раз меньше, а над океаном меньше в 10-100 раз. В сельской местности фоновая концентрация близка к 0,5 мкг/м3 , а концентрация в городах в 50-100 раз выше. Из-за химических превращений время жизни диоксида серы в атмосфере невелико (порядка нескольких часов). В связи с этим возможность загрязнения и опасность воздействия непосредственно диоксида серы носят, как правило, локальный, а в отдельных случаях региональный характер.
Термин «взвешенные частицы» относится к ряду тонкодисперсных твердых веществ или жидкостей, диспергированных в воздухе в результате процессов горения, производственной деятельности и естественных источников. До 20 % общего количества взвешенных частиц может состоять из серной кислоты и сульфатов (частицы до 1 мкм в диаметре состоят из них на 80 %) [7].
Влияние на окружающую среду . Высокие концентрации диоксида серы вызывают серьезное повреждение растительности. Острое повреждение, вызванное диоксидом серы, отражается в появлении белесых пятен на широколистных растениях или обесцвеченных некротических полос на листьях с продольным жилкованием. Хронический эффект проявляется как обесцвечивание хлорофилла, приводящее к пожелтению листьев, появлению красной или бурой окраски, которая в нормальных условиях маскируется зеленой. Независимо от формы проявления, результатом является снижение продуктивности и замедление роста. Лишайники особенно чувствительны к SO2 и используются как биоиндикаторы при определении его избыточных количеств в воздухе. Однако диоксид серы не всегда вызывает повреждение: в сульфатдефицитных местностях дополнительные небольшие уровни SO2 могут благотворно влиять на растения, однако происходящее параллельно некоторое подкисление почвы может потребовать дополнительного известкования [7].
Предложения по уменьшению количества выбросов вредных веществ в окружающую среду
В процессе производства серной кислоты некоторая часть серы уходит в атмосферу в виде диоксида серы SO2 . Неполное окисление SO1. Амелин А.Г. Производство серной кислоты. – М.: Химия, 1964. – 247с.
2. Васильев Б. Т., Отвагина М. И., Технология серной кислоты. – М.:Химия, 1985. – 352с.
3. Малин К.М., Аркин И.А., Боресков Г.К., Слинько М.Г. Технология серной кислоты. – М.: Госхимиздат, 1984. –380с.
4. Соколов Р.С. Химическая технология. Учеб. пособие для вузов. Т.1. – М.: Гуманитарный издательский центр ВЛАДОС, 2000. – 368с.
5. Производство серной кислоты: Учебник для проф.-техн. учеб. заведений.—2-е изд., перераб. и доп. — М.: Высш. школа, 1980. — 245 с, ил.
6. Протасов В.Ф. Экология, здоровье и охрана окружающей среды в России/ Учебн. и справочное пособие. – М.: Финансы и статистика. – 2001. – 672с.
7. Степеновских А.С. Охрана окружающей среды/ Учебник для вузов. – М.:Юнити-Дана, 2000. – 559с.
8. Малкин И.З./ ЭКиП//Утилизация сернокислых промышленных отходов. – 2003. – №6. – с. 10-14.