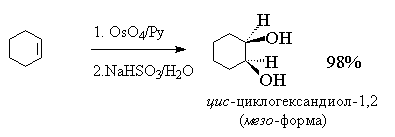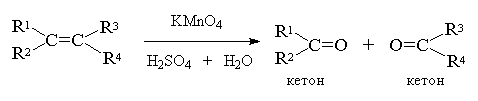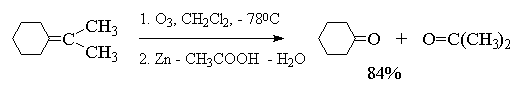| Скачать .docx |
Курсовая работа: Окисление алкенов
Санкт-Петербургский Государственный Технологический Институт
(Технический Университет)
Кафедра органической химии Факультет 4
Курс III
Группа 476
Курсовая работа
Окисление алкенов
Студентка………………………………………Рытина А.И.
Преподаватель………………………………... Питерская Ю.Л.
Санкт-Петербург
2010
Содержание
Введение
1.Эпоксидирование (реакция Н.А. Прилежаева,1909 г.)
2.Гидроксилирование
2.1анти -Гидроксилирование
2.2син -Гидроксилирование
3.Окислительное расщепление алкенов
4.Озонолиз
5.Окисление алкенов в присутствии солей палладия
Заключение
Список использованных источников
Введение
Окисление - одно из наиболее важных и распространенных превращений органических соединений.
Под окислением в органической химии понимают процессы, приводящие к обеднению соединения водородом или обогащению его кислородом. При этом происходит отнятие от молекулы электронов. Соответственно, под восстановлением понимают отрыв от органической молекулы кислорода или присоединение к ней водорода.
В окислительно-восстановительных реакциях окислителями являются соединения, обладающие большим сродством к электрону (электрофилы), а восстановителями – соединения, имеющие склонность к отдаче электронов (нуклеофилы). Легкость окисления соединения возрастает вместе с ростом его нуклеофильности.
При окислении органических соединений, как правило, полной передачи электронов и соответственно изменения валентности атомов углерода не происходит. Поэтому понятие степени окисления – условного заряда атома в молекуле, вычисленного, исходя из предположения, что молекула состоит только из ионов – носит лишь условный, формальный характер.
При составлении уравнений окислительно-восстановительных реакций необходимо определить восстановитель, окислитель и число отдаваемых и принимаемых электронов. Как правило, коэффициенты подбирают, используя метод электронно-ионного баланса (метод полуреакций).
В этом методе рассматривают переход электронов от одних атомов или ионов к другим с учетом характера среды (кислая, щелочная или нейтральная), в которой протекает реакция. Для уравнивания числа атомов кислорода и водорода вводят или молекулы воды и протоны (если среда кислая), или молекулы воды и гидроксид-ионы (если среда щелочная).
Таким образом, при написании полуреакций восстановления и окисления нужно исходить из состава ионов, действительно имеющихся в растворе. Вещества малодиссоциирующие, плохо растворимые или выделяющиеся в виде газа следует писать в молекулярной форме.
В качестве примера рассмотрим процесс окисления этилена разбавленным водным раствором перманганата калия (реакция Вагнера). В ходе данной реакции этилен окисляется до этиленгликоля, а перманганат калия восстанавливается до диоксида марганца. По месту двойной связи присоединяются два гидроксила[1] :
3С2 H4 + 2KMnO4 +4H2 O→ 3C2 H6 O2 + 2MnO2 +2KOH
![]() Полуреакция восстановления: MnO4
¯
+ 2H2
O + 3
e
→ MnO2
+ 4OH¯
2
Полуреакция восстановления: MnO4
¯
+ 2H2
O + 3
e
→ MnO2
+ 4OH¯
2
Полуреакция окисления: С2 H4 + 2OH− − 2 e → C2 H6 O2 3
Окончательно имеем в ионном виде:
2MnO4 ¯ + 4H2 O + 3C2 H4 + 6OH¯ → 2MnO2 + 8OH¯ + 3C2 H6 O2
После проведения необходимых сокращений подобных членов, записываем уравнение в молекулярном виде:
3C2 H4 + 2KMnO4 + 4 H2 O = 3C2 H6 O2 + 2MnO2 + 2KOH.
Характеристика некоторых окислителей
Кислород
Кислород воздуха находит широкое применение в технологических процессах, так как является наиболее дешевым окислителем. Но окисление кислородом воздуха сопряжено с трудностями, связанными с контролем процесса, который протекает в различных направлениях. Окисление обычно проводят при высокой температуре в присутствии катализаторов.
Озон
Озон O3 применяют для получения альдегидов и кетонов, если их затруднительно получить другими способами. Чаще всего озон применяют для установления структуры ненасыщенных соединений. Получают озон при действии тихого электрического разряда на кислород. Одним из существенных достоинств озонирования, по сравнению с хлорированием, является отсутствие токсинов после обработки[2] .
Перманганат калия
Перманганат калия – наиболее часто применяемый окислитель. Реактив растворим в воде (6.0% при 20ºС), а также в метаноле, ацетоне и уксусной кислоте. Для окисления применяют водные (иногда ацетоновые) растворы KMnO4 в нейтральной, кислой или щелочной среде. При проведении процесса в нейтральной среде в реакционную массу добавляют соли магния, алюминия или пропускают углекислый газ для нейтрализации выделяющегося во время реакции гидроксида калия. Реакцию окисления KMnO4 в кислой среде чаще всего ведут в присутствии серной кислоты. Щелочную среду при окислении создает образующийся во время реакции KOH, либо его изначально добавляют в реакционную массу. В слабощелочной и нейтральной средах KMnO4 окисляет по уравнению:
KMnO4 + 3 e + 2H2 O = K+ + MnO2 + 4OH¯
в кислой среде:
KMnO4 + 5 e + 8H+ = K+ + Mn2+ + 4H2 O[3]
Перманганат калия используется для получения 1,2-диолов из алкенов, при окислении первичных спиртов, альдегидов и алкиларенов до карбоновых кислот, а также для окислительного расщепления углеродного скелета по кратным связям.
На практике обычно используется довольно большой избыток (более чем 100%) KMnO4 . Это объясняется тем, что в обычных условиях KMnO4 частично разлагается на диоксид марганца с выделением O2 . Разлагается концентрированной H2 SO4 при нагревании в присутствии восстановителей со взрывом; смеси калия перманганата с органическими веществами также взрывчаты[4] .
Надкислоты
Перуксусную и пермуравьиную кислоты получают реакцией 25-90%-ного пероксида водорода с соответствующей карбоновой кислотой по следующей реакции:
RCOOH + H2 O2 = RCOOOH + H2 O
В случае уксусной кислоты это равновесие устанавливается относительно медленно, и для ускорения образования перкислоты обычно в качестве катализатора добавляют серную кислоту. Муравьиная кислота достаточно сильна сама по себе для того, чтобы обеспечить быстрое установление равновесия.
Пертрифторуксусная кислота, получаемая в смеси с трифторуксусной кислотой реакцией трифторуксусного ангидрида с 90%-ным пероксидом водорода, еще более сильный окислитель. Аналогичным образом из уксусного ангидрида и пероксида водорода можно получить перуксусную кислоту.
Особой популярностью пользуется твердая м -хлорпербензойная кислота, поскольку она относительно безопасна в обращении, достаточно стабильна и может храниться длительное время.
Окисление происходит за счет выделяющегося атома кислорода:
RCOOOH = RCOOH + [O]
Надкислоты применяют для получения эпоксидов из алкенов, а также лактонов из алициклических кетонов.
Пероксид водорода
Пероксид водорода – бесцветная жидкость,cмешивается с водой, этанолом и диэтиловым эфиром. 30%-ный раствор H2 O2 называется пергидролем. Высококонцентрированный препарат может реагировать с органическими веществами со взрывом. При хранении разлагается на кислород и воду. Стойкость пероксида водорода возрастает с разбавлением. Для окисления применяют водные растворы различной концентрации (от 3 до 90%) в нейтральной, кислой или щелочной средах.
H2 O2 = H2 O + [O]
Действием этого реагента на α,β-непредельные карбонильные соединения в щелочной среде получают соответствующие эпоксиальдегиды и кетоны, окислением карбоновых кислот в кислой среде синтезируют надкислоты. 30%-ный раствор H2 O2 в уксусной кислоте окисляет алкены в 1,2-диолы. Пероксид водорода применяют: для получения органических и неорганических пероксидов, пербората и перкарбоната Na; как окислитель в ракетных топливах; при получении эпоксидов, гидрохинона, пирокатехина, этиленгликоля, глицерина, ускорителей вулканизации группы тиурама и др.; для отбеливания масел, жиров, меха, кожи, текстильных материалов, бумаги; для очистки германиевых и кремниевых полупроводниковых материалов; как дезинфицирующее средство для обезвреживания бытовых и индустриальных сточных вод; в медицине; как источник О2 в подводных лодках; Н2 О2 входит в состав реактива Фентона (Fe2 + + Н2 О2 ), который используют как источник свободных радикалов ОН в органическом синтезе[5] .
Тетраоксиды рутения и осмия
Тетраоксид осмия OsO4 – порошок от белого до бледно-желтого цвета с т. пл. 40.6ºС; т. кип. 131.2ºС. Возгоняется уже при комнатной температуре, растворим в воде (7.47 г в 100 мл при 25ºС), ССl4 (250 г в 100 г растворителя при 20ºС). В присутствии органических соединений чернеет вследствие восстановления до OsO2 [6] .
RuO4 представляет собой золотисто-желтые призмы с т. пл. 25.4ºС, заметно возгоняется при комнатной температуре. Умеренно растворим в воде (2.03 г в 100 мл при 20ºС), очень хорошо растворим в CCl4 . Более сильный окислитель, чем OsO4 . Выше 100ºС взрывается. Как и тетраоксид осмия обладает большой токсичностью и высокой стоимостью.
Данные окислители применяются для окисления алкенов в α-гликоли в мягких условиях.
Диоксираны
Наиболее часто используются диметилдиоксиран и метил(трифторметил)-диоксиран.
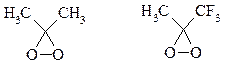
Диоксираны чаще всего получают in situ из соответствующих кетонов и KHSO5 (или K2 SO4 ·KHSO4 ·2KHSO5 (оксона)) в слабощелочной среде[7] :
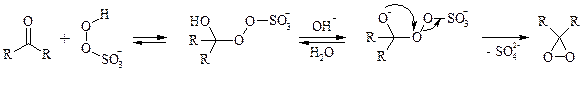
Диоксираны отличаются высокой реакционной способностью, сочетающейся с хорошей селективностью, и используются для окисления неактивированных С–Н-связей в алканах, при получении эпоксидов из алкенов, для окисления аминов, оксимов, сульфидов, сульфоксидов и др.
Окисление алкенов может проходить в нескольких направлениях:
1)с сохранением углеродного скелета молекулы; так протекают эпоксидирование и гидроксилирование двойной связи,приводящее к образаванию вицинальных транс- или цис-гликолей.
2)с разрывом двойной связи; так идут озонолиз и исчерпывающее окисление алкенов,приводящее к образованию различного рода карбонильных соединений и карбоновых кислот.
В зависимости от типа окисления применяют различные окислители
1. Эпоксидирование (реакция Н.А. Прилежаева, 1909 г)
Ациклические и циклические алкены при взаимодействии с перкислотами (надкислотами) RCOOOH в неполярной, индифферентной среде образуют эпоксиды (оксираны), поэтому сама реакция носит название реакции эпоксидирования.
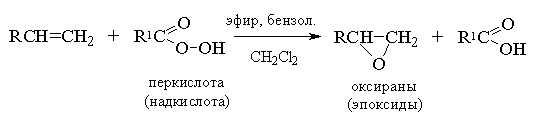
Согласно современной номенклатуре ИЮПАК - трехчленный цикл с одним атомом кислорода носит название оксиран.
Эпоксидирование алкенов следует рассматривать как синхронный, согласованный процесс, в котором не участвуют ионные интермедиаты типа гидроксильного катиона ОН+. Другими словами, эпоксидирование алкенов представляет собой процесс син -присоединения одного атома кислорода по двойной связи с полным сохранением конфигурации заместителей при двойной связи.[8]
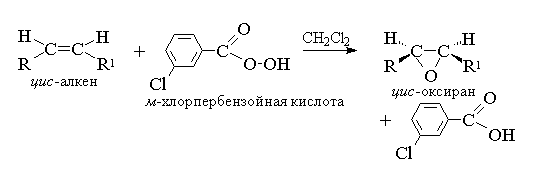
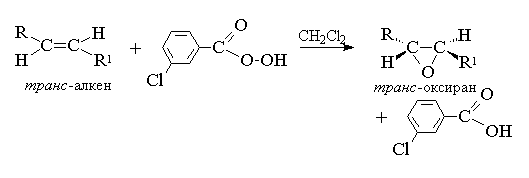
Для эпоксидирования был предложен механизм, характерный для согласованных процессов.
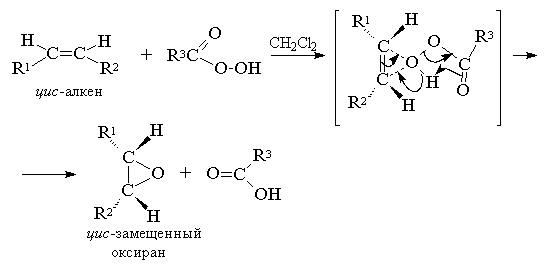
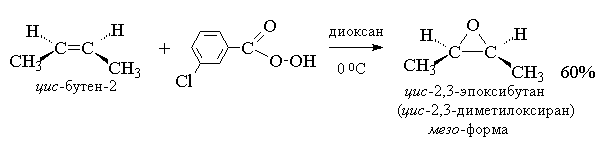
Т. к. атака двойной связи атомом кислорода надкислоты равновероятна с обеих сторон плоскости двойной связи, образующиеся оксираны представляют собой либо мезо -формы, либо смеси энантиомеров. В качестве эпоксидирующих агентов используются следующие перкислоты: пербензойная, м -хлорпербензойная, моноперфталевая, перуксусная, трифторперуксусная и пермуравьиная. Перкислоты ароматического ряда применяют в виде индивидуальных реагентов, тогда как перкислоты алифатического ряда - СН3 СО3 Н, CF3 CO3 H и НСО3 Н не выделяют в индивидуальном виде, а используют после их образования при взаимодействии 30% или 90%-ного пероксида водорода и соответствующей карбоновой кислоты. Пербензойную и м -хлорпербензойную кислоты получают окислением соответственно бензойной и м -хлорбензойной кислот 70%-ной перекисью водорода в растворе метансульфокислоты или из хлорангидридов этих кислот и перекиси водорода.
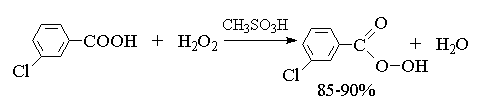
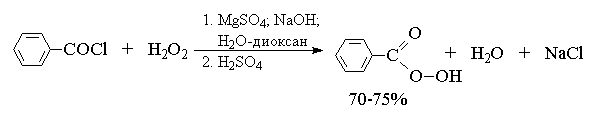
Моноперфталевую кислоту получают подобным методом из фталевого ангидрида и 30%-ной перекиси водорода.
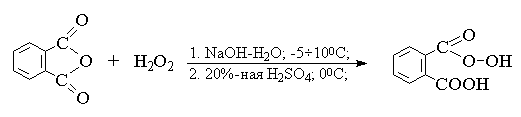
В настоящее время значительное применение находит монопероксифталевая кислота в виде Mg-соли.Этот реагент можно применять в смесях органических растворителей с водой[9] .
Первоначально для получения оксиранов (эпоксидов) использовались пербензойная или моноперфталевая кислоты[10] :
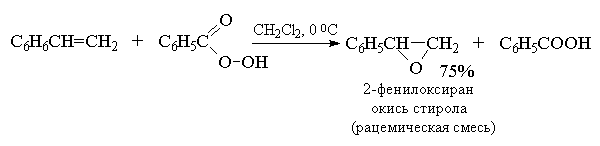
В настоящее время для эпоксидирования чаще всего используют м -хлорпербензойную кислоту. В отличие от других перкислот она стабильна при хранении в течение длительного времени (до 1 года) и абсолютно безопасна при обращении. Выходы оксиранов, полученных при окислении ациклических и циклических алкенов м -хлорпербензойной кислотой в растворе хлористого метилена, хлороформа или диоксана, обычно довольно высоки[11] .
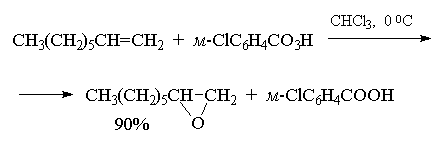
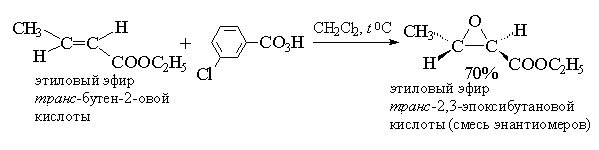
Перкислоты часто генерируют прямо в реакционной смеси из 90% перекиси водорода и карбоновой кислоты в хлористом метилене.
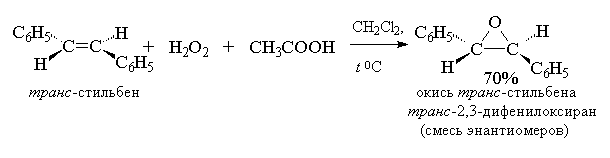
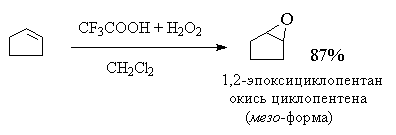
Алкены с двойной связью, сопряженной с карбонильной группой или другим акцепторным заместителем, малоактивны и для их окисления лучше использовать более сильные окислители, такие как трифторперуксусная кислота, получаемая из ангидрида трифторуксусной кислоты и 90%-ной перекиси водорода в хлористом метилене. Пероксикарбоксимидовые кислоты RC(NH)OOH являются нестойкими промежуточными продуктами, образующимися в реакциях нитрилов со щелочными растворами пероксида водорода[12] :
Простейший оксиран - окись этилена получают в промышленности окислением этилена кислородом в присутствии серебра, как катализатора[13] .
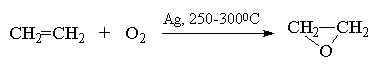
Известен ряд окислительных реагентов, с помощью которых в мягких условиях возможно присоединение двух гидроксильных групп к алкенам.
Реакция гидроксилирования алкенов, протекающая под действием холодного раствора перманганата калия и сопровождаемая его обецвечиванием, известна как реакция Вагнера(1888 г.). Она имеет в настоящее время незначительное синтетическое применение, поскольку сопровождается образованием значительного числа побочных продуктов. Однако это реакция может применяться при изучении строения органического соединения как качественная проба на двойную связь. Гидроксилирование циклогексена действием водного раствора перманганата калия на холоду впервые провел В.В. Марковников. В настоящее время для гидроксилирования алкенов чаще всего применяют оксид осмия(VIII)(реакция Криге,1936г.)[14] .
Четырехокись осмия OsO4 представляет собой бесцветное кристаллическое вещество,плавящееся при 40о С и легко растворимое в эфире. При окислении циклогексена эфирным раствором этого реагента выделяется черный осадок, который представляет собой циклический эфир осмиевой кислоты I[15] :
Эфир образуется в результате одновременного раскрытия углерод-углеродной двойной связи алкена и двух двойных связей окиси металла. Затем этот эфир гидролизуют, используя в качестве катализатора сульфит натрия. Продукт гидролиза представляет собой цис-циклогександиол-1,2(II),у которого гидроксилы расположены в β-области,т.е. спереди, а водороды-в α-области,т.е. сзади.
2.1 анти -Гидроксилирование
Трехчленное кольцо оксиранов легко раскрывается под действием самых разнообразных нуклеофильных реагентов. Гидролиз оксиранов катализируется как кислотами, так и основаниями. В обоих случаях образуются вицинальные диолы, т. е. гликоли. При кислотном катализе в первой стадии происходит протонирование атома кислорода оксирана с образованием циклического оксониевого катиона, который раскрывается в результате нуклеофильной атаки молекулы воды[16] :
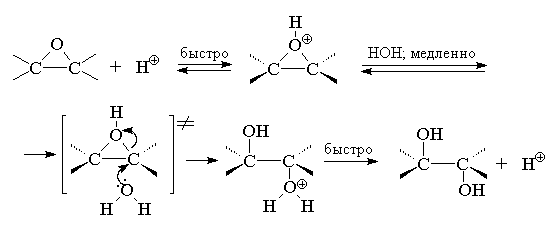
Ключевой стадией в раскрытии кольца, определяющей скорость всего процесса, является нуклеофильная атака водой на протонированную форму оксирана. С точки зрения механизма этот процесс аналогичен раскрытию бромониевого иона при нуклеофильной атаке бромид-иона или другого нуклеофильного агента. С этих позиций стереохимическим результатом должно быть образование транс -гликолей при расщеплении циклических эпоксидов. Действительно, при кислотно-катализируемом гидролизе циклогексеноксида или циклопентеноксида образуются исключительно транс -1,2-диолы.
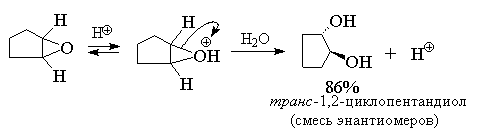
Таким образом, двухстадийный процесс эпоксидирования алкена с последующим кислотным гидролизом эпоксида суммарно соответствует реакции анти -гидроксилирования алкенов.
Обе стадии анти -гидроксилирования алкенов можно совместить, если алкен обрабатывать водной 30-70%-ной перекисью водорода в муравьиной или трифторуксусной кислоте. Обе эти кислоты являются достаточно сильными для того, чтобы вызвать раскрытие оксиранового цикла.
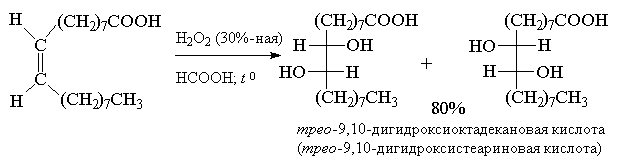
Раскрытие оксиранового кольца, катализируемое основанием, также приводит к образованию циклических транс -гликолей.
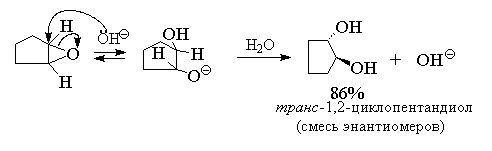
Следовательно, двухстадийный процесс эпоксидирования алкенов с последующим щелочным гидролизом эпоксидов также является реакцией анти -гидроксилирования алкенов.
Некоторые соли и оксиды переходных металлов в высших степенях окисления являются эффективными реагентами син -гидроксилирования двойной связи алкена, когда обе гидроксильные группы присоединяются с одной и той же стороны двойной связи. Окисление алкенов перманганатом калия - один из старейших методов син -гидроксилирования двойной связи - продолжает широко использоваться, несмотря на свойственные ему ограничения. Цис -1,2-циклогександиол был впервые получен В.В. Марковниковым в 1878 году гидроксилированием циклогексена водным раствором перманганата калия при 0 0 С.
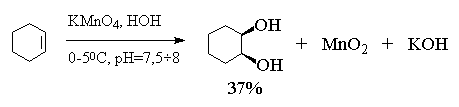
Этот метод в дальнейшем получил развитие в работах русского ученого Е.Е. Вагнера, поэтому син
-гидроксилирование алкенов под действием водного раствора перманганата калия носит название реакции Вагнера. Перманганат калия является сильным окислителем, способным не только гидроксилировать двойную связь, но и расщеплять образующийся вицинальный диол. Для того, чтобы по возможности избежать дальнейшего расщепления гликолей, необходимо тщательно контролировать условия реакции. Выходы гликолей при этом обычно невелики (30-60%). Наилучшие результаты достигаются при гидроксилировании алкенов в слабощелочной среде (рН~8![]() 9) при 0-5 0
С разбавленным 1%-ным водным раствором KMnO4
[17]
.
9) при 0-5 0
С разбавленным 1%-ным водным раствором KMnO4
[17]
.
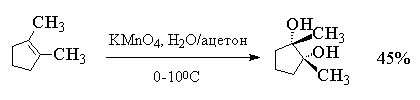
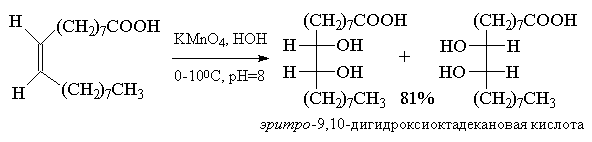
Первоначально при окислении алкенов перманганатом калия образуется циклический эфир марганцевой кислоты, который немедленно гидролизуется до вицинального диола.
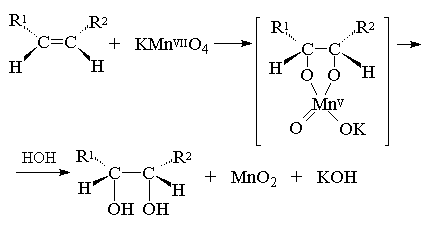
Циклический эфир марганцевой кислоты как интермедиат не был выделен, однако его образование следует из экспериментов с меченым 18 О перманганатом калия: оба атома кислорода в гликоле оказываются мечеными при окислении алкена KMn18 O4 . Это означает, что оба атома кислорода переходят от окислителя, а не из растворителя - воды, что находится в хорошем соответствии с предлагаемым механизмом.
Другой метод син -гидроксилирования алкенов под действием оксида осмия (VIII) OsO4 был предложен Р. Криге в 1936 году. Тетраоксид осмия представляет собой бесцветное, летучее, кристаллическое вещество, хорошо растворимое в эфире, диоксане, пиридине и др. органических растворителях. При взаимодействии тетраоксида осмия с алкенами в эфире или диоксане образуется черный осадок циклического эфира осмиевой кислоты - осмат, который легко может быть изолирован в индивидуальном виде. Присоединение OsO4 к двойной связи заметно ускоряется в растворе в пиридине. Разложение осматов до вицинальных гликолей достигается действием водного раствора гидросульфита натрия или сероводородом.
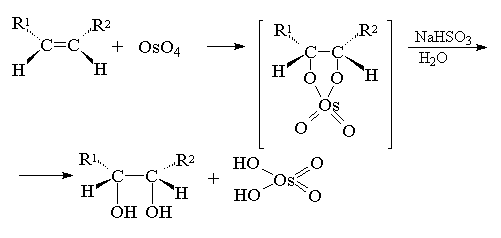
Выходы продуктов син -гидроксилирования алкенов в этом методе значительно выше, чем при использовании перманганата в качестве окислителя. Важным достоинством метода Криге является отсутствие продуктов окислительного расщепления алкенов, характерного для перманганатного окисления[18] .
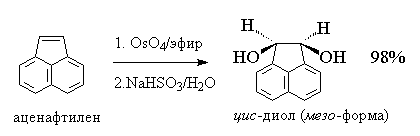
Тетраоксид осмия очень дорогой и труднодоступный реагент, к тому же он токсичен. Поэтому оксид осмия (VIII) используется при синтезе малых количеств трудно доступных веществ с целью получения наиболее высокого выхода диола. С целью упрощения син -гидроксилирования алкенов под действием OsO4 была разработана методика, позволяющая использовать лишь каталитические количества этого реагента. Гидроксилирование алкенов осуществляется с помощью перекиси водорода в присутствии OsO4 , например:
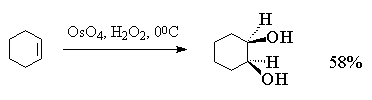
В заключение можно привести стереохимические отношения между алкеном цис - или транс -конфигурации и конфигурацией образующегося вицинального диола, который может быть цис - или транс -изомером, эритро - или трео -формой, мезо - или D,L -формой в зависимости от заместителей в алкене[20] :

Аналогичные стереохимические отношения наблюдаются и в других реакциях син - или анти -присоединения по кратной связи водорода, галогенводородов, воды, галогенов, гидридов бора и др. реагентов.
3. Окислительное расщепление алкенов
При окислении алкенов щелочным водным раствором перманганата калия при нагревании или раствором KMnO4 в водной серной кислоте, а также при окислении алкенов раствором оксида хрома (VI) CrO3 в уксусной кислоте или дихроматом калия и серной кислотой первоначально образующийся гликоль подвергается окислительной деструкции. Конечным результатом является расщепление углеродного скелета по месту двойной связи и образование в качестве конечных продуктов кетонов и (или) карбоновых кислот в зависимости от заместителей при двойной связи. Если оба атома углерода при двойной связи содержат только по одной алкильной группе, конечным продуктом исчерпывающего окисления будет смесь карбоновых кислот, тетразамещенный при двойной связи алкен окисляется до двух кетонов. Однозамещанные алкены с концевой двойной связью расщепляются до карбоновой кислоты и углекислого газа[21] .
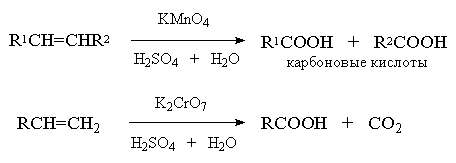
Из-за невысоких выходов карбоновых кислот и кетонов, реакции исчерпывающего окисления алкенов в классическом варианте не нашли широкого применения и ранее использовались, в основном, для установления строения исходного алкена по продуктам деструктивного окисления. В настоящее время окисление алкенов (R-CH=CH-R и R-CH=CH2 ) до карбоновых кислот (RCOOH) с помощью перманганата или дихромата калия проводят в условиях межфазного катализа. Выходы карбоновых кислот при этом превышают 90%.
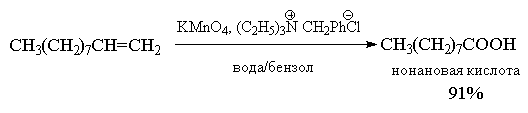
4.Озонолиз алкенов
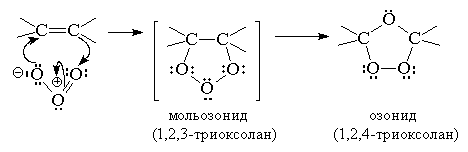
Реакция алкенов с озоном является наиболее важным методом окислительного расщепления алкенов по двойной связи. В течение многих десятилетий эта реакция служила основным методом определения строения исходного углеводорода, а также находила применение в синтезе разнообразных карбонильных соединений. Реакция алкена с озоном проводится пропусканием тока ~5%-ной смеси озона и кислорода в раствор алкена в хлористом метилене или этилацетате при -800
![]() -1000
С. Окончание реакции контролируется пробой на свободный озон с иодидом калия. Механизм этой своеобразной и сложной реакции установлен главным образом благодаря работам Криге. Первым продуктом 1,3-диполярного циклоприсоединения к двойной связи является так называемый мольозонид (1,2,3-триоксолан). Этот продукт нестабилен и далее самопроизвольно разлагается с раскрытием цикла и образованием в качестве конечного продукта нормального озонида (1,2,4-триоксолана)[23]
.
-1000
С. Окончание реакции контролируется пробой на свободный озон с иодидом калия. Механизм этой своеобразной и сложной реакции установлен главным образом благодаря работам Криге. Первым продуктом 1,3-диполярного циклоприсоединения к двойной связи является так называемый мольозонид (1,2,3-триоксолан). Этот продукт нестабилен и далее самопроизвольно разлагается с раскрытием цикла и образованием в качестве конечного продукта нормального озонида (1,2,4-триоксолана)[23]
.
В настоящее время общепризнано, что превращение мольозонида в обычный озонид происходит по механизму расщепления - рекомбинации. Мольозонид претерпевает самопроизвольное раскрытие нестабильного 1,2,3-триоксоланового цикла с образованием карбонильного соединения и биполярного иона, которые далее реагируют между собой также по схеме 1,3-диполярного циклоприсоединения.
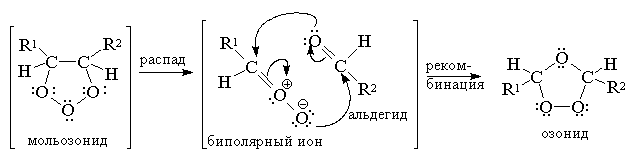
Приведенная схема перегруппировки мольозонида в нормальный озонид подтверждается тем, что если до полного образования озонида в реакционной смеси присутствует в качестве "перехватчика" биполярного иона другое карбонильное соединение, то образуется так называемый "смешанный озонид". Так, например, при озонилизе цис -стильбена в присутствии бензальдегида, меченного изотопом 18 О, метка входит в состав эфирного, а не перекисного мостика озонида:
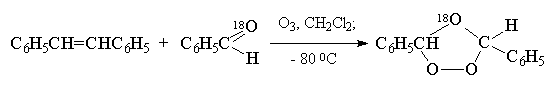
Этот результат хорошо согласуется с образованием смешанного озонида при рекомбинации биполярного иона с меченным бензальдегидом:
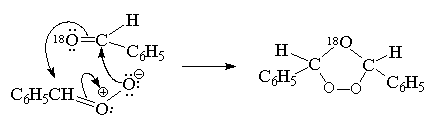
Озониды представляют собой очень нестабильные соединения, разлагающиеся со взрывом. Их не выделяют в индивидуальном виде, а расщепляют при действии самых разнообразных регентов. Следует различать восстановительное и окислительное расщепление. При гидролизе озониды медленно расщепляются на карбонильные соединения и перекись водорода. Перекись водорода окисляет альдегиды до карбоновых кислот. Это так называемое окислительное разложение озонидов:
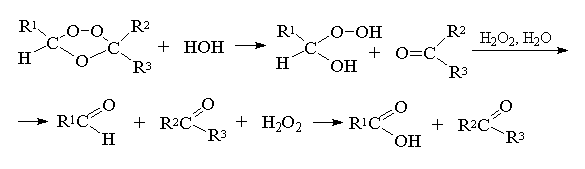
Таким образом, при окислительном разложении озонидов образуются карбоновые кислоты и (или) кетоны в зависимости от строения исходного алкена. В качестве окислителей можно использовать кислород воздуха, перекись водорода, перкислоты или гидроокись серебра. Наиболее часто в синтетической практике для этой цели используют перекись водорода в уксусной или муравьиной кислоте, а также перекись водорода в щелочной среде.
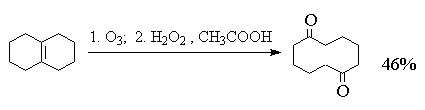
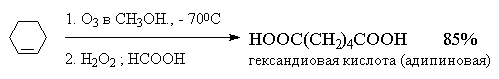
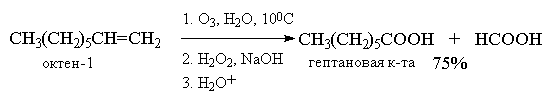
На практике метод окислительного разложения озонидов используется, в основном, для получения карбоновых кислот.
Более важное значение имеет восстановительное расщепление озонидов. В качестве восстановителей наиболее часто используются цинк и уксусная кислота, трифенилфосфин или диметилсульфид. В этом случае конечными продуктами озонолиза оказываются альдегиды или кетоны в зависимости от строения исходного алкена.
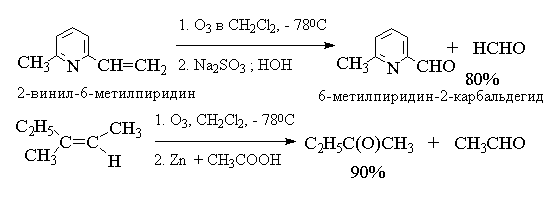
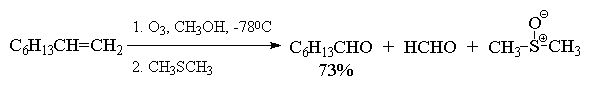
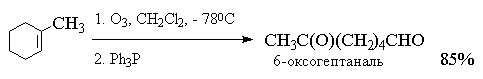
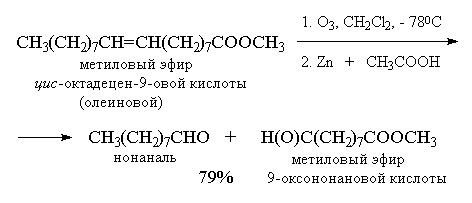
Из приведенных выше примеров видно, что тетразамещенный при двойной связи алкен при озонолизе и последующем восстановительном разложении озонида образует два кетона, тогда как тризамещенный алкен дает кетон и альдегид. Дизамещенный симметричный алкен при озонолизе образует два альдегида, а алкены с концевой связью - альдегид и формальдегид.
Интересной модификацией озонолиза является метод, где в качестве восстановителя озонида используется боргидрид натрия, В этом случае конечными продуктами реакции оказываются первичные или вторичные спирты, образующиеся при восстановлении соответственно альдегидов и кстонов[26] .
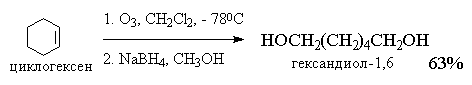
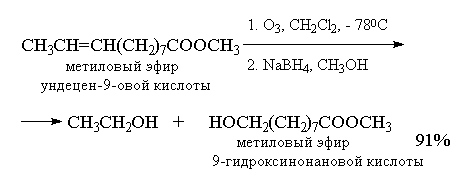
Озонолиз алкенов - это сложный, трудоемкий и взрывоопасный процесс, требующий применения специальной аппаратуры. По этой причине были разработаны другие методы окислительного расщепления алкенов до карбонильных соединений и карбоновых кислот, которые с успехом заменяют реакцию озонолиза в синтетической практике.
Один из современных препаративных методов окислительной деструкции алкенов был предложен в 1955 г Р. Лемье. В основе этого метода лежит гидроксилирование алкенов с помощью перманганата калия с последующим расщеплением вицинального гликоля периодатом натрия NaIO4
при рН ~ 7![]() 8. Периодат сам по себе не взаимодействует с алкеном. Продуктами этого двухстадийного окислительного расщепления являются кетоны или карбоновые кислоты, поскольку альдегиды в этих условиях также окисляются до карбоновых кислот. В методе Лемье не возникает трудоемкой проблемы отделения одного из продуктов реакции, - двуокиси марганца, так как и двуокись, и манганат вновь окисляются периодатом до перманганат-иона. Это позволяет использовать только каталитические количества перманганата калия. Ниже приведены некоторые типичные примеры окислительного расщепления алкенов по методу Лемье.
8. Периодат сам по себе не взаимодействует с алкеном. Продуктами этого двухстадийного окислительного расщепления являются кетоны или карбоновые кислоты, поскольку альдегиды в этих условиях также окисляются до карбоновых кислот. В методе Лемье не возникает трудоемкой проблемы отделения одного из продуктов реакции, - двуокиси марганца, так как и двуокись, и манганат вновь окисляются периодатом до перманганат-иона. Это позволяет использовать только каталитические количества перманганата калия. Ниже приведены некоторые типичные примеры окислительного расщепления алкенов по методу Лемье.

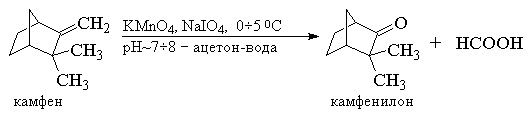
Цитронеллол - спирт, входящий в состав розового масла, масла герани и лимона, - окисляется смесью перманганата калия и периодата натрия в водном ацетоне при 5![]() 10 0
С до 6-гидрокси-4-метилгексанкарбоновой кислоты с количественным выходом.
10 0
С до 6-гидрокси-4-метилгексанкарбоновой кислоты с количественным выходом.
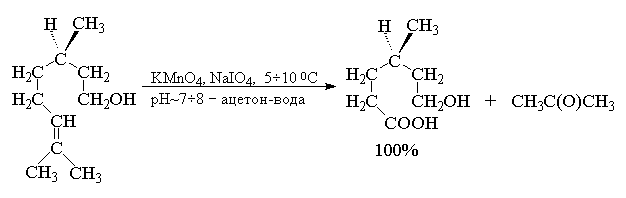
В другой разновидности этого метода вместо перманганата калия используют каталитические количества тетраоксида осмия (Лемье, Джонсон 1956 г). Особое достоинство комбинации OsO4 и NaIO4 заключается в том, что она позволяет остановить окисление на стадии альдегида. Тетраоксид осмия присоединяется к двойной связи алкена с образованием осмата, который окисляется периодатом натрия до карбонильных соединений с регенерацией четырехокиси осмия.
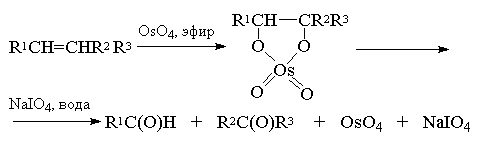
Вместо тетраоксида осмия можно использовать и тетраоксид рутения RuO4 . Окислительная деструкция алкенов по Лемье-Джонсону приводит к тем же продуктам, что и озонолиз с восстановительным расщеплением озонидов.
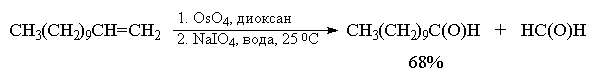
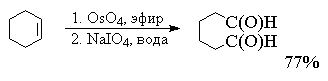
В терминах, характерных для современной органической химии, это означает, что комбинация OsO4 -NaIO4 представляет собой синтетический эквивалент реакции озонолиза алкенов с последующим восстановительным расщеплением. Аналогично, окисление алкенов смесью перманганата и периодата - это синтетический эквивалент озонолиза с окислительным разложением озонидов.
Таким образом, окисление алкенов - это не только совокупность препаративных методов получения спиртов, эпоксидов, диолов, альдегидов, кетонов и карбоновых кислот, это также один из возможных путей установления структуры исходного алкена. Так, по результату, окислительной деструкции алкена можно определить положение двойной связи в молекуле, тогда как стереохимический результат син- или анти- гидроксилирования алкена позволяет сделать вывод о его геометрии.
5.Окисление алкенов в присутствии солей палладия
Окислению алкенов в карбонильные соединения с помощью хлорида палладия посвящен значительное количество исследований в основном благодаря важному значению для промышленности реакции получения ацетальдегида из этилена (Вакер-процесс). В ходе окисления хлорид палладия восстанавливается в палладий, и такой процесс представлял бы ограниченный интерес, если бы не то обстоятельство, что дорогой хлорид палладия можно использовать в каталитических количествах в присутствии второго окислителя, чаще всего хлорида меди(II),который окисляет палладий в палладий(II),сам восстанавливаясь при этом до меди (I).Реокисление меди(I) в медь(II) можно осуществить атмосферным кислородом, так что суммарный процесс весьма привлекателен в качестве промышленного метода окисления[27] .
Этилен легко окисляется до ацетальдегида[28] :
Предполагаемый механизм[29] :
Реакция идет в кислой среде, не сопровождается изменением числа атомов углерода в молекуле этилена и является в настоящее время основным источником ацетальдегида в промышленности.
Окисление гомологов этилена в тех же условиях идет по наименее гидрогенезированному атому углерода двойной связи с образованием кетонов. В частности, при окислении пропена получают ацетон, а при окислении циклогексена-циклогексанон.
Заключение
Реакция окисления является важной группой реакций двойной связи. Вообще, реакции окисления в органической химии занимают особое место. При рассмотрении этих реакций приходится учитывать не только природу окисляемого органического соединения, но и природу окислителя, наличие или отсутствие катализатора, среды, в которой протекает реакция и т.д.
Поэтому приходится очень часто запоминать окислители и условия их применения для получения нужного продукта окисления. Например, реакция окисления алкенов разбавленным раствором перманганата калия приводит к образованию диолов (гликолей), в то время как концентрированный раствор перманганата калия разрушает молекулу алкена по двойной связи с образованием кислородсодержащих продуктов. Таким образом, один и тот же окислитель в различных средах дает разные продукты окисления.
Среди реакций окисления наиболее важной считается рассмотренная нами реакция озонирования, которая позволяет по конечным продуктам установить структуру исходного алкена. В данной работе были рассмотрены основные реакции окисления алкенов и катализаторы, которые используются в ходе окислительных процессов.
Список использованных источников:
1)Реутов О. А. Органическая химия.В 4-х частях.Ч. 1.-М.:БИНОМ. Лаборатория знаний,2004.-567с.
2)Реми Г. Курс неорганической химии. Т. 1. М.: Изд-во иностранной литературы, 1963. – 920 с.
3) Казаков Д.В., Волошин А.И., Казаков В.П., Шерещовец В.В., Кабальнова Н.Н. Химия и хемилюминесценция диоксиранов. М.: Наука, 1999
4) Травень В.Ф. Органическая химия: Учебник для вузов: В 2 т / В.Ф.Травень. — М.: ИКЦ «Академкнига», 2004. — Т. 1
5)Хейнс А. Методы окисления органических соединений. Алканы, алкены, алкины и арены. М.: Мир, 1988.
6)Моррисон Р., Бойд Р. "Органическая химия" М.:Мир, 1974
7)Шабаров Ю.С. "Органическая химия" ч.1 М.:Химия 1994
8)Петров А.А.,Бальян Х. В.,Трощенко А.Т. Органическая химия:Учебник для вузов.-5-е изд.,перераб. И доп.-СПб.: «Иван Федоров»,2002.-624 с.
9)Л. Физер,М. Физер Органическая химия.Углубленный курс.Том 1-М., «Химия»,1969 г.,688 с.
10)Плотников В.Ф.,Питерская Ю.Л. Алкены.Учебное пособие.-СПб:СПбГТИ(ТУ)-2003.-20 с.
11) Нейланд О. Я. Глава II. Алкены // Органическая химия: Учеб. для хим. вузов. — М.: «Высшая школа», 1990.
12) Марч Д. Органическая химия: В 4-х т./Пер. с англ. – М.: Мир, 1987. – Т. 4. 470 с.
13) Терней А. Современная органическая химия: В 2-х т. – М.: Мир, 1981.
14) Гауптман З., Грефе Ю., Ремане Х. "Органическая химия" М.:Химия, 1979
15) Дрюк В.Г., Малиновский М.С. "Курс органической химии" Киев:Вища школа 1987
16) http://www.chemistry.ssu.samara.ru/chem2/u442.htm
17) http://www.xumuk.ru/
[1] Петров А.А.,Бальян Х.В.,Трощенко А.Т. Органическая химия: Учебник для вузов,с.85
[2] http://kosmin.ru/ozon/
[3] Реми Г. Курс неорганической химии. Т. 1.,с.817
[4] http://www.xumuk.ru/encyklopedia/1801.html
[5] http://www.xumuk.ru/encyklopedia/792.html
[6] http://www.internetseti.ru/index/o/osmix.php
[7] В. П. Казаков, А. И. Волошин, Д. В. Казаков. Диоксираны: от окислительных превращений до хемилюминесценции, с.286
[8] О.А.Реутов, А.Л.Курц, К.П. Бутин Органическая химия Ч.1,с. 422
[9] Травень В.Ф. Органическая химия: Учебник для вузов. Т.1,с.279
[10] О.А.Реутов, А.Л.Курц, К.П. Бутин Органическая химия Ч.1,с..423
[11] О.А.Реутов, А.Л.Курц, К.П. Бутин Органическая химия Ч.1,с. 424
[12] Хейнс А. Методы окисления органических соединений. Алканы, алкены, алкины и арены, с.112
[13] Травень В.Ф. Органическая химия: Учебник для вузов. Т.1,с.280
[14] Травень В.Ф. Органическая химия: Учебник для вузов. Т.1,с.280
[15] Л.Физер, М.Физер Органическая химия. Углубленный курс. Том 1, с.217
[16] О.А.Реутов, А.Л.Курц, К.П. Бутин Органическая химия Ч.1,с. 425
[17] О.А.Реутов, А.Л.Курц, К.П. Бутин Органическая химия Ч.1,с. 428
[18] Травень В.Ф. Органическая химия: Учебник для вузов. Т.1,с.280
[19] Хейнс А. Методы окисления органических соединений. Алканы, алкены, алкины и арены, с.90
[20] О.А.Реутов, А.Л.Курц, К.П. Бутин Органическая химия Ч.1,с. 430
[21] О.А.Реутов, А.Л.Курц, К.П. Бутин Органическая химия Ч.1,с. 431
[22] Травень В.Ф. Органическая химия: Учебник для вузов. Т.1,с.283
[23] Л.Физер, М.Физер Органическая химия. Углубленный курс. Том 1, с.231
[24] Р. Моррисон, Р. Бойд. Органическая химия, с.203
[25] О.А.Реутов, А.Л.Курц, К.П. Бутин Органическая химия Ч.1,с. 434
26 Травень В.Ф. Органическая химия: Учебник для вузов. Т.1,с.285
27 Хейнс А. Методы окисления органических соединений. Алканы, алкены, алкины и арены, с.146
[28] Травень В.Ф. Органическая химия: Учебник для вузов. Т.1,с.285
[29] Шабаров Ю.С. Органическая химия. Ч.1 Нециклические соединения, с.58