| Скачать .docx |
Реферат: Комплексы Связи координационная дативная Обратное связывание
Комплексы. Связи координационная, дативная. Обратное связывание (универсальное !).
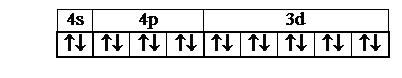
Комплексные соединения. Координационная связь. Дативная связь. Валентная конфигурация центрального атома металла 3d10 4s2 4p6 . Правило «18 электронов» (Правило устойчивости комплексов).
Валентные эффекты в координационных соединениях очень наглядны на примере карбонилов переходных металлов. Имеется превосходная возможность для сравнения молекулы оксида углерода в свободном состоянии и в виде лиганда в комплексах.
Карбонилы переходных металлов. Cr(CO)6; Fe(CO)5; Ni(CO)4;
О взаимном расположении уровней АО в молекуле говорить в строгом смысле сложно, – они имеют статус лишь базисных единиц, а не волновых функций в строгом смысле. Тем не менее, валентная конфигурация центрального атома металла в каждом из этих трёх карбонилов может быть представлена в виде 3d104s24p6 в условном порядке увеличения главного квантового числа.
Если последовательность уровней этих базисных АО связать с увеличением числа узлов и лепестков, то конфигурация принимает вид 4s24p63d5. На шкале молекулярных уровней энергии связывающие s-орбитали лежат ниже, и поэтому нагляднее схема
В неё включены все электроны валентного слоя центрального атома и валентные электроны лигандов. У выступающей в качестве лиганда молекулы CO эту роль играет неподелённая электронная пара 5sn2, заселяющая несвязывающую ВЗМО. Часть электронов относится к обеспечивающим s-связывание гибридным орбиталям центрального атома, форма которых определяется максимальным перекрыванием с орбиталями лигандов.
Наиболее эффективна гибридизация с участием s-АО. Учитывая s-АО в составе гибрида, получаем разные числа смешивающихся базисных АО центрального атома у каждого из трёх карбонилов. Оставшиеся вне гибрида 3d-АО центрального атома обеспечивают перекрывание p-типа с лигандами.
Связывающие и разрыхляющие МО лигандов. Частоты колебаний связи CO.
Обратное связывание металл-лиганд на примере карбонилов.
Пиктографическая схема обратного связывания.

Cr¬C=O Гибридизация АО и соединения платины:
![]() PtCl2; PtCl4; [PtCl4]2-; [Pt(NH3)2]2-; [PtCl6]2-;
PtCl2; PtCl4; [PtCl4]2-; [Pt(NH3)2]2-; [PtCl6]2-;
PtCl4(NH3)2; [Pt(CO)4]2+; [Pt(CN)4]2-; PtF62-;
Геометрия аниона соли Цейзе: K+[PtCl3(C2H4)]- :
Молекула этена ориентирована перпендикулярно плоскости аниона.
Наблюдается обратное связывание.
Платина p-донор, s-акцептор. Этен
p-акцептор на разрыхляющую p*-МО,
но s-донор на dsp2-гибридную s-АО платины.
|
Методы ионизационной фотоэлектронной спектроскопии (ФЭС-РЭС) дают возможность прямого экспериментального исследования орбитальных уровней МО, а также и заселённостей АО базиса.
В основе метода лежит фотоэффект, независимо открытый Столетовым и Герцем. Идея построения ионизационного спектрометра принадлежит нашему фотохимику академику Теренина.
Метод реализовал шведский учёный Карл Зигбан, за это удостоен нобелевской премии.
Основными энергетическими диапазонами ионизирующего излучения в методе ФЭС являются ультрафиолетовый и рентгеновский. В ультрафиолетовом диапазоне осуществляется спектроскопия электронов внешнего валентного (оптического) слоя. В рентгеновском диапазоне осуществляется спектроскопия внутренних электронов (1s слоя)-РЭС. ФЭС доступны уровни валентного слоя, РЭС- уровни внутренние (1s, ..).
Физическая идея эксперимента состоит в измерении кинетической энергии выбиваемых электронов. Основное соотношение:
Квант поля = Работа выхода + Кинетическая энергия выбитого электрона
hi = Wi + mV2 /2; Wi = ПИi = - Ei ; (Теорема Купманса);
У рассмотренных молекул следует ожидать нескольких потенциалов ионизации. Интенсивность фототока, образуемого выбиваемыми из оболочки электронами, пропорциональна кратности вырождения уровня, с которого происходит ионизация. Участие разрыхляющих МО в формировании связи в карбонилах d-элементов подтверждается понижением частот собственных валентных колебаний группы CO.
Частоты валентных колебаний, силовые константы и длины связей различных карбонильных групп
| Соединение |
n (CO), см-1 |
k(CO)10- 5 , дн/см-1 |
| CO |, Ao |
| CºO |
2150 |
18.6 |
1.13 |
| Ni(CºO)4 |
2057 |
16.2 |
1.15 |
| H2 C=C=O |
1935 |
14.5 |
1.17 |
| H2 C=O |
1750 |
12.1 |
1.21 |
Частоты валентных колебаний карбонильной группы в молекуле и в некоторых карбонилах металлов
| Соединение |
n |
n (CO), см-1 |
| CºO |
2150 |
|
| Ni(CºO)4 |
0 |
2057 |
| [Co(CºO)4 ]- |
-1 |
1886 |
| [Fe(CºO)4 ] 2- |
-2 |
1786 |
| Mn2 (CºO)10 |
0 |
2074, 2015, 1972 |
| [Cr2 (CºO)10 ] 2- |
-1 |
1945, 1922, 1897 |
| Fe(CºO)5 |
0 |
2034, 2014 |
| [Mn(CºO)5 ]- |
-1 |
1898, 1863 |
| Re2 (CºO)10 |
0 |
2049, 2013, 1983 |
| [W2 (CºO)10 ] 2- |
-1 |
1944, 1906, 1882 |
Правило «18 электронов» соблюдается у молекул «сэндвичей»:
Cr(C6 H6 )2 (симметрия D6 h ); Fe(C5 H5 )2 (симметрия D5 d ); Ru(C5 H5 )2 (симметрия D5 h );
Ti(C6 H6 )2 ; Zr(C6 H6 )2 ; Hf(C6 H6 )2 .
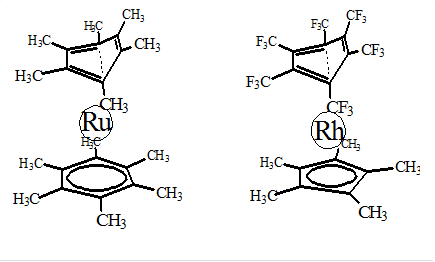
Правило «18 электронов» «вызывает» искажения колец в “сэндвичах” рутения и родия: Ru[C6 (CH3 )6 ]2 ; Rh[C6 (CF3 )2 ](C5 H5 ); (см. рисунок). Чтобы удовлетворить правилу «18 электронов», в оболочку центра от двух колец-лигандов должно включиться всего 10 внешних электронов. Это происходит благодаря тому, что искажается геометрия одного из двух колец арен надламывается, его система сопряжения нарушается, и одна его p-связь от металла отдаляется, и вблизи металла оказываются две p-связи сломанного кольца; Правило 18 в комплексе оказывается «сильнее» критерия ароматичности в кольце-лиганде...
Ориентировочное содержание.
1) «Сэндвичи» (ценовые структуры).
2) «Правило 18» и сэндвичи с искажённой геометрией ароматического лиганда.
3) Полярная связь. Уровни и составы МО. Электронные распределения. Диполи.
4) Многоатомные молекулы гидридов. Коллективные орбитали лигандов и многоцентровые МО.
«Сэндвичи» - комплексы с плоскими многоцентровыми ароматическими лигандами. Их ещё называют «ценовыми» соединениями.
Их оболочка отвечает правилу «18 электронов»:
Наиболее устойчивы оболочки комплексов,
содержащие 18 электронов в валентном слое центрального атома.
Примеры:
1) Cr [C6 H6 ]2 ; ® Геометрия правильная, есть ось симметрии 6-го порядка..
Особенность структуры имеет место у двух сэндвичей:
2) Ru [C6 (CH3 )6 ][C6 (CH3 )6 ] ; ® Геометрия одного из двух 6-членного циклов искажена.
3) Rh [C5 H5 ][C6 (CF3 )6 ] ; ® Геометрия 6-членного цикла искажена.
К электронам собственной конфигурации самого центрального атома добавляются электроны, находящиеся на координационных (s-) связях с лигандами.
Электронный баланс у центрального атома у двух последних сэндвичей на первый взгляд привёл бы к 20 электронам.
Однако форма лигандов искажается – они так «надламываются», что в поле центра остаётся всего 18 e: Одна связь C=C в одном из циклов комплекса-сэндвича выходит из плоскости...
44 Ru (5s1 4d7 ) ®8e +6e ´2 =20>18 ® надлом одного цикла C6 .
45 Rh (5s1 4d8 )®9e +6e+5e =20>18 ® надлом цикла C6 .
В обоих случаях имеет место надлом кольца. Одна двойная связь удаляется от центра, и её электронная пара уже не попадает в его оболочку. За счёт этого на базисных АО центра восстанавливается электронный баланс стандартной оболочки из 18 валентных электронов.
Полярная связь.
Уровни и составы МО. Электронные распределения. Дипольные моменты.
Граничные МО гидридов ответственны за основную долю зарядовой асимметрии в системе МО. Электронное распределение смещено к базисной АО с более низким уровнем. Её коэффициент в составе МО больший. Больше и парциальная (и следовательно полная) электронная заселённость этого атома. На нём возникает отрицательный центр молекулярного диполя. К нему направлен вектор дипольного момента.
Два предельных случая. Примеры 1 (LiH) и 2 (HF):
Молекулы гидридов предельных элементов 2-го Периода Системы Менделеева
+ Li Þ LiH (пример 1)
H ® + F Þ HF (пример 2)
| Моле-кулы |
r0 , Ao |
Ho , кДж/моль |
k´105 , дн/см |
, D |
| HF |
0.92 |
586.2 |
9.66 |
1.82 |
| HCl |
1.28 |
431.3 |
5.16 |
1.12 |
| HBr |
1.42 |
364.3 |
4.1 |
0.78 |
| HJ |
1.61 |
297.3 |
3.1 |
0.38 |
Полярные связи и МО:
Образуется общая пара, она смещена
Li-H « Li+ H- ¬ либо к атому H
H- F « H + F- ¬ либо от атома H
Представим МО у молекул с полярными связями в следующем виде:
LiH; j(LiH) = h± ´1s(H)± l± ´2s(H) (-13.6; -5.5) эВ ® h± >l± ® h± 2 >l± 2
HF; j(HF) = h± ´1s(H) ± f± ´2p(F) (-13.6; -17.4) эВ ® h± <f± ® h± 2 <f± 2
Уровень связывающей МО всегда ниже нижнего уровня исходных АО.
Уровень разрыхлюящей МО всегда выше высшего уровня исходных АО.
Зарядовая асимметрия очень высокая.
Вектор дипольного момента считается направленным от плюса к минусу.
Пиктограммы и профильные диаграммы имеют больший «всплеск» у атома, у которого базисная АО лежит ниже. Он акцептор. К нему смещена электронная плотность. Вектор дипольного момента ориентирован от плюса к минусу.
Эта связь полярная. Она и ковалентная, и частично ионная одновременно, однако без полного переноса электронов от одного атома к другому. Электронное облако деформировано. Есть аналогия со связью донорно-акцепторного типа, но в полярной связи электронная пара совместная – по одному электрону от каждого атома, образующего связь, и резонансные структуры учитывают и пару электронов, и частичное смещение заряда. Полного переноса электронов от одного атома к другому нет.
Полярная связь описывается наложением раздельных ковалентной и ионной структур.
m (LiH)= -5.9 D Li+ H- « Li¾H
m (HF) = 1.8 D H+ F- « H ¾F
Напротив, у донорно-акцепторной связи этих символы пишутся раздельно.
Химические символы всегда беднее оригинала. Электронно-ядерная структура молекулы сложнее, чем могут передать графические средства и символы, выработанные современной теорией.
В органической химии для качественного изображения электронного распределения на полярной связи используют один из графических способов посредством изогнутых стрелок, указывающих смещение зарядов.
Получить числа – коэффициенты при базисных АО в составе МО легко прямым расчётом МО ЛКАО как в упрощённых версиях теории, так и в неэмпирических расчётах.
Полярная связь является одним из наиболее распространённых видов связи...
В сочетании с ионной связью и донорно-акцепторными взаимодействиями можно качественно описать множество известных молекулярных структур
Типы химических связей (простое перечисление):
1) Гомеополярная (ковалентная)
2) Гетерополярная (ионная)
3) Полярная (валентные символы)
4) Донорно-акцепторная (валентные символы)
5) Металлическая
6) Водородная
7) Силы Ван-дер-Ваальса
Орбитальные характеристики атомов 1-2 Периодов.
По теореме Купманса потенциалы ионизации суть энергии орбиталей с обратным знаком. В таблице приведены потенциалы ионизации и электронное сродство.
| H |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
|
| Z |
1 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
1-й ПИ, эВ |
13.62 |
5.377 |
9.281 |
8.28 |
11.23 |
14.48 |
13.57 |
17.37 |
21.509 |
ЭС, эВ |
0.747 |
0.82 |
-0.19 |
0.38 |
2.1;1.12 |
0.05 |
1.465 |
3.58;3.50 |
- |
| E2s2p , эВ |
теор. |
1.85 |
3.36 |
5.76 |
8.77 |
12.39 |
16.53 |
21.54 |
Эти же данные удобно округлить:.
| 1ПИ,эВ |
СЭ,эВ |
|DSP|=E2s2p , эВ |
||
| H |
1 |
13.6 |
0.7 |
- |
| Li |
3 |
5.4 |
0.8 |
2 |
| Be |
4 |
9.3 |
-0.2 |
3 |
| B |
5 |
8.3 |
0.4 |
6 |
| C |
6 |
11.2 |
1.1 |
9 |
| N |
7 |
14.5 |
0.1 |
12 |
| O |
8 |
13.6 |
1.5 |
17 |
| F |
9 |
17.4 |
3.5 |
22 |
| Ne |
10 |
21.5 |
- |
- |
Многоатомные молекулы. Многоцентровые МО молекул гидридов элементов 2-го периода.
Молекулы BeH2 ; BH3 ; CH4 ; NH3 ; H2 O. Коллективные орбитали и уровни МО.
Атомные составы молекул и валентный базис с минимальным числом необходимых АО:
Гидрид бериллия АО(Be+H1 +H2 ) ® (2s;2px ;2py ;2pz ) (1s1 ;1s2 )
Гидрид бора АО(B+H1 +H2 +H3 ) ® (2s;2px ;2py ;2pz ) (1s1 ;1s2 ;1s3 )
Метан АО(C+H1 +H2 +H3 +H4 ) ® (2s;2px ;2py ;2pz ) (1s1 ;1s2 ;1s3 ;1s4 )
Аммиак АО(N+H1 +H2 +H3 ) ® (2s;2px ;2py ;2pz ) (1s1 ;1s2 ;1s3 )
Вода АО(O+H1 +H2 ) ® (2s;2px ;2py ;2pz ) (1s1 ;1s2 )
Молекулы с двумя лигандами. Орбитали двух эквивалентных атомов подобны H2 + .
(a;b;c;d) (g;h)
(g;h) ® [(g+h); (g-h)] ® символы (A,B)
Молекулы с тремя лигандами. Орбитали трёх эквивалентных атомов подобны циклу H3 + .
(a;b;c;d) (g;h;i)
(g;h;i) ®[(g+h+i); (g+h-2i) /A; (g-h) /B] ® символы (A,E)
Молекулы с четырьмя лигандами. Орбитали четырёх эквивалентных атомов нетрудно получить из узловых свойств.
(a;b;c;d) (g;h;i;k)
(g;h;i;k) ®[(g+h+i+k); (g+h-i-k); (g-h+i-k); (g-h-i+k);] ®символы (A,T)
Устанавливая систему координат, ориентируем в ней АО. Одна p-АО вдоль оси.
Две другие ей перпендикулярны.
В линейных и треугольных молекулах две p-АО центра из трёх совершенно эквиваленты, образуя дважды вырожденный базис.
В четырёхугольных молекулах они вписаны в куб симметричным образом.
При построении уровней МО полезно придерживаться элементарных правил:
01) Уровни базисных АО полезно представлять более-менее в масштабе.
02) Перекрывание вызывает расщепление.
03) Перерываются орбитали лишь одинаковой симметрии.
04) Связь сильнее разрыхления
05) Уровни МО повышаются с увеличением числа узлов.
06) В общей декартовой системе координат молекулы АО центрального атома предпочтительно ориентировать максимально симметрично.
07) Соответственно, лиганды удобно располагать симметричным способом.
08) Орбитали эквивалентных лигандов образуют симметричные линейные комбинации.
09) Их вид определяется симметрией фигуры, образуемой лигандами. Чаще всего это линия, треугольник, квадрат, ... тетраэдр,...и т.д....
10) Расщепление уровней симметричных орбиталей лигандов считаем почти нулевым, так как лиганды удалены друг от друга в пространстве, и перекрыванием между их АО можно пренебречь...
11) Полезно выделить гипотетические стадии формирования базисов центра и лигандов.
12) У центра АО гибридизуются.
13) У лигандов симметризуются.
14) Базис эквивалентных лигандов образован многоцентровыми коллективными орбиталями.
Связи и МО в молекулах гидридов элементов II периода: LiH, HF; Трёхцентровые МО: Молекула BeH2 ; Многоцентровые -МО: BH3 , NH3 , H2 O, CH4 .
Молекула CH4 . Стереохимия. Гибрид sp3 : (s, px , py , pz )®(f1 , f2 , f3 , f4 )
Атом С-(Центр) Гибридные АО f(С):
f1g = s+px +py +pz
f2g = s+px - py -pz
f3g = s- px +py - pz
f4g = s- px - py +pz
Базис направленных валентностей-связей
Атом С-(Центр) Базисные АО:
f1 =S; (0 узлов)
f2 =Px ; (1 узел)
f3 =Py ; (1 узел)
f4 =Pz ; (1 узел)
a®(f1 );
t®(f2 , f3 , f4 );
Базис МО
Атомы H1 , H2 , H3 , H4 –(Лиганды)
Симметричные орбитали СО:
1 = s1 +s2 +s3 +s4 ; (0 узлов)
2 = s1 +s2 -s3 -s4 ; (1 узел)
3 = s1 -s2 +s3 -s4 ; (1 узел)
4 = s1 - s2 -s3 +s4 ; (1 узел)
a®(1 );
t®(2 , 3 , 4 )
Базис МО
|