| Скачать .docx |
Реферат: Обычное и необычное вещество вода
Оглавление
Введение…………………………………………………………………….3
Основная часть
1. Свойства воды…………………………………………………………5
2. Строение молекулы воды…………………………………………….10
Заключение…………………………………………………………………12
Библиография………………………………………………………………13
Приложение…………………………………………………………………14
Введение
Вода – одно из самых распространённых веществ в природе (гидросфера занимает 71 % поверхности Земли). Воде принадлежит важнейшая роль в геологии, истории планеты. Без воды невозможно существование живых организмов. Дело в том, что тело человека почти на 63% - 68% состоит из воды. Практически все биохимические реакции в каждой живой клетке – это реакции в водных растворах. В растворах же (преимущественно водных) протекает большинство технологических процессов на предприятиях химической промышленности, в производстве лекарственных препаратов и пищевых продуктов. И в металлургии вода чрезвычайно важна, причём не только для охлаждения. Не случайно гидрометаллургия – извлечение металлов из руд и концентратов с помощью растворов различных реагентов – стала важной отраслью промышленности.
Вода – вещество обычное и необычное. Известный советский учёный академик И. В. Петрянов свою научно-популярную книгу о воде назвал "самое необыкновенное вещество в мире". А "Занимательная физиология", написанная доктором биологических наук Б. Ф. Сергеевым, начинается с главы о воде – "Вещество, которое создало нашу планету".
Учёные абсолютно правы: нет на Земле вещества, более важного для нас, чем обыкновенная вода, и в тоже время не существует другого такого вещества, в свойствах которого было бы столько противоречий и аномалий, сколько в её свойствах.
Почти ⅔ поверхности нашей планеты занято океанами и морями. Твёрдой водой – снегом и льдом – покрыто 20% суши. От воды зависит климат планеты. Геофизики утверждают, что Земля давно бы остыла и превратилась в безжизненный кусок камня, если бы не вода. У неё очень большая теплоёмкость. Нагреваясь, она поглощает тепло; остывая, отдаёт его. Земная вода и поглощает, и возвращает очень много тепла и тем самым "выравнивает" климат. А от космического холода предохраняет Землю те молекулы воды, которые рассеяны в атмосфере – в облаках и в виде паров…
Свойства воды
Наиболее полно изучены свойства воды, благодаря которым возникла жизнь. Эти свойства сделали возможным существование живой природы в том диапазоне температур, который характерен для Земли как космического тела.
Что же это свойства?
Плотность воды.
Одно из важнейших свойств воды - ее плотность. Максимальную плотность пресная вода имеет при 4 °С. При этой температуре один килограмм воды занимает минимальный объем (рис.1 ) . При понижении температуры от 4 °С до 0 плотность уменьшается, т. е. вода с температурой 4°С находится внизу, а более холодная поднимается наверх, где и замерзает, превращаясь в лед.
Плотность обычного льда - твердой кристаллической фазы воды - меньше плотности воды, поэтому лед плавает на поверхности, предохраняя воду от дальнейшего охлаждения. Он выступает в роли ледяной «шубы», защищающей пресноводный объект от полного промерзания. Таким образом формируются условия для жизни обитателей водоемов при низких температурах.
В морской воде растворено значительное количество солей, и она ведет себя при охлаждении совершенно по-другому. Температура ее замерзания зависит от солесодержания, но в среднем составляет - 1,9°С. Максимальная плотность такой воды - при температуре -3,5°С. Морская вода превращается в лед, не достигая максимальной плотности. Поэтому происходит вертикальное перемешивание морской воды при ее охлаждении от плюсовой температуры до температуры замерзания. Благодаря такой циркуляции нижние горизонты океана обогащаются кислородом, а в верхние слои из нижних поступает вода, богатая питательными веществами. Необходимо отметить, что как морской, так и пресный лед легче воды и плавает на ее поверхности, предохраняя глубинные слои воды в морях и океанах от непосредственного контакта с холодными массами воздуха и способствуя тем самым сохранению тепла. В то же время искусственно при высоком давлении были получены разные модификации льда. Одни из них тяжелее воды, другие плавятся и, следовательно, замерзают при высокой температуре. Это так называемый «горячий лед». Поэтому всем нам повезло не только с наличием на Земле воды и солнечной радиации, но и с величиной атмосферного давления. Иначе вся Земля могла бы оказаться скованной ледяным панцирем.
Термодинамические константы воды.
Вода имеет особенные, аномальные свойства. В первую очередь это касается таких термодинамических констант, как теплоемкость воды, теплота парообразования, скрытая теплота плавления льда. Аномальаный характер этих величин определяет большинство физико-химических и биологических процессов на Земле.
Удельная теплоемкость воды составляет 4,1868 кДж/(кг-К), что почти вдвое превышает удельную теплоемкость таких веществ, как этиловый спирт (2,847), растительное масло (2,091), парафин (2,911) и многие другие. А это значит, что при нагревании на одинаковое количество градусов вода способна воспринять почти вдвое больше тепла, чем перечисленные жидкости. Но и при остывании вода отдает больше тепла, чем другие жидкости. Поэтому при нагревании вод Мирового океана под воздействием солнечных лучей и их остывании при отсутствии энергии солнечной радиации теплоемкость выступает как свойство, обеспечивающее минимальные колебания температуры воды днем и ночью, летом и зимой.
Аномально высокое значение имеет теплота парообразования воды. Эта величина более чем вдвое превышает теплоту парообразования этанола, серной кислоты, анилина, ацетона и других веществ. Поэтому даже в самое жаркое время вода испаряется крайне медленно, что способствует ее сохранению и, следовательно, сохранению жизни на Земле.
Высокое значение скрытой теплоты плавления льда также обеспечивает стабильность температурного режима на планете.
Одно из интересных свойств воды заключается в том, что ее наименьшая теплоемкость приходится на температуру 37 °С, а это значит, что при данной температуре необходимы минимальные энергетические затраты для ее изменения. Наверное, поэтому температура тела теплокровных существ близка к этому значению.
Вода имеет аномально высокие значения и других констант. Вещества, образованные соединением водорода со стоящими в одном ряду периодической таблицы кислородом, серой, селеном, теллуром, называются гидридами. Гидрид кислорода называется водой. Необычность свойств гидрида кислорода, по сравнению со свойствами других гидридов, заключается в том, что, в отличие от них, вода в обычных условиях (при нормальном давлении и температуре от 0 до 100 °С) находится в жидком состоянии, а не в газообразном. Если бы вода не обладала аномальными значениями температуры кипения и замерзания, то эти процессы происходили бы при значительно более низких отрицательных температурах, и вода в жидком виде присутствовала бы на более холодных планетах. И следовательно, жизни на Земле не было бы.
Сила поверхностного натяжения воды.
Есть и другие особые свойства воды, которые позволяют назвать ее поистине удивительнейшим соединением. Речь идет о поверхностном натяжении жидкости. Силы взаимодействия молекул, составляющих воду, притягивают их друг к другу, и разорвать эту связь не так просто. Большинству людей известен школьный опыт, когда осторожно положенная в блюдце с водой иголка плавает на поверхности. Многие видели интереснейший фокус, когда в полный стакан воды опускают значительное количество монет и вода, не переливаясь через край, поднимается небольшим куполом. Наконец, известна библейская легенда о том, как Христос шел по воде. Все эти явления и легенды связаны с большим поверхностным натяжением воды. Благодаря поверхностному натяжению, вода поднимается по капиллярным каналам в грунте на поверхность Земли, поступает в ткани и клетки растений и живых организмов. Из всех известных жидкостей только у ртути сила поверхностного натяжения выше, чем у воды.
Известна очень интересная особенность воды, связанная с распространением в ней звуковых волн. Скорость распространения звука в воде аномально высока, она превышает скорость его распространения в воздухе почти в 6 раз.
Свойства чистой воды.
Чистая вода представляет собой прозрачную жидкость без цвета и запаха. При давлении 1 атм вода замерзает при температуре 0, а кипит при 100 °С. При повышении давления вдвое вода закипает при температуре 120 °С, а при понижении вдвое - при 81 °С. Однако при уменьшении давления температура плавления льда (или замерзания воды) повышается. При низких давлениях вода может существовать только в виде льда или пара, а при высоких температурах - только в виде пара. Существуют также критические значения давления и температуры воды. При давлении свыше 22,1 атм. и температуре свыше 374,4°С исчезает разница между жидкостью и паром вода существует в газообразном состоянии.
Удивительные значения давления и температуры атмосферы сложились на Земле, так как именно при этих значениях вода присутствует на планете в жидком виде, обеспечивая развитие всех существующих форм жизни. При этих параметрах происходит растворение в воде кислорода, необходимого для жизни водных организмов, а также для протекания процессов самоочищения воды. На протяжении многих тысячелетий наличие атмосферы, гидросферы и солнечного излучения создавало незначительный перепад температур летом и зимой, днем и ночью, обеспечивая условия для существования жизни.
Способность воды к растворению.
Однако самая удивительная особенность воды - ее способность растворять другие вещества. Способность веществ к растворению зависит от их диэлектрической постоянной. Чем она выше, тем больше способно вещество растворять другие. Так вот, для воды эта величина выше, чем для воздуха или вакуума в 9 раз. Поэтому пресные или чистые воды практически не встречаются в природе. В земной воде всегда что-то растворено. Это могут быть газы, молекулы или ионы химических элементов. Считается, что в водах Мирового океана могут быть растворены все элементы таблицы периодической системы элементов, по крайней мере, на сегодня их обнаружено более 80.
Строение молекулы воды
Эти два элемента - водород и кислород - являются антагонистами. Один из них господствует в Космосе, другой - на Земле. Один (водород) стремится отдать единственный электрон своей электронной оболочки, а другой (кислород) стремится заполучить два электрона от других химических элементов.
Анализируя состав молекулы воды , можно сказать, что в ней два атома водорода и один атом кислорода «нашли друг друга». Таким образом, в составе воды, химическая формула которой записывается как Н2 0 теоретически могут присутствовать девять различных стабильных видов воды (число перестановок из 5 по 3) Однако 99,97% всей води - в гидросфере представлено обычной водой вида 1 Н2 16 0. доля тяжелой воды 2 Н2 16 0 составляет менее 0,02%.
Современной науке известно несколько моделей, с помощью которых можно разрешить многие аномальные свойства воды. Считается, что некоторые свойства определяются количеством ассоциаций молекул мономеров (Н2
О)1
, димеров (Н2
О)2
и тримеров (Н2
О)3
, которые преимущественно присутствуют в воде при различных температурах.
Так, при температуре около 0 в воде присутствуют в основном тримеры, при температуре около 4°С - димеры, а в газообразном состоянии вода содержит главным образом мономеры. Иногда эти ассоциации называют тригидролями.
Некоторые ученые предлагают рассматривать воду как совокупность ассоциаций молекул, включая при этом в каждую ассоциацию от одной до восьми молекул. Другие считают, что структура воды представляет собой пространственное «кружево», образованное различными «мерцающими кластерами» (рис.2). Третьи предлагают исследовать свойства воды с учетом особенностей строения ее молекулы, которые, в свою очередь, определяются особенностями составляющих молекулу воды элементов. В соответствии с современными представлениями, молекула воды похожа на маленький магнит.
Почему в воде присутствуют растворенные вещества?
Датский ученый Н. Бьеррум в 1951 г. предложил модель молекулы воды с точечным распределением зарядов. В соответствии с современными представлениями, молекула воды представляет собой тетраэдр (или пирамиду, ( рис. 3), в середине которого размещен центр молекулы, а в углах – электрические заряды.
Два положительных заряда соответствуют двум атомам водорода, каждый из которых «предоставил» свои электроны атому кислорода, и т отрицательных заряда, соответствующих «непарным» электронам кислорода. Таким образом, молекула воды представляет собой диполь, один из полюсов которого имеет положительный заряд, а другой - отрицательный. Полюсы диполя разнесены на некоторое расстояние, поэтому в электростатическом поле диполь воды разворачивается вдоль линий напряженности электрического поля. Если электростатическое поле образовано отрицательно заряженным ионом, то диполь воды разворачивается к этому иону своим положительным полюсом, и наоборот. Свойства воды как растворителя во многом определяются поляризованным строением ее молекулы. Высокая полярность молекул является причиной активности воды при химических взаимодействиях, при растворении в ней солей, кислот и оснований, т. е. при образовании электролитов. Вода способна растворять многие вещества, создавая с ними однородные физико-химические системы переменного состава. Растворенные в природных водах соли находятся в ионном состоянии, т. е. подвергнуты электролитической диссоциации.
Заключение
В ходе курсовой работы были рассмотрены свойства и строение молекулы воды. Вода – это вещество на первый взгляд обычное, но если рассмотреть его более подробно, то можно выяснить много чего интересного и необычного. Во первых, вода – это источник жизни на Земле, если бы не было воды то не зародилась бы жизнь. Во вторых, свойства которыми обладает вода, не обладает не одно вещество. Вода может находиться в трех агрегатных состояниях, при определенной температуре. Вода также может принимать и отдавать тепло, и испарятся медленнее чем другие вещества. Более того, в воде могут распространяться звуковые волны и причем с очень высокой скоростью. Но самое удивительное свойство воды, это способность растворять другие вещества.
Что же касается строения воды, то оно по своему также уникально. Вода состоит из двух атомов водорода и одного атома кислорода, можно сказать что эти атомы просто нашли друг друга. Но ученые до сих пор не могут разгадать всех особенностей строения этого удивительного вещества, и многое для нас всех остается загадкой.
Вот что представляет собой на первый взгляд обычное вещество. А ведь никто и не задумывался о том когда каждый день сталкивается с водой, что это столь не вероятное и очень не обычное вещество, хранящее в себе много неразгаданных тайн. Но до конца нам их и не разгадать, в этом и есть вся необычность и особенность воды, без которой бы мы никогда не появились на свет.
Библиография
1. Ахметов Н.С., Неорганическая химия. М., 2001г.
2. Глинка Н.Л., Общая химия. СПб, 2003г.
3. Кнунянц И. Л., Химическая энциклопедия. Том 1. М., 2002г.
4. Петрянов И.В., Самое необыкновенное вещество в мире. М., 2005г.
5. Хомченко Г.П. , Химия для поступающих в ВУЗы. М., 2002г.
Приложение
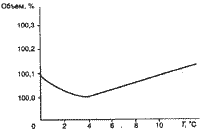
( рис 1.)
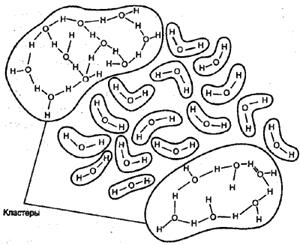
( рис. 2)
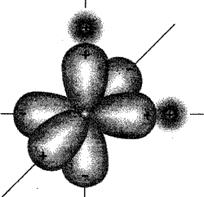
( рис.3)