| Скачать .docx |
Реферат: Молекулярная фотометрия и спектрофотометрия
КУРСОВАЯ РАБОТА
|
По дисциплине __________________________________________________________
(наименование учебной дисциплины согласно учебному плану)
| |
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Тема: Молекулярная фотометрия и спектрофотометрия
ВЫПОЛНИЛА: студ. ______________ /./
(подпись) (Ф.И.О.)
ОЦЕНКА: _____________
ДАТА: __________________
ПРОВЕРИЛ: доцент _____________ /./
(подпись) (Ф.И.О.)
Санкт-Петербург
2010
КУРСОВАЯ РАБОТА
По дисциплине: _____________Методы контроля и анализа веществ __________________
(наименование учебной дисциплины согласно учебному плану)
Студента группы .
(шифр группы) (Ф.И.О)
1. Тема проекта: Молекулярная фотометрия и спектрофотометрия.
2. Выходные данные к проекту: методическое указание «Физико-химические методы анлиза» (Санкт-Петербург, 2000)
3. Содержание пояснительной записки: задание на выполнение работы, библиографический список.
4. Срок сдачи законченного проекта: 15. 12. 10
Руководитель проекта: доцент ____________ /. /
Дата выдачи задания: 15. 09. 10
Оглавление
Краткая историческая справка - 3 -
Понятие «спектральный анализ» - 3 -
Ограничения и условия применимости закона Бугера-Ламберта-Бера - 3 -
Молекулярный спектральный анализ - 3 -
Принципиальная схема спектрометра - 3 -
Библиографический список - 3 -
Аннотация
Данная пояснительная записка представляет собой отчет о выполнении курсового проекта. В ней рассматриваются основные вопросы молекулярной фотометрии и спектрофотометрии.
Страниц 15, рисунков 2.
The Summary
The given explanatory note represents the report on performance of the course project. In it are considered main questions of molecular photometry and spectrophotometric analysis.
Pages 15, figures 2.
Краткая историческая справка
Спектроскопия вообще и молекулярная спектроскопия в частности – это разделы физики, занимающиеся изучением качественного и количественного составов электромагнитного излучения, поглощенного, испущенного, рассеянного или отраженного веществом. Электромагнитное излучение, разложенное по длинам волн или по энергии, образует спектр. В качестве объектов спектрометрического исследования могут быть использованы самые разнообразные вещества, находящиеся в любых агрегатных состояниях. В простейшем случае это разреженный газ, среднее расстояние между молекулами которого настолько велико, что их можно рассматривать изолированно друг от друга. В наиболее сложном случае это конденсированное тело, в котором каждая образующаяся его частица находится под влиянием сил межмолекулярного взаимодействия. В связи с этим из спектроскопических данных можно получать информацию как о структуре и свойствах молекул, так и о силах межмолекулярного взаимодействия, а следовательно, и о строении вещества в целом.
В развитии спектроскопии как физического метода исследования веществ можно выделить два основных этапа. Первый этап представляет собой период эмпирического накопления фактов (разложение белого света в спектр с помощью призмы – Ньютон, 1666г.; наблюдение линий и полос поглощения – Волластон и Фраунгофер, 1802-1814гг.), установления многих фундаментальных феноменологических закономерностей (связь между поглощательной и излучательной способностью вещества – Кирхгоф, 1859г.; влияние на спектральные линии внешних магнитных и электрических полей – Зееман, 1896г., Штарк, 1913г.), а также попыток теоретического описания и интерпретации наблюдаемых зависимостей (классическая теория поглощения и дисперсии – вторая половина XIXв.; гипотеза квантов энергии – Планк, 1900г.).
Второй этап, начавшийся после формулировки Бором в 1913г. своих знаменитых квантовых постулатов и последовавшего за этим бурного развития квантовой теории, ознаменовался тем, что спектроскопия была поставлена на прочную научную основу. Значительный вклад в это внесли русские и в особенности советские ученые (Рождественский, Вавилов, Басов, Прохоров и пр.). В настоящее время спектроскопия и , в частности, молекулярная спектроскопия является одним из важнейших и перспективных физических методов исследования веществ, что делает ее особенно эффективной при решении разнообразных задач современной химии.
Понятие «спектральный анализ»
Под названием спектральный анализ понимают физический метод анализа химического состава вещества, основанный на исследовании спектров испускания и поглощения атомов или молекул. Эти спектры определяются свойствами электронных оболочек атомов и молекул, колебаниями атомных ядер в молекулах и вращением молекул, а также воздействием массы и структуры атомных ядер на положение энергетических уровней.
Различные типы спектрального анализа следует рассматривать с трех позиций:
1. По решаемым задачам:
· Элементный – устанавливается состав пробы по элементам
· Изотопный – устанавливается состав пробы по изотопам
· Молекулярный – устанавливается молекулярный состав пробы
· Структурный – устанавливаются структурные составляющие молекулярного соединения
2. По применяемым методам:
· Эмиссионный, использующий спектры поглощения, главным образом атомов.
· Абсорбционный, использующий спектры поглощения, главным образом молекул и их структурных частей
· Комбинационный, использующий спектры комбинационного рассеяния твердых, жидких и газообразных проб, возбуждаемые монохроматическим излучением
· Люминесцентный, использующий спектры люминесценции вещества, возбуждаемые ультрафиолетовым излучением или катодными лучами
· Рентгеновский, использующий рентгеновские спектры атомов, получающиеся при переходах внутренних электронов в атомах, или дифракцию рентгеновых лучей при прохождении их через исследуемый объект для изучения структуры вещества
· Радиоспектроскопический, использующий спектры поглощения молекул в микроволновом участке спектра с длинами волн больше 1 мм
3. По характеру получаемых результатов:
· Качественный, когда в результате анализа определяется состав без указания на количественное соотношение компонентов
· Полуколичественный, когда результат выдается в виде оценки содержания компонентов в некоторых более или менее узких интервалах концентраций в зависимости от применяемого метода приближенной количественной оценки
· Количественный, при котором выдается точное количественное содержание определяемых элементов или соединений в пробе.
Законы поглощения света
Молекулярный анализ с помощью спектров поглощения основан на использовании законов поглощения света. Формальное выражение этих законов одинаково для излучения любых частот, от инфракрасных до ультрафиолетовых.
Рассмотрим наиболее простой случай, когда лучи монохроматического света проходят через поглощающее вещество параллельным пучком, причем ослабление света определяется только числом поглощающих молекул, находящихся на пути лучей, и не зависит от абсолютной величины потока, а также от взаимного влияния молекул. В более сложных случаях требуются дополнительные расчеты, при которых используются законы ослабления пучка параллельных лучей. Первый из законов поглощения, открытый французским ученым Бугером (1729г.) и подробно проанализированный Ламбертом (1760г.) можно сформулировать следующим образом: каждый бесконечно тонкий слой внутри однородной среды поглощает определенную долю входящего в него потока излучения, пропорциональную его толщине. Вторая закономерность была установлена Бером (1852г.): поглощение данным тонким слоем однородной среды пропорционально числу содержащихся в нем поглощающих молекул, а следовательно также числу их в единице объема среды, т.е. концентрации. Установленные опытным путем Бугером, Ламбертом и Бером закономерности можно выразить математическим выражением:
![]() (1)
(1)
где ![]() - показатель поглощения света, рассчитанный на единицу концентрации вещества и на единицу толщины слоя, - константа, не зависящая от интенсивности падающего света и концентрации вещества (но зависящая от длины волны света). Физический смысл
- показатель поглощения света, рассчитанный на единицу концентрации вещества и на единицу толщины слоя, - константа, не зависящая от интенсивности падающего света и концентрации вещества (но зависящая от длины волны света). Физический смысл ![]() становится понятней, если принять
становится понятней, если принять ![]() см и
см и ![]() моль/л, тогда
моль/л, тогда ![]() . Следовательно, молярный коэффициент поглощения равен оптической плотности одномолярного раствора при толщине слоя 1 см.
. Следовательно, молярный коэффициент поглощения равен оптической плотности одномолярного раствора при толщине слоя 1 см.
Интегрируя выражение (1) от 0 до ![]() , получим:
, получим:
![]() (2)
(2)
закон Бугера-Ламберта-Бера. Предположение о пропорциональности ![]() концентрации имеет приближенный характер. Оно справедливо для газов при малых давлениях и для растворов при малых концентрациях. Когда происходит сближение молекул при увеличении давления газа или увеличении концентрации раствора С, показатель поглощения
концентрации имеет приближенный характер. Оно справедливо для газов при малых давлениях и для растворов при малых концентрациях. Когда происходит сближение молекул при увеличении давления газа или увеличении концентрации раствора С, показатель поглощения ![]() обычно начинает изменяться вследствие физико-химического взаимодействия молекул.
обычно начинает изменяться вследствие физико-химического взаимодействия молекул.
В случае невозможности установить значение С поглощение относят к слою единичной толщины, полагая ![]() , т.е.
, т.е. ![]() или
или ![]() (закон Бугера-Ламберта). В этом случае величину k
называют показателем поглощения, отнесенным к слою единичной толщины.
(закон Бугера-Ламберта). В этом случае величину k
называют показателем поглощения, отнесенным к слою единичной толщины.
Закон Бугера-Ламберта-Бера справедлив только для монохроматического излучения; кроме того, в качестве ![]() рассматривался световой поток, только что вступивший в исследуемый слой вещества, а в качестве
рассматривался световой поток, только что вступивший в исследуемый слой вещества, а в качестве ![]() - покидающий его.
- покидающий его. ![]() обычно не равно интенсивности излучения
обычно не равно интенсивности излучения ![]() , падающего на поверхность твердого образца или на поверхность кюветы с раствором, так же как
, падающего на поверхность твердого образца или на поверхность кюветы с раствором, так же как ![]() не равно интенсивности
не равно интенсивности ![]() излучения, вышедшего из твердого образца или из слоя раствора. Это неравенство обусловлено уменьшением измеряемых величин
излучения, вышедшего из твердого образца или из слоя раствора. Это неравенство обусловлено уменьшением измеряемых величин ![]() и
и ![]() вследствие отражения при переходе излучения в среду с другим коэффициентом преломления. Кроме того, интенсивность может уменьшаться и вследствие поглощения окошками кюветы и растворителя.
вследствие отражения при переходе излучения в среду с другим коэффициентом преломления. Кроме того, интенсивность может уменьшаться и вследствие поглощения окошками кюветы и растворителя.
Задача спектрофотометрии состоит в определении ![]() и
и ![]() по измеряемым значениям
по измеряемым значениям ![]() и
и ![]() . В случае твердых тел
. В случае твердых тел ![]() определяют при помощи измерения величин
определяют при помощи измерения величин ![]() и
и ![]() для двух образцов различной толщины
для двух образцов различной толщины ![]() и
и ![]() . Если
. Если ![]() больше
больше ![]() и
и ![]() , то при условии, что поверхности обоих образцов имеют одинаковые коэффициенты отражения:
, то при условии, что поверхности обоих образцов имеют одинаковые коэффициенты отражения: ![]() . Этот метод применим также при измерении поглощения жидкости.
. Этот метод применим также при измерении поглощения жидкости.
В случае измерения поглощения растворами необходимо исключить также поглощение, обусловленное растворителем. Для этой цели обычно используют две тождественные кюветы. Одну из них заполняют раствором, а другую – растворителем. Если отсутствует взаимодействие между исследуемым веществом и растворителем![]() и если оптические параметры обеих кювет одинаковы, то измеренное отношение:
и если оптические параметры обеих кювет одинаковы, то измеренное отношение: ![]() для исследуемого растворенного вещества ( здесь
для исследуемого растворенного вещества ( здесь ![]() - показатель поглощения растворителя, а
- показатель поглощения растворителя, а ![]() - показатель поглощения исследуемого вещества).
- показатель поглощения исследуемого вещества).
В аналитической литературе также пользуются написанием Бугера-Ламберта-Бера в логарифмическом виде:
![]()
Если вместо натуральных логарифмов использовать десятичные логарифмы, то
![]() или
или ![]()
где ![]() называют десятичным показателем поглощения на единицу концентрации С вещества. Эту величину называют также коэффициентом погашения или экстинкцией. Величины
называют десятичным показателем поглощения на единицу концентрации С вещества. Эту величину называют также коэффициентом погашения или экстинкцией. Величины ![]() и
и ![]() связаны соотношениями
связаны соотношениями ![]() и
и ![]() . Отношение светового потока, прошедшего через тело, к потоку, упавшему на тело
. Отношение светового потока, прошедшего через тело, к потоку, упавшему на тело ![]() , называют коэффициентом пропускания и обозначают буквой Т. Величину отношения потока излучения, поглощенного данным телом, к потоку излучения, упавшего на него
, называют коэффициентом пропускания и обозначают буквой Т. Величину отношения потока излучения, поглощенного данным телом, к потоку излучения, упавшего на него ![]() , называют коэффициентом поглощения. Обратный логарифм коэффициента пропускания называют оптической плотностью
, называют коэффициентом поглощения. Обратный логарифм коэффициента пропускания называют оптической плотностью ![]() .
.
![]()
![]()
Оптическая плотность раствора, содержащего несколько окрашенных веществ, обладает свойством аддитивности, которое иногда называют законом аддитивности светопоглощения. В соответствии с этим законом поглощение света каким-либо веществом не зависит от присутствия в растворе других веществ. При наличии в растворе нескольких окрашенных веществ каждое из них будет давать свой аддитивный вклад в экспериментально определяемую оптическую плотность:
![]()
где ![]() - оптическая плотность вещества 1,2, n
- оптическая плотность вещества 1,2, n
Концентрацию вещества С выражают в различных единицах. Для газов (и растворов) ее можно выражать числом ![]() молекул в 1 см3
. Соответствующий этому случаю показатель поглощения
молекул в 1 см3
. Соответствующий этому случаю показатель поглощения ![]() называют молекулярным и относят к одной молекуле. Концентрацию растворенного вещества выражают также числом С грамм-молей в 1 литре раствора. В этом случае показатель поглощения принято обозначать буквой
называют молекулярным и относят к одной молекуле. Концентрацию растворенного вещества выражают также числом С грамм-молей в 1 литре раствора. В этом случае показатель поглощения принято обозначать буквой ![]() и называть молярным показателем поглощения. Численное соотношение между обоими коэффициентами можно получить из соотношения
и называть молярным показателем поглощения. Численное соотношение между обоими коэффициентами можно получить из соотношения ![]()
![]()
Ограничения и условия применимости закона Бугера-Ламберта-Бера
Зависимость оптической плотности от концентрации графически выражается прямой линией, выходящей из начала координат. Опыт показывает, что линейная зависимость выполняется не всегда. При практическом применении закона Бугера-Ламберта-Бера необходимо учитывать следующие ограничения:
1. Закон справедлив для монохроматического света.
2. Коэффициент ![]() зависит от показателя преломления среды. Если концентрация раствора сравнительно невелика, его показатель преломления остается практически таким же, каким он был у чистого растворителя, и отклонений от закона по этой причине не наблюдается.
зависит от показателя преломления среды. Если концентрация раствора сравнительно невелика, его показатель преломления остается практически таким же, каким он был у чистого растворителя, и отклонений от закона по этой причине не наблюдается.
3. Температура при измерениях должна оставаться постоянной хотя бы в пределах нескольких градусов.
4. Пучок света должен быть параллельным.
5. Закон соблюдается только для систем, в которых светопоглощающими центрами являются частицы одного сорта.
Молекулярный спектральный анализ
Молекулярный спектральный анализ предполагает качественное и количественное определение молекулярного состава пробы по молекулярным спектрам поглощения и испускания. Эти методы применяются для промышленного контроля молекулярного состава проб, например, при производстве красителей, бензинов и т.д. Молекулярные спектры очень сложны, так как возможны различные электронные переходы в молекулах (электронные спектры), колебательные переходы с изменением колебательных состояний ядер атомов, входящих в состав молекулы (колебательный спектр), и изменения вращательных состояний молекулы (вращательный спектр). Эти спектры расположены в различных областях длин волн.
При проведении абсорбционного анализа по спектрам поглощения проба берется в газообразном, жидком или твердом состоянии, помещается между источником сплошного спектра (лампа накаливания для видимой области спектра, водородная или криптоновая лампа для ультрафиолетовой области, раскаленный штифт для инфракрасной области) и спектральным прибором. Спектр поглощения анализируется при помощи спектрометра или спектрофотометра.
Применение
Спектроскопия считается прикладной наукой и отличается большой информативностью. В молекулярной спектроскопии можно выделит следующие основные направления ее применения в науке и технике.
1. Идентификация веществ. Она основана на том, что каждое соединение, включая изомеры, имеет свой собственный и только ему присущий спектр. Это свойство используется для качественного анализа тех веществ, спектры которых уже известны.
2. Количественный анализ. Измерение интенсивности молекулярных спектров позволяет проводить с очень высокой чувствительностью количественный анализ различных веществ, не разрушая их.
3. Структурно-групповой (функциональный) анализ. Систематическое изучение спектров веществ с одинаковыми структурными группами показало, что в их спектрах имеются характерные полосы, с помощью которых можно решать обратную задачу – по характеристичным полосам определять в исследуемом соединении наличие той или иной структурной группы.
4. Определение строения молекул и вещества, т.е. пространственного расположения ядер и расстояний между ними.
5. Определение различных тепловых эффектов (напр., теплот испарения) по изменению интенсивности спектров в зависимости от температуры вещества.
6. Исследования межмолекулярного взаимодействия.
Принципиальная схема спектрометра
Фотометрическое измерение заключается в оценке различий в интенсивности двух потоков излучения: падающего на исследуемый объект ![]() и прошедшего через него
и прошедшего через него ![]() на определенной длине волны. Приборы, на которых производят такие измерения, классифицируют по следующим основным принципам:
на определенной длине волны. Приборы, на которых производят такие измерения, классифицируют по следующим основным принципам:
1. По спектральным областям, в которых они работают
2. По способу монохроматизации потока излучений:
· С высокой степенью монохроматизации (призменные и дифракционные монохроматоры)
· С низкой степенью монохроматизации (светофильтры)
3. По способу регистрации интенсивности излучения:
· Визуальные (спектроскопы)
· Фотографические (спектрографы)
· Фотоэлектрические (фотометры, спектрометры, спектрофотометры)
Спектральные приборы, основанные на фотоэлектрическом принципе регистрации спектров, называются спектрометрами (спектрофотометрами). Они получили широкое распространение. Спектрометр состоит из следующих основных узлов: источника излучения, монохроматора 1, кюветного отделения 2, анализатора 3, приемника излучения 4, усилителя 5, регистрирующего устройства 6.
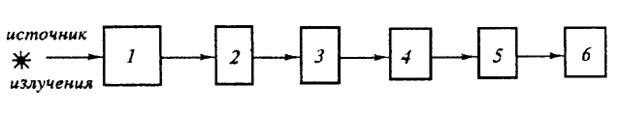
Рис.1. Принципиальная схема спектрофотометра
Для УФ-области спектра в качестве источников излучения используются водородные или более мощные дейтериевые лампы, дающие спектр излучения в области 180-400 нм. Обычным источником видимого излучения от 360 нм до ближней ИК-области является лампа накаливания с вольфрамовой нитью.
В спектрофотометрах применяются как призменные, так и дифракционные монохроматоры. Для уменьшения рассеянного излучения используются двойные монохроматоры либо дополнительные светофильтры.
В качестве приемников в УФ- и видимой областях используют вакуумные фотоэлементы, а также твердотельные фотоэлементы. Для УФ-области (150-400 нм) приемником служит фотоэлемент с сурьмяно-цезиевым фотокатодом, в видимой и ближней ИК-областях (до 1200 нм) применяют элементы с кислородно-цезиевым фотокатодом.
При использовании такого типа приборов построение спектра поглощения по точкам требует большого числа измерений. Кроме того, однолучевые приборы не пригодны для измерения очень малых изменений поглощения. Эти недостатки были устранены в более совершенных двулучевых схемах, которые предусматривают два равноценных пути прохождения излучения от одного и того же источника света. Один проходит через исследуемый образец, другой – через кюветы, содержащую раствор сравнения. Оба потока измеряют по отдельности или с помощью двух приемников излучения, или на одном приемнике с модулятором.
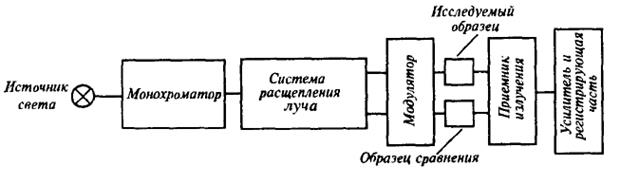
Рис.2. Принципиальная схема двулучевого спектрофотометра
После монохроматора с помощью системы расщепления луч света делится пополам, а затем через модулятор попадает на образец и эталон. На фотоприемник поочередно направляются лучи, проходящие через образец и эталон. При этом чаще всего используется дифференциальный метод регистрации поглощения или пропускания исследуемого образца относительно эталона. Изменяя длину волны света с помощью монохроматора, получают спектр поглощения исследуемого образца.
Библиографический список
1. Бабушкин А.А., Бажулин П.А., Королев Ф.А и др. Методы спектрального анализа (под ред. Левшина В.Л.). М.: Издательство Московского университета, 1962
2. Бахшиев Н.Г. Введение в молекулярную спектроскопию. Ленинград: Издательство Ленинградского университета, 1987
3. Левшин Л.В., Салецкий А.М. Оптические методы исследования молекулярных систем. Молекулярная спектроскопия. М.: Издательство Московского университета, 1994
4. Мальцев А.А. Молекулярная спектроскопия. М.: Издательство Московского университета, 1980
5. Зайдель А.Н., Островская Г.В., Островский Ю.И. Техника и практика спектроскопии. М.: Издательство «Наука», 1972