| Похожие рефераты | Скачать .docx |
Реферат: Кубический нитрид бора
СОДЕРЖАНИЕ:
ВВЕДЕНИЕ:
1. ОБЩАЯ ХАРАКТЕРИСТИКА КУБИЧЕСКОГО НИТРИДА БОРА
2. ОСНОВНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ НИТРИДА БОРА (куб.)
3. СВОЙСТВА БОРАЗОНА
4. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА.
5. ЭЛЕКТРИЧЕСКИЕ И ОПТИЧЕСКИЕ СВОЙСТВА.
6. ПРИМЕНЕНИЕ БОРАЗОНА.
7. РАСЧЁТНАЯ ЧАСТЬ.
8. ВЫВОДЫ.
9. ЛИТЕРАТУРА.
ВВЕДЕНИЕ:
Группа полупроводниковых соединений типа AIII BV на основе бора - одна из наименее изученных среди полупроводниковых соединений с алмазоподобной структурой.
Однако эти соединения представляют большой интерес из-за их высокой химической стойкости, большой ширины запрещённой зоны и других специфических свойств.
Эти свойства обусловлены особым положением бора в периодической системе.
Бор принадлежит к тем элементам второго ряда периодической системы, атомы которых характеризуются наиболее прочными связями. Бор – проводник весьма тугоплавкий (~23000 С) и твёрдый (~3000кг/мм2 ).Всё это даёт основание полагать, что, соединения типа AIII BV на основе бора будут обладать интересными свойствами.
Общая характеристика
кубического нитрида бора (боразона) BN .
Нитрид бора BN - электронный аналог углерода. Как химическое соединение он известен уже свыше 100 лет. Различные способы позволяют получать нитрид бора в гексагональной структуре, имеющей очень большое сходство со структурой графита. Это позволяет предполагать, что возможна кристаллизация нитрида бора и в другой структуре, сходной со структурой второй модификации углерода- алмаза.
Первые сведения о получении кубической модификации BN были опубликованы в 1957г.
Причина такого «запоздалого» получения кубического нитрида бора становится ясной, если попытаться распространить аналогию между углеродом и нитридом бора на физико-химические свойства этих материалов. Алмаз термодинамически устойчив лишь при сверхвысоких давлениях. В отсутствии сверхвысоких давлений стабильной формой существования углерода является гексагональная модификация этого вещества - графит. Поэтому можно было ожидать, что и в случае нитрида бора стабильной фазой при относительно невысоких давлениях будет гексагональная форма BN , а получение кубической модификации этого соединения потребует использование техники сверхвысоких давлений. Неудивительно поэтому, что получение кубического нитрида бора стало возможно лишь во второй половине 50-х годов, когда техника сверхвысоких давлений развилась настолько, что позволила получать давления в сотни тысяч атмосфер при температурах в несколько тысяч градусов. Необходимость создания высоких температур для осуществления аллотропического перехода гексагонального нитрида бора в кубический, так же как и в случае перехода, графит – алмаз, связана с тем, что при относительно низких температурах такой переход «заморожен», то есть протекает с настолько малой скоростью, что практически невозможен. Приведённые выше теоретические соображения были подтверждены главным образом в работах Венторфа. Автору удалось, используя технику сверхвысоких давлений, получить нитрид бора BN в структуре цинковой обманки. Этот кубический нитрид бора получил название «боразон».
Основные методы получения боразона
(кубического нитрида бора).
Описанные в литературе методы получения кубического нитрида бора можно разделить на три группы. Первая группа включает металлы, в которых также используют сверхвысокое давление и аллотропический переход в присутствии катализаторов.
BN (гексаг.) → BN (куб.)
Ко второй группе относятся металлы, в которых также используют сверхвысокое давление, однако в основе их лежит не аллотропическое превращение нитрида бора, а определённая химическая реакция.
Наконец третья группа – получение кубического нитрида бора при явлениях, близких к нормальному.
Высокое давление, необходимое для реализации двух первых методов, создают с помощью аппаратуры, которую применяют для получения искусственных алмазов. Образец, состоящий из исходного продукта и добавленного к нему катализатора, нагревают с помощью тока, проходящего по нагревательной трубке из графита, тантала и др., расположенной в реакционной камере.
Реакционный сосуд, помещаемый в камеру высокого давления, приведён на рис. 1. Сосуд имеет высоту 11,5 мм и диаметр ~ 9 мм.
С помощью такой техники возможны процессы при давлениях в 100.000 атм. И температуре до 25000 С
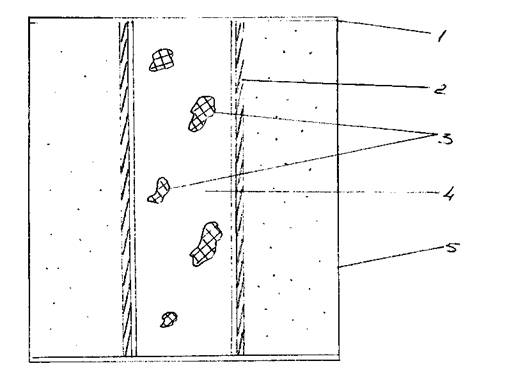
Схема блока, загружаемого в камеру высокого давления.
1- диск из тантала или титана;
2- нагревательная трубка;
3- куски «катализатора»;
4- гексагональный нитрид бора;
5- изолирующий пирофиллит.
Процесс аллотропического превращения В N (гексаг.) → BN (куб.) заключается в выдерживании гексагонального нитрида бора (с добавкой катализатора) при высоких температурах и давлениях. Постепенно температуру уменьшают до «замораживания» превращения, после чего давление понижается до атмосферного.
Получение исходного продукта – гексагонального нитрида бора – не представляет особых трудностей.
Естественно, что в первых опытах по получению боразона, Венторф пытался облегчить аллотропическое превращение BN (гексаг.) → BN (куб.)
Процесс аллотропического превращения BN (гекс.) → BN (куб.) заключается в выдерживании гексагонального нитрида бора ( с добавкой катализатора ) при высоких температурах и давлениях. Постепенно температуру уменьшают до ’’замораживания’’ превращения, после чего давление понижается до атмосферного.
Получение исходного продукта гексанального нитрида бора – не предоставляет особых трудностей.
Естественно, что в первых опытах по получению боразона Венторф пытался облегчить аллотропическое превращение BN (гекс.) → BN (куб.), используя в качестве ’’катализирующих добавок’’ переходные металлы (железо, никель, марганец), т.е. те ’’катализаторы,’’? которые оказались эффективными в случае превращения графит → алмаз.
Однако даже при давлении в 100000 атм. И температурах более 2000 ˚С кубическая форма BN не была обнаружена.
Единственным результатом являлось некоторое укрупнение кристаллов исходного нитрида бора (от 5 до 20 мик.).
Неудачная попытка использовать переходные металлы в качестве ’’катализирующих добавок’’ заставила Венторфа заняться поисками подходящих ’’катализаторов’’.
Ими оказались щелочные и щелочноземельные металлы, а также сурьма, олово и свинец. Использование других элементов не дало положительных результатов.
Найденные ’’катализаторы’’ имели различную эффективность, благо чему в зависимости от применения того или иного из них удавалось осуществлять переход BN (гекс.) → BN (куб.) при различных давлениях(50000-90000 атм.) и температурах (1500-2000 ˚С). Было отмечено, что необходимо для аллотропического превращения давления и температуры возрастают с увеличением атомного веса используемого ’’катализаторы’’. Так, для того чтобы осуществить превращение BN (гекс.) → BN (куб.) с использованием в качестве ’’катализаторов’’ калия или бария необходимо было минимальное давление 70000 атм.
При небольшом понижении давления боразон не образовался, хотя указанные металлы реагировали с гексагональным нитридом бора и диффундировали в него. С другой стороны, при использовании в качестве ’’катализаторов’’ более легких металлов – магния, кальция или лития – уже при давлении в 45000 атм. Наблюдалось образование кубического нитрида бора, причем процесс характеризовался высоким выхлопом этого продукта.
Отмечено также, что эффективность применения ’’катализатора’’ сильно падала в присутствии некоторых процентов воды, борного антифриза и других примесей.
Проведенные исследования позволяют утверждать, что нитрид бора, так же как и углерод, может устойчиво существовать в гексагональной и кубической формах.
Область устойчивого существования боразона лежит при высоких давления и отделена от области гексагонального нитрида бора пограничной линией, соответствующая равновесному существовании обеих кристаллических модификаций нитрида бора. Указанная пограничная линия, так же как и в случае углерода, проходит не параллельно от абсцисс (оси температур), а образует некоторый угол с ней, так что с ростом температуры требуются более высокие давления для того, чтобы переход BN (гекс.) → BN (куб.) оказался возможным.
Сравнение этой пограничной линии с соответствующе линий системы углерода показывают, что при данной температуре переход BN (гекс.) → BN (куб.) наблюдается при более низком давлении, чем переход графит → алмаз.

Рис 2. Фазовая диаграмма углерода.
Фазовая диаграмма боразона сравнена с данной диаграммо й.
Оказалось, что в качестве ’’катализаторов’’ можно использовать также нитриды перечисленных выше металлов. Поскольку применение легких металлов имеет определенные преимущества, в качестве ’’катализаторов’’ использовали нитриды лития, магния, или кальция. Эти ’’катализаторы’’ позволяли получать кристаллы кубического нитрида бора при давлениях 44000-74000 атм. И температурах 1200-2000 ˚С. Общее количество боразона, образующего за один опыт, достигало 0,3 г., а размеры отдельных полиэдрических кристаллов доходили до 0,7 мм.
Наиболее подробно исследована система нитрид бора – нитрид лития. Было установлено, что в этой системе проходит образование комплекса примерно состава Li3N·3BN. Этот комплекс действует как расплавленный растворитель, который растворяет гексагональный BN и заставляет выпадать кубический нитрид бора в силу смещения от термодинамического равновесия в область устойчивости кубической формы при рабочем давлении и температуре.
По-видимому, процесс представляет собой перекристаллизацию нитрида бора из раствора
Li3N·3BN действует как жидкий растворитель, и кристаллизация нитрида бора из раствора происходит при пересыщении последнего. Высокие давления и температуры обуславливают алмазоподобную структуру выпадающих из раствора кристаллов BN. Размер образующихся кристаллов боразона зависит прежде всего от тех давлений и температур, при которых проводится процесс. Чем ближе к пограничной линии между областями существовании кубической и гексагональной форм нитрида бора находятся эти параметры, там крупнее образуются кристаллы. Если процесс проходит у пограничной линии, то при более высоких температурах, то скорость реакции увеличивается; в следствии этого уже небольшие изменения давления или температуры оказывают сильное влияние на качество кристаллов. Поэтому наилучшие кристаллы были выращены при средних значениях давления и температуры (50000 и 1700 ˚С). Время образования кристаллов при таких условиях составляло всего лишь несколько минут. При повышении давления до 70000 атм. кристаллы уменьшились до 0,02 мм, что свидетельствовало о значимом увеличении скорости образования зародышей.
Во вторую группу методов входят химические реакции, которые проводят при сверхвысоких давлениях. В качестве исходных материалов использовались смеси из бора и нитрида лития. При этом наблюдали образование кубического нитрида бора, однако выход процесса и качество кристаллов были хуже, чем при использовании гексагонального нитрида бора и нитрида –’’катализатора’’.
Виккери описывает способ получения кубического нитрида бора при обычном давлении путем азотирования фосфида бора BP при температуре 800 ˚С. Фосфид бора, полученный путем термического соединения BCe3 ·PCe5 , имел вид тонких темных пленок. При обработке этих пленок в токе смеси, состоящей из 5% аммиака им 95% азота, они свели, и происходило выделении фосфина. Рентгеноструктурный анализ полученного продукта показал, что он представляет кубический нитрид бора.
В основе описанного процесса лежит реакция:
BP+NH
3 → BN(куб.)+PH3
Учитывая данные Венторфа и кристаллохимическую близость кубического нитрида бора и алмаза, следует критически подойти к сообщению Виккери, тем более, что за годы, прошедшие с момента опубликования его работы, в литературе не появилось ни одного сообщения, подтверждающего возможность получения боразона таким способом.
Свойства боразона.
Физико-химические свойства
Фазовая диаграмма нитрида бора, равно как и диаграмма состояния системы B-N, не разработана. В литературе имеются сведения, что, кроме нитрида бора BN, в этой системе существуют и другие соединения бора с азотом: триазид бора B(N3 ) 3 и, возможно, низший нитрид бора B3 N.
Химический Анализ кристаллов боразона показал, что они содержат 41,5% (вес.) бора и 50,1% (вес.) азота (теоретический состав BN: 43,6% бора и 50,4% азота). Анализ проводили, растворяя боразон в расплаве NaOH (с титрованием образующегося аммиака), поскольку на него не действуют ни одна из обычных кислот.
Кристаллы боразона не изменяются при нагреве в вакууме до температуры выше 2000 ˚С. При нагреве на воздухе медленное окисление боразона наблюдалось лишь при 2000 ˚С, тогда как алмаз сгорает на воздухе уже при 875 ˚С.
При нагреве боразона под давлением в 40000 атм. Наблюдался переход его в гексагональный нитрид бора при 2500 ˚С.
Боразон кристаллизуется в структуре цинковой обманки (сфалерита) с периодом решетки 3,615±0,001 Ả при 25 ˚С.
Кристаллы боразона, полученные при аллотропическом переходе
BN (гекс.) → BN (куб.) при высоких давлениях, имеют вид полиэдров, обычно тетраэдров или октаэдров. Они прозрачны, а их цвет зависит от наличия тех или иных примесей. Так, бор окрашивает кристаллы боразона, полученного из смесей, в коричневый или черный цвет, бериллий – в синий, сере – в желтый. Желтую окраски имеют также кристаллы боразона, полученного из смеси гексагонального нитрида бора с нитридом лития. Были получены также красные, белые и бесцветные кристаллы.
Плотность боразона составляет 3,45 г/см3 (ренгеновская плотность 3,47 г/см3 ). Твердость его при оценке по шкале Мооса оказалась соизмеримой с твердостью алмаза (10 баллов).
Данные о некоторых свойствах нитрида бора приводятся в табл. 1.
| Соединение | Т пл., ˚С | Теплота образования ккал/моль |
Период решетки Ả |
Удельный вес г/см3 |
Микротвердость Кг/мм2 |
Твердость по шкале Мооса | Ширина запрещенной зоны, эВ |
Т.Э.Д.С. МкВ/гра. |
| BN(куб.) | ~3000 | - | 3,615 | 3,45 | - | 10 | ~5 (теор.) | - |
Таблица 1.
Электрические и оптические свойства
Измерение спектра отражения кубического нитрида бора (полученного с применением нитрида лития в качестве ’’катализатора’’), показали, что кристаллы обладают большим поглощением в интервалах от 7 до 9 эВ. Общий вид спектра поглощения похож на спектр поглощения алмаза, но характеризуется энергией, приблизительно на 2 эВ больше. Показатель преломления кубического нитрида бора составляет 2,22.
Зонная структура кубического нитрида бора рассчитана теоретически из зонной структуры алмаза методами теории возмущения (рис. 3). Максимум валентной зоны остается в точке ![]() = 0, однако минимум валентной зоны проводимости оказывается смещенным по оси. В результате значение ΔЕ возрастает до ~10 эВ, вдвое превышая значение ΔЕ для алмаза.
= 0, однако минимум валентной зоны проводимости оказывается смещенным по оси. В результате значение ΔЕ возрастает до ~10 эВ, вдвое превышая значение ΔЕ для алмаза.
Исследуя влияние примесей на проводимость боразона показало, что присутствие в реакционной смеси металлического бериллия или его соли (от 0,01 до 1% (вес.)) способствует образованию кристаллов BN с проводимостью р – типа

Рис. 3. Зонная структура кубического нитрида бора.
Такие кристаллы обладали сопротивлением 103 ом·см, хотя иногда наблюдались и такие низкие сопротивления, как 2·102 ом·см при комнатной температуре. Значение энергии активации проводимости колебалось в зависимости от индивидуальности измеряемого кристалла (а возможно также и за счёт влияния контактов). На основе опыта по легированию других соединений типа AIII BV предполагается, что атомы бериллия могут замещать атомы бора или азота в решётке кубического нитрида бора.
Попытки создать в кристаллах боразона, полученных из системы B-N-Li, дырочную проводимость за счет добавки в реакционную смесь магния или цинка, не дали хороших результатов. Это, вероятно, связано с относительно большими размерами атомов указанных элементов и трудностью замещения ими атомов в структуре боразона.
Проводимость n-типа удавалось получить в кристаллах боразона при добавке в реакционную смесь избытка бора, а также серы, кремния и др.
Добавка бора придавала кристаллам тёмно-коричневую окраску. Такие кристаллы имели высокое удельное сопротивление.
Однако наиболее активное донорное действие проявила сера в количестве 0,3-3% оказалось возможным получить кристаллы, удельное сопротивление которых было 104 Ом ·см и иногда даже 103 Ом · см при 250 С. Предполагают, что атомы серы замещают атомы азота в кубическом нитриде бора. Энергия ионизации примесных центров равнялась 0,05 эВ.
При добавке в реакционную смесь соединений, содержащих углерод и азот, удавалось получить кристаллы с проводимостью n-типа, имевшие сопротивление 105 -107 Ом · см и энергию активации проводимости 0,28-0,41 эВ. Такие кристаллы имели жёлтую, коричневую или красно-коричневую окраску.
Наконец, электронная проводимость иногда наблюдалась на кристаллах боразона, полученных из реакционных смесей нитрид лития – нитрид бора или нитрид магния- нитрид бора без преднамеренно введенных легирующих добавок. Эти кристаллы обычно имели высокие сопротивления – порядка 106 -109 Ом · см при комнатной температуре. Возможно, что причиной электронной проводимости в этом случае служил кислород, который было очень трудно исключить из реакционной смеси ввиду высокой активности нитридов, входивших в шихту. Указанное предположение согласуется с тем, что использование в качестве катализатора нитрида магния, являющегося более сильным раскислителем, чем нитрид лития, получились более высокоомные кристаллы боразона. Исследование выпрямляющих свойств кристаллов кубического нитрида бора производились на паре кристаллов n-и p-типа, находящихся в контакте. Через такую пару пропускался слабый постоянный ток (10-6а ) при низком напряжении (5в) с помощью серебряных контактов.
Отношение прямого тока к обратному было довольно низким – от 2 до 20.
При 250 С самые большие токи пропускали так, что p-кристалл был положительным. Однако при температурах 300-4000 С направление выпрямления менялось для некоторых пар кристаллов. При охлаждении устанавливалось первоначальное направление выпрямления.
Дальнейший прогресс в изучении свойств кубического нитрида бора связан с получением крупных кристаллов подходящей формы, а также с разработкой технологии получения p-n-переходов.
Применение боразона .
Нитрид бора и материалы на его основе занимают заметное место в ряду важнейших инструментальных материалов и являются основой многих современных технологий Основанием для широкого применения нитрида бора в инструментах, послужила наибольшая твёрдость, приближающаяся к твёрдости алмаза. Термодинамические особенности полиморфизма нитрида бора обусловили появление большого количества материалов на основе его плотных модификаций и различных технологий его получения.
Во «ВНИИАЛМАЗ» разработана технология получения двухслойных пластин на основе кубического нитрида бора, обеспечивающая высокую твёрдость режущего слоя(28-30 ГПа), высокую термостойкость (более 12000 ) и стабильность качества. Разработанные и выпускаемые «ВНИИАЛМАЗ» режущие пластины на основе кубического нитрида бора рекомендуются для высокопроизводительного точения (гладкого и с ударом) закаленных сталей, серого, высокопрочного и отбеленного чугуна, для обработки стального и чугунного литья по литейной корке и других сверхтвёрдых материалов, а также фрезерования чугунов. Достоинством двухслойных пластин из кубического нитрида бора, производимых ВИИНИАЛМАЗом, является их высокая износостойкость, не уступающая зарубежным аналогам, и большой размер пластин (15 мм), позволяющий изготавливать резцы с большой режущей кромкой для обработки деталей из чугуна с глубиной резания, достигающей 6 мм на сторону при высоких скоростях резания 600м/мин. Это обеспечивает высокую производительность обработки, недостижимую для твёрдосплавных резцов.
Также нитрид бора нашёл широкое применение в реакциях промышленного органического синтеза и при крекинге нефти, в изделиях высокотемпературной техники, в производстве полупроводников, получении высокочистых металлов, газовых диэлектриков, как огнетушащее средство.
Нитрид бора входит в состав получения промышленной керамики.
Боразон предназначен для:
· изготовления изделий, применяемых в высокотемпературной технике (тигли, изоляторы, тигли для получения полупроводниковых кристаллов, детали электровакуумных приборов);
· производства полупроводниковых приборов и интегральных схем (твердотельные планарные источники примеси бора, диэлектрические прокладки конденсаторов);
· деталей электровакуумных приборов (окон выводов энергии, стержней теплоотводов).
РАСЧЁТНАЯ ЧАСТЬ
Таблица данных взятых из справочника:
Δ H298 , кДж/моль |
Δ S298, Дж/моль |
Δ G 298 , кДж/моль | Ср Дж/моль | |
| BN | 648 | 212 | 615 | 19.7 |
| PH 3 | -5 | 210.2 | - | 31 |
| NH 3 | -46.2 | 192.6 | - | 50.3 |
| BP | 455 | 202.1 | - | - |
Рассчитаем тепловой эффект, энтропию, изменение стандартной энергии Гиббса при Т=2980 К и стандартном давлении для следующей реакции по формулам, используя таблицу данных.
BP+NH3 →BN( k ) +PH3
ΔH298 =∑nΔH298прод .-∑nΔH298исх.
ΔH298 =(648+(-5))-(455+(-46,2))=234,2 · 103 Дж/моль
ΔS298 =∑nΔS298прод. - ∑nΔS298исх.
ΔS298 =(212+210,2)-(202,1+192,6)=27,6 Дж/моль
ΔG298 = ΔH298 -T · ΔS298
ΔG298 =234,2 · 103 -298·27,6=151 кДж/моль
Теперь рассчитаем всё тоже самое, но только в интервале температур 2980 ±150 К и построим график зависимости ΔG=f(T).
ΔHT = ΔH298 +∫298 ΔCp dT
ΔST = ΔS298 +∫298 ΔCp /T dT
ΔGT = ΔHT -TΔST
Расчет:
ΔH283 =648+19.7(283-298) = 352.5 кДж/моль
ΔH288 =648+19.7(288-298) = 451 кДж/моль
ΔH293 =648+19.7(293-298) =623, 3 кДж/моль
ΔH298 =648+19.7(298-298) =648 кДж/моль
ΔH303 =648+19.7(303-298) =746, 5 кДж/моль
ΔH308 =648+19.7(308-298) =845 кДж/моль
ΔH 313 =648+19.7(313-298) =943.5 кДж/моль
ΔH318 =648+19.7(318-298) =985 кДж/моль
ΔS283 =27,6+19.7(ln283- ln 298)=26.61 кДж/моль
ΔS288 =27,6+19.7(ln 288- ln 298)=27.01 кДж/моль
ΔS293 =27,6+19.7(ln 293- ln 298)=27.4 кДж/моль
ΔS298 =27,6+19.7(ln 298- ln 298)=27.6 кДж/моль
ΔS303 =27,6+19.7(ln 303- ln 298)=28.7 кДж/моль
ΔS308 =27,6+19.7(ln 308- ln 298)=28.9 кДж/моль
ΔS313 =27,6+19.7(ln 313- ln 298)=29.3 кДж/моль
ΔS318 =27,6+19.7 (ln 318- ln 298)=29.6 кДж/моль
ΔG283 =352.5*103 -283*26.61=345 кДж/моль
ΔG288 =451-288*27.01=443.3 кДж/моль
ΔG293 =623, 3-293*27.4=615.2 кДж/моль
ΔG298 =648-298*27.6=639.7 кДж/моль
ΔG303 =746, 5 -303*28.7=737.3кДж/моль
ΔG308 =845-308*28.9=835.6кДж/моль
ΔG313 =943.5 -313*29.3=933.3кДж/моль
ΔG318 =985-318*29.6=975.4кДж/моль
T, K

![]() 318
318
![]() 283
283
300 1000
ΔG, кДж/моль
Построили график зависимости ΔG=f(T), из него видно, что с увеличением температуры растет ΔG(в выбранном интервале).
ЗАКЛЮЧЕНИЕ:
На основе проделанной работы можно сделать вывод о том, боразон, как соединение типа AIII BV на основе бора, обладает высокой химической стойкостью, большой шириной запрещённой зоны, малой энергией ионизации примесных центров. Получение боразона связано с технологическими трудностями (использование техники сверхвысоких давлений ). Его свойства на данный момент не до конца изучены, но уже сейчас можно говорить о том, что он является удачным материалом для полупроводниковых приборов, предназначенных для работы в широком интервале температур.
ЛИТЕРАТУРА:
1. Шмарцев Ю.В., ВаловЮ.А., Борщевский А.С.,
Тугоплавкие алмазоподобные проводники.
М.Металлургия,1964
2. Wentorf R . H . J . Chem . Phys ., 1962
3. Гёринг Х., Полупроводниковые соединения A III BV .М.
Металлургия,1967.
4. Кировская И.А., Поверхностные свойства
алмазоподобных полупроводников.1984.
5. Рябин В.А., Термодинамические свойства веществ.1983.
6. Морачевский С.М., Сладков Д.Ю. Физико-химические
свойства молекулярных соединений.
Похожие рефераты:
Производство искусственных алмазов
Методика решения задач по теоретическим основам химической технологии
Биокерамика на основе фосфатов кальция
Распределение Fe2+/Mg отношения в системе расплав - шпинель - оливин
Образование, свойства и добыча алмазов
Межпредметные связи в курсе школьного предмета химии на предмете углерода и его соединений
Химическая и радиационная стойкость керамики
Генезис минералов. Методы выращивания кристаллов
Технология производства полупроводниковых материалов типа А2В6
Разработка источников диффузионного легирования для производства кремниевых солнечных элементов