| Скачать .docx |
Реферат: Біологічна активність S-заміщених похідних 2-метил-4-меркапто-8-метоксихіноліну
НАЦІОНАЛЬНА АКАДЕМІЯ НАУК УКРАЇНИ
ІНСТИТУТ БІООРГАНІЧНОЇ ХІМІЇ ТА НАФТОХІМІЇ
Генчева Вікторія Іванівна
УДК: 547.831: 577.175.5
Біологічна активність S-ЗАМІЩЕНИХ ПОХІДНИХ 2-МЕТИЛ-4-МЕРКАПТО-8-МЕТОКСИХІНОЛІНУ
02.00.10 – біоорганічна хімія
АВТОРЕФЕРАТ
дисертації на здобуття наукового ступеня
кандидата біологічних наук
Київ– 2008
Дисертацією є рукопис
Робота виконана на кафедрі хімії Запорізького національного університету
Науковий керівник: доктор фармацевтичних наук, професор Омельянчик Людмила Олександрівна, Запорізький національний університет, завідувач кафедри хімії, декан біологічного факультету
Офіційні опоненти: доктор біологічних наук, професор Кібірєв Володимир Костянтинович, Інститут біоорганічної хімії та нафтохімії НАН України, завідувач відділу хімії білкаэ, кандидат біологічних наук Новосад Наталія Василівна, Запорізький національний університет, доцент кафедри імунології та біохімії
Захист відбудеться 20 червня 2008 р. о 10 годині на засіданні спеціалізованої вченої ради в Інституті біоорганічної хімії та нафтохімії НАН України, 02094, м. Київ-94, вул. Мурманська, 1.
З дисертацією можна ознайомитись у бібліотеці Інституту біоорганічної хімії та нафтохімії НАН України, 02094, м. Київ-94, вул. Мурманська, 1.
Автореферат розіслано 20 травня 2008 р.
Вчений секретар спеціалізованої вченої ради Д.М. Федоряк
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Пошук доступних, ефективних та нетоксичних біорегуляторів є важливим завданням біоорганічної та медичної хімії. Для створення біоактивних молекул застосовуються не лише речовини природного походження, але й їх синтетичні аналоги. За останні два десятиріччя з’явилася значна кількість публікацій про різнобічну біологічну активність похідних хіноліну.
Існує багато ефективних лікарських засобів із групи 8-гідроксипохідних хіноліну (хінозол, ентеросептол, нітроксолін, інтестопан), фторхінолони тощо. Перш за все похідні хіноліну відомі як антимікробні та протипаразитарні препарати. Похідні цього азагетероциклу проявляють також протипухлинну, анальгетичну, фунгістатичну, нейротропну та інші види дії. Хінолінові сполуки використовуються як ветеринарні препарати, пестициди.
Зараз здебільшого досліджені аміно- та гідроксипохідні хіноліну. Скринінг деяких S-заміщених хіноліну показав, що ці гетероциклічні сполуки є перспективним класом з антиоксидантною, анальгетичною, нейротропною дією.
Дослідження останніх років свідчать про стрімке зростання антиоксидантної фармакопрофілактики та фармакотерапії. Отже пошук ефективних антиоксидантів важливий і актуальний.Поєднання природного L(-)-цистеїну та інших його аналогів (меркаптокарбонових кислот) із залишком 8-метоксизаміщених похідних хіноліну призводить до посилення біологічної дії і створення ефективних антиоксидантів.
Вивчення біологічної активності S-заміщених 2-метил-4-меркапто-8-метоксихінолінів не проводилось, а прогнозування біологічної активності за допомогою комп’ютерної програми PASS (Prediction of Activity Spectra for Substances) показало, що ці похідні хіноліну є перспективним класом сполук з антиоксидантною, нейропротекторною, гепатопротекторною та іншими видами дії.
Таким чином, усе зазначене свідчить про актуальність роботи зі створення нових біологічно активних субстанцій на основі S-заміщених 2-метил-4-меркапто-8-метоксихінолінів.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційна робота виконана в межах тематичних планів Запорізького національного університету (тема: “Пошук біологічно активних речовин на основі тіо- та гідразинопохідних азагетероциклів”, номер держреєстрації 0104U010164, “Синтез біологічно активних речовин на основі N- та S-заміщених сірковмісних амінокислот та їх аналогів”, номер держреєстрації 0106U000585), у виконанні якої автор брала безпосередню участь.
Мета та основні завдання дослідження . Основною метою роботи є пошук ефективних біорегуляторів широкого спектру дії в ряду S-заміщених 2-метил-4-меркапто-8-метоксихінолінів та встановлення залежності структура – біологічна дія.
Для реалізації поставленої мети були визначені такі завдання :
1. Синтезувати S-заміщені похідні 2-метил-4-меркапто-8-метоксихіноліну та вивчити їх фізико-хімічні властивості.
2. Здійснити прогноз можливих видів їх біологічної дії за допомогою комп’ютерної програми PASS.
3. Експериментально дослідити прогнозований спектр їх біологічної дії, що включає вивчення таких видів активності:
− гострої токсичності;
– антиоксидантної активності на моделях in vitro ;
− мембраностабілізуючої дії сполук на моделі гострого токсичного гепатиту;
− антиоксидантної та нейропротекторної дії найбільш активних сполук в умовах in vivo (на моделі експериментальної ішемії головного мозку).
4. Вивчити залежність біологічної дії синтезованих сполук від їх хімічної структури.
5. Провести доклінічне дослідження найбільш активної сполуки – натрієвої солі 2-гідрокси-3-(8-метокси-2-метилхінолін-4-ілтіо)пропанової кислоти на специфічний вид активності.
Об’єкт дослідження. S-заміщені похідні 2-метил-4-меркапто-8-метоксихіноліну.
Предмет дослідження. Пошук нових високоефективних і малотоксичних сполук з антиоксидантною, мембраностабілізуючою, нейропротекторною активністю в ряду S-заміщених 2-метил-4-меркапто-8-метоксихінолінів.
Методи дослідження. Хімічний синтез, біологічні та біохімічні методи (дослідження токсичної дії, антиоксидантної активності in vitro , енергетичного стану міокарда білих щурів і стану антиоксидантної системи захисту клітин міокарда щурів), фізико-хімічні методи (елементний аналіз, тонкошарова хроматографія, ІЧ-, ПМР-, УФ-спектроскопія, хромато-мас-спектрометрія). Статистична обробка отриманих результатів проводилася за допомогою блоку комп’ютерних програм SPSS для Windows (версія 10.0).
Наукова новизна отриманих результатів. Вперше синтезовано 35 S-заміщених похідних 2-метил-4-меркапто-8-метоксихіноліну, встановлена будова й вивчені їх фізико-хімічні властивості. Здійснено прогноз біологічної активності нових похідних хіноліну за допомогою комп’ютерної програми PASS.
У дослідах in vitro на моделі аутоокиснення адреналіну встановлено, що натрієві солі (8-метокси-2-метилхінолін-4-ілтіо)оцтової кислоти і 2-гідрокси-3-(8-метокси-2-метилхінолін-4-ілтіо)пропанової кислоти проявляють найбільшу антирадикальну активність.
Механізм антиоксидантної дії вивчених сполук обумовлений їх здатністю реагувати з активними формами кисню – вони виявляють властивості “пасток” супероксиданіону у водній фазі, перехоплюють гідроксилрадикал в гетерогенних системах; гальмують утворення активних форм оксиду азоту. Встановлено, що антиоксидантна активність сполук знижується за наявності розгалуженого карбонового ланцюга, аміногрупи, ацетильного залишку в карбоновому ланцюзі.
На моделі гострого токсичного гепатиту in vivo встановлено, що найбільш виражена мембранозахисна дія властива 2-гідрокси-3-(8-метокси-2-метилхінолін-4-ілтіо)пропановій кислоті.
На моделі окисного стресу in vivo (ішемія головного мозку) показано, що похідні S-заміщених 2-метил-4-меркапто-8-метоксихіноліну мають антиоксидантну і нейропротекторну дію щодо ферментів антиоксидантного захисту в тканинах головного мозку. Досліджені сполуки зменшують вміст продуктів вільнорадикального окиснення (рівень триєнкетонів), показники вуглеводного обміну; впливають на рівень антиоксидантних ферментів (супероксиддисмутази, каталази, глутатіонпероксидази та вміст α-токоферолу), а за показниками активності перевищують препарат порівняння – пірацетам і наближають показники до рівня інтактних тварин.
Практичне значення одержаних результатів. Встановлена залежність між хімічною будовою та біологічною активністю S-заміщених 2-метил-4-меркапто-8-метоксихіноліну дозволяє вести цілеспрямоване конструювання нових біологічно активних сполук у цьому ряду.
Виявлені перспективні біологічно активні сполуки для створення нових лікарських та ветеринарних засобів з антиоксидантною, нейропротекторною та мембраностабілізуючою дією.
Порівняльний аналіз даних комп’ютерної програми “PASS” та результатів експериментальних біологічних досліджень дав можливість поповнити банк пам’яті комп’ютерних програм новими дескрипторними центрами.
Проведено доклінічне вивчення специфічної активності натрієвої солі 2-гідрокси-3-(8-метокси-2-метилхінолін-4-ілтіо)пропанової кислоти, якій властиві виражені антиоксидантна та нейропротекторна дії.
Особистий внесок здобувача полягає у самостійному виконанні всього обсягу експериментальної частини, у статистичній обробці матеріалів, аналізі й узагальненні отриманих даних. Дисертант брала участь у синтезі S-заміщених похідних 2-метил-4-меркапто-8-метоксихіноліну під керівництвом д.б.н., проф. О.А. Бражка та д.фарм.н., проф. Л.О. Омельянчик. Дослідження антиоксидантної і нейропротекторної активності in vivo здійснювалося спільно з д.б.н., проф. І.Ф. Бєленічевим.
Методологія та схема дослідження були відпрацьовані разом з науковим керівником.
Апробація результатів дисертації. Результати дисертаційної роботи доповідалися й обговорювалися на наукових конференціях викладачів і студентів Запорізького національного університету (Запоріжжя, 2005, 2006, 2007), на II Міжнародній науково-технічній конференції студентів і аспірантів та молодих учених “Хімія і сучасні технології” (Дніпропетровськ, 2005), 6 Всеукраїнській конференції студентів та аспірантів “Сучасні проблеми хімії” (Київ, 2005), 10 науковій конференції “Львівські хімічні читання” (Львів, 2005), XXI науковій конференції з біоорганічної хімії та нафтохімії (Київ, 2006), Всеукраїнській науково-практичній конференції “Сучасні досягнення фармацевтичної науки та практики” (Запоріжжя, 2006), Міжнародній конференції “Сучасні проблеми біології, екології та хімії” (Запоріжжя, 2007), на XXI Українській конференції з органічної хімії (Чернігів, 2007).
Публікації. За матеріалами дисертації опубліковано 11 праць, у тому числі 5 статтей у наукових фахових журналах і збірниках та у 6 тезах доповідей.
Структура й обсяг дисертації . Дисертаційна робота викладена на 165сторінках машинописного тексту, складається зі вступу, огляду літератури, матеріалів і методів досліджень, чотирьох розділів власних досліджень, висновків, списку використаних джерел (183 найменування) і містить 28 таблиць та 35 рисунків.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Огляд літератури. В огляді літератури на основі даних про біологічну активність похідних хіноліну обґрунтована перспективність пошуку біологічно активних речовин у ряду S-заміщених 2-метил-4-меркапто-8-метоксихінолінів.
Матеріали та методи досліджень. Дослідження антирадикальної активності синтезованих сполук проводили на моделі аутоокиснення адреналіну (Ю.І. Губський і співавт., 2002).
Антиоксидантна активність (АОА) у дослідах in vitro вивчалася на моделях ініціації утворення вільних радикалів кисню та їх біологічної дії: інгібування супероксидрадикалу, ферментативне ініціювання (ФІ), неферментативне ініціювання (НФІ), утворення NO-радикалу (Ю.І. Губський і співавт., 2002).
Оцінку мембраностабілізуючої дії S-заміщених 2-метил-4-меркапто-8-метоксихінолінів проводили в умовах гострого токсичного гепатиту (Волошина Е.С. і співавт., 1999; Дроговоз С.М. і співавт., 2001).
У значенні біохімічних маркерів пошкодження гепатоцитів використовувалася активність амінотрансфераз – АлТ (КФ.2.6.1.1) та АсТ (КФ.2.6.1.2) у сироватці крові (В.В. Меньшиков, 1987).
Оцінку біологічної ефективності in vivo вивчали на моделі окисного стресу, який спричиняли двосторонньою перев’язкою загальної сонної артерії головного мозку (Дунаєв В.В. і співавт., 1998).
Інтенсивність процесів вільнорадикального окиснення ліпідів (ВРОЛ) у тканинах головного мозку оцінювали за накопиченням початкових, проміжних та кінцевих продуктів – дієнових кон’югатів (ДК), триєнкетонів (ТК) і малонового діальдегіду (МДА).
Стан антиоксидантної системи оцінювали за активністю супероксиддисмутази (СОД, КФ 1.15.1.1), каталази (КФ 1.11.1.6), глутатіонпероксидази (ГПР, КФ 1.11.1.9) та вмістом α-токоферолу.
Стан вуглеводно-енергетичного обміну визначали за рівнем АТФ, лактату, пірувату й малату. Для визначення їх рівня використовували уніфіковані методи (В.В. Меньшиков, 1987).
Вивчення гострої токсичності проводили на інтактних дорослих двостатевих мишах вагою 16-20 г. Середні летальні дози ЛД50 визначали за методом Прозоровського (Прозоровський В.Б., 1998).
Комп’ютерний прогноз біологічної активності S-заміщених похідних 2-метил-4-меркапто-8-метоксихіноліну та аналіз даних літератури показали, що зазначений ряд похідних хіноліну є перспективним класом хімічних сполук для пошуку антиоксидантів, нейропротекторних, гепатопротекторних лікарських засобів. З метою пошуку серед них ефективних біорегуляторів широкого спектру дії було проведено первинну оцінку біологічної дії сполук.
Синтез S-заміщених похідних 2-метил-4-меркапто-8-метоксихіноліну.
S-заміщені похідні 2-метил-4-меркапто-8-метоксихіноліну були синтезовані на основі 2-метил-4-хлоро-8-метоксихінолінів (І) і 2-метил-4-меркапто-8-метоксихінолінів (П) за відомими реакціями, що наведені на схемах 1, 2 [Бражко О.А. дис... доктора біол. наук: .- К., 2005].
Будову отриманих сполук (Табл.) доведено за допомогою елементного аналізу, ІЧ- та ПМР-спектроскопії, хромато-мас-спектрометрії, а чистота – за допомогою тонкошарової хроматографії.
Для забезпечення кращої водорозчинності синтезованих похідних вони були перетворені у ряді випадків у відповідні гідрохлориди або натрієві чи калієві солі (див. сполуки 2, 5, 6, 10, 12, 14, 15, 17, 19-21, 23, 25, 26, 34, 35).
Таблиця
S-заміщені похідні 2-метил-4-меркапто-8-метоксихінолінів
| № | Сполука | № | Сполука | № | Сполука |
| 1 | 13 | 25 | 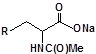 |
||
| 2 | 14 | 26 | 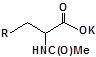 |
||
| 3 | 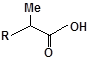 |
15 | 27 | 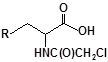 |
|
| 4 | 16 | 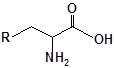 |
28 | 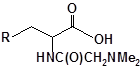 |
|
| 5 | 17 | 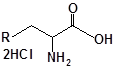 |
29 |  |
|
| 6 | 18 | 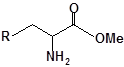 |
30 | 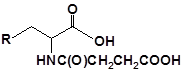 |
|
| 7 | 19 | 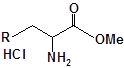 |
31 | 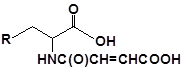 |
|
| 8 | 20 | 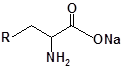 |
32 | 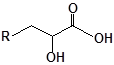 |
|
| 9 | 21 | 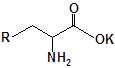 |
33 | 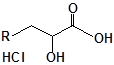 |
|
10 |
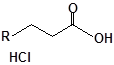 |
22 |  |
34 |
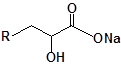 |
| 11 | 23 |  |
35 | 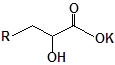 |
|
| 12 | 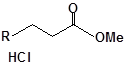 |
24 | 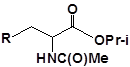 |
36 | 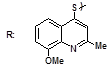 |
Зв’язок між хімічною будовою й біологічною активністю в ряду S-заміщених 2-метил-4-меркапто-8-метоксихінолінів
Гостра токсичність. За результатами дослідження гострої токсичності показано, що ЛД50 синтезованих сполук знаходиться в межах від 566 − 2000 мг/кг і залежить від їх хімічної будови. Це дозволяє віднести їх до мало- та нетоксичних сполук за класифікацією Сидорова (Сидоров К.К., 1973).
Подовження карбонового ланцюга на метиленову групу не впливає на ЛД50 (сполуки 1 та 9 ). ЛД50 знаходиться майже на рівні – 900 і 969 мг/кг відповідно.
Наявність аміногрупи в карбоновому ланцюзі збільшує токсичність (сполука 16 – в порівнянні зі сполукою 9 ) – 898 і 969 мг/кг відповідно.
Заміна аміногрупи на гідроксильну в α-положенні карбонового ланцюга (сполука 32 – 2-гідрокси-3-(8-метокси-2-метилхінолін-4-ілтіо)пропанова кислота) не змінює ЛД50 в порівнянні зі сполукою 16 .
Наявність N–ацетильного залишку в карбоновому ланцюзі в 4-му положенні хінолінового циклу зменшує токсичність (сполука 22 – 2-ацетиламіно-3-(8-метокси-2-метилхінолін-4-ілтіо)пропанова кислота) в порівнянні зі сполукою 16 . ЛД50 – 1245 мг/кг.
Етерифікація (-ОС2 Н5 ) карбоксильної групи (сполука 4) збільшує гостру токсичність (ЛД50 – 714±56 мг/кг), а сполуки 13 – зменшує її (ЛД50 – <2000 мг/кг).
Найбільшу токсичність має гідрохлорид метилового естеру (8-метокси-2-метилхінолін-4-ілтіо)пропанової кислоти − сполука 12 (рис. 1). Його ЛД50 становить 566 мг/кг.
Рис. 1. Гостра токсичність S-заміщених 2-метил-4-меркапто-8-метоксихінолінів
Антирадикальна і антиоксидантна активність. У дослідах in vitro на моделі аутоокиснення адреналіну виявлено антирадикальну активність S-заміщених 2-метил-4-меркапто-8-метоксихінолінів. На цій моделі високу активність проявили водорозчинні форми – натрієві та калієві солі (сполуки 5 , 6 , 34 ). Подовження карбонового ланцюга на метиленову групу і наявність гідроксильної групи зменшує прояв антирадикальної активності (сполука 32 ) порівняно зі сполуками 5 , 6 (рис. 2). Сполуки 5, 6 та 34 перевищують антирадикальну активність еталону порівняння – L-ацетилцистеїну.
Рис. 2. Антирадикальна активність S-заміщених похідних 2-метил-4-меркапто-8-метоксихіноліну (концентрація сполук 25 мкм)
Встановлено, що подовження на метиленову групу карбонового ланцюга в 4-му положенні хінолінового циклу (сполука 10 ) зменшує антирадикальну активність, наявність гідроксильної групи (сполука 32 ) – її підвищує. Етерифікація (-ОСН3 ) карбоксильної групи (сполука 12 ) призводить до зменшення прояву активності в порівнянні зі сполукою 10 .
За результатами проведених досліджень виявлено, що синтезовані сполуки проявляють антирадикальні і антиоксидантні властивості.
Вільнорадикальне окиснення ліпідів. На моделях генерації вільнорадикального окиснення ліпідів in vitro S-заміщені похідні 2-метил-4-меркапто-8-метоксихіноліну знижують утворення вільних радикалів, виявляючи властивості “пасток” супероксиданіону у водній фазі, перехоплюють гідроксилрадикал у гетерогенній системі та є протекторами меркаптогруп протеїнів, включаючи ферменти антиоксидантного захисту (супероксиддисмутази, каталази, глутатіонпероксидази, знижують утворення малонового діальдегіду).
(Хінолін-4-ілтіо)карбонові кислоти (сполуки 1 , 3 ) і гідрохлорид (сполука 2 ) на всіх моделях ініціації вільнорадикального окиснення ліпідів проявляють високу антиоксидантну активність (рис. 3).
Наявність метильної групи в α-положенні карбонового ланцюга S-заміщених 2-метил-4-меркапто-8-метоксихінолінів зменшує прояв антиоксидантної активності (сполука 3 ) (рис. 3). Калієва сіль 3-(8-метокси-2-метилхінолін-4-ілтіо)пропанової кислоти – сполука 15 – проявляє антиоксидантну активність в 3 рази меншу, ніж сполука 1 . Наявність аміногрупи – сполука 17 , N-ацетильного залишку − сполука 22 – в карбоновому ланцюзі S-заміщених 2-метил-4-меркапто-8-метоксихінолінів зменшує активність на даній моделі в порівнянні зі сполукою 1 .
На моделі ферментативного ініціювання вільнорадикального окиснення ліпідів найменша кількість малонового діальдегіду утворилась в присутності сполук 2 та 3 (рис. 3), що проявляють найбільшу антиоксидантну активність (АОА). Наявність аміногрупи або N-ацетильного залишку в карбоновому ланцюзі S-заміщених похідних − сполуки 17 , 22 − проявляють меншу АОА в порівнянні зі сполукою 2 та еталонами порівняння – метіоніном та унітіолом.
Найбільшу активність на моделі неферментативного ініціювання показала сполука 2 , АОА якої перевищує активність дибунолу на 19 % (р<0,05), α-токоферолу – на 36 % (р<0,05). Введення СН3 -групи в α-положення карбонового ланцюга − сполука 3 , зменшує прояв АОА.
Для N-ацильних 2-метил-4-S-гетерилзаміщених 8-метоксипохідних хіноліну спостерігається зменшення АОА − сполуки 17 та 22 . Калієва сіль 3-(8-метокси-2-метилхінолін-4-ілтіо)пропанової кислоти − сполука 15 – проявляє антиоксидантну активність, яка знаходиться на рівні з АОА еталону порівняння − α-токоферолу (23 та 24 % відповідно).
Найбільша антирадикальна активність на моделі інгібування NO-радикалу властива 3-(8-метокси-2-метилхінолін-4-ілтіо)оцтовій кислоті (сполука 1 ) та 2-(8-метокси-2-метилхінолін-4-ілтіо)пропановій кислоті (сполука 3 ) (63,5 та 40,8 % відповідно) в порівнянні з ацетилцистеїном. Гідрохлорид – сполука 2 – на цій моделі проявляє меншу активність, ніж кислота (35,0 та 63,5% відповідно). Водорозчинна форма – калієва сіль 3-(8-метокси-2-метилхінолін-4-ілтіо)пропанової кислоти – сполука 15 – проявляє значно меншу антирадикальну активність порівняно зі сполукою 1 . N-ацильні S-заміщені 2-метил-4-меркапто-8-метоксипохідні хіноліну – сполуки 17 та 22 характеризуються проявом збільшення антирадикальної активності в порівнянні з калієвою сіллю та зменшення в порівнянні з кислотою (сполука 1 ).
Таким чином, на всіх моделях ініціювання вільнорадикального окиснення ліпідів спостерігається наступна залежність: подовження карбонового ланцюга залишку меркаптокарбонової кислоти на СН2 -групу, наявність аміногрупи, N-ацетильного залишку в карбоновому ланцюзі в 4-му положенні хінолінового циклу, зменшує прояв антиоксидантної активності.
На всіх моделях ініціювання вільнорадикального окиснення ліпідів in vitro похідні S-заміщених 2-метил-4-меркапто-8-метоксихінолініу (сполуки 5 , 14 , 34 – натрієві солі) проявили антиоксидантну активність.
На моделі гальмування окиснення адреналінуспостерігається наступна залежність: подовження карбонового ланцюга на СН2 -групу і поява в ньому ОН-групи в α-положенні впливає на збільшення прояву АОА на 10 – 32,5% (сполуки 14 та 34 відповідно) порівняно зі сполукою 5 (Р<0,05).
Для сполук 5 , 14 , 34 на моделі ферментативного ініціювання вільнорадикального окиснення ліпідів встановлено, що збільшення карбонового ланцюга на метиленову групу (сполука 14 ) збільшує АОА на 22,8% порівняно зі сполукою 5 . Наявність гідроксигрупи в α-положенні карбонового ланцюга (сполука 34 ) зменшує прояв АОА на 12,8% порівняно зі сполукою 14 . Всі досліджені сполуки в цьому випадку перевищують АОА препарату порівняння – унітіолу.
На моделі неферментативного ініціювання спостерігається аналогічна залежність між хімічною будовою і дією для сполук 5 , 14 , 34 , як і на моделі інгібування супероксидрадикалу, тобто збільшення карбонового ланцюга на СН2 -групу і поява ОН-групи в ньому збільшує прояв АОА.
На моделі інгібування NO-радикалу спостерігаємо таку закономірність: відбувається збільшення антирадикальної активності в ряду: сполука 5 − сполука 14 – сполука 34 (25,0, 40,0 та 55,0 % відповідно). Дві сполуки 14 та 34 перевищують активність еталону порівняння – ацетилцистеїну – на 10 та 15% відповідно (Р<0,05).
Антиоксидантна та мембраностабілізуюча активність in vivo . На основі даних комп’ютерного прогнозу і вивчення антиоксидантної активності in vitro досліджено мембраностабілізуючу та антиоксидантну активності в умовах цілісного організму (in vivo ).
Найбільш виражений ефект на 14 добу дослідження мали сполуки 3 та 32 (рис. 4). При їх введенні спостерігалась стабілізація мембран гепатоцитів, про що свідчить суттєве зменшення показників активності амінотрансфераз – АлТ і АсТ, які є вірогідними по відношенню до контролю. Наявність гідроксигрупи в α-положенні карбонового ланцюга − сполука 32 − зменшує показники рівня АлТ та АсТ, наближаючи їх до інтактної групи тварин. Ці сполуки на фоні токсичного гепатиту наближають показники білоксинтезуючої активності до рівня інтактних тварин.
На моделі окисного стресу in vivo (ішемія головного мозку) введення нетоксичних S-заміщених 2-метил-4-меркапто-8-метоксихінолінів (натрієві солі) у дозі 1/50 ЛД50 (препарат порівняння − пірацетам) наближає до норми рівень показників вільнорадикального окиснення (рівень триєнкетонів), показники вуглеводного обміну (рис. 5); впливає на рівень антиоксидантних ферментів (супероксиддисмутази, каталази, глутатіонпероксидази, вміст α-токоферолу).
Сполуки, що досліджувались, по-різному впливали на рівень лактату. При дії сполуки 5 вміст лактату зменшився на 40,6% відносно контролю (Р<0,05). Збільшення ланцюга на СН2 -групу в залишку карбонової кислоти (сполука 14) впливає на достовірне зменшення вмісту лактату на 43,7% (Р<0,05). Наявність ОН-групи в α-положенні карбонового ланцюга (сполука 34) зменшує рівень показника лактату на 50% відносно контролю. Всі досліджені сполуки перевищують дію еталона – пірацетаму.
Всі сполуки впливали на підвищення показників малату. Наявність залишку оцтової кислоти (сполука 5) впливає на достовірне збільшення рівня малату (на 110 %) відносно контролю. Збільшення карбонового ланцюга на СН2 -групу (сполука 14) призводить до зростання вмісту малату на 140% (Р<0,05). Наявність ОН-групи в карбоновому ланцюзі (сполука 34) впливає на підвищення рівня малату на 180% відносно контролю і відповідає рівню малату інтактної групи тварин. Всі сполуки перевищують дію препарату порівняння – пірацетаму на 50-100% (Р<0,05) (рис. 5).
Важливим моментом досліджень є значне (по відношенню до контрольної групи) зниження рівня пошкоджень мозкової тканини – креатинфосфокінази – на 28,5 – 57,1% під дією натрієвих солей S-заміщених 2-метил-4-меркапто-8-метоксихінолінів, що свідчить про мембраностабілізуючу та нейропротекторну дію. За впливом на рівень ізоферменту КФК вони переважали пірацетам на 7,1 – 35,7%. Похідні хіноліну на цьому фоні зменшують витрати ендогенного антиоксиданту – α-токоферолу.
Встановлено, що збільшення карбонового ланцюга на метиленову групу (сполука 14 ) та наявність гідроксильної групи (сполука 34 ) впливає на збільшення показників і наближення до рівня показників інтактних тварин.
Захисна дія S-заміщених 2-метил-4-меркапто-8-метоксихінолінів реалізується на початкових етапах розвитку вільнорадикального окиснення при ішемії за рахунок гальмування утворення активних форм кисню, реактивації антиоксидантного комплексу та позитивного впливу на порушення біоенергетичних процесів. Можливо, в механізмі антиоксидантної, мембраностабілізуючої і нейропротекторної дії найбільш активних сполук – натрієвих солей S-заміщених похідних 2-метил-4-меркапто-8-метоксихіноліну – бере участь атом сірки залишку тіогліколевої кислоти, 3-меркаптопропанової кислоти, як замісники з потенційно високими антиоксидантними властивостями, а також карбоксильна, гідроксильна група та ендогенний атом азоту (метильна група в 2-му положенні хіноліну підсилює основність азоту). Це свідчить про те, що вони приймають участь у хелатоутворенні і здатні зв’язувати метали змінної валентності – прооксиданти – гальмують процеси вільнорадикального окиснення в реакціях Фентона і Габера-Вейса.
Синтез та вивчення специфічної активності натрієвої солі 2-гідрокси-3-(8-метокси-2-метилхінолін-4-ілтіо)пропанової кислоти. На основі проведених досліджень нами встановлено, що натрієва сіль 2-гідрокси-3-(8-метокси-2-метилхінолін-4-ілтіо)пропанової кислоти (сполука 34 ) малотоксична, проявляє високу антирадикальну і антиоксидантну активність in vitro . Тому вона була обрана для поглибленого вивчення специфічної дії in vivo .
Для доклінічного дослідження натрієву сіль 2-гідрокси-3-(8-метокси-2-метилхінолін-4-ілтіо)пропанової кислоти синтезовано нами за схемою 3.
Гостра токсичність (ЛД50 ) цієї сполуки становить <1000 мг/кг.
За результатами дослідження її специфічної активності встановлено, що сполука 34 знижує показники окисного стресу при гострому порушенні мозкового кровообігу, проявляє антиоксидантну активність та ефективно захищає мембрани клітин печінки, перевищуючи ефект пірацетаму.
Кількість дієнових кон’югатів у тканинах головного мозку при введенні сполуки 34 зменшувалася на 55,5%, триєнкетонів – на 61,5%, малонового діальдегіду – на 53,7% відповідно (Р<0,05), що на 27,8%, 19,2% та 22,7% перевищувало дію еталона порівняння – пірацетаму (Р<0,05).
У тканинах головного мозку активність супероксиддисмутази підвищувалася на 120,3%, що на 81,4% більше показника пірацетаму. Зростала активність глутатіонпероксидази на 85,6%, що перевищує дію пірацетаму на 61% (Р<0,05).
При введенні сполуки 34 тваринам з експериментальною ішемією головного мозку спостерігалася нормалізація рівня каталази і вмісту a-токоферолу. Рівень a-токоферолу зростав на 100% порівняно з контролем. Це перевищувало дію препарату порівняння − пірацетаму на 35,0% (Р<0,05).
Сполука 34 збільшує показники окисної продукції енергії – рівень лактату на 50,0%, пірувату на 111,1%, малату на 180,0% порівняно з контролем (Р<0,05). При цьому спостерігалося збільшення показників вуглеводного обміну порівняно з пірацетамом.
Пошкодження структурної цілісності клітинних мембран супроводжувалося збільшенням активності ВВ-ізоформи КФК. Наслідком антиоксидантного ефекту та позитивної реакції на порушення тонких ланок метаболізму була нейропротекторна дія щодо клітинних мембран мозкової тканини, про що свідчить зниження гіперферментації ВВ-КФК.
Порівнюючи антиоксидантну дію сполуки 34 з дією еталону порівняння − пірацетамом при гострому порушенні мозкового кровообігу, встановлено, що вона реалізує свій ефект як на початкових етапах вільнорадикального окиснення, так і на вільнорадикальному етапі розвитку ВРО, а також на етапі пероксидації.
Дуже важливо, що на фоні використання сполуки 34 не спостерігалося загибелі експериментальних тварин на моделі гострого порушення мозкового кровообігу.
Таким чином, натрієва сіль 2-гідрокси-3-(8-метокси-2-метилхінолін-4-ілтіо)пропанової кислоти може бути використана в медичній та ветеринарній практиці як перспективний антиоксидант і нейропротектор.
ВИСНОВКИ
1. У дисертації наведено теоретичне узагальнення і нове вирішення наукової задачі, що виявляється у пошуку ефективних біорегуляторів серед S-заміщених похідних2-метил-4-меркапто-8-метоксихіноліну, у результаті чого знайдені сполуки з антиоксидантними, мембраностабілізуючими, нейропротекторними властивостями.
2. Комп’ютерний прогноз біологічної активності за допомогою програми “PASS” показав доцільність пошуку серед похідних хіноліну речовин з різнобічною біологічною активністю та дав можливість поповнити банк даних комп’ютерних програм новими дескрипторними центрами.
3. Синтезовано 35 нових S-заміщених похідних2-метил-4-меркапто-8-метоксихіноліну та вивчено їх фізико-хімічні властивості й біологічну активність в модельних дослідах in vitro та in vivo .
4. Встановлено, що ЛД50 отриманих похідних знаходиться в межах 566 − 2000 мг/кг, тобто вони відносяться до мало- та нетоксичних сполук. Наявність N–ацетильних залишків в 4-му положенні хінолінового циклу або гідроксигрупи в карбоновому ланцюзі зменшує токсичність. Етерифікація карбоксильної групи залишку оцтової кислоти збільшує гостру токсичність сполук, а пропанової − зменшує її.
5. У дослідах in vitro виявлена властивість S-заміщених 2-метил-4-меркапто-8-метоксихінолінів виконувати функцію “пасток” супероксиданіона у водній фазі, “пасток” гідроксилрадикала у гетерогенних системах та захист антиоксидантних ферментів. Усі досліджені сполуки гальмують утворення активних форм оксиду азоту. Ступінь прояву антиоксидантних властивостей залежить від природи залишків карбонових кислот у 4-му положенні хінолінового циклу.
6. Встановлено, що найбільш виражена мембранозахисна дія in vivo властива 2-гідрокси-3-(8-метокси-2-метилхінолін-4-ілтіо)пропановій кислоті, наближає до норми рівень ферментативної активності та білоксинтезуючу функцію печінки.
7. Показано, що S-заміщені похідні 2-метил-4-меркапто-8-метоксихіноліну in vivo (модель двосторонньої перев’язки загальної сонної артерії) проявляють властивості ефективних біорегуляторів з антиоксидантною, нейропротекторною дією і переважають еталон порівняння – пірацетам.
8. Розроблено зручний метод синтезу та проведені доклінічні дослідження натрієвої солі 2-гідрокси-3-(8-метокси-2-метилхінолін-4-ілтіо)пропанової кислоти. Встановлено, що сполука має виражену антиоксидантну та нейропротекторну активність. Зокрема, вона знижує активність вільнорадикальних процесів, нормалізує енергетичні процеси і відновлює ферментну систему антиоксидантного захисту.
Список опублікованих праць за темою дисертації
1. Антиоксидантна та гепатопротекторна активність натрієвих солей похідних β-(2-метилхінолін-4-ілтіо)-молочної кислоти / М.П. Завгородній, І.Ф. Бєленічев, Л.О. Омельянчик, О.А. Бражко, В.І. Генчева, І.Б. Лабенська // Питання біоіндикації та екології.− 2004.− Вип. 9, № 2.− С. 149 − 157.
2. Генчева В.І., Омельянчик Л.О., Бражко О.А. Дослідження антирадикальної активності похідних 2-метил-8-метокси-4-тіохіноліну // Вісник Запорізького національного університету. − 2005.− № 1.− С. 71 − 74.
3. Пошук антиоксидантів серед похідних 8-метоксизаміщених 4-меркаптохінолінів / В.І. Генчева, Л.О. Омельянчик, І.Ф. Бєленічев, О.А. Бражко, М.П. Завгородній // Питання біоіндикації та екології.− 2006.− Вип. 11, № 1.− С. 194 − 200.
4. Вивчення біологічної дії деяких 4-S-похідних хіноліну / В.І. Генчева, Л.О. Омельянчик, Д.М. Федоряк, О.А. Бражко, М.П. Завгородній// Біополімери і клітина.− 2006.− Т. 22.− С. 475 − 479.
5. Пошук біорегуляторів з антиоксидантною дією серед S–похідних 4-меркаптохінолінів / Л.О. Омельянчик, В.І. Генчева, Д.М. Федоряк, О.А. Бражко, М.П. Завгородній, І.Б. Лабенська, М.М. Корнет // Ukrainica bioorganica acta. − 2007.– Т. 5, №2 – С. 17 – 24.
6. Синтез похідних 4-тіо та 4-гідразинохінолінів як потенційних біологічно активних речовин / В.І. Генчева, Д.С. Коваленко, І.Б. Лабенська, М.М. Корнет, Є.О. Уліщенко, М.Ф. Шаабан // Хімія і сучасні технології: II Міжнародна науково-технічна конференція студентів і аспірантів та молодих вчених. Дніпропетровськ.- 2005. − С. 116.
7. Синтез похідних 2-метил-6(8)-метокси-4-тіохінолінів як потенційних біологічно активних речовин / В.І. Генчева, М.П. Завгородній, І.Б. Лабенська, М.М. Корнет // Сучасні проблеми хімії: 6 Всеукраїнська конференція студентів та аспірантів.− К., 2005. – С. 73.
8. Синтез біологічно активних речовин на основі S-заміщених 4-тіохінолінів/ Л.О. Омельянчик, О.А. Бражко, М.П. Завгородній, В.І. Генчева, І.Б.Лабенська // Львівські хімічні читання. – Львів, 2005. – С. О29.
9. Виявлення потенційних біорегуляторів серед S-заміщених 4-меркаптохіноліну / В.І. Генчева, Л.О. Омельянчик, О.А. Бражко, М.П. Завгородній // Сучасні досягнення фармацевтичної науки та практики: Всеукраїнська науково-практична конференція з міжнародною участю. Запоріжжя.- 2006.− Вип. XV, Т. 1.− С. 217.
10. Біологічна активність похідних хіноліну / В.І. Генчева, Л.О. Омельянчик, О.А. Бражко, М.П. Завгородній // Сучасні проблеми біології, екології та хімії: Міжнародна конференція. Запоріжжя.2007. – С. 533.
11. Синтез потенційних біорегуляторів серед S-заміщених L-цистеїну та цистеаміну / О.А. Бражко, Л.О. Омельянчик, М.П. Завгородній, В.І. Генчева, М.М. Корнет, І.Б. Лабенська, Ю.Ю. Петруша, Є.О. Уліщенко // XXI Українська конференція з органічної хімії. – Чернігів, 2007. – С. 22.
АНОТАЦІЯ
Генчева В.І. Біологічна активність S-заміщених похідних 2-метил-4-меркапто-8-метоксихіноліну. – Рукопис.
Дисертація на здобуття наукового ступеня кандидата біологічних наук за спеціальністю 02.00.10 – біоорганічна хімія. − Інститут біоорганічної хімії та нафтохімії НАН України, Київ, 2008.
Дисертацію присвячено вивченню антирадикальної, антиоксидантної, мембраностабілізуючої, нейропротекторної активностей S-заміщених похідних 2-метил-4-меркапто-8-метоксихіноліну та встановленню залежності “хімічна будова – біологічна дія”.
Синтезовані S-заміщені похідні 2-метил-4-меркапто-8-метоксихіноліну, всановлено, що вони відносяться до мало- та нетоксичних сполук (ЛД50 знаходиться в межах 566 − 2000 мг/кг).
На моделі окисного стресу in vivo (ішемія головного мозку) показано, що введення нетоксичних натрієвих солей S-заміщених похідних2-метил-4-меркапто-8-метоксихіноліну у дозі 1/50 ЛД50 (препарат порівняння − пірацетам) впливає на рівень показників вільнорадикального окиснення (рівень триєнкетонів) та вуглеводного обміну; захищає активність антиоксидантних ферментів (супероксиддисмутаза, каталаза, глутатіонпероксидаза та вміст α-токоферолу). Встановлено, що подовження на метиленову групу карбонового ланцюга в 4-му положенні гетероциклу і наявність гідроксигрупи в карбоновому ланцюзі посилює антиоксидантну і нейропротекторну активність.
Розроблено зручний метод синтезу натрієвої солі 2-гідрокси-3-(8-метокси-2-метилхінолін-4-ілтіо)пропанової кислоти та проведені її доклінічні дослідження. На моделі окисного стресу in vivo (ішемія головного мозку) сполука проявила виражену антиоксидантну і нейропротекторну дію, що перевищує ефективність еталону порівняння – пірацетаму.
Ключові слова :S-заміщені похідні 2-метил-4-меркапто-8-метоксихіноліну, комп’ютерний прогноз біологічної активності, антиоксидантна активність, перекисне окиснення ліпідів, окисний стрес, мембранозахисна дія, нейропротекторна дія.
АННОТАЦИЯ
Генчева В.И. Биологическая активность S-замещенных производных 2-метил-4-меркапто-8-метоксихинолина. – Рукопись.
Диссертация на соискание ученой степени кандидата биологических наук по специальности 02.00.10 – биоорганическая химия. Институт биоорганической химии и нефтехимии НАН Украины, Киев, 2008.
Диссертация посвящена изучению антирадикальной, антиоксидантной, мембраностабилизирующей, нейропротекторной активностей S-замещенных производных 2-метил-4-меркапто-8-метоксихинолина и установлению зависимости “химическая структура − биологическое действие”.
Синтезированы S-замещенные производные 2-метил-4-меркапто-8-метоксихинолина - потенциальные биорегуляторы.
Осуществлен прогноз биологической активности S-замещенных 2-метил-4-меркапто-8-метоксихинолинов с помощью компьютерной программы PASS, который показал целесообразность поиска среди исследуемых соединений антиоксидантной, гепатопротекторной, нейропротекторной и других видов активности.
S-замещенные 2-метил-4-меркапто-8-метоксихинолины относятся к мало- и нетоксическим соединениям (ЛД50 находится в пределах 566 − 2000 мг/кг).
В опытах in vitro на модели аутоокисления адреналина изучалась их антирадикальная активность. Установлено, что увеличение карбоновой цепи на метиленовую группу в 4-м положении хинолинового цикла влияет на уменьшение антирадикальной активности, наличие гидроксильной группы в карбоновой цепи − ее увеличивает. Натриевые соли (8-метокси-2-метилхинолин-4-илтио)уксусной кислоты и 2-гидрокси-3-(8-метокси-2-метилхинолин-4-илтио)пропановой кислоты проявляют наибольшую антирадикальную активность.
По результатам проведенных экспериментальных исследований установлено, что S-замещенные 2-метил-4-меркапто-8-метоксихинолины на моделях генерации свободнорадикального окисления in vitro проявляют антиоксидантные свойства: снижают образование свободных радикалов, проявляя свойства “ловушек” супероксиданиона в водной фазе, перехватывают гидроксилрадикал в гетерогенных системах, тормозят образование активных форм оксида азота; снижают уровень образования малонового диальдегида и являются протекторами меркаптогрупп протеинов, включая ферменты антиоксидантной защиты (супероксиддисмутазы, каталазы, глутатионпероксидазы).
На модели острого токсического гепатита in vivo исследован их мембраностабилизирующий эффект. Установлено, что наиболее выраженное мембраностабилизирующее действие характерно для 2-гидрокси-3-(8-метокси-2-метилхинолин-4-илтио)пропановой кислоты.
Установлено, что изученные вещества на моделях окислительного стресса in vivo проявляют протекторную активность по отношению к ферментам антирадикальной и антиоксидантной защиты в тканях головного мозга, уменьшают содержание продуктов свободнорадикального окисления, нормализуют основные звенья углеводного и энергетического обмена, защищают структурно-функциональную целостность клеток при ишемии.
На модели окислительного стресса in vivo (ишемия головного мозга) введение нетоксических натриевых солей S-замещенных 2-метил-4-меркапто-8-метоксихинолинов в дозе 1/50 ЛД50 (препарат сравнения − пирацетам) влияет на уровень показателей свободнорадикального окисления (уровень триенкетонов) и углеводного обмена, защищает активность антиоксидантных ферментов (супероксиддисмутазы, каталазы, глутатионпероксидазы и содержание α-токоферола). Установлено, что увеличение на метиленовую группу в остатке меркаптокарбоновой кислотыи введение гидроксигруппы в карбоновую цепь в 4-м положении гетероцикла усиливало антиоксидантную и нейропротекторную активность.
Разработан удобный метод синтеза натриевой соли 2-гидрокси-3-(8-метокси-2-метилхинолин-4-илтио)пропановой кислоты. По результатам исследования специфической активности установлено, что она проявляет выраженную антиоксидантную и нейропротекторную активность, превышающую эффективность эталона сравнения – пирацетама. В частности она снижает активность свободнорадикальных процессов, нормализует энергетические процессы и восстанавливает ферментную систему антиоксидантной защиты.
Ключевые слова :S-замещенные производные 2-метил-4-меркапто-8-метоксихинолина, компьютерный прогноз биологической активности, антиоксидантная активность, перекисное окисление липидов, окислительный стресс, мембраностабилизирующее действие, нейропротекторное действие.
ANNOTATION
Gencheva V.I. Biological activity of S-substituted 2-methyl-4-mercapto-8-methoxyquinoline. – Manuscript.
Thesis for a Candidate of Biological Science Degree on specialty 02.00.10 – Bioorganic Chemistry. – Institute of Bioorganic Chemistry and Petrochemistry, National Academy of Sciences of Ukraine, Kyiv, 2008.
The goal of the thesis is to study antiradical, antioxidative, membrane-stabilizing, neuroprotective activity of S-substituted derivatives of 2-methyl-4-mercapto-8-methoxyquinoline and also to establish the dependency “chemical structure – biological action”.
S-substituted derivatives of 2-methyl-4-mercapto-8-methoxyquinoline were synthesized and were considered as low-toxic and nontoxic compounds (LD50 is within 566-2000 mg/kg).
Basing on the model of oxidative stress in vivo (brain cerebrum ischemia) it was demonstrated that the injection of nontoxic sodium salts of S-substituted derivatives of 2-methyl-4-mercapto-8-methoxyquinoline in dose 1/50 LD50 (comparative compound – piracetam) affects the value of free radical oxidation and carbohydrate metabolism, as well as protects antioxidative enzyme activities (superoxiddismutase, catalase, glutationperoxidase, and the amount of α-tocopherol). It was shown that the extension of carbonic chain in 4-position of the heterocycle and the presence of hydroxy-group induce antioxidative and neuroprotective activity.
Convenient method of synthesis of sodium salt of 2-hydroxy-3-(8-methoxy-2-methylquinolin-4-ylthio)propionic acid has been developed and its pre-clinical research was conducted. Using the model of oxidative stress in vivo (brain cerebrum ischemia) this compound proved to have apparent antioxidative and neuroprotective activity which exceeds the efficacy of the comparative standard – piracetam.
Key words : S-substituted derivatives of 2-methyl-4-mercapto-8-methoxyquinoline, computational prediction of the biological effects, antioxidative activity, lipid peroxidation, oxidative stress, membrane-protective action, neuroprotective action.