| Скачать .docx |
Реферат: Влияние кислорода на активность нанесенного ванадиевого катализатора в процессе газофазной полимеризации этилена
ВЛИЯНИЕ КИСЛОРОДА НА АКТИВНОСТЬ НАНЕСЕННОГО ВАНАДИЕВОГО КАТАЛИЗАТОРА В ПРОЦЕССЕ ГАЗОФАЗНОЙ ПОЛИМЕРИЗАЦИИ ЭТИЛЕНА
Каталитические системы циглеровского типа отличаются высокой чувствительностью к примесям кислорода. На примере гомогенных каталитических систем на основе соединений титана [1, 2] и ванадия [3, 4] и гетерогенных титановых катализаторов [5, 6] показано, что под действием кислорода может происходить активация и ингибирование процесса полимеризации, меняется ММ и стереорегулярность полимерных продуктов.
В литературе нет сведений о влиянии кислорода на полимеризацию с катализаторами, закрепленными на носителе. В связи с тем, что в производстве полиолефинов и наполненных полимерных материалов все более широкое распространение получают процессы газофазной полимеризации с использованием нанесенных катализаторов, в настоящей работе была поставлена задача исследовать влияние кислорода на активность нанесенного ванадиевого катализатора при полимеризации этилена в отсутствие растворителя.
Кинетику газофазной полимеризации этилена изучали в стеклянной вакуумной установке [7]. Полимеризацию осуществляли в термостатируемом реакторе объемом 400 мл, снабженном двумя отростками для раздельного введения нанесенного ванадиевого катализатора и алюминийорганического соединений (в парообразном состоянии). В ходе полимеризации давление мономера и скорость перемешивания реакционной массы поддерживали постоянными.
Ванадиевый катализатор был получен нанесением VC14 на неорганический носитель — перлит (фракция с размером частиц 0,2 мм) по методике, разработанной в ИХФ АН СССР [8]. Содержание ванадия на носителе, определенное колориметрическим методом [9], менялось от 0,27 до 0,55 вес.%; валентное состояние ванадия, по данным потенциометрического титрования, было равно 3.
В качестве сокатализатора использовали А1(изо-С4Н3)з (А1(изо-Вu)3) (т. кип. 39-40°/0,65 гПа). По анализу содержание А1 13,65, содержание изо-Вu-группы 85,4 вес.%.
Этилен подвергали низкотемпературной разгонке и пропускали через колонку с пиролюзитом для очистки от примеси кислорода. Количество кислорода в очищенном этилене по данным колориметрического анализа составляло менее 5 млн. долей.
Кислород, использованный для добавок, был получен разложением КМnСr.А1(изо-Вu)2(ОВu-изо) синтезировали из А1(изо-Вu)з и абсолютного изобутилового спирта. Содержание изо-Вu-групп в диизобутилалюминийизобутоксиде, по данным хроматографического анализа, составляло 58 вес.%; мольное отношение (OBu-изо): (изо-Bu), рассчитанное из ПМР-спектров, равнялось 0,46. Полимеризацию с А1 (изо-Вu)2(ОВu-изо) осуществляли в среде сухого спектрально чистого н-гептана.
В присутствии каталитической системы VCL/перлит — А1 (изо-Вu)3 про-цесс газофазной полимеризации этилена носит нестационарный характер. Активность катализатора, максимальная в начальный момент времени, снижается в ходе полимеризации и достигает постоянного значения (рис. 1).

Рис. 1. Изменение эффективной константы скорости полимеризации этилена во времени в присутствии катализатора УС14/перлит — Al (изо-Bu) з. 70°, Al: V=22, [С2Н4] =0,018 моль/л, содержание ванадия на носителе 0,55 вес.%. Содержание кислорода в этилене 5 (1), 280 млн. долей (2)
В исследованных условиях (70°, содержание ванадия на носителе 0,27—0,55 вес.%, мольное отношение Al: V=5—40) эффективная константа скорости полимеризации каф, определяемая как скорость полимеризации, рассчитанная на единицу концентрации мономера и 1 г переходного металла, не зависит от содержания ванадия в нанесенном катализаторе и мало меняется с увеличением мольного отношения Al : V и с изменением порядка подачи компонентов катализатора и мономера в реакционную зону.
Эффекты, наблюдаемые при введении кислорода в процессе полимеризации, обусловлены протеканием химических реакций кислорода либо с исходными компонентами катализатора, либо с продуктами их взаимодействия. Поэтому при изучении влияния кислорода на каталитическую активность количество добавки целесообразно определять не только абсолютной концентрацией кислорода, но и отношением концентраций кислорода и каждого из компонентов катализатора, т. е. мольным отношением 02: V и О2: AI. Добавки кислорода вводили в реакционную зону на стадии формирования каталитических центров и в ходе полимеризации.
В первом случае проводили предварительное взаимодействие одного из компонентов катализатора с кислородом (в течение 5 мин), затем в систему вводили второй компонент и мономер. Условно такой порядок подачи реагентов можно обозначить [А1(изо-Вu)3+О2]+V (I) и [V+О2] + +А1(изо-Вu), (II).
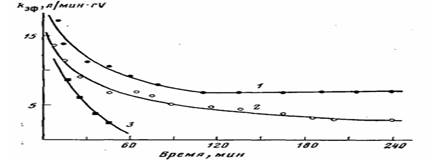
Рис. 2. Кинетические кривые полимеризации этилена на нанесенном ванадиевом катализаторе при различных концентрациях кислорода для системы I. 70°, Al: V= •=18-23, [С2Н4] =0,018 моль/л, содержание ванадия на носителе 0,27 вес.%- 02: А1=0 (1); 0,1 (2); 0,15 (3)
Рис. 2 демонстрирует влияние добавок кислорода на процесс полимеризации для системы I. Из рисунка видно, что с увеличением мольного отношения О2: А1 снижается каталитическая активность, меняется характер кинетики полимеризации, т. е. резко ускоряется дезактивация катализатора. При мольном отношении О2: А1=0,2 (соответственно 0,2 об.% О2) система I полностью теряет каталитическую активность.
Известно, что окисление алюминийтриалкилов кислородом приводит к образованию их алкоксипроизводных [10, 11]. Реакция протекает через стадии образования высокореакционноспособных перекисных соединений алюминия и их превращений. При температурах выше 20° основным продуктом реакции является моноалкоксид алюминия. На примере титановых катализаторов показано, что системы, включающие в качестве сокатализа-тора алкоксипроизводные триэтилалюминия, либо характеризуются низкой каталитической активностью [11], либо не активны в полимеризации [12].
В настоящей работе с целью установления причин дезактивации системы I исследовали продукт окисления Аl(изо-Ви)3 — диизобутилалюми-нийизобутоксид как сокатализатор с VCL/перлит. Методика эксперимента не позволяла осуществлять полимеризацию в газовой фазе из-за низкой упругости паров А1(изо-Вu)2(ОВu-изо) (т. кип. 120°/0,65 гПа), поэтому опыты проводили в к-гептане. Подобное различие в скоростях полимеризации в жидкой и газовой фазе отмечается также Кейи [13] при полимеризации пропилена с <x-TiCl3 — AlEt2Cl.
Полученные экспериментальные результаты по полимеризации этилена с А1(изо-Вu)2(ОВu-изо) приведены на рис. 3 и сводятся к следующему: катализатор УС14/перлит не обладает каталитической активностью в сочетании с А[(изо-Вu)2(ОВu-изо); добавки А1(изо-Вu)2(ОВu-изо) на стадии формирования активных центров в виде смеси с А1(изо-Вu)3 при одной и той же концентрации триизобутилалюминия (рис. 3, кривые 3, 4) и в ходе полимеризации (рис. 3, кривая 5) приводят к снижению начальной скорости полимеризации и ускорению дезактивации катализатора. На основании этих результатов, исходя из представлений о биметаллической природе активных центров, можно высказать следующие предположения: во-первых, Al(uзo-Bu)2(OBu-uзo) не является алкилирующим агентом и его действие ограничивается образованием комплексов с исходными и алки-лированными соединениями ванадия; во-вторых, образующиеся комплексы являются, пo-видимому, более прочными, по сравнению с комплексами, включающими А1(изо-Вu)3 (из-за сильных донорных свойств А1(изо-Вu)2-(ОВu-изо) [14, 15]); диизобутилалюминийбутоксид может замещать А1(изо-Вu)3 в ванадий-алюминиевых комплексах; в-третьих, комплексы A1(изо-Bu)2(OBu-изо) с алкилированным ванадием неактивны в процессе полимеризации этилена.
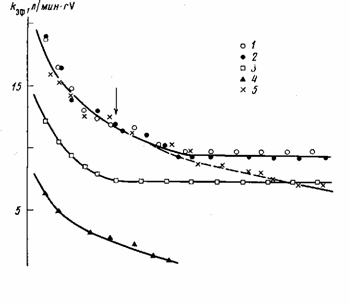
Рис. 3. Влияние добавок А1(изо-Вu)2 (OBu-uao) на каталитическую активность системы УС14/перлит - А1(изо-Вu)з. 70°, Al(uso-Bu)3: V=10-14, [С2А4] =0,018 моль/л, объем и-гептана 70 мл, содержание ванадия на носителе 0,38 вес.% [А1(изо-Вu)г(ОВu-изо)]:[А1(изо-Вu)3]=0 (7); 0,43 (2); 1 (3); 5 (4); 2 (5); стрелкой показано время введения А1(изо-Вu)2(ОВu-изо)
Таким образом, приведенные кинетические данные позволяют объяснить дезактивацию катализатора I с ростом мольного отношения О2: А1 (как и в случае катализатора [(О2+AlEt3)+a-TiCl3] [5]) образованием оксипроизводных алюминия и, как следствие, уменьшением начального числа активных центров в результате понижения эффективной концентрации исходных компонентов (алкилирующего агента А1(изо-Вu)3 и соединений ванадия, не связанных в комплекс с А1(изо-Вu)2(ОВu-изо)), а также накоплением неактивных комплексов алкилированного ванадия с диизо-бутилалюминийизобутоксидом.
Тот факт, что при полимеризации в газовой фазе дезактивация катализатора наблюдается при значительно меньших концентрациях бутоксида алюминия по сравнению с полимеризацией в растворителе, может быть связан с тем, что в растворе алкоксипроизводные алюминия находятся преимущественно в виде димеров и концентрация реакционноспособной мономерной формы низка [15].

Рис. 4. Кинетические кривые полимеризации этилена на нанесенном ванадиевом катализаторе при различных концентрациях кислорода. Система II. Условия полимеризации те же, что на рис. 2. 02: V=0 (i), 1 (2), 2 (3), 4 (4), 7 (5), 7 (6) (через 5 мин после начала взаимодействия с ванадиевым компонентом кислород удаляли из реактора вакуумированием, после чего вводили А1(изо-Вu)3)
Изменение каталитической активности системы II с концентрацией кислорода показано на рис. 4. Из полученных экспериментальных данных следует, что если первым в контакт с кислородом вступает ванадиевый компонент, то образующаяся система II (в отличие от системы I) по стабильности не отличается от исходной. Характер кинетических кривых не меняется с увеличением мольного отношения О2 : V. Из рис. 4 видно также, что предварительное взаимодействие ванадиевого компонента с кислородом в эквимольных количествах (кривая 2) приводит к активации катализатора. Значения кэф. и кэф. ст, полученные в отсутствие кислорода и при различных мольных отношениях О2 : V, приведены на рис. 5. Как видно из этих данных, зависимость каталитической активности системы II от мольного отношения О2 : V носит экстремальный характер. При увеличении мольного отношения О2 : V от 0 до 1 (0,05 об. % О2) /сэф. 0 возрастает от 19,5 до 26 л/минт V, кэф. ст от 6,5 до 9 л/мин-г V. При более высоких концентрациях кислорода активность системы II снижается, при мольных отношениях 02.' V>10 (>1 об.% О2) система становится неактивна в полимеризации.
Таким образом, наблюдаемая активация системы II может быть связана с образованием соединений ванадия высшей валентности. Известно, что активность катализаторов, включающих в качестве исходного ванадиевого компонента соединения высоковалентного ванадия (VOCl3, VO(OR)3), значительно превышает активность катализаторов на основе галоидов ванадия низшей валентности [17]. Дезактивация катализатора при мольных отношениях О2: V выше эквимольного (рис. 5), как было показано, не является результатом взаимодействия кислорода с исходным ванадиевым соединением. Если после окисления ванадия (при высоких мольных отношениях О2: V) непрореагировавший кислород удаляли вакуумированием и затем добавляли А1(изо-Вu)3, то активность катализатора была значительно выше, чем в опытах без удаления кислорода (рис. 4, кривая 6 и рис. 5). По-видимому, понижение активности системы II с увеличением концентрации кислорода, как и системы I, обусловлено ингибирующим действием образующегося диизобутилалюминийизобутоксида.
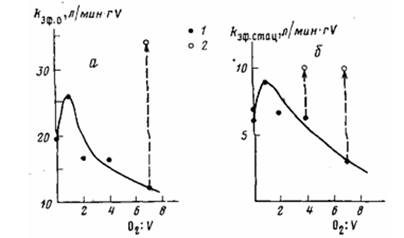
Рис. 5. Зависимость начальной (а) и стационарной (5) эффективных констант скорости полимеризации этилена с системой II от мольного отношения 02: V. Условия полимеризации те же, что на рис. 2. 1 — полимеризацию проводили без удаления кислорода; 2 — через 5 мин после начала взаимодействия с ванадиевым компонентом кислород удаляли из реактора вакуумированием, после чего вводили А1(изо-Вu)з
Для изучения влияния кислорода на сформированную каталитическую систему взаимодействие компонентов катализатора с кислородом осуществляли в ходе полимеризации в различное время после начала процесса. Как было показано, добавление кислорода в активную систему в количестве, близком к концентрации ванадиевого компонента, 0,07 об.°/о (соответственно О2 : А1=0,05 и О2: V=l) приводит к полному ингибированию полимеризации.
Наблюдаемая дезактивация связана с гибелью каталитических центров в результате разрушения активных ванадийуглеродных связей под действием кислорода. По аналогии с Ti-органическими соединениями [18] можно предположить, что при окислении органических производных ванадия происходит внедрение кислорода по связи V—С и образование оксипроизводных ванадия, неактивных в процессе полимеризации
![]()
Полученные экспериментальные результаты для наглядности сведены в таблицу. Из таблицы видно, что низкое по сравнению с концентрацией катализатора содержание кислорода в реакционной зоне не влияет на активность системы. Увеличение концентрации кислорода отражается на поведении катализатора. Наиболее подвержена ингибирующему действию кислорода сформированная каталитическая система. В тех случаях, когда кислород присутствует на стадии формирования активных центров, его ингибирующее действие проявляется сильнее, если первым с ним в контакт вступает алюминийорганическое соединение. Количество кислорода, приводящее к полному ингибированию процесса полимеризации, в случае системы I в 4 раза, а системы II в 10 раз ниже по сравнению со сформированной каталитической системой. Более того, количество кислорода, вызывающее дезактивацию катализатора в ходе полимеризации, активирует систему И.
Таким образом, на основании полученных экспериментальных результатов можно сделать заключение, что влияние примеси кислорода на активность исследованного ванадиевого катализатора в процессе газофазной полимеризации этилена определяется последовательностью подачи компонентов катализатора и кислорода в реакционную зону и соотношением их концентраций.
ЛИТЕРАТУРА
1. Breslow D. S., Newburg N. R. J. Amer. Chem. Soc, 1957, v. 79, JVs 18, p. 5072.
2. Белов Г. П., Распопов Л. И., Лисицкая А. П., Цветова В. И., Чирков Н. М. Высокомолек. соед., 1966, т. 8, № 9, с. 1568.
3. Шилов А. Е., Шулындин С. В., Сотникова Г. И. Высокомолек. соед. А, 1967, т. 9. № 4,0.808.
4. Phillips G. W., Carrick W. L. J. Polymer Sci., 1962, v. 59, № 168, p. 401.
5. Yoshuhari Doi, Yasuo Hattori, Ichiro Okure, Tominaga Keii. J. Chem. Soc. Japanu Industr. Chem. Sec, 1969, v. 72, № 12, p. 2621.
6. Masuda Takachi, Takami Yasuo. J. Polymer Sci. Polymer Chem. Ed., 1977. v. 15 № 8, p. 2033.
7. Фирсов А. П., Цветова В. И., Чирков Н. М. Высокомолек. соед., 1961, т. 3, № 8, 11.
8. Костандов Л. А., Ениколопов Н. С, Дьячковский Ф. С, Новокшонова Л. А., Гаврилов, Маклакова Т. А., Акопян Л. А., Брикинштейн X. А.-А. с. 763379 (СССР).Опубл. в Б. И., 1980, № 34.