| Скачать .docx |
Реферат: Гидроксикарбонильные соединения. Дикарбоновые кислоты
Гидроксикарбонильные соединения
a-Гидроксикарбонильные соединения, как уже отмечалось, могут быть получены окислением диолов гипобромитом натрия или реагентом Фентона.
Для a-гидроксикарбонильных соединений характерна димеризация в циклические полуацетали, соответственно кетали (2,5-дигидрокси-1,4-диоксаланы):
 (55)
(55)
Как a-гидроксиальдегиды так и a-гидроксикетоны находятся в таутомерном равновесии с ендиолами и через такие формы могут превращаться друг в друга (перегруппировка Лобри-де Брюина - Ван-Экенштейна).
 ендиолы
ендиолы
Упр. 38. Напишите реакции взаимного превращения глицеринового альдегида (2,3-дигидроксипропаналя) и 1,3-дигидроксиацетона (1,3-дигидрокси-2-пропанона) в щелочной среде.
Ендиолы имеют кислую реакцию и в щелочной среде образуют соли, называемые редуктонатами. Редуктонаты являются сильными восстановителями, поэтому в противоположность просто кетонам a-оксикетоны, обладающие восстановительными свойствами, реагируют с реактивом Фелинга. При этом сами они окисляются до 1,2-дикарбонильных соединений.
Отличительной чертой 1,4- и 1,5-гидроксикарбонильных соединений является оксо-цикло таутомерия (кольчато-цепная таутомерия), приводящая к образованию циклических полуацеталей, причем гидроксильная группа может занимать как аксиальное так и экваториальное положение:

Образующиеся полуацетали являются энантиомерами и находятся между собой в равновесии.Если нет необходимости указывать конфигурацию полуацеталя пользуются волнистой линией:

Циклические полуацетали реагируя со спиртами, могут превращаться в полные ацетали:

 (56)
(56)
Ацетали, как известно, устойчивы в щелочной среде, но легко гидролизуются в кислой среде:
 |
(57)
Дикарбонильные соединения
Как и в случае других бифункциональных производных, химические свойства диальдегидов, дикетонов и кетоальдегидов в заметной степени определяются относительным расположением функциональных групп друг относительно друга. Поэтому различают: 1,2- или a-дикарбонильные соединения, 1,3- или b-дикарбонильные соединения, 1,4- или c-дикарбонильные соединения и т.д.
a -Дикарбонильные соединения
a-Дикарбонильные соединения могут быть получены окислением альдегидов и кетонов диоксидом селена в уксусной кислоте при обычной температуре или действием на них азотистой кислотой с последующим гидролизом монооксима в разбавленной кислоте:
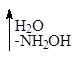
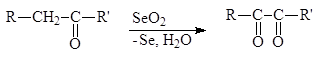

К характерным свойствам a-дикарбонильных соединений относится их способность изомеризоваться в щелочной среде в a-гидроксикислоты:
![]() (58)
(58)
гликолевая кислота
Реакции 1,3-дикарбонильных соединений
Химические свойства 1,3-дикарбонильных соединений в значительной степени определяются кето-енольной таутомерией. 1,3-Дикарбонильные соединения являются более сильными С-Н-кислотами, чем простые альдегиды и кетоны. Например, ацетилацетон (pKa = 9,0) растворим в щелочах и реагирует с натрием с выделением водорода. С солями тяжелых металлов 1,3-дикарбонильные соединения образуют очень стабильные хелатные комплексы, растворимые в органических растворителях и перегоняющиеся без разложения при обычном давлении.

Ацетилацетонат меди
Сопряженные 1,3-дикарбонильным соединениям основания могут алкилироваться в соответствии с правилом Корнблюма как по атому кислорода, так и по атому углерода.
При нагревании с сильными щелочами 1,3-дикарбонильные соединения расщепляются с образованием кетона и кислоты:
Упр. 39. Допишите реакции:
 |
(а) (б)
 |
 (в) (г)
(в) (г)
 |
 |
(д) (е)
 |
|
(ж) (з)
 |
 |
 |
![]() (и) (к)
(и) (к)
(л)
Дикарбоновые кислоты
Все дикарбоновые кислоты представляют собой твердые кристаллические вещества. Низшие дикарбоновые кислоты хорошо растворимы в воде. Дикарбоновые кислоты получают теми же методами, что и монокарбоновые кислоты.
Карбоксильные группы характерным образом влияют друг на друга в зависимости от их взаимного расположения. Эта зависимость проявляется, прежде всего, в разном отношении дикарбоновых кислот к нагреванию. Щавелевая и малоновая кислоты разлагаются соответственно при 200 и 150о С, отщепляя диоксид углерода. Янтарная, глутаровая, адипиновая, малеиновая и фталевая кислоты при нагревании легко превращаются во внуутренние ангидриды.
Упр. 40. Каковы промышленные методы получения адипиновой кислоты? Где она применяется?
Упр.41. Сравните отношение к нагреванию щавелевой, малоновой, янтарной, глутаровой и адипиновой кислот. Напишите соответствующие реакции и назовите образующиеся продукты.
Упр.42. Предложите схему синтеза малоновой кислоты из уксусной кислоты. Чем обусловлена легкость декарбоксилирования малоновой и алкилмалоновых кислот?
Упр. 43 . Напишите формулы всех фталевых кислот. Какая из них превращает-ся в ангидрид при нагревании? Исходя из п -ксилола и этилена и других необходимых реагентов, предложите схему получения полиэтилентерефталата.
Упр. 44. Предложите схему (схемы) получения капрона исходя из бензола.
Упр. 45. Эластомерное волокно лайкра (спандекс) получают при переработке полиуретана, синтезируемого из гексаметилендиизоцианата и 1,4-бутандиола. Приведите схему получения этого полимера. Предложите схему получения гексаметилендиамина из адипиновой кислоты, а бутандиола-1,4 из ацетилена и других необходимых реагентов.
Упр. 46. Исходя из п-ксилола и этилена и других необходимых реагентов предложите схему получения полиэтилентерефталата.
Упр. 47. Исходя из бензола и других необходимых неорганических веществ предложите схему (схемы) получения нейлона-6,6.
Упр. 48. По реакции Виттига получите следующие соединения:
(а) метиленциклопентан, (б) 1,2-дифенилметан, (в) 2-фенилпропен,
(г) 2-метил-1-фенил-1-пропен, (д) 1-фенил-1,3-бутадиен, (е) 1,2-дифенилэтан.
Упр. 49. Какие продукты образуются в результате взаимодействия пропаналя с нижеследующими соединениями: (а) NaBH4 в водной NaOH; (б) C6 H5 MgBr, затем вода; (в) LiAlH4 , затем вода; (г) Ag(NH4 )+ ; (д) (C6 H5 )3 P=CH2 ; (е) H2 и Pt; (ж) HOCH2 CH2 OH и Н+ ; (з) СН3 СН=Р(С6 Н5 )3 ; (и) гидроксиламин; (к) семикарбазид; (л) фенилгидразин; (м) разб. р-р KMnO4 ;т(н) HSCH2 CH2 SH, H+ , затем никель Ренея.
Упр. 50. Напишите схему реакции п-толуилового альдегида с: (а) уксусным ангидридом в присутствии ацетата натрия (реакция Перкина), (б) анилином, (в) фенолом (2 моля), (г) ацетоном в присутствии щелочи (0.5 моля), (д) гидразином, (е) этилмагнийбромидом а затем с водой, (ж) с метилацетиленидом натрия а затем с водой.
Упр. 51. Предложите схему (схемы) получения капрона исходя из бензола.
Упр. 52. Исходя из бензола, Сl, CO и Н2 и других необходимых
неорганических веществ предложите схему (схемы) получения фенолформаль-дегидной смолы.
Упр. 53. Исходя из бензола и пропена, а также фоcгена предложите схему получения лексана (мерлона).
Упр. 54. Исходя из бензола и других необходимых реагентов предложите схему получения ацетилсалициловой кислоты (аспирина) и напишите ее реакцию с бикарбонатом натрия.
Галогенирование, галоформная реакция
Насыщенные альдегиды и кетоны при взаимодействии с галогенами дают исключительно продукты замещения атомов водорода в a-положении к карбонильной группе:

Реакции галогенирования альдегидов и кетонов имеют следующие характерные особенности:
- скорости реакции со всеми галогенами одинаковы;
- скорость образования продукта не зависит от концентрации галогена;
- реакции промотируются основаниями и катализируются кислотами.
 Наиболее изученной является реакция бромирования ацетона. Подробное ее изучение привело к выводу о том, что она проходит стадию предварительного превращения в енольную форму.
Наиболее изученной является реакция бромирования ацетона. Подробное ее изучение привело к выводу о том, что она проходит стадию предварительного превращения в енольную форму.
бромацетон
 |
ацетофенон w-хлорацетофенон
В присутствии оснований сначала медленно образуются еноляты или енолы, которые далее быстро реагируют с галогенами:
 |
|||||
 |
|||||
 |
 |
||||
 |
|||||
или
 |
В присутствии кислоты галогенирование происходит через стадию образования енола, быстро реагирующего с галогеном:
 |
||
 |
||
При галогенировании метилкетонов в щелочной среде проходит галоформная реакция:
C6 H5 СОCH3 + 3X2 + 4NaOH ®C6 H5 COONa + CHX3 + 3NaX + 2H2 O (53)
Механизм стадии расщепления галоформной реакции
Упр. 55. Напишите схему взаимодействия ацетона с бромом (1:1), опишите механизм и объясните: почему скорость реакции не зависит от концентрации брома? Объясните также: почему ацетон реагирует со всеми галогенами с одинаковой скоростью?
Упр. 56. При бромировании ацетофенона без катализатора образуется w-бромацетофенон, если же реакцию вести в присутствии хлорида алюминия, то получается м -бромацетофенон. Напишите уравнения этих реакций и объясните их механизмы.
Использование альдольных реакций в синтезе спиртов. Альдольные реакции широко используются в органическом синтезе для получения альдегидов, кетонов и спиртов различного строения, что легко видеть из приводимой ниже схемы.
 |
альдегид альдоль 1,3-диол
 |
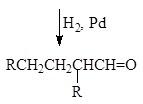 насыщенный спирт ненасыщенный альдегид аллильный спирт
насыщенный спирт ненасыщенный альдегид аллильный спирт
альдегид
Упр. 58. Используя альдольное присоединение, синтезируйте следующие соединения: (а) 4-гидрокси-2-пентанон; (б) 3-метил-4-гидрокси-2-пентанон, (в) 4-гидрокси-2-гептанон.
Упр. 59. В одном из промышленных методов получения 1-бутанола в качестве исходного продукта используется ацетальдегид. Напишите реакции, лежащие в основе этого метода.
Упр. 56. Напишите реакции получения нижеследующих соединений исходя из бутаналя: (а) 2-этил-3-гидроксигексаналь, (б) 2-этил-2-гексен-1-ол, (в) 2-этил-1-гексанол, (г) 2-этил-1.3-гександиол (репеллент насекомых “6-12”).
Протеканием альдольных реакций объясняется образование дивинила из этилового спирта по методу Лебедева:
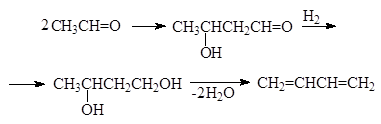 |
||
Упр. 60. Напишите реакцию получения циангидрина бензофенона и опишите ее механизм.
Ответ:

Механизм

Большое практическое значение имеет реакция между ацетальдегидом и избытком формалина в щелочной среде:
 |
триоксиметилацетальдегид пентаэритрит
Первоначально в этой реакции образуется триоксиметилацетальдегид (продукт альдольного присоединения), вступающий далее в реакцию Канниццаро еще с одной молекулой формальдегида.
Упр. 61. Триоксиметилацетальдегид может быть получен в качестве основного продукта если смесь формалина и ацетальдегида в молярном соотношении 3:1 нагревать при 40 о С с разбавленным раствором карбоната натрия. Напишите соответствующую реакцию и опишите ее механизм.
Пентаэритрит широко применяется в химии полимеров, а также для получения эфира азотной кислоты:
(54)
пентаэритриттетранитрат
Пентаэритриттетранитрат представляет собой взрывчатое вещество.
Конденсация с нитрилами
В нитрилах a-атомы водорода также подвижны и способны участвовать в реакциях по типу альдольдольной конденсации.
Упр. 62. Напишите реакцию фенилацетонитрила с бензальдегидом.
