| Скачать .docx |
Реферат: Реакции спиртов. Кислотно-основные свойства спиртов. Реакции с участием нуклеофильного центра
Спирты представляют собой соединения общей формулы ROH, в которых гидроксильная группа присоединена к насыщенному атому углерода. По номенклатуре ИЮПАК насыщенные спирты называют алканолами, нумерация в которых определяется гидроксильной группой. Гидроксильная группа при наличии двойной и тройной связей является старшей.
![]()
![]()
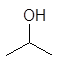
![]()
![]()
этанол 1-пропанол 2-пропанол 2-пропен-1-ол 2-пропин-1-ол
этиловый пропиловый изопропиловый аллиловый пропаргиловый спирты
![]()
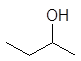
![]()


1-бутанол 2-бутанол 2-метил-1-пропанол 2-метил-2-пропанол
н -бутиловый втор -бутиловый изобутиловый трет -бутиловый спирты
При нумерации атомов главной цепи спиртов гидроксильная группа имеет преимущество перед алкильными группами, атомами галогенов и кратной связью.

транс -3-(2’-гидроксиэтил)-1-циклопентанол
Часто спирты называют по углеводородной группе (этиловый спирт). В этой номенклатуре положение заместителя в алкильной группе спирта обозначается буквами греческого алфавита:
![]()
![]()
g-бромпропиловый спирт b-метоксиэтиловый спирт
В зависимости от того, является ли атом углерода, к которому присоединена гидроксильная группа, первичным 1о , вторичным 2о или третичным 3о спирты бывают 1о (RCH2 OH), 2о (R2 CHOH) или 3о (R3 COH). Например, из четырех возмож-ных бутиловых спиртов два – бутиловый и изобутиловый являются первичными 1о , втор -бутиловый - вторичным 2о итрет -бутиловый – третичным 3о .
Число гидроксильных групп в молекуле определяет так называемую атомность спирта. По числу гидроксильных групп в молекуле спирты подразделяются на одноатомные, двухатомные, трехатомные и т.д. Например, этанол является одноатомным спиртом, этиленгликоль _ двухатомным, а глицерин _ трехатомным.
![]()
![]()
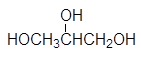
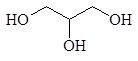
этиленгликоль глицерин
1. Реакции спиртов
Функциональная группа спиртов содержит электроотрицательный атом кислорода с двумя неподеленными парами электронов. В молекуле спиртов можно выделить следующие реакционные центры:
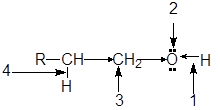
1. ОН-кислотный центр, обусловливающий возможность отщепленя протона вследствие высокой полярности связи О-Н;
2. нуклеофильный и n -основный центр - атом кислорода, имеющий неподеленные пары электронов;
3. электрофилный центр -a-атом углерода, на котором дефицит электронов вызван -I -эффектом соседней гидроксильной группы;
4. b-С-кислотный центр, в котором поляризация связи С-Н также обусловлена электроноакцепторным влиянием гидроксильной группы.
1.1. Кислотно-основные свойства спиртов
Спирты являются слабыми ОН-кислотами Бренстеда и жесткими кислотами по Пирсону. По кислотности спирты близки к воде. Кислотные свойства спиртов определяются способностью к протонизации атома водорода гидроксильной группы. Последняя обусловливается не только разницей в электроотрицательностях между атомами кислорода (3,5) и водорода (2,1), но и природой радикала. Метанол (pKa = 15,5), несколько более сильная кислота, чем вода (pKa = 15,7), но большинство спиртов являются более слабыми кислотами, чем вода. Причиной этого являются стерические препятствия, мешающие в разветвленных спиртах сольватации образующегося алкоксид-аниона. Сольватация стабилизирует алкоксид-анион и следовательно усиливает кислотные свойства.
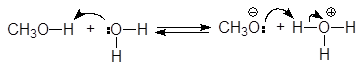 (26)
(26)

pK a = 15.5
Образование межмолекулярной водородной связи в жидкой фазе определяет различие в кислотности первичных, вторичных и третичных спиртов. В водном растворе кислотность спиртов уменьшается в ряду:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
pKa (в воде) 5.0 15,5 15,7 15,9 17,0 18,0
тогда как в газовой фазе наблюдается прямо противоположная последователь-ность
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 30
20
10
10
30
20
10
10
В жидкой фазе определяющим фактором стабилизации алкоксид-анионов является эффект сольватации, который тем больше, чем меньше стерические препятствия для сольватации, т.е. чем меньше в молекуле углеводородных радикалов и меньше их размер. Разветвленность алкильной группы снижает кислотность спиртов, а введение в их молекулы атомов галогена, наоборот повышает ее.
Кислотные свойства спиртов проявляются во многих реакциях, например:
![]() (27)
(27)
метоксид натрия
(MeO‾Na+ )
![]() (28)
(28)
этоксид натрия
(EtO‾Na+ )
![]() (29)
(29)
трет -бутоксид калия
(t - BuO‾K+ )
1.2. Реакции с участием нуклеофильного центра
Высокая электроотрицательность атома кислорода (3,5 по шкале Полинга), являющегося основным центром, позволяет рассматривать спирты как слабые n-основания Бренстеда и жесткие основания по Пирсону. Неудивительно, что спирты способны образовывать соли оксония только с сильными протонными кислотами и жесткими кислотами по Пирсону (фторид бора, хлорид цинка и др.).
 (30)
(30)
гидроний этилоксоний
Таким образом, спирты обладают слабыми кислотными и слабыми основными свойствами, т.е. являются амфипротонными соединениями.
При достаточно высокой температуре и в отсутствие хорошего нуклеофила протонированные спирты способны к реакции Е1, т.е. к реакции дегидратации.
Будучи жесткими основаниями, вследствие низкой поляризуемости и высокой электроотрицательности, атома кислорода спирты являются слабыми нуклеофилами. Кислоты Бренстеда протонируют атом кислорода гидроксигруппы.
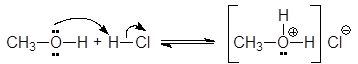 (31)
(31)
метилгидроксоний хлорид
Кислоты Люиса образуют со спиртами доноро-акцепторные комплексы, в которых атом кислорода является донором неподеленной электронной пары.
 (32)
(32)
В общем, спирты являются сравнительно слабыми основаниями: значения pKa их сопряженных кислот ROH2 + составляют около -2. Разветвление алкильной группы в молекуле спирта увеличивает его основность.
К реакциям, протекающим с участием нуклеофильного центра, можно отнести реакции О-ацилирования и О-алкилирования спиртов.
А. О-Ацилирование
Спирты реагируют с карбоновыми кислотами с образованием сложных эфиров (эстеров) по реакции конденсации получившей название этерификация .
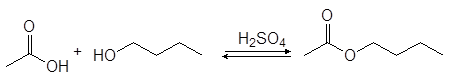 (33)
(33)
уксусная кислота 1-бутанол бутилацетат
Реакция этерификации катализируется кислотами. Без добавления кислоты равновесие достигается очень медленно, но если же смесь спирта и кислоты нагревать в присутствии небольшого количества концентрированной серной кислоты или хлороводорода равновесие устанавливается достаточно быстро.
В качестве ацилирующих реагентов могут использоваться как неорганические, так и органические кислоты, и их функциональные производные. С неорганически-ми кислотами без осложнений реагируют только первичные спирты, в результате чего образуются сложные эфиры (кислые или средние):
 (34)
(34)
этилгидросульфат
Эта реакция имеет промышленное значение, т.к. с ее помощью из высших спиртов получают синтетические моющие средства:
 (35)
(35)
При использовании избытка спирта можно получать диалкилсульфаты. Так при нагревании метанола с олеумом получают диметилсульфат.
 (36)
(36)
Диметилсульфат - это нервный яд, он хорошо адсорбируется кожей. Его используют для получения метилиодида.
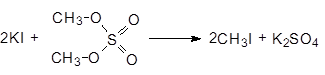 (37)
(37)
Вторичные и третичные спирты при нагревании с серной кислотой подвергаются дегидратации.
При действии на спирты азотной кислоты образуются нитраты. Тринитрат глицерина, неправильно называемый тринитроглицерином, является взрывчатым веществом, однако он очень чувствителен к удару, поэтому его применяют в виде динамита, представляющего собой опилки, пропитанные тринитроглицерином. Взрывчатыми веществами являются нитраты и других полиолов.
 (38)
(38)
глицерин тринитрат глицерина
Спирты реагируют с фосфорной кислотой, давая алкилфосфаты:
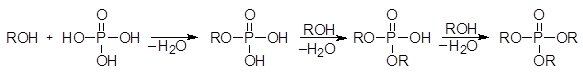 (39)
(39)
фосфорная к-та алкилдигидро- диалкилгидро- триалкилфосфат
Фосфат фосфат
При нагревании фосфорной кислоты она превращается в ангидриды, называемые дифосфорной и трифосфорной кислотой. Ди- и трифосфорная кислоты также реагируют со спиртами давая эфиры. Эфиры фосфорной кислоты играют очень важную роль в биохимических реакциях. Особенно большое значение имеют эфиры трифосфорной кислоты. В воде они способны медленно гидролизоваться с выделением тепла. В организме эти реакции катализируются энзимами.
 (40)
(40)
Б. О-Алкилирование
В качестве алкилирующих агентов используются галогенопроизводные, диалкилсульфаты и алкилсульфонаты. Для увеличения нуклеофильности спиртов их превращают в алкоксиды щелочных металлов.
![]() (41)
(41)
этоксид натрия пропилбромид пропилэтиловый эфир
Активность спиртов как нуклеофильных реагентов может быть увеличена, если использовать в качестве среды полярные апротонные растворители, например диметилсульфоксид. Растворители этого типа в меньшей степени сольватируют спирты, т.к. не образуют с ними водородных связей. Отсутствие сольватации повышает нуклеофильность спиртового атома кислорода. В этом случае можно использовать спирт и щелочь вместо алкоголята:
 (42)
(42)
бутилпропиловый эфир
Эта реакция, называемая синтезом Вильямсона, протекает по механизму SN 2.
Использование в синтезе Вильямсона вторичных и третичных галогеноалканов приводит к получению простых эфиров с более низким выходом, поскольку нуклеофильное замещение сопровождается конкурентной реакцией дегидрогалогенирования с образованием алкенов. Также ограничено применение в синтезе Вильямсона алкоголятов вторичных и третичных спиртов, основность которых сопоставима с их нуклеофильностью, что способствует конкурентному протеканию реакции дегидрогалогенирования. Синтетические возможности реакции Вильямсона расширяются при использовании диалкилсульфатов и алкилсульфонатов вместо галогеноалканов. Этот вариант применется главным образом для метилирования и этилирования спиртов:
 (43)
(43)
пропоксид натрия диметилсульфат метилпропиловый эфир