| Похожие рефераты | Скачать .docx |
Реферат: Способы получения сложных эфиров. Конденсации формальдегида с изобутиленом. Различные способы получения фенола
Способы получения сложных эфиров. Основные продукты и области их применения. Условия проведения реакции этерификации органических кислот со спиртами. Катализаторы процесса. Особенности технологического оформления реакционного узла этерификации.
1. Взаимодействие кислот со спиртами:
![]()
Это наиболее распространенный способ получения сложных эфиров.
2. Синтез сложных эфиров методом конденсации альдегидов:
![]()
Синтез сложных эфиров из альдегидов (реакция Тищенко) осуществляется в присутствии алкоголята алюминия, активированного хлоридом железа или, что лучше, хлоридом алюминия и окисью цинка. Данный метод имеет промышленное значение.
3. Присоединение органических кислот к алкенам:
![]()
4. Синтез сложных эфиров путем дегидрогенизации спиртов:

5. Получение сложных эфиров методом переэтерификации.
Данная реакция имеет две разновидности: реакция обмена между эфиром и спиртом спиртовыми радикалами (реакция алкоголиза):
![]()
и реакция обмена кислотными радикалами у спиртовой группы эфира:
![]()
6. Синтез эфиров из ангидридов кислот и спиртов:

7. Взаимодействие кетонов со спиртами:
![]()
8. Взаимодействие между галоидангидридами и спиртами:
![]()
9. Реакция между серебряными или калиевыми солями кислот и алифатическими галоидными производными:
![]()
10. Взаимодействие кислот с алифатическими диазосоединениями (в основном с диазометаном):
![]()
Основными продуктами реакции этерификации являются сложные эфиры, используемые в качестве растворителей, пластификаторов, синтетических смазочных масел и гидравлических жидкостей, душистых веществ, мономеров.
Этерификацию спиртов карбоновыми кислотами можно проводить в отсутствии катализатора, но в этом случае она протекает медленно и для достижения достаточной скорости требуется высокая температура (200-300О С). Но когда примесь катализатора трудно отмывается, применяют именно некаталитический процесс. В присутствии кислотных катализаторов этерификация протекает при температуре 70-150О С.
Наиболее распространенными катализаторами этерификации являются минеральные кислоты: серная, фосфорная. Могут использоваться бензолсульфокислота, толуолсульфокислота и т.д. Большую группу катализаторов составляют соли органических и неорганических кислот. Могут быть использованы в качестве катализаторов реакции этерификации: перекись титана, молибден на инертном носителе, активный этилат алюминия, алкоголяты титана и др. Все более широкое применение в качестве катализаторов получают ионообменные смолы.
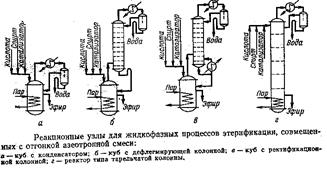
Вариант 18
Реакции гидролиза. Получаемые продукты и области их применения. Основные гидролизующие агенты и катализаторы. Способы регулирования селективности в процессах гидролиза. Обосновать выбор реакторного узла для процесса жидкофазного гидролиза хлорпентана в аллиловые спирты.
Реакциями гидролиза называют процессы замещения или двойного обмена, протекающие под действием воды или щелочей. С помощью гидролиза синтезируют некоторые производные фенолов, служащие основой для получения пестицидов. Для получения спиртов щелочной гидролиз сохраняет значение как путь синтеза аллилового спирта. Гидролиз – одна из стадий получения глицерина. Гидролизом нитрилов получают карбоновые кислоты. Кроме того, гидролиз – одна из стадий получения таких продуктов как: акрилонитрил, поливиниловый спирт, этиловый спирт из древесины, акриламид, высшие жирные спирты (процесс «Алфол»), МХУК, производство капролактама из анилина и т.д.
Вода или водяной пар в отсутствии катализатора – очень слабый гидролизующий агент. В качестве щелочных гидролизующих агентов применяют водные или водно – спиртовые растворы щелочей (для щелочного плавления – твердая щелочь с небольшой добавкой воды). Водные растворы слабых щелочей оказывают более медленное и мягкое гидролизующее действие. Для гидролиза типично каталитическое влияние кислот, которое зависит от их силы. Часто используют серную кислоту, но ее применение нередко ведет к побочным реакциям конденсации и осмоления. Поэтому используют и кислоты более мягкого действия – органические сульфокислоты, которые лучше растворимы в органических средах, и, кроме того, обладают поверхностно – активными свойствами, что облегчает гомогенизацию реакционной массы. Кроме этого часто применяются гетерогенные контакты кислотного типа (катиониты, фосфорная кислота на носителе и т.д.), преимущество которых состоит в малом расходе, меньшей коррозионной активности и снижении количества сточных вод.
При действии щелочей на хлорпроизводные возможны параллельные реакции замещения (гидролиз) и отщепления (дегидрохлорирование) атомов хлора. На их относительную долю влияют температура, среда, но самым эффективным методом регулирования направления этих двух реакций является выбор гидролизующего агента. Для гидролизу требуется слабое основание, обладающее высокой нуклеофильностью (например Na2 CO3 ), а для дегидрохлорирорвания – сильное основание с небольшой нуклеофильностью (NaOH, Ca(OH)2 ). Эффективный путь подавления побочных реакций – снижение концентрации целевого продукта в реакционной массе путем его непрерывной отгонки. Этому способствует то обстоятельство, что целевой продукт всегда более летучий, чем исходные реагенты. Для повышения селективности реакций гидролиза целесообразно применять реакторы, близкие к модели идеального вытеснения.
При жидкофазном гидролизе хлорпентана в аллиловые спирты в качестве гидролизующих агентов применяют 5-10%-ный раствор Na2 CO3 или NaOH, который для обеспечения более высокой интенсивности процесса и повышения степени конверсии хлорпроизводного берут в избытке 10-25% к стехиометрическому количеству. Ввиду наличия двух жидких фаз важное значение имеет увеличение поверхности их контакта. При непрерывных процессах это достигается обычно уже в насосе, во всасывающую линию которого подают оба реагента. Сохранение системы в эмульгированном состоянии обеспечивается турбулизация потока за счет его достаточно большой линейной скорости. Это предопределяет использование реакторов типа змеевиков или многоходовых кожухотрубных аппаратов, что возможно при небольшом времени реакции. Когда ее продолжительность велика и продукт выпускают в небольшом масштабе, процесс осуществляется периодическим способом в автоклаве, перемешивая смесь мешалкой или барботируя через нее пар соответствующего давления. Реакционную массу по окончании процесса дросселируют до атмосферного давления, причем целевой продукт переходит в газовую фазу (аллиловый спирт). После этого спирт чистят ректификацией.
Конденсации формальдегида с изобутиленом
При конденсации формальдегида с изобутиленом можно использовать изобутилен-изобутановую фракцию с содержанием изобутилена до 50%масс и примесями линейных бутенов без предварительного выделения. Изложите химизм процесса и объясните, почему это возможно. Поясните, почему лимитируется содержание бутадиена-1,3 в исходном сырье. Каковы условия и особенности гетерофазного процесса конденсации и оформления реакционного узла.
Конденсация формальдегида с изобутиленом, протекающая в присутствии катализаторов кислотного типа (реакция Принса), приобрела практическое значение для синтеза 4,4 – диметилдиоксана – 1,3. Побочно образуются ненасыщенные одноатомные спирты, триметилкарбинол (продукт гидратации изобутилена) и более сложные кислородсодержащие соединения. Образование всех этих веществ объясняет следующая схема.
Обычно сопутствующие изобутилену непредельные углеводороды С4 нормального строения, также как пропилен и олефины С5 , значительно уступают по реакционной способности изобутилену, обладающему активным реакционноспособным атомом водорода при третичном атоме углерода во взаимодействии с формальдегидом. Скорости взаимодействия с формальдегидом 1-бутена и 2-бутена приблизительно на два порядка ниже, чем с изобутиленом. Это означает, что в условиях синтеза диметилдиоксана бутены нормального строения практически не реагирует, и, следовательно, их предварительное выделение из углеводородного сырья не требуется.
Данный вывод неприемлем лишь к бутадиену-1,3, продукт взаимодействия которого с формальдегидом (4-винилдиоксан-1,3), при последующем расщеплении даёт циклопентадиен – сильнейший каталитический яд реакции стереоспецифической полимеризации изопрена. Поэтому на исходную фракцию С4 налагаются жёсткие требования по содержанию бутадиена (≤ 0,3 % мас.).
Конденсация изобутилена с формальдегидом – это гетерофазная жидкофазная каталитическая реакция, в которой взаимодействие осуществляется в пределах одной реакционной фазы (водной), а реакционная масса представляет собой жидкую двухфазную систему. Продукты реакции распределяются между двумя фазами в соответствии с их природой. Присутствие ДМД в водной фазе нежелательно, т.к. в присутствии серной кислоты он гидролизуется, поэтому его экстрагируют в углеводородную фазу парафиновыми углеводородами, содержащимися в сырье. Интенсивность реакции во многом зависит от развития поверхности контакта.
Условия процесса: Т=85-95o C, Р = 1,5-2 МПа, когда все реагенты находятся в жидком состоянии. Конверсия 85-90% по обоим реагентам, мольное соотношение – формальдегид: i-бутилен = 2/1, причем в реакционной массе должен всегда находиться свободный формальдегид, чтобы препятствовать полимеризации изобутилена. Катализатор H2 SO4 – 1 – 1,5 % вес. по отношению к изобутилену. Процесс проводится в реакторе идеального вытеснения, работающем по принципу прямо – или противотока. Реактор должен удовлетворять следующим требованиям:
1. интенсивный массообмен между углеводородной и водной фазами;
2. равномерный съем тепла, t = const;
3. постоянное время пребывание исходных реагентов в зоне реакции.
Реакционный узел синтеза ДМД представляет два последовательно соединенных между собой трубчатых аппарата. Каждая трубка реактора снабжена соплом, обеспечивающим высокую скорость подачи изобутиленовой фракции и ее расщепление при соприкосновении с движущей навстречу водной фазой. Отвод тепла реакции осуществляется паровым конденсатом через межтрубное пространство.
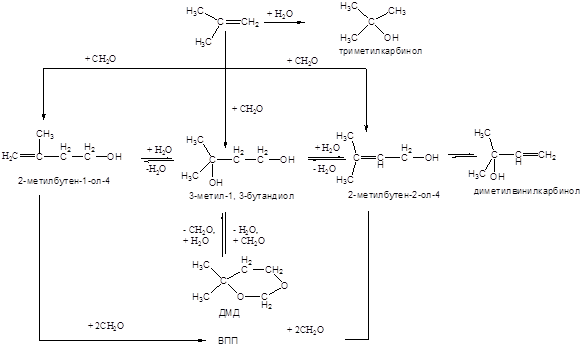
Различные способы получения фенола. Для кумольного способа привести принципиальную технологическую схему. Обосновать выбор типа и конструкции реактора окисления изопропилбензола. Перечислить основные побочные продукты кумольного способа, как они образуются и утилизируются.
a) Хлорбензольный :
![]()
Сульфирование бензола
![]()
Метод Рашига :
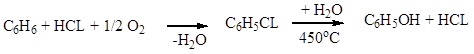
Кумольный метод :
![]()
Окисление толуола :

Окисление циклогексана :

б) 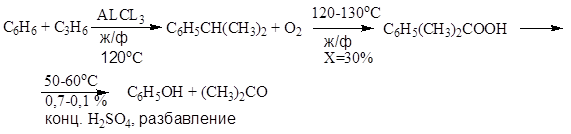
в) колонна окислительная – РИВ, противоток; все недостатки гетерофазного процесса
каскад реакторов идеального смешения.
г) разложение гидроперекиси на катионитах


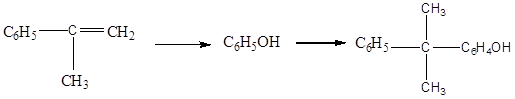
Похожие рефераты:
Развитие, становление и основные аспекты фармации
Карбоновые кислоты, их производные
Программа для поступающих в вузы (ответы)
Проектирование мастерской по производству 3,5-динитробензойной кислоты мощностью 13 тонн/год
Синтез пиррольных интермедиатов для высокосопряженных порфиринов
Полимераналогичные превращения хитозана
Сравнительный анализ: методы получения синтез-газа
Химический эксперимент по неорганической химии в системе проблемного обучения
Химия поверхностно-активных веществ
Синтез изобутилового эфира уксусной кислоты реакцией этерификации