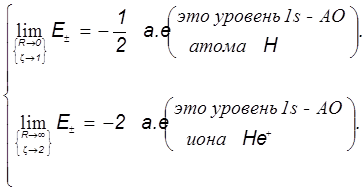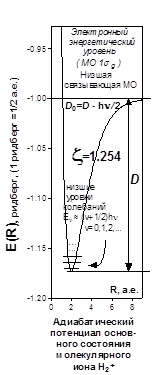| Скачать .docx |
Реферат: Теория МО ЛКАО
.
Молекулярные интегралы и формула энергетические уровни:
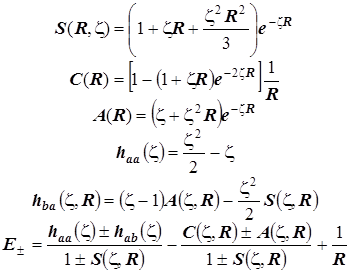
Эти формулы удобны для графического исследования уровней МО с помощью компьютера.
Наконец, для проверки физической корректности расчётов и положенных в их основу схем проанализируем предельные значения интегралов и уровней энергии МО:
Пределы интегралов (Квази-ион He+) Пределы электронной энергии
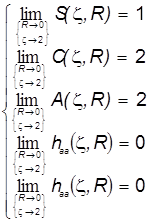 |
|
Можно видеть, что с физической точки зрения расчёт совершенно верно предсказывает пределы изменения электронной энергии системы в электростатическом поле ядер в гипотетическом процессе их сближения от бесконечного удаления до гипотетического слияния. Так подтверждается корректность теории, и это особенно важно, поскольку при её построении было использовано значительное количество непростых приближений.
В простейшей модели без оптимизации базисной АО получаем :
Показатель экспоненты в АО фиксирован и равен![]()
Все выводимые ниже выражения легко получаются из более общих выражений при ![]()
Интегралы существенно упрощаются и получаются следующие выражения:
1) Уровень исходной базисной АО ![]()
2) Интеграл перекрывания:
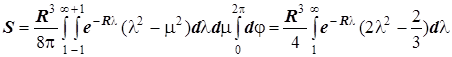 .
.
Интегрируя по частям, получаем
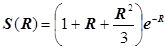 ,
,
3) Кулоновский интеграл:
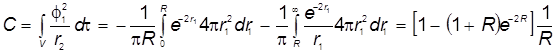 ,
,
4) Резонансный интеграл:
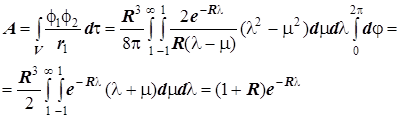
Отсюда получаются энергетические уровни МО в виде:
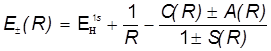 .
.
Этот простой подход был исторически первым на пути построения квантово-механической теории валентности. Несмотря на свою ограниченность, он позволил на качественном уровне понять и происхождение электронного облака в межъядерной области, и природу устойчивости простейшей молекулярной системы. В количественном отношении этот примитивный подход очень слаб, и, вроде бы, не идёт ни в какое в сравнение с уточнёнными расчётами. НО...!!!
Самый трудный шаг на неизведанном и полном неясностей пути создания ранее не существовавшей теории всегда первый. Автор этого учебного текста наблюдал триумфальное развитие квантовой химии с середины 60-х годов по настоящее время (январь 1999 года) и застал переход от её исходного состояния к уже современному этапу и видел ещё слегка недоверчивое, изумлённое отношение химиков-синтетиков - людей, вообще-то весьма прагматично и дерзко мыслящих о веществе, к необычному ещё в то время варианту теории валентности, которая властно и как бы играючи вытесняла вариант привычной с 19 века качественной теории Бутлерова, оперирующей валентными штрихами с её причудливым нагромождением дополнительных конструкций. Оказалось, что не только качественно, но и количественно можно легко и точно объяснять и предсказывать спектрально наблюдаемые свойства молекул. Автор со студенческих лет хорошо помнит многочисленные дискуссии о сравнительных достоинствах и недостатках методов МО ЛКАО и ВС ЛКАО. Где-то сейчас метод ВС...?!!
Бесспорным фаворитом теории валентности стал метод МО ЛКАО, идеально приспособленный к алгоритмам современной вычислительной математики и компьютерной техники.
Сейчас уже совершенно ясно, что теория ЛКАО МО была настоящей идейной революцией. В её основу положено одноэлектронное приближение. Молекулярный ион водорода был первой и простейшей системой, на примере которой было понято и теоретически изучено физическое происхождение феномена валентности.
Необходимые молекулярные интегралы принимают вид
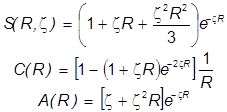
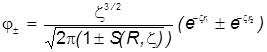 .
.
Выражая локальные переменные (r 1 , r 2 ) через единые декартовы координаты , запишем выражение МО в виде:
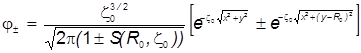 .
.
Оптимизированные параметры ![]() отвечают абсолютному минимуму целевой функции - полной энергии связывающей МО, определяемой в зависимости от двух переменных: межъядерного расстояния и эффективного заряда ядра - показателя экспоненты в формуле базисной АО. Энергетические уровни передаются формулой, на первый взгляд того же вида, что и в расчётах с одним варьируемым параметромR
:
отвечают абсолютному минимуму целевой функции - полной энергии связывающей МО, определяемой в зависимости от двух переменных: межъядерного расстояния и эффективного заряда ядра - показателя экспоненты в формуле базисной АО. Энергетические уровни передаются формулой, на первый взгляд того же вида, что и в расчётах с одним варьируемым параметромR
:
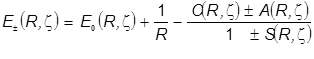 .
.
Однако весьма существенное качественное отличие этой формулы состоит в том, что расчёт с двумя варьируемыми параметрами R
, z состоит в том, что ![]() в общем случае является довольно сложной функцией обеих переменных, и лишь его предел переходит в величину E1
s
(H):
в общем случае является довольно сложной функцией обеих переменных, и лишь его предел переходит в величину E1
s
(H):
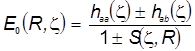 ,
,
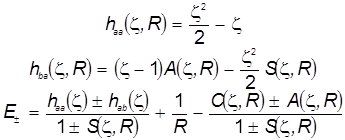
Оптимизация энергетического уровня за счёт дополнительного варьирования показателя экспоненты приводит к намного лучшему согласию с экспериментом.
|
![]()
|
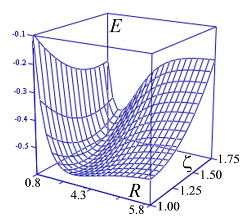
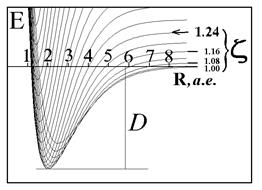
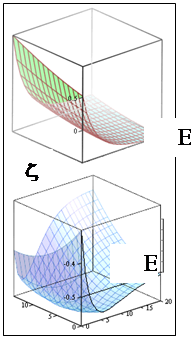
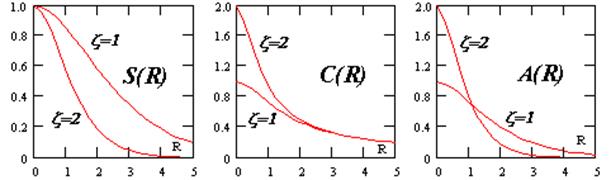
График функции
![]() представляет собой поверхность. Рассматривая переход системы в минимум энергии вдоль одного лишь межъядерного расстояния, не следует забывать о сопутствующем изменении и второй переменной - показателя экспоненты базисной АО. Мысленное сближение частиц протекает в условном энергетическом минимуме адиабатического потенциала и завершается достижением точки абсолютного минимума. Условный минимум на поверхности энергии представляет собою пространственную кривую, а его проекция на координатной плоскости это плоская кривая, которую называют координатой реакции исследуемого процесса. В этом процессе образование молекулярной системы формально является лишь промежуточной стадией.
представляет собой поверхность. Рассматривая переход системы в минимум энергии вдоль одного лишь межъядерного расстояния, не следует забывать о сопутствующем изменении и второй переменной - показателя экспоненты базисной АО. Мысленное сближение частиц протекает в условном энергетическом минимуме адиабатического потенциала и завершается достижением точки абсолютного минимума. Условный минимум на поверхности энергии представляет собою пространственную кривую, а его проекция на координатной плоскости это плоская кривая, которую называют координатой реакции исследуемого процесса. В этом процессе образование молекулярной системы формально является лишь промежуточной стадией.
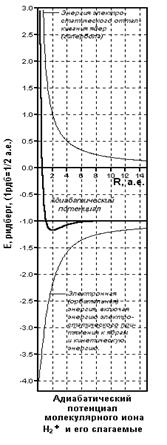
Применяя графические процессоры для современных персональных компьютеров (MATHCAD PLUS/PENTIUM 2,3,4), можно проиллюстрировать все вычисления. Наглядные пространственные графики на рис. изображают адиабатические потенциалы основного и первого разрыхляющего одноэлектронных уровней E ± (z,R ).
 |
 |
|||
|
|
|||
|
|
|
|
|
|
|||||||||
|
|||||||||
|
|||||||||
|
|||||||||
|
|||||||||
|
|
|
|||||||
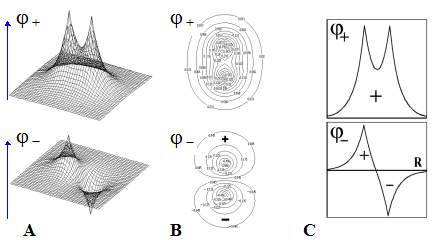 |
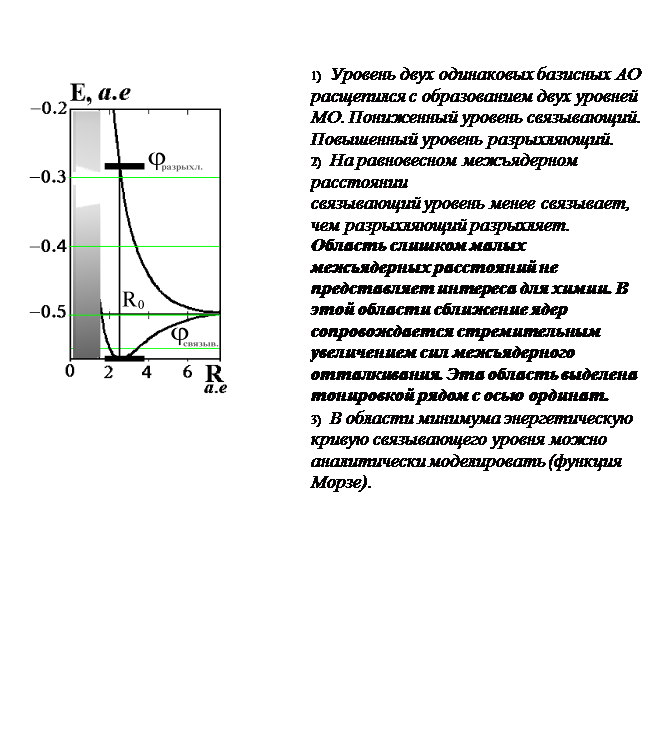
Признаки связывающих и разрыхляющих свойств МО (признаки связи и разрыхления).
Рис.Графические изображения молекулярных орбиталей s ( s )- типа .
Используют три способа графического изображения МО молекулярного иона H2+ :
1) Вариант A - изображение МО в виде поверхности.
Вариант B - изображение МО в топографической форме
(в виде совокупности горизонтальных сечений - линий уровня).
3) Вариант C - изображение сечения МО вдоль линии связи.
Во всех случаях ярко выделяются пучности и узлы МО, формирующие пространственные «лепестки».
Подобное изображение возможно только для МО, базис которых составляют лишь прос-тейшие1s-АО.