| Похожие рефераты | Скачать .docx |
Дипломная работа: Полимерные композиты на основе активированной перекисью водорода целлюлозы и малеиногуанидинметакрилатом
Полимерные композиты на основе активированной перекисью водорода целлюлозы и малеиногуанидинметакрилатом
ВВЕДЕНИЕ
Среди полимеров, нашедших широкое применение в различных областях жизнедеятельности человека, важное место занимает целлюлоза, как постоянно возобновляемый в природе полимер, и ее производные. Целлюлоза, обладая комплексом ценных свойств, имеет и сравнительно низкую себестоимость.
За последние десятилетия появилась большая группа материалов, при получении которых были реализованы различные подходы модификации целлюлозы: термические превращения, синтез привитых сополимеров, образование пространственной структуры. Все это позволило создать углеродные и другие сорбционно-активные материалы, материалы медицинского назначения с пролонгированным эффектом действия лекарственных препаратов, волокна-биокатализаторы, содержащие иммобилизованные ферменты, повысить эластические характеристики текстильных материалов из целлюлозных волокон. На более отдаленную перспективу целлюлозу можно рассматривать как источник экологически чистого возобновляемого сырья для создания новых технологических процессов получения мономеров для синтетических полимеров.
Одной из актуальных проблем в области химии и технологии природных полимеров является разработка экологически чистых и безвредных для человека технологий переработки целлюлозы в готовые изделия. Разработка методов синтеза производных целлюлозы, обладающих бактерицидными свойствами, позволяет создать новый тип целлюлозного волокна — антимикробные волокна, изделия из которых могут быть эффективно использованы в медицине и некоторых отраслях промышленности. За последнее десятилетие широкое развитие получили работы, посвященные синтезу биологически активных производных целлюлозы путем химического присоединения бактерицидных и фунгицидных веществ к макромолекуле целлюлозы.
Хорошо известно, что соединения, содержащие в своем составе гуанидиновую группу, обладают широким спектром бактерицидного действия и используются в качестве лечебных препаратов и фунгицидов, поэтому присутствие в элементарном звене полимеров гуанидиновой группы должно придавать им высокую биоцидную активность
В связи с вышесказанным, объектами наших исследований стали процессы синтеза новых биоцидных нанокомпозитов на основе окисленной перекисью водорода целлюлозы и аминогуанидинметакрилата.
Целью настоящей работы является создание нового биоцидного нанокомпозита на основе производного целлюлозы и катионного полиэлектролита - полиаминогуанидинметакрилата.
Исходя из поставленной цели, перед нами стояли следующие задачи:
- отработать методику окисления целлюлозы перекисью водорода;
- отработать методику синтеза винилсодержащего мономера на основе метакриловой кислоты и аминогуанидина;
- разработать оптимальную методику взаимодействия окисленной перекисью водорода целлюлозы с аминогуанидинметакрилатом;
- получить нанокомпозит на основе окисленной целлюлозы и синтезированного мономера.
- исследовать биоцидные свойства синтезированного нанокомпозита
Методы исследований. Для достижения поставленных задач мы использовали работы отечественных и зарубежных ученых. С целью получения достоверных и обоснованных данных нами использовались современные методы исследований, такие, как элементный анализ, ИК- спектроскопия и т.п.
Научная новизна. Синтез мономеров и полимерных нанокомпозитов, содержащих гуанидиновые группы, обладающих биоцидными свойствами, является перспективным и новым направлением в полимерной химии и медицине.
Дипломная работа состоит из введения, литературного обзора, обсуждения результатов, экспериментальной части, выводов, списка цитируемой литературы.
Во введении определен объект исследований, сформулированы цель работы и основные задачи исследования.
В литературном обзоре приведен аналитический обзор литературы как отечественной, так и зарубежной, охватывающий вопросы строения целлюлозы и продуктов ее окисления различными окислителями, синтеза бицид- ных производных целлюлозы, получения биологически активных полиэлектролитов, в том числе содержащих гуанидин и его производные.
В экспериментальной части представлены методики окисления целлюлозы перекисью водорода, синтеза мономера - аминогуанидинметакрилата, продукта взаимодействия окисленной целлюлозы с аминогуанидинметакри- латом, методика получения нанокомпозита и методы исследования свойств полученных веществ.
В обсуждении результатов приведены результаты проведенных исследований, подведены итоги проделанной работы.
Объем и структура работы. Квалификационная работа изложена на 57 страницах, содержит 2 таблицы, 7 рисунков, 60 библиографических ссылок.
1 ЛИТЕРАТУРНЫЙ ОБЗОР
1.1 Строение целлюлозы
Целлюлоза является веществом, широко распространенным в растительноммире. Она входит в состав как однолетних растений, так и многолетних, в частности - в состав древесных пород.
Современная теория строения целлюлозы отвечает на следующие основные вопросы [1-3]:
- Строение макромолекул целлюлозы: химическое строение элементарного звена и макромолекулы в целом; конформация макромолекулы и ее звеньев.
- Молекулярная масса целлюлозы и ее полидисперсность.
- Структура целлюлозы: равновесное фазовое состояние целлюлозы (аморфное или кристаллическое); типы связей между макромолекулами; надмолекулярная структура; структурная неоднородность целлюлозы; структурные модификации целлюлозы.
2) Строение макромолекулы целлюлозы может быть представлено формулой
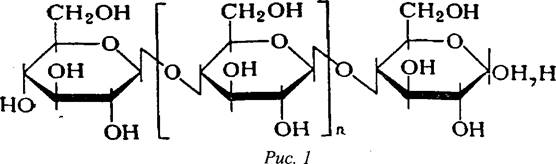
Справедливость этой формулы подтверждается данными частичного кислотного и ферментативного гидролиза, ацетолиза, перйодатного окисления, ИК - спектроскопии и поляриметрии. Точность методов, достигнутая в настоящее время, позволяет считать, что другие типы связей в молекуле целлюлозы встречаются не чаще, чем одна на 1000 моносахаридных остатков.
Регулярность строения полимерной цепи и строго определенная конфигурация асимметрических углеродных атомов позволяют отнести целлюлозу к стереорегулярным полимерам.
Существенное значение при исследовании строения макромолекулы целлюлозы имеет выяснение вопроса о конформации пиранозного цикла в макромолекуле. Так же, как у производных циклогексана, пиранозный цикл для уменьшения внутренних напряжений может приниматьконформацию (форму)ванны или кресла. Так как в пиранозном цикле имеется атом кислорода,то возможны две конформации кресла (С) и. шесть конформаций ванны (В):
Необходимо отметить, что при одном и том же строении элементарногозвена в зависимости от конформации пиранозного цикла меняется пространственная ориентация заместителей (ОН-групп) в цикле. Гидроксильные группы в элементарном звене могут быть расположены экваториально, т. е. в плоскости кольца, или аксиально - перпендикулярно к этой плоскости:
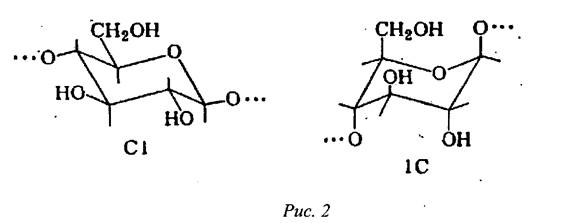
Гидроксильные группы, находящиеся в аксиальном и в экваториальном положениях, обладают различной реакционной способностью. Этери- фикации подвергаются в первую очередь гидроксильные группы, находящихяв экваториальном положении, так как для этих групп стерические усложнения для осуществления реакции более благоприятны. Для p-D-глюкопиранозы се производных (в том числе и для целлюлозы) наиболее энергетически выгодной формой является конформация кресла С1, где все гидроксильные группы находятся в экваториальном положении.
Приведенные выше данные позволяют сделать достаточно обоснование выводы о строении макромолекулы целлюлозы. Согласно этим данным, макромолекула целлюлозы состоит из большого числа остатков D-глюкопиранозы,находящихся в конформации кресла С1, соединенных между собой 1,4-Р-гликозидными связями. Однако различные химические и физические воздействия могут привести к переходу звеньев в другую конформацию. Многие данные о химическом строении макромолекул целлюлозы и, особенно о строении элементарных звеньев, из которых состоит макромолекула, являются в настоящее время бесспорными. Их можно формулировать следующим образом.
- Элементарным звеном макромолекулы целлюлозы является ангид- po-D-глюкоза.Это доказывается многочисленнымиработами [4,7] по исследованию продуктов полного гидролиза целлюлозы. При полном гидролизе целлюлозы выделена D-глюкоза с выходом до 96 - 98% от теоретического.
- Элементарное звено в макромолекуле целлюлозы содержит три свободные гидроксильные группы. Это доказывается тем, что при любых реакциях этерификации целлюлозы удается получить в качестве продуктов полной этерификации только трехзамещенные эфиры целлюлозы. Из трех гидроксильных группы элементарного звена одна группа является первичной и две вторичными. Эти группы значительно различаются по реакционной способности.
Гидроксильные группы в элементарном звене макромолекулы находятся у 2-го, 3-го и 6-го атомов углерода.Это доказано идентификацией основного продукта, полученного при гидролизе триметилцеллюлозы,как 2,3-6-три-0-метил-0-глюкозы, а также рядом других методов. Из этого следует, что глюкозные остатки должны быть связаны либо 1,4-гликозидными группами (в этом случае элементарное звено находится в пиранозной форме), шбо 1,5-гликозидными связями (при фуранозной форме элементарного звена.
- Остатки D-глюкозы в молекуле целлюлозы имеют пиранозную форме. Сравнительная устойчивость целлюлозы к кислотному гидролизу исключает возможность существования звеньев в фуранозной форме, поскольку фуранозиды чрезвычайно неустойчивы к действию кислот.
- Элементарные звенья макромолекулы целлюлозы-D-глю- глюпираноза - соединены между собой J3- гликозидной связью. Это доказывается тем, что продуктом частичного гидролиза целлюлозы является целло- биоза [4-0((3-В-глюкопиранозил)-0-глюкоза], содержащая два остатка глюкозы, соединенные (3-гликозидной связью.
1.2 Окисление целлюлозы
Действие окислителей на целлюлозу имеет место во многих производственных процессах, основанных на переработке целлюлозы или содержащих целлюлозу растительных материалов.
Возможность окисления целлюлозы необходимо учитывать при отварке хлопчатобумажных и льняных тканей (действие кислорода воздуха в щелочной среде), при отбелке тканей (действие солей хлорноватистой кислоты или перекисных соединений), при производстве вискозного волокна (процессы мерсеризации и предварительного созревания — действие кислорода воздуха в щелочной среде), при получении медноаммиачного искусственного волокна, в производстве целлюлозы (отбелка) и в ряде других производств. Прогрессирующее окисление целлюлозы, активируемое действием световых лучей и приводящее к постепенному разрушению материала, одит и в процессе эксплуатации хлопчатобумажных и других целлю- тканей.
Указанными обстоятельствами объясняется то, что изучению процес- окисления целлюлозы различными окислителями посвящено большое исследований [8-10]. Процесс окисления целлюлозы представляет большой научный интерес, так как путем избирательногоокисления первичных спиртовыхгрупп удается ввести в макромолекулу целлюлозы функциональные группы - карбонильные (альдегидные и кетонные) карбоксильные, - и получить препараты окисленной целлюлозы, обла- хей новыми свойствами.
В качестве окислителей целлюлозы могут быть применены любые реа- I, окисляющие первичные или вторичные спиртовые группы или при- мдащие к Образованию перекисных соединений.
Продукты, которые получаются при действии окислителей на целлюлозу и которые в результате частичного окисления гидроксильных групп отличаются по химическому составу от исходной целлюлозы, носят название оксицеллюлоз [11]. В большинстве случаев процесс частичного окисления спиртовых групп сопровождается понижением степени полимеризации целлюлозы. Известен, однако, ряд методов получения оксицеллюлоз, при которых деструкции целлюлозы не происходит.
В начальной стадии процесса окисления целлюлозы происходит час- тачное окисление гидроксильных групп или, возможно образование перекисных соединений [16-17]. На более глубоких стадиях процесса окисления целлюлозы происходит деструкция макромолекул целлюлозы с образованием низкомолекулярных моно- и дикарбоновых оксикислот. При полном окислении целлюлозы образуются двуокись кислорода и вода.
Кроме того, при окислении целлюлозы могут получаться вещества с различным положением образовавшихся функциональных групп в элементарных звеньях макромолекул окисленной целлюлозы, т. е. изомерные. Поэтому продукты окисления целлюлозы, получаемые по разным способам, значительно различаются как по составу, так и по свойствам. При действии окислителей на целлюлозу могут иметь место следующее реакции избирательного окисления отдельных групп [18]:
Окисление первичных спиртовых групп элементарного звена до альдегидных групп:
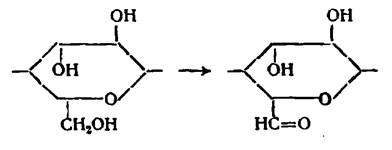
Окисление первичных спиртовых групп до карбоксильных
Окисление вторичных спиртовых групп элементарного звена (в положении 2 или 3) до кетогрупп, например
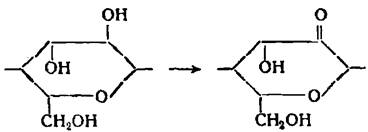
Одновременное окисление вторичных спиртовых групп в положениях 2 и 3 до альдегидных групп, сопровождающееся разрывом пиранового цикла элементарного звена.
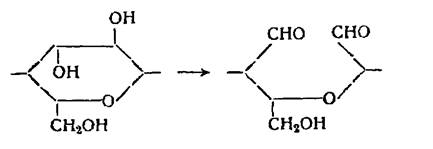
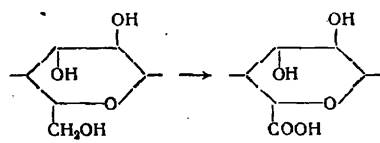
При комбинированном действии окислителей может произойти дальнейшее окисление альдегидных групп, образующихся при окислении вторичных спиртовых групп до карбоксильных групп:
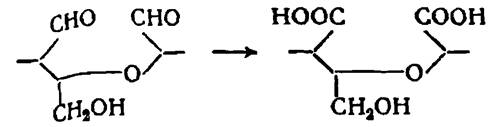
Кроме того, принципиально возможно присоединение кислорода к «кислородному мостику» между элементарными звеньями макромолекул целлюлозы или к амиленоксидному кольцу элементарного звена макромолекулы с образованием перекисей. Перекиси затем распадаются и обуславливают разрыв глюкозидной связи между звеньями или расщепление пира- неового цикла.
До настоящего времени удалось осуществить не все перечисленные схемы избирательного окисления различных спиртовых групп целлюлозы. В большинстве случаев при действии различных окислителей на целлюлозу происходит одновременное окисление как первичных, так и вторичных спиртовых групп с образованием в различном соотношении альдегидных, кетонных и карбоксильных групп, находящихся у различных атомов углерода элементарного звена макромолекулы. В зависимости от условий проведения процесса, в частности от рН среды, в отдельных случаях удается изменять соотношение карбонильных и карбоксильных групп в макромоле кулах окисленной целлюлозы. В последние годы разработаны методы избирательного окисления спиртовых групп молекул целлюлозы. Избирательное окисление. Избирательное окисление целлюлозы может быть осуществлено по двум основным схемам:
1. При действии на целлюлозу двуокиси азота происходит преимущественное окисление первичных спиртовых групп до карбоксильных групп.
Окисление целлюлозы двуокисью азота происходит по следующей схеме:
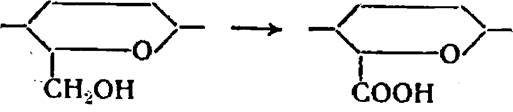 |
Окисление целлюлозы может быть осуществлено действием на нее газообразной двуокиси азота (N02 ), жидкого азотноватого ангидрида (N2 04 ) или действием раствора азотноватого ангидрида в индифферентном органическом растворителе (обычно в четыреххлористом углероде). Степень окисления целлюлозы, т. е. количество окисленных первичных спиртовых групп, зависит от длительности окисления, температуры и количества двуокиси азота. Изменяя эти условия, можно регулировать степень окисления целлюлозы. Максимальное содержание карбоксильных групп в целллюлозе составляет 25% по массе, что отвечает окислению всех вторичных спиртовых групп, т. е. введению одной карбоксильной группы в каждое элементарное звено макромолекулы.
Получаемый продукт окисления целлюлозы, названный монокарбок- силцеллюлозой [1-4] значительно отличается по свойствам от целлюлозы. При частичном окислении первичных спиртовых групп двуокисью азота макромолекула полученной окисицеллюлозы содержит элементарные зве нья глюкопиранозы и глюкуроновой кислоты. При окислении всех первичных спиртовых групп получаемый продукт представляет собой полиангид- роглюкуроновую кислоту. При содержании в монокарбоксилцеллюлозе более 13% карбоксильных групп, т. е. при окислении более 50% первичных спиртовых групп получается продукт, полностью растворимый в разбавленных растворах щелочи, аммиака и соды с образованием соответствующих солей, растворимых в воде. Препараты монокарбоксилцеллюлозы начинают в последнее время получать практическое применение в качестве кровеостанавливающих средств. С поливалентными металлами такая окисленная целлюлоза дает нерастворимые соли в результате образования химических связей между макромолекулами. Монокарбоксилцеллюлоза является сравнительно сильной кислотой; она вытесняет уксусную кислоту из ее солей, и на этом свойстве основан метод определения содержания карбоксильных групп в окисленной целлюлозе. Наличие карбоксильных групп в макромолекуле окисленной целлюлозы изменяет (по сравнению с исходной целлюлозой) отношение к красителям [19]. Монокарбоксилцеллюлоза, содержащая всего 2-3% карбоксильных групп, уже интенсивно окрашивается основными красителями, которые почти не окрашивают неокисленную целлюлозу. На поглощении основных красителей основывается один из методов количественного определения содержания карбоксильных групп в окисленной целлюлозе.
2. При действии на целлюлозу йодной кислоты и ее солей или ацетата свинца происходит одновременное окисление обеих вторичных спиртовых групп до альдегидных групп, сопровождающееся разрывом пиранового кольца элементарного звена макромолекулы целлюлозы. При обработке продуктов окисления бромидом или хлоритом натрия альдегидные группы окисляются до карбоксильных.
Метод одновременного окисления обеих вторичных спиртовых групп целлюлозы, также как других полисахаридов (крахмал) и моносахаридов до альдегидных был разработан в 1935 - 1938 гг. Гудсоном и Джексоном.
При действии йодной кислоты на многоатомные спирты, в частности на моно- и полисахариды, происходит одновременное окисление в альдегидные группы двух соседних спиртовых групп (гликолевая группировка) с одновременным разрывом углерод-углеродной связи между ними. Для целлюлозы процесс окисления протекает с разрывом пиранового кольца по следующей схеме:
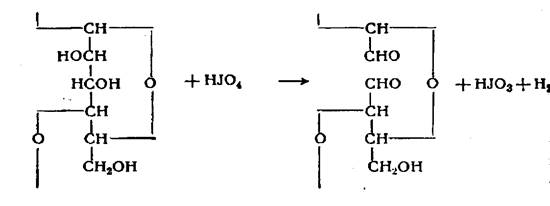
Эта схема реакции была доказана исследованием продуктов гидролиза целлюлозы и крахмала, окисленных йодной кислотой. Окисления первичных спиртовых групп при действии йодной кислоты или ее солей не происходит. Продукт окисления целлюлозы йодной кислотой, представляющий полиполуацеталь эритрозы и глиоксаля, названный Роговиным ди- альдегидцеллюлозой, может быть отнесен к оксицеллюлозам только условно, поскольку один из основных признаков, характерных для строения как самой целлюлозы, так и продуктов превращения, - наличие пиранового цикла - у этих соединений отсутствует.
Аналогичное избирательное окисление гликолевой группировки, в частности вторичных спиртовых групп в молекуле моносахаридов и полисахаридов, может быть осуществлено также при действии раствора тетраацетата свинца.
Окисление вторичных спиртовых групп макромолекулы целлюлозы раствором йодной кислоты или ее солей производится в водных растворах, в отличие от окисления раствором тетраацетата свинца, которое проводится в органических растворителях. Проведение реакции в водных растворах обеспечивает большее набухание целлюлозы и, соответственно, более равномерное проведение реакции. Введение в элементарное звено макромолекулы целлюлозы двух альдегидных групп в положение 2 и 3 значительно изменяет свойства препаратов [20-23].
При окислении диальдегидцеллюлозы в мягких условиях получается препарат окисленной целлюлозы, у которой в элементарном звене в положениях 2 и 3 имеются вместо вторичных спиртовых групп карбоксильные группы. Получение этого препарата, названного дикарбоксилцеллюлозой, происходит при обработке диальдегидцеллюлозы бромом или хлоритом натрия. Оба реагента в определенных условиях не окисляют спиртовых групп, но окисляют альдегидные группы:
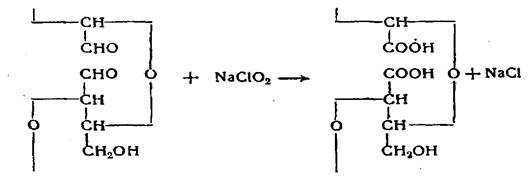
Окисление вторичных спиртовых групп до карбоксильных в одну стадию до настоящего времени не разработано.
Так же, как и диальдегидцеллюлоза, дикарбоксилцеллюлоза, представляющая собой полиполуацеталь глиоксиловой кислоты, может быть отнесена к препаратам окисленной целлюлозы только условно, так как и в этих продуктах пирановый цикл разорван.
Введение даже в небольшое число элементарных звеньев макромолекулы целлюлозы двух альдегидных групп путем частичного окисления вторичных спиртовых групп резко влияет на свойства получаемых эфиров окисленной целлюлозы и на устойчивость глюкозидной связи к действию разбавленных щелочей. В этом отношении влияние альдегидных групп в положениях 2 и 3 аналогично влиянию карбоксильной группы в положении 6, образующейся при окислении первичной спиртовой группы.
Введение в молекулу целлюлозы диальдегидных группировок понижает устойчивость глюкозидной связи к действию щелочей, но не изменяет ее устойчивость к действию кислот. Если провести в мягких условиях дополнительное окисление альдегидных групп до карбоксильных, то устойчивость окисленного волокна к действию щелочей значительно повышается.
Приведенные методы окисления спиртовых групп целлюлозы исчерпывают известные до настоящего времени возможности избирательного окисления целлюлозы. Все остальные окислители, применяемые для окисления целлюлозы, вызывают окисление как первичных, так и вторичных спиртовых групп, причем, в зависимости от условий окисления и характера окислителя, спиртовые группы окисляются до карбонильных (альдегидная и кетогруппы) или до карбоксильных групп.
Все продукты окисления целлюлозы, получаемые при действии большинства окислителей, могут быть схематически разделены на два типа:
а)продукты восстановительного характера
б)продукты кислотного характера.
Окисленные препараты целлюлозы обоих типов имеют ряд общих свойств и ряд отличий, характерных для каждой группы этих препаратов.
Общими свойствами для всех типов оксицеллюлоз являются: 1. повышенное содержание кислорода по сравнению с содержанием кислорода в исходной целлюлозе;
- наличие в заметных количествах карбонильных или карбоксильных групп, содержание которых в макромолекулах исходной целлюлозы очень мало;
- пониженная устойчивость глюкозидных связей в макромолекуле к действию щелочи;
- повышенная растворимость в щелочи.
Препараты окисленной целлюлозы восстановительного типа характеризуются дополнительно следующими свойствами:
- высокими значениями медных и йодных чисел;
- возможностью взаимодействия с гидроксиламином, фенилидразином и другими веществами, реагирующими с карбонильными группами;
- большими потерями в массе при нагреваний с разбавленными растворами щелочей и окрашиванием этих растворов в желтый цвет при кипячении со щелочью (в результате протекания процессов изомеризации);
- низким содержанием карбоксильных групп и отсутствием сродства к основным красителям.
Препараты оксицеллюлоз кислотного типа характеризуются:
- высоким содержанием карбоксильных групп;
- сродством к основным красителям;
- низким значением медных и йодных чисел.
Устойчивость к действию щелочей этих типов окисленной целлюлозы будет различна, в зависимости от места положения карбоксильных групп в элементарном звене макромолекулы.
Окисление целлюлозы различными окислителями может привести к получению продуктов, приближающихся к первому или ко второму типу оксицеллюлоз. Кроме указанных выше методов избирательного окисления, при которых реакция окисления протекает преимущественно в одном направлении, препараты окисленной целлюлозы содержат как карбоксильные, так и карбонильные группы.
Препараты окисленной целлюлозы восстановительного типа образуются, как правило, при действии окислителей в кислой или нейтральной среде. При окислении целлюлозы в щелочной среде происходит постепенное превращение альдегидных групп в карбоксильные группы, и полученные продукты окисления содержат преимущественно карбоксильные группы. Если применять для окисления целлюлозы одни и те же окислители, то, в зависимости от рН среды, полученные препараты содержат различные количества карбонильных и карбоксильных групп.
При окислении раствором гипобромита натрия в щелочной среде получают окисленную целлюлозу кислотного типа, содержащую большое количество карбоксильных и незначительное количество альдегидных и ке- тонных групп. При окислении перманганатом калия в кислой среде получается окисленная целлюлоза, занимающая промежуточное положение между указанными типами оксицеллюлоз и содержащая сравнительно большое количество как карбоксильных, так и альдегидных групп.
1.3 Методы определения содержания карбонильных и карбоксильных групп в препаратах окисленной целлюлозы
Для характеристики получаемых препаратов окисленной целлюлозы необходимо определить содержание в них карбонильных или карбоксильных групп. Точное определение содержания этих групп необходимо и для исследования механизма реакции окисления и свойств различных типов ок- сицеллюлозы. Этим объясняется большое количество работ, опубликованных по методике определения карбонильных и карбоксильных групп в препаратах окисленной целлюлозы. Систематическая разработка количественных методов определения содержания различных функциональных групп в препаратах окисленной целлюлозы проводится в последнее время Каверзневой. Ею было впервые показано наличие оксикетонных и лактонных групп в препаратах окисленной целлюлозы и проведена большая работа по определению кетонных групп в этих препаратах
Определение содержания карбонильных групп. В отличие от препаратов гидролизованной целлюлозы, в макромолекуле окисленной целлюлозы могут находиться как альдегидные группы в скрытой форме (на конце макромолекулы у 1-го атома углерода), так и альдегидные группы, образующиеся в результате окисления спиртовых групп. При определении содержания альдегидных групп в препаратах окисленной целлюлозы необходимо учитывать малую устойчивость этих групп в щелочной среде, в результате чего содержание альдегидных групп в препаратах окисленной целлюлозы понижается. Кроме того, в макромолекуле окисленной целлюлозы, содержащей в элементарном звене две альдегидные группы в положении 2 и 3 или карбоксильную группу в положении 6, глюкозидная связь также малоустойчива к действию щелочей [24,26]. Если определение альдегидных групп проводить в щелочной среде, то при действии щелочи происходит разрыв глюкозидных связей между элементарными звеньями макромолекулы, содержащей альдегидные или карбоксильные группы. В результате этой реакции появляются новые альдегидные группы (в скрытой форме), которых не было в исходном препарате окисленной целлюлозы. Учитывая эти данные, необходимо для определения количества альдегидных групп в препаратах окисленной целлюлозы применять такие методы, при которых возможность действия щелочей исключается или сводится к минимуму.
Для количественного определения содержания альдегидных групп в препаратах окисленной целлюлозы предложены следующие методы: 1. Определение медного числа. Определение медного числа для препаратов окисленной целлюлозы, содержащих свободные альдегидные группы, до настоящего времени все еще применяется некоторыми исследователями. Однако, учитывая все указанные недостатки определения содержания аль- дегидных групп в щелочной среде, этот метод нельзя считать достаточно надежным.
Определение йодного числа. Принципиально более точным методом, чем определение медного числа, является определение йодного числа. Это определение, особенно для препаратов окисленной целлюлозы, содержащей две альдегидные группы в элементарном звене, необходимо проводить при минимальном содержании щелочи в растворе. Поэтому целесообразнее проводить определение йодного числа в препаратах окисленных целлюлоз не в щелочном растворе, а в буферном растворе (бура + борная кислота). При соблюдении стандартных условий и проведении определения в присутствии буферных веществ (при рН = 9 - 9,5) определение содержания альдегидных групп по йодному числу даже для препаратов окисленной целлюлозы дает достаточно точные и воспроизводимые результаты.
Определение гидроксиламинового числа. Суммарное содержание карбонильных групп (как альдегидных, так и кетонных) в препаратах окисленной целлюлозы может быть определено при помощи реакции с солянокислым гидроксиламином; при этом образуется альдоксим и выделяется хлористый водород. Выделяющийся хлористый водород оттитровывается щелочью в присутствии индикатора (бромфеноловый синий). Содержание карбонильных групп может быть определено также и по количеству азота в оксимах целлюлозы, образующихся при этой реакции. Этот метод позволяет определить общее количество карбонильных групп, находящихся в оксицеллюлозе. Для раздельного определения альдегидных групп и кетогрупп препараты окисленной целлюлозы, содержащие карбонильные группы, могут быть окислены хлоритом. Все альдегидные группы при этой обработке окисляются до карбоксильных групп, а кетогруппы остаются без изменения. Зная общее количество карбонильных групп и определив количество карбоксильных групп, образовавшихся при окислении хлоритом, можно определить раздельно количество альдегидных групп и кетогрупп в препарате оксицеллюлозы.
Определение содержания карбоксильных групп.
Содержание карбоксильных групп в препаратах окисленной целлюлозы может быть определено следующими методами:
Непосредственным титрованием щелочью. Содержание карбоксильных групп в целлюлозе может быть определено непосредственным титрованием 0,01—0,02 N раствором едкого натра или обратным титрованием избытка щелочи 0,02 N раствором соляной кислоты. Индикатор - фенолфталеин или тимолфталеин. При применении этого метода для определения карбоксильных групп в препаратах окисленной целлюлозы, содержащей наряду с карбоксильными группами большое число альдегидных групп, получаются завышенные результаты. Это объясняется, по-видимому, частичным превращением альдегидных групп в щелочной среде и образованием дополнительного количества карбоксильных групп.
Обменной реакцией с ацетатом кальция или с ацетатом серебра, а также обменной реакцией с о-нитрофенолятом серебра. Такое определение содержания карбоксильных групп основано на том, что окисленная целлюлоза, содержащая карбоксильную группу, является более сильной кислотой, чем уксусная кислота, и поэтому вытесняет уксусную кислоту из ее солей. Выделяющаяся уксусная кислота оттитровывается щелочью. Определение содержания карбоксильных групп по этому методу дает правильные результаты, если карбоксильные группы в препарате окисленной целлюлозы находятся в положении 6; следовательно, входят в состав остатка глюкуро- новой кислоты, являющейся сравнительно сильной кислотой. Если карбоксильные группы образуются в результате окисления вторичных спиртовых групп и, следовательно, соединены с остатками глиоксалевой или аритроно- вой кислоты (константа диссоциации этих кислот значительно меньше), то взаимодействие этих кислот с ацетатом кальция не идет до конца. В этом случае для получения правильных результатов необходимо применять для реакции обменного разложения соли более слабых кислот, в частности - о- нитрофенолят серебра. Взаимодействие всех карбоксильных групп окисленной целлюлозы с солями серебра происходит количественно при рН=8.
Взаимодействием с аминами. Для определения карбоксильных групп в препаратах окисленной целлюлозы предложено использовать реакцию взаимодействия с диаминами и моноаминами. При последующем диазотирова- нии и сочетании с азосоединениями (для диаминов) или с диазосоединения- ми (для моноаминов) получаются окрашенные препараты различных цветов (в зависимости от характера примененных соединений). Авторы предложили использовать эти реакции для качественного и даже для количественного определения содержания карбоксильных групп. Эти реакции, однако, не однозначны, так как с аминами могут реагировать также и альдегидные группы, имеющиеся в окисленной целлюлозе
Взаимодействием с метиленовым голубым (определение по количеству связанного красителя). Введение карбоксильных групп в молекулу целлюлозы резко повышает ее сродство к основным красителям и к аминам. Основные красители, 'в частности метиленовый голубой, при рН > 7 количественно реагируют с карбоксильными группами оксицеллюлозы. Это используется для определения содержания карбоксильных групп. Определение количества красителей производится колориметрически (по изменению концентрации красителя в растворе после взаимодействия его с препаратами окисленной целлюлозы) или титрованием.
По количеству углекислого газа, выделившегося при нагревании оксицеллюлозы с 12%-ной соляной кислотой. Принцип этого метода основан на том, что глюкуроновая кислота при кипячении с 12%-ным раствором соляной кислоты отщепляет углекислый газ и превращается в ксилозу, которая при дегидратации дает фурфурол. Препараты окисленной целлюлозы, содержащие остатки глюкуроновой кислоты, так же как и полиуроновые кислоты, будут выделять углекислый газ при кипячении с разбавленной НС1. По количеству выделившегося углекислого газа могут быть определены только карбоксильные группы в положении 6, т. е. образующие остаток глюкуроновой кислоты. Карбоксильные группы, находящиеся в положениях 2 и 3, незначительно отщепляются при кипячении оксицеллюлоз с разбавленной соляной кислотой.
При определении содержания карбоксильных групп по любому методу препарат окисленной целлюлозы должен быть предварительно обработан разбавленным раствором минеральной кислоты для разложения солей кар- боновых кислот и затем тщательно отмыт дестиллированной водой от кислоты, удерживаемой волокном.
Все приведенные методы определения содержания карбоксильных групп могут быть использованы для определения только свободных карбоксильных групп.
Интересным и многообещающим методом качественной, и до известной степени, количественной характеристики содержания функциональных групп в молекуле окисленной целлюлозы является определение инфракрасных спектров поглощения этих продуктов [25]. Каждая из функциональных групп, имеющихся в макромолекулах окисленной целлюлозы (альдегидная, кетонная, карбоксильная и гидроксильная группа), имеет свои характерные спектры поглощения. По изменению спектров поглощения инфракрасных лучей препаратами окисленной целлюлозы, по сравнению с исходной целлюлозой, можно приблизительно определить содержание тех или иных функциональных групп. Этим методом начали пользоваться для исследования процесса окисления целлюлозы сравнительно недавно.
1.4 Методы окисления целлюлозы
Окисление целлюлозы может быть осуществлено как в гомогенной, так и в гетерогенной среде.
Окисление целлюлозы в гомогенной среде имеет сравнительно ограниченное значение. Наиболее исследованным является окисление целлюлозы, растворенной в медноаммиачном растворе, кислородом воздуха.
Из методов окисления целлюлозы в гетерогенной среде наибольшее практическое значение имеют следующие методы:
Окисление солями хлорноватистой кислоты (гипохлоритом натрия) в нейтральной и щелочной среде. Эти окислители наиболее доступны и получили широкое промышленное применение при отбелке хлопчатобумажных тканей, целлюлозы и искусственных волокон. К этой группе окислителей относятся также и гипобромиты.
Окисление кислородом воздуха в щелочной среде. Этот метод окисления получил промышленное применение при процессе предварительного созревания щелочной целлюлозы в производстве вискозного волокна. Возможность окисления целлюлозы кислородом воздуха в щелочной среде необходимо учитывать при отварке хлопка щелочью при высокой температуре, а также при мерсеризации.
Окисление озоном. Этот метод окисления имеет практическое значение при так называемом луговом способе отбелки льна, а также при одновременном действии на целлюлозу кислорода воздуха и ультрафиолетовых лучей.
Окисление перекисями (перекисью водорода и перекисью натрия). Этот метод окисления получает в последнее время практическое значение при отбелке искусственных и натуральных целлюлозных волокон, как один из методов, не приводящий к разрушению целлюлозных материалов.
Окисление кислыми окислителями (разбавленной азотной кислотой, хромовой кислотой, гипохлоритом в кислой среде, галоидами, перманга- натом калия в кислой среде и др.). При действии этих окислителей наряду с окислением целлюлозы происходит и ее гидролиз, что приводит к значительной деструкции целлюлозы и к понижению прочности материала.
1.5 Биологически активные полиэлектролиты
Полиэлектролиты находят самое широкое применение в различных областях промышленности и медицины в качестве физиологически-активных веществ, как носители лекарственных форм, иммуностимуляторы, антимикробные препараты и др. [27].
В настоящий момент трудно найти группу материалов, на которую микроорганизмы не оказывают разрушающего действия. Жизнедеятельность различных патогенных микробов вызывает не только нежелательные изменения структурных и функциональных характеристик материалов и изделий, но они также реализуют свое губительное действие внутри живых клеток организма. Кардинальной задачей современной химии биоцидных соединений является повышение эффективности противобактериальной терапии. Для решения этих задач перспективным представляется использование биоцидных полимеров. Полимеры позволяют включать в структуру одной макромолекулы различные биологически активные вещества, отличающиеся механизмом действия на бактериальную клетку, а также обеспечивать транспорт лечебной формулы к бактериальной клетке-мишени. Сорби- руясь на клетке и взаимодействуя с клеточными мембранами, они могут влиять на их функционирование, в частности на барьерные функции, а также создавать более высокие локальные концентрации биоцидного агента на поверхности бактериальных клеток и образовывать на обработанных поверхностях длительно сохраняющуюся полимерную пленку, обеспечивающую пролонгированный биоцидный эффект.
Наибольшая биоцидная активность отмечена у полиэлектролитов, содержащих четвертичные аммониевые группы как в основной, так и в боковой цепи макромолекулы [25-31]. Минимальные концентрации этих полимеров, подавляющие, например, рост стафилококков, составляют 50-250 мкг мл1 [32] .
В работах [33-36] было показано, что диаллильные катионные полиэлектролиты, содержащие четвертичные аммониевые группы, оказывают бактерицидное действие на Treponemapallidum(возбудитель сифилиса).
Японскими исследователями в работах [37,38,39] изучены полимеры четвертичных аммониевых соединений и бигуанидов и исследована их сравнительная антимикробная активность в зависимости от молекулярной массы. Ими выявлено, что полимерные бигуаниды с молекулярной массой 11 900 обладали значительно более высоким бактерицидным действием в отношении золотистого стафилококка по сравнению с мономером и полимерами на основе четвертичных аммониевых соединений с молекулярной массой 14 300.
Поскольку аминогуанидиновые производные значительно эффективнее четвертичных аммониевых соединений, они находят широкое применение в качестве физиологически активных веществ: лекарств, антисептиков, пестицидов [40]. Аминогуанидиновые соединения щироко распространены в природе. К ним относятся: аминокислота аргинин, фолиевая кислота, многочисленные белки и нуклеиновые кислоты, в которые производные амино- гуанидина входят в качестве различных структурных элементов. Аминогуа- нидиновая группировка служит началом многих лекарственных веществ (сульгин, исмелин, фарингосепт) и антибиотиков (стрептомицин, бластици- дин, мильдомицин). Производные аминогуанидина представлены и среди специфических веществ, с помощью которых растения защищаются от атаки микроорганизмов [41].
Первые данные о биоцидных свойствах аминогуанидиновых производных и полимеров на их основе были опубликованы в патентной литературе [например, 38-41]. В указанных патентах описывается применение подобных соединений в качестве инсектицидов и отмечается, что соответствующие соединения особенно активны против грибковых заболеваний на фруктовых деревьях.
К наиболее сильным из известных аминогуанидиновых антисептиков относятся 1,6-бис-4,4-хлорфеноксибигуанидогексин («хлоргексидин») и низкомолекулярный полигексаметиленбигуанидин («вантоцил» или «кос- моцил») [37-40]. 9-3 Так, например, хлоргексидин используется в качестве дезинфицирующего средства в виде солей (гидрохлорида, ацетата, глюкона- та). До последнего времени хлоргексидин широко рекомендовался в виде растворов, мазей, присыпок как эффективное дезинфицирующее средство в хирургии для борьбы с внутрибольничными инфекциями, лечения кожных заболеваний и бытовых целей. Однако следует отметить, что это вещество получают по сложной 4-х стадийной технологической схеме, кроме того, при его синтезе исходным сырьем служит хлорциан, поэтому технологический процесс дорог и опасен.
В России (в ИНХС РАН) был разработан процесс производства полимерного гуанидинового антисептика - полигексаметиленаминогуанидингид- рохлорида (ПГМАГ) («полисепт») [42], исходя из гексаметилендиамина и гидрохлорида аминогуанидина.
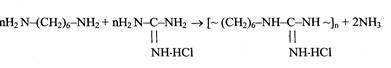
Так как аминогруппы аминогуанидингидрохлорида имеют различную реакционную способность, то молекулярную массу и структуру «полисепта» удается регулировать, изменяя условия реакции и содержание гексаметилендиамина в исходной смеси [6, 27]. Так, при сравнительно низких температурах для процесса поликонденсации (120-130°С) в реакцию с гексамети- лендиамином вступают преимущественно одна аминогруппа аминогуанидингидрохлорида, образуя хорошо растворимый линейный олигомер с молекулярной массой (1.7-12.5) х103 . При увеличении количества гексамети- лендиамина в реакционной смеси сверх одного моля на 1 моль аминогуани- дингидрохлорида и повышении температуры до 180-200°С в реакцию может вступать третья аминогруппа и образуется разветвленный полимер, который имеет молекулярную массу (20-43) x103 .
Различные соли ПГМГ (фосфат, глюконат, сорбат, фторид, сульфат, нитрат, силикат, ацетат, стеарат, олеат, фумарат, сукцинат, адипинат, себа- цинат) были получены при действии различных кислот или их солей на основание или карбонат ПГМГ [6]. Среди указанных полимерных солей наибольшее практическое значение помимо гидрохлорида имеют фосфат и глюконат. По данным, указанным в работе [6], растворы гидрохлорида в концентрации 0.1-0.05 вес.% вызывают гибель грамположительных и грамот- рицательных микроорганизмов: коринебактерий дифтерии (с. Duphtheretiae), золотистого стафилококка (St.aureus), а также St.aibusи St. faekalis, брюшно-тифозной палочки (S.typhi), шигелл Зонне и Флекснера (ShigellaSonnae, Flexneri), кишечной палочки (E.Coli), сальмонелл Бреслау и Гертне- ра (Salmonellath.murum), вульгарного протея (ProteusVulgarus), синегной- ной палочки (Ps.aeruginosa) в течение 5-25 минут.
По сравнению с другими катионными полиэлектролитами использование гуанидинсодержащих биоцидных полимеров имеет еще одно положительное преимущество. При использовании синтетических биоцидных полимеров следует учитывать их биодеградируемость в живом организме. В случае использования небиодеградируемых синтетических полимеров существенное значение имеет их молекулярная масса, поскольку полимеры с молекулярной массой выше 50000 не могут выводиться через почки, а накапливаются в почечных канальцах, вызывая выраженные токсические эффекты. В этом отношении биоцидный эффект аминогуанидиновых соединений может оказаться физиологичным, т.к. в живом организме имеются ферментные системы, способные вызывать деградацию этих соединений, предотвращая их кумуляцию [43]. Однако, как уже отмечалось, для каждого нового аминогуанидинсодержащего соединения данный факт требует отдельной проверки.
С учетом вышесказанного и приведенных примеров, разработка новых биоцидных препаратов, несомненно, является актуальной задачей. По аналогии с предложенными в работе [31] критериями, применяемыми в подходе к лекарственным препаратам, значительная часть которых является и биоцидными препаратами, можно эти ключевые моменты рассматривать в применении к противомикробным средствам, именуемыми также биоцидными и бактерицидными.
Биоцидное вещество должно обладать высокой активностью, избирательностью и продолжительностью своего действия;
Оно должно быть чистым и иметь высокую стабильность при хранении;
Оно должно быть доступным, а доходность его на рынке биоцидных препаратов - достаточно высокой;
Все эти факторы при правильном сочетании будут определять время жизни данного препарата среди применяемых аналогично действующих биоцидных средств.
Стратегия и тактика создания новых биоцидных веществ может опираться на следующие ключевые моменты [44].
Принцип химического модифицирования структуры известных синтетических и природных биоцидных веществ, при этом предполагается, что биологическая активность нового соединения окажется более высокой.
Принцип молекулярного моделирования, в котором учитывается пространственное строение биоцида и биорецепторного участка его захвата.
Стратегия пробиоцида, когда действующее начало доставляется к месту действия некоей комбинированной молекулой, из которой в необходимом месте выделяется собственно биоцидное вещество.
Концепция антиметаболитов, веществ, которые подменяют метаболит в естественных биореакциях и нарушают их нормальное протекание, т.к. не могут в полном объеме заменить природный объект.
Принцип использования полимерной матрицы или полимерного вещества, который в первую очередь приводит к пролонгированному действию и контролю подачи необходимого биоцида.
1.6 Механизм биоцидного действия полиэлектролитов
Под собственной физилогической активностью полимеров обычно понимают активность, которая связана с полимерным состоянием и не свойственна низкомолекулярным аналогам или мономерам [45]. С учетом сказанного выше, механизмы проявления собственной физиологической активности могут включать в себя как важнейшую составляющую физические эффекты, связанные с большой массой, осмотическим давлением, конфор- мационными перестройками и др., а также могут быть связаны с межмолекулярными взаимодействиями и с биополимерами организма. Многие биополимеры организма являются полианионами (белки, нуклеиновые кислоты, ряд полисахаридов), а биомембраны также имеют суммарный отрицательный заряд. Взаимодействие между противоположно заряженными полиэлектролитами протекают кооперативно, причем образующиеся в результате поликомплексы достаточно прочны. Известно, что наибольшее значение имеют при таких взаимодействиях плотность заряда и молекулярная масса [4, 5, 17-19]. Если же говорить о биоцидных свойствах, то важную роль в этом случае играет знание механизма действия.
Последовательность элементарных актов летального действия полиэлектролита на бактериальные клетки может быть представлены следующим образом [5]:
В первую очередь, это касается поликатионов, так как биомембраны имеют отрицательный суммарный заряд, хотя отрицательно заряженные в целом клеточные мембраны имеют изолированные поликатионные области, на которых могут сорбироваться полианионы [45].
При изучении влияния различных факторов на уровень антимикробной активности катионных полиэлектролитов было показано [46], что их активность возрастает с увеличением числа ионогенных групп в макромолекуле [5]; молекулярная масса и характер распределения ионогенных групп по цепи не влияют существенно на уровень антимикробной активности. Использование полиэлектролитов с люминисцентной меткой [47] при изучении взаимодействия полимеров с эритроцитами и бактериальными клетками показало, что полимер быстро связывается клеточной стенкой и цитоплазматической мембраной, а затем уже проникает в цитоплазму и ядро клетки. При этом увеличивается проницаемость клеточной мембраны как для низкомолекулярных [5, 30, 31], так и высокомолекулярных веществ [48]. Повышение концентрации полиэлектролитов до 50-100 мкг мл"1 и более приводит к интенсивному повреждению клеточной мембраны, обнаруживаемому по выделению из клеток белков и нуклеиновых кислот [49-50].
Ключевым моментомв механизме действия катионных полиэлектролитов на биологическиемембраныявляется электростатическое взаимодействие с отрицательно заряженными фосфолипидамии белками, локализованными в ней. Следствием этого является нейтрализация заряда мембраны и клетки в целом, а также изменение соотношения гидрофобных и электростатических взаимодействий, стабилизирующих мембрану.
В работе [51] исследовано поведение полиэлектролитов в биологическом окружении. Авторы для изучения взаимодействия клеток с полиэлектролитами использовали модельные системы - бислойные липидные везикулы. Поведение системы поликатион-везикула было исследовано в зависимости от строения и линейной плотности заряда поликатиона, фазового состояния мембраны, содержания заряженного липида в везикулах и их размера, а также ионной силы раствора. Показано, что данное взаимодействие может сопровождаться латеральной агрегацией липидов, резким ускорением трансмембранной миграции липидных молекул (флип-флопом), торможением обмена липидов между везикулами, встраиванием адсорбированных макромолекул в везикулярную мембрану, а также агрегацией и разрушением везикул. Поликатионы, адсорбированные на мембране только за счет электростатических взаимодействий, могут быть количественно вытеснены в раствор при увеличении ионной силы раствора или при добавлении избытка полианиона-конкурента. Это приводит к восстановлению как исходного распределения липидов в мембране, так и межвезикулярного обмена липидов. Гидрофобизация основной цепи поликатиона или модификация цепи боковыми гидрофобными радикалами обеспечивает стабильность комплекса поликатион-везикула в водно-солевых растворах и в присутствии значительных избытков отрицательно заряженных полиионов за счет встраивания гидрофобных фрагментов поликатиона в гидрофобную часть везикулярной мембраны.
Полученные результаты представляют интерес с точки зрения прогнозирования возможных последствий контакта полиэлектролитов и биоцидных веществ на их основе с клеточной поверхностью. Таким образом, дестабилизация мембраны ведет к изменению локализации и фосфолипид- ного окружения ферментов, связанных с мембраной, что естественно отражается на их активности. При этом несомненный интерес представляет выяснение влияния катионных полиэлектролитов на бактериальные ферменты, обусловливающие устойчивость бактериальных клеток к антибиотикам.
Оказалось , что катионные полиэлектролиты взаимодействуют также и с бактериальными ферментами. Обнаружено ингибирующее действие четвертичных аммониевых солей полидиэтиламиноэтилметакрилата и полиди- метиламиноизопропилметакрилата на ферменты «агрессии» (факторы пато- генности) золотистого стафилококка - плазмокоагулазу и гиалуронидазу, которые обуславливают его патогенность [50]. Эти полимеры также подавляли способность стафилококкового а-токсина гемолизировать эритроциты кролика. Катионные полиэлектролиты проявляют ингибирующее действие также в отношении бактериальных ферментов, инактивирующих антибиотики; пенициллиназу, гидролизующую амидную связь Р-лактамного кольца пенициллинов и превращающую пенициллины в неактивные пенициллои- новые кислоты. Свойство катионных полиэлектролитов подавлять активность бактериальных ферментов, инактивирующих антибиотики, а также повышать проницаемость клеточной стенки и цитоплазматической мембраны может способствовать усилению действия антибиотиков в отношении резистентных (устойчивых к действию антибиотиков) штаммов бактерий, так как при этом создаются условия, облегчающие достижение антибиотиком его мишени в клетке. Поэтому катионные полиэлектролиты представляют интерес не только как новые антимикробные вещества, но и как мем- бранотропные биологически активные полимеры-носители для низкомолекулярных биоцидных веществ.
Таким образом, по имеющимся к настоящему времени данным, механизм биоцидного действия катионных полимерных биоцидных веществ, и, в частности, аминогуанидинсодержащих, состоит в следующем. Поскольку микроорганизмы обычно обладают отрицательным суммарным электрическим зарядом, они субстантивны к катиону бактерицидного препарата, который, соприкасаясь с микроорганизмом, адсорбируется на клеточной мембране, вызывает ее лизис и проникает внутрь клетки. Находясь внутри нее, препарат оказывает блокирующее действие на биологическую активность ферментов, препятствует репликации нуклеиновых кислот и угнетает дыхательную систему [52-53]. В своей совокупности этот комплекс воздействий препарата приводит к гибели микроорганизма.
2 ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проблема создания биологически активных волокнистых материалов в последние десятилетия вызывает все возрастающий интерес. Широкое развитие исследований по приданию биоцидных свойств именно целлюлозным волокнистым материалам обусловлено тем, что целлюлоза является доступным и распространенным в природе полимерным материалом. Исследования, посвященные синтезу производных целлюлозы, содержащих антимикробные вещества, разработке научных основ получения биоцидных целлюлозных волокнистых материалов с заданными свойствами, методов и технологии их изготовления, а также изучению свойств и наиболее эффективных областей применения указанных материалов имеют большое научное и практическое значение.
Перед исследователями стоит вопрос о том, при каких типах химической связи между антимикробным веществом и макромолекулой целлюлозы проявляется антимикробная активность материала, как влияет строение введенных биоцидных веществ, в том числе и полимеров, на химические и антимикробные свойства модифицированной целлюлозы. Систематическое исследование этой проблемы имеет существенное теоретическое и большое практическое значение, так как только научно обоснованный подход позволит создать высокоактивные антимикробные волокнистые материалы, антимикробные свойства которых будут сохраняться на протяжении всего периода применения изготовленных из них изделий даже при очень жестких условиях эксплуатации и многократных мокрых обработках.
В настоящее время описано большое число биоцидных производных целлюлозы и других волокнообразующих полимеров разного строения. Вопрос о влиянии строения производных целлюлозы, содержащих химически связанные антимикробные вещества, на антибактериальные свойства этих полимеров был изучен в цикле работ, обобщенных в [28-29]. В этих работах были синтезированы производные целлюлозы (в виде волокнистых мате- риалов), содержащие антимикробные вещества акридинового ряда, галоген- производные фенола (ГПФ), галогены или ионы серебра, связанные с различными функциональными группами макромолекулы модифицированной целлюлозы разными типами химических связей (координационными, ионными, лабильными и стабильными ковалентными), и исследована их антимикробная активность.
Анализ приведенных выше литературных данных показывает, что в последние годы синтезировано большое число производных целлюлозы, содержащих разные антимикробные вещества, присоединенные различными типами химических связей. В настоящее время происходит процесс накопления экспериментальных данных о влиянии строения нерастворимых в воде производных целлюлозы, содержащих химически связанные антимикробные вещества, и характера связи между молекулой антимикробного вещества и макромолекулой полимера на антимикробные свойства волокнистого материала. Установлено, что полимеры с прочной ковалентной связью между производным целлюлозы и антимикробным веществом не обладают антибактериальной активностью. Антимикробная активность волокнистых материалов, содержащих антимикробные вещества, присоединенные ионной или координационной связью, обусловлена отделением антимикробного вещества от полимера вследствие гидролиза указанных связей, диффузией антимикробного вещества из полимерного материала и взаимодействием его с микробной клеткой. Аналогичный механизм антимикробного действия может быть принят для производных целлюлозы, содержащих антимикробные вещества, присоединенные лабильной ковалентной связью (альдиминовой, аце- тальной, триацетальной, сложноэфирной).
Проведенные исследования позволили обосновать и сформулировать представления о механизмах антимикробного действия волокнистых материалов, содержащих химически связанные антимикробные вещества: антимикробная активность изученных волокнистых материалов, обусловлена тем, что антимикробное вещество, присоединенное химической связью к функциональной группе модифицированной целлюлозы, постепенно отщепляется от этой группы вследствие гидролиза связи, диффундирует из волокнистого материала и вступает во взаимодействие с микробной клеткой .
Как было показано в литературном обзоре, способность целлюлозы и ее производных образовывать ковалентные, ионные или координационные связи с солями четвертичных аммониевых оснований широко используется для модификации большого числа целлюлозных волокнистых материалов, при этом в конечном продукте часто проявляется синергизм уникальных свойств исходных компонентов. Выбор окисленной целлюлозы хлопковой и аминогуани- динсодержащих цвиттер-ионных делокализованных резонансных структур для получения новых модифицированных моно- и биматричных композиционных материалов открывает перспективу создания наноструктур и нанокомпозитов с трансформерной полимерной матрицей, представляющих существенный научный и практический интерес. Изделия на их основе можно использовать для изготовления одежды, упаковки, перевязочных материалов медицинского назначения, а также фильтрующих мембран для стерилизации воздуха и обеззараживания речной воды, обладающих одновременно пролонгированными биоцид- ными и легко регенирируемыми адсорбционными свойствами, поскольку в состав аминогуанидинсодержащих мономеров и полимеров входят ионогенные группы. Именно назначение будущих изделий в значительной степени определило способы их получения, состав и важнейшие параметры новых биоцидных мономеров, тип связывания в них основного биоцидного компонента, природу супрамолекулярных связей, обуславливающих его иммобилизацию с матрицей в композитах, полученных нами.
Отметим, что все исследования проводились с одной партией исходных и синтезированных веществ.
При создании композиционных материалов, в том числе и нанокомпозитов с полимерной биматрицей, мы руководствовались тем, что каждый из предполагаемых процессов взаимной иммобилизащш можно условно разделить на четыре типа включения основного биоцидного компонента (катиона гуанидиния) в зависимости от природы носителя:
механический, когда за счет пропиточного раствора аминогуанидинметакрилата (АГМ) биоцидный компонент остается на поверхности окисленной целлюлозы (ОЦХ) и может быть использован как «ударная доза», т.к. деиммобилизуется первым;
сорбированный, когда биоцидный компонент связан с носителем за счет ионных, водородных, ван-дер-ваальсовых связей; деиммобилизуется пролонгировано;
химический, когда биоцидный компонент связан ковалентными связями с карбонильными и карбоксильными группами ОЦХ, или в результате привитой полимеризации АГМ (матрица - ОХЦ) в присутствии персульфата аммония.
сорбционно-химический, при полимеризации АГМinsitu.
Ключевым фактором при создании композитов на основе целлюлозы хлопковой и биоцидного компонента явилась предварительная активация исходных компонентов для придания способности к структурной и химической взаимной иммобилизации и дополнительной целенаправленной модификации. С этой целью целлюлоза хлопковая (взятая в виде волокнистого материала и бинта) обрабатывалась 1 М водным раствором перекиси водорода. Как было показано в литературном обзоре, при окислении целлюлозы перекисью водорода происходит неизбирательное окисление, в результате которого возможно образование карбонильных (альдегидных и кетонных) и карбоксильных групп, с разрывом и без разрыва пиранового кольца.
Вторым компонентом, используемым нами для получения биоцидного волокнистого нанокомпозита, явился метакрилат аминогуанидина. Как отмечалась в литературном обзоре, метакриловая кислота и ее производные характеризуются значительной реакционной способностью в реакциях ра- дикальной гомо- и сополимеризации. Ее производные, содержащие виниловый фрагмент и химически активные функциональные группы, представляют собой перспективный ряд мономеров. Соответствующие им полимеры могут сохранять потенциал активности, являясь удобными носителями биологически активных веществ.
Аминогуанидин NH2 -NH-C(=NH)-NH2 , который входит в метакрила- таминогуанидина, в отличие от гуанидинаNH2-C(=NH)-NH2 , наряду с амино- и иминогруппой содержит гидразиновую группу. Данный фрагмент в силу своего химического строения расширяет возможности химической модификации и способен дополнительно выполнять ту или иную специфическую функцию, в частности, введение такого фрагмента приводит к усилению биоцидных свойств.
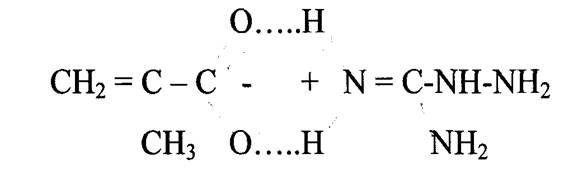
синтезировали по предлагаемой в литературе методике. По этой методике соль гуанидина (сульфат, карбонат, нитрат и др.) помещали в этилат натрия, через 12 часов отфильтровывали выпавшую натриевую соль и затем к раствору аминогуанидина при температуре 0-5 °С прикапывали очищенную от ингибиторов радикальной полимеризации метакриловую кислоту.
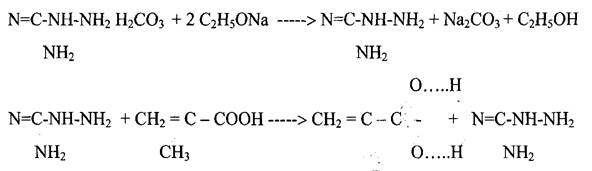
Были были найдены оптимальные условия проведения этой реакции: 2 М раствор одной из солей неорганических кислот аминогуанидина в абсолютном этаноле обрабатывали эквимольным количеством этилата натрия, при этом высаждается натриевая соль неорганической кислоты. К фильтрату, содержащему раствор аминогуанидина в этиловом спирте, при низких температурах приливали эквимольное количество метакриловой кислоты. Полученный продукт реакции высаждали из раствора диэтиловым эфиром. Аминогуанидин метакрилат перекристаллизовывали из смеси воды и этанола. Выход «80 - 85%. Температура плавления аминогуанидинметакрилата - 171 °С
Строение и чистоту полученной соли определяли с помощью элементного анализа
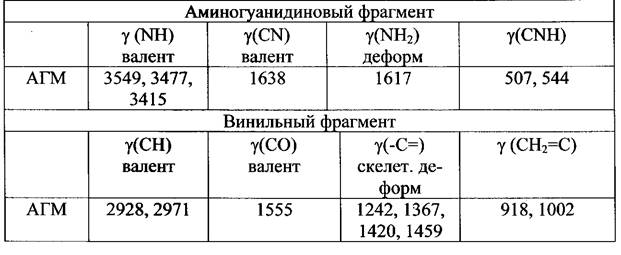
Результаты элементного анализа: аминогуанидинметакрилат - Найдено, %: С =37,26; Н =7,71; N =35,08 . Вычислено для C5 H12 N4 02 %: С = 37,50; Н = 7,50; N = 35,00 В ИК-спектре метакрилатаминогуанидина ионизованный координационно-связанный карбоксил проявляется в спектре в виде типичной интенсивной полосы поглощения 1555,19 см"1 , характерной для делокализо- ванного цвиттер-иона Остальные характеристические полосы поглощения, наблюдаемые в ИК спектре метакрилат аминогуанидина, приведены в таблице 1. ИК-спектральные данные для аминогуанидинметакрилата (АГМ) (в см"1 )
Таблица 1
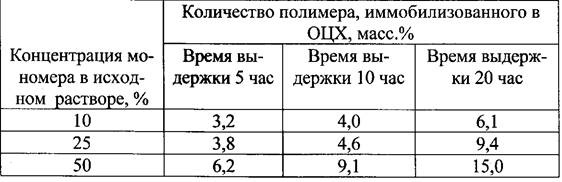
Биоцидный композит на основе окисленной целлюлозы и метакрилата аминогуанидина получали следующим путем. К суспензии окисленной целлюлозы (ОЦХ) в воде при перемешивании добавляли метакрилатаминогуа- нидин и персульфат аммония, нагревали смесь до 60°С и проводили полимеризацию в течение 4-20 часов. Соотношение ОЦХ : Н2 0 = 1:6 масс., концентрация АГМ в воде - варьировалась от 10 до 50% (масс), соотношение АГМ : ПСА = 1:0,001 мае. Полученный композит отделяли от маточного раствора, выдерживали 1 час в дистиллированной воде при 60°С, промывали в воде для отделения метакрилатаминогуанидина, не иммобилизованного в ОЦХ, и сушили.
Проведенные исследования показали, что количество аминогуани- динметакриалата, вошедшего в состав композита, зависит от концентрации мономера.
Структуры, образующиеся при взаимодействии окисленной целлюлозы (ОЦХ) с цвиттер-ионными делокализованными парами метакрилат- и поли- метакрилатаминогуанидина представлены в общем виде на схемах а,б,в.
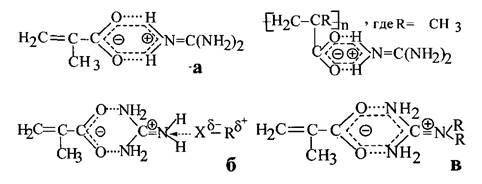
Для мономер/полимерных катионотропных четвертичных иминопроизвод- ных солей метакрилатаминогуанидина можно ожидать первый тип связывания (а) основного биоцидного компонента - катиона аминогуанидиния (C(NH))® (прото- нированная форма исходного гуанидина, который имеет симметрию третьего порядка) с карбоксилат-анионом метакриловой кислоты (исходный носи-тель основного биоцидного компонента, имеющий симметрию второго порядка). Надо отметить, что длина связи C-Nв катионе равна 0,132 нм, и он является прекрасным центром связывания с различными структурными фрагментами нук- леофильной природы, т.к. остается протонированным в очень широком диапазоне рН, например,4% водные растворы гуанидингидрохлорида (H2 N)2 C=NH-HC1 и гуанидингидрокарбоната (H2 N)2 C=NH-0,5H2 CО3 имеют значения рН = 6,4 и 11,2 [4]. Данный тип наиболее вероятен для истинных четвертичных иминопро- изводных солей слабых кислот [5]. Второй тип связыва-ния (б) скорее следует ожидать при наличии нуклеофилов, конкурирующих с карбоксилат-анионами (исходными носителями основного биоцидного компо-нента) при стабилизации четвертичных аммониевых катионов гуанидиния, но не образующих истинные цвитгер-ионные резонансные структуры. В нашем случае нуклеофильной составляющей -X в таких мономер/полимерных цвиттер- ион-ных делокализо- ванных резонансных структурах может выступить атом кислорода карбоксиль- ной(-СООН) или гидроксильной (-ОН) групп активированной целлюлозы химической. При этом указанные связи относительно легко могут разрушаться и восстанавливаться (иногда образуя другие структуры) как под действием различных природных факторов, так и в результате направленного целевого воздействия (изменение рН среды, температуры, природы растворителя, а также за счет взаимодействия с конкурирующими обменными катионами или мембранной поверхностью бактериальной клетки) [6]. Третий тип связывания (в) возможен за счет образования альдиминовых связей C=N(азот- углеродных ковалентных связей) при реакции конденсации метакрилатгуа- нидина с активированной целлюлозой. Не исключается также возможность образования углерод - углеродных связей за счет радикальной привитой сопо- лимеризации активированной целлюлозы с виниловой составляющей метак- рилатаминогуанидина. [7]. В этих случаях получаются достаточно устойчивые модифицированные продукты.
Возможность образования лабильных связей в ходе иммобилизации за счет взаимодействия альдегидных или гидроксильных групп активированной целлюлозы с мономер/полимерными цвиттер-ионными парами метак- рилатгуанидина была доказана ИК-спектроскопией, элементным и рентгено- дифракционным анализами опытных образцов целлюлозы хлопковой в виде волокнистого материала и бинта (ЦХ), окисленной целлюлозы (ОЦХ), композитов целлюлоза хлопковая + метакрилатаминогуанидин (ЦХ+АГМ), окисленная целлюлоза + метакрилатаминогуанидин (ОЦХ+АГМ), целлюлоза хлопковая + по- лиметакрилатаминогуанидин (ЦХ+ПАГМ), окисленная целлюлоза + полиме- такрилатаминогуанидин (ОЦХ+ ПАГМ). Косвенным подтверждением иммобилизации явилось наличие биоцидных свойств у исследованных образцов.
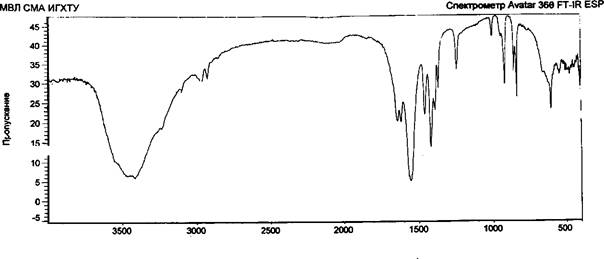
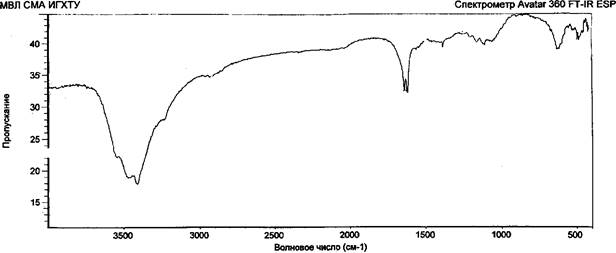
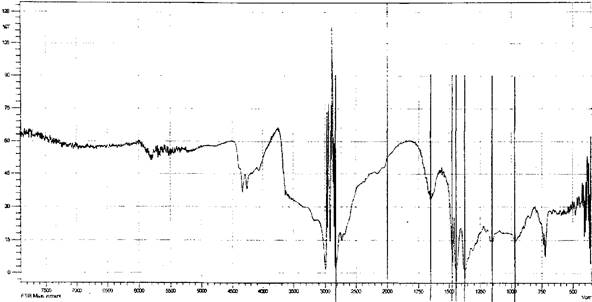
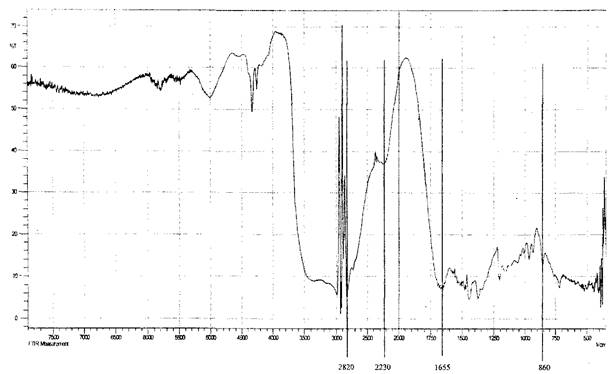
Обработка ОЦХ водным раствором АГМ (механическая смесь) приводит к увеличению степени кристалличности образцов, что связано, видимо, с рекристаллизацией ОЦХ.
Антимикробную активность ОЦХ/АГМ изучали в условиях Нальчикской городской ветеринарной лечебницы. Перед использованием препарата рану предварительно механически очищали без использования антимикробных препаратов, а затем покрывали салфетками из ОЦХ/АГМ и перевязывали стерильными бинтами. При необходимости в раны вставляли турунды из исследуемого композита и ставили провизорные швы.
Бактерицидная эффективность модифицированной целлюлозы оценивалась по динамике воспалительного процесса и характеру заживления раневого дефекта. При оценке течения раневого процесса учитывался внешний вид раны, наличие отделяемого, гиперемии, отека и инфильтрации окружающих тканей, сроки формирования грануляций, очищения раны от некротических тканей, эпителизации раневой поверхности и заживления ран. Наблюдение проводилось ежедневно с учетом гистологических изменений в ранах. Через 3 суток от начала лечения отмечено, что при применении ОЦХ/АГМ степень выраженности воспалительных процессов была снижена. Так, язвенный дефект кожи с гнойно-некротическими изменениями в дне сохранялся в течение первых 2 суток, к 5-м суткам происходило практически полное очищение раны от гнойно-некротического детрита и формирование соединительно-тканного рубца.
Таким образом, гистологические исследования свидетельствуют о том, что использование нанокомпозита ОЦХ/АГМ при лечении гнойных ран приводит к скорейшему купированию гнойного воспаления и ускоряет заживление инфицированных дефектов кожных покровов. Бактериологическими исследованиями установлено, что ОЦХ/АГМ эффективна против протея вульгарного (Proteusvulgaris), синегнойной палочки (Ps. aureginosa) и золотистого стафилококка (Staph. Aureus).
3 Экспериментальная часть
3.1 Очистка исходных веществ
Все растворители очищались соответствующими способами. Чистоту растворителей контролировали по их температурам кипения и показателям преломления, которые совпали с литературными данными и приведены в таблице 1.
Все реагенты очищались по соответствующим методикам, чистоту реагентов контролировали по температурам плавления, которые совпадали с литературными данными и приведены в таблице 1.
Этанол абсолютный (Эт) (С2 Н5 ОН). В продаже имеются очищенный спирт («95%) и технический абсолютный спирт. Только перегонкой спирт не удается обезводить, так как он с водой образует постоянно кипящую смесь, содержащую 95,6% спирта. Поэтому остаток воды удаляют химическим путем.
Очистку проводили в несколько стадий [54]:
Этанол (ректификат) кипятили над свежепрокаленным сульфатом меди C11SO4 (на 1 л этанола 200 г Q1SO4 ). По интенсивности синей окраски сульфата меди можно судить о качестве исходного спирта.
В колбу, снабженную обратным холодильником, помещали 5 г магниевой стружки, приливали 50-75 мл технического абсолютного спирта, высушенного над сульфатом меди, прибавляли 0,5 г сублимированного йода. Смесь нагревали до момента начала экзотермической реакции (по мере необходимости прибавляли еще 0,5 г сублимированного йода) [55]. После окончания реакции колбу нагревали до растворения всего магния. Затем добавляли остальное количество спирта 900 мл, раннее обработанного сульфатом меди, кипятили в течение 2 часов с обратным холодильником без доступа влаги воздуха затем перегоняли спирт обычным способом ( первую порцию дистиллята отбрасывали).
В основе способа лежит реакция:
Mg+ 2С2 Н5 ОН = Н2 + Mg(0 С2 Н5 ) 2
Mg(0 С2 Н5 ) 2 + 2Н2 0 =Mg(OH)2 + 2С2 Н5 ОН
Этанол абсолютный содержит «0,1 - 0,5% воды и 0,5-10% денатурированного агента (ацетона, бензола, диэтилового эфира или метанола) Гордон, Форд
Диэтиловый эфир (ДЭ) ((С2 Н5)2 0). Технический продукт обычно содержит 2,5-4% спирта, небольшое количество воды, иногда ацетальде- гид.
Для очистки эфира его многократно встряхивали с концентрированным раствором хлористого кальция, затем оставляли стоять на 1-2 дня над безводным хлористым кальцием (=10% от веса эфира), фильтровали в сухую колбу и высушивали тонко нарезанным натрием (0,5-1% от веса эфира).3атем эфир перегоняли в присутствии нескольких кусочков све- женарезанного натрия. Полученный абсолютный эфир хранили над небольшим количеством натрия.
Для регенерации отработанного эфира поступали следующим образом:
Отработанный эфир встряхивали 2 раза с 5%-ной соляной или серной кислотой (1/5 от его объема), отделяли и встряхивали дважды с 5%- ным раствором едкого натра (1/5 от его объема), затем 3 раза водой (1/5 от его объема) и наконец, 2 раза со свежеприготовленным 5%-ным раствором железного купороса (1/10 от его объема), слабо подкисленным серной кислотой. Эфир высушивали хлористым кальцием и перегоняли. Собирали фракцию кипящую до 40 °С. Полученный таким способом эфир не используется для приготовления абсолютного эфира (его нельзя сушить натрием), а применяется только для экстракции.
Изопропиловый спирт (ИС) (СН3 )2СНО. Имеет температуру кипения 82,4 °С, с водой образует азеотропную смесь с температурой кипения 80 °С, содержащую 87,4% изопропилового спирта. С водой смешивается во всех соотношениях.
Изопропиловый спирт предварительно подсушивали углекислым натрием и окончательно абсолютировали его хлористым кальцием. Затем перегоняли в токе сухого азота, при этом отбиралась фракция, кипящая при температуре 81-82 °С.
Метакриловая кислота (МК) СН2 =С(СН3 )-СООН. Метакриловую кислоту очищали от радикальных ингибиторов, которые добавляют с целью предотвращения полимеризации метакриловой кислоты при ее хранении, перегонкой под вакуумом [56].
4.2 Синтез мономеров и полимеров 4.2.1 Окисление целлюлозы перекисью водорода.
В 200 мл. дистиллированной воды приливаем 160 мл. и добавляли 5 г. целлюлозу. Окисляли целлюлозу при перемешивании в течении трех часов. По завершении перемешивания закрывали пробкой и оставляли на ночь. На утро отфильтровывали, промывали дистиллированной водой несколько раз, сушили при комнатной температуре и получали окисленную целлюлозу:
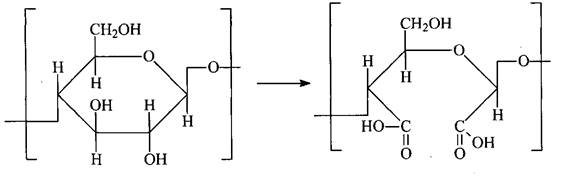
3.2 Синтез аминогуанидинметакрилата (АГМК)
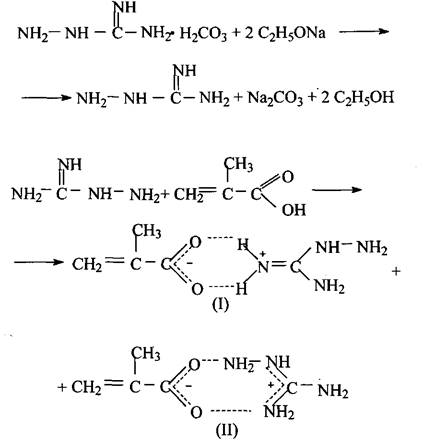
В спиртовой раствор аминогуанидина, предварительно полученный из этилата натрия и гидрокарбоната аминогуанидина, при охлаждении до - 10 °С добавили эквимольное количество метакриловой кислоты (температура в реакционной массе при этом не превышала -5 °С). Раствор перемешивали 3 часа при комнатной температуре, после чего МКАГ выделяли из спиртового раствора высаждением их в избыток диэтилового эфира. Полученную соль перекристаллизовывали из смеси воды и этанола. Выход «73 %.
Температура плавления аминогуанидинметакрилата 170 °С.
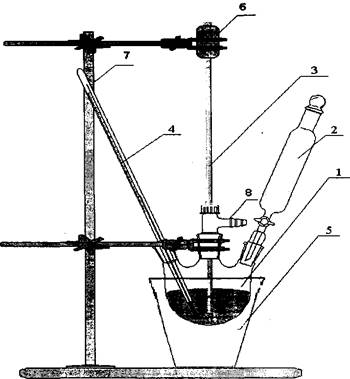
Схема установки для синтеза аминогуанидинметакрилата
1 - трехгорлая круглодонная колба; 2 - капельная воронка; 3 - мешалка; 4 - термометр; 5 - баня с охлаждающей смесью; 6 - электромотор; 7 - штатив с лапками; 8 - газоотводная трубка.
Синтез 2
В трехгорлую колбу, снабженную мешалкой и барботером для подачи азота налили метиловый спирта и добавили рассчитанное количество карбоната аминогуанидина. Перемешивали с подачей азота. Под колбу поставили баню со льдом и из капельной воронки постепенно прикапывали ме- такриловоую кислоту при охлаждении до - 10 °С При этом усиливали подачу азота. Раствор перемешивали 3 часа при комнатной температуре, после чего аминогунидинметакрилат выделяли из спиртового раствора высажде- нием в избыток диэтилового эфира. Получали белый порошок с температурой плавления 170 °С.
ЛИТЕРАТУРА
1. Роговин З.А. Химия целлюлозы.-М.:Химия, 1972.-520с.
2. Целлюлоза и её производные / Под ред. Н.Байклза, Л.Сегала.- М.:Мир,1974.-Т.1-2.
3. Роговин З.А., Гальбрайх Л.Г. Химические превращения и модификация целлюлозы.-М.:Химия, 1979.-206с.
4. Шарков В.И., Гидролизное производство, т. 1, ГЛТИ 1945; т.2, ГЛТИ, 1948; Т.З ГЛТИ, 1950.
5. Деревицкая В.А., Докторская диссертация, Институт химии природных соединений АН СССР, Москва, 1962.
6. Васильев А.В., Майборода В.И.// Хим. Волокна, 1966, №5,28
7.. Pastcka М., Faserforsch. U. Textiltechn., 14, 141 (1963).
8.. Непенин Ю.Н., Технология целлюлозы, 2 изд., т1 -2, М. 1976.-90с.
9. Жбанков Р.Г, Козлов Г.В., Физика целлюлозы и ее производных, Минск, 1988. 10 . Regelson W. //J/ Polymer Sci: Polimer sympok. 1979, Vol. 66. p.483-538/ 11. Donaruma L.G., Bezanno J.//J. Med. Chem. 1971, Vol. 14, №4.p.224 12 . Dombroski J.R., Donaruma L.G. //J. Med. Chem. 1971, Vol. 14, №5 p461 13. Платэ H.A., Васильев A.E., Физиологически активные полимеры-М.: Химия, 1986. с.296
10. Панарин Е.Ф., Заикина Н.А.// Антибиотики, т.22, 1977, с. 327
11. Агаджанян М.Е. // Арм. Хим. Журн. 1975. т. 21 ,№8, с. 658-661
12. Donaruma L.G., Bezanno J. // J. Med. Chem. 1971, Vol. 14,№4, p 224
13. Charaher Ch.F., Moon W.Y., Langwarthy Th.A.//Polymer Preprints. 1976 Vol.17 №l,p.l-5
14. Zubov V.P., Vijaga Kumar M., Masterova M.N. et al //J. Macromol. Sci. 1988. T. 30. №4. c.675.
15. Кабанов В.А., Топчиев Д.A. // Высокомолек. Соед. А. 1988. Т. 30. с.675.
16. Топчиев Д.А., Нажметдинова Г.Т., Крапивин A.M. и др. // Высокомолек.
17. Соед. А. 1982. Т. 24. №6. с.437.
18. Кабанов В.А., Топчиев Д.А., Нажметдинова Г.Т. // Высокомолек. Соед.
19. А. 1984. Т. 26. №1. с.51. 22 . Топчиев Д.А., Нажметдинова Г.Т. и др. // Изв. Ан СССР. Сер.хим. 1983. №10. с. 22-32.
20. К.Е. Скворцова, Нехорошева А.Г., Гембицкий П.А. // Проблемы
21. дезинфекции и стерилизации. М.: ВНИИДиС, 1974, вып.23, с.58. 24 . Ryser H.J. // Science. 1965, V.150, р.501. 2 5 . Ryser H.J. // Biomembranes. 1971, V.2, p. 197.
22. Ярославов А.А., Кабанов В.A. // Материалы Всероссийского
23. Каргинского симпозиума. 2000. Тез. докл. ч.1, с. 17. 2 7 . Panarin E.F. // 26 Microsymposium on Macromolecules Polymers in medicine and Biology. Prague, 1984, p.87
24. Ghosh M. // Polymer Material Sci. Eng. ACS. 1986, V.55, p.755. 29. Ghosh M.//Polymer News. 1988, V.13, p.71.
25. Панарин E.Ф., Заикина H.А., //Антибиотики том 22, 1977, с. 327. 31. Патент Франции 789429 (1959).
26. Патент США 2,867,562 (1959).
27. Патент Великобритании 1114155 (1960).
28. Патент Швеции 339076 (1971).
29. А.с. СССР 4341826 (1988).
30. Патент Великобритании 115243 (1969).
31. Патент ФРГ 2437844 (1982).
32. Патент США 4,587,266 (1986). 39. А.с. СССР 847893 (1981).
33. А.с. СССР 2039735 (1995).
34. Приказ Минздрава СССР № 15-6/31 от 22 декабря 1989 года. 4 2 . Заикина Н.А.// Антибиотики 1977, №22, с.327
35. Милич М.В., Федорова Д.Л., Топчиев Д.А. // Вестник дерматологии, 1988, №4, с.37
36. Милич М.В., Федорова Д.Л., Топчиев Д.А. // Вестник дерматологии, 1988, №5, с.25
37. Эсмурзиев A.M., Хаширова С.Ю., Сивов Н.А. и др. Радикальная гомо(со)полимеризация акрилат- и метакрилатгуанидинов в водных средах // Структура и динамика молекулярных систем, 2003, выпуск X, ч. 1, с.214-216
38. Фельдштейн М.М. // Синтетические полимеры медицинского назначения. Материалы 6 Всесоюзного симпозиума. Алма-Ата, 1983, с. 142
39. Khokhlov A.R., Pavlova S.A., Timofeeva G.L. // J. Polymer. 1994, V.35, №8, p. 1769
40. Тимофеева JI.M., Клещева H.А., Топчиев Д.A. // Изв. АН. Сер. Хим. 1999, №5, с.865
41. Васильева Ю.А., Клещева Н.А., Громова Г.Л., Топчиев Д.А., Крутько Е.Б., // Изв. АН. Сер. Хим. 2000, №3, с.430
42. Ikeda Т., Yamaguchi Н., Suzuke Y. // Macromol. Chem. 1984, V. 185, Р869
43. Химическая энциклопедия / под ред. И.Л. Кунянца, 1988, М.,Т.1, с.617
44. Топчиев Д.А., Нажметдинова Г.Т., Гембицкий П.А. // Изв. Ан СССР, Сер. Хим. 1983, №10, с.22-32
45. Платэ Н.А., Васильев А.Е., Физиологически активные полимеры-М.: Химия, 1986. с.296
46.Патент США 4,532,128 (1985).
47.Гембицкий П.А., Воинцева И.И., Полимерный биоцидный препарат
48. Лабораторная техника органической химии / Под ред. Б. Кейла. - М.: Мир, 1966
49. Lund Н., Bjerrum J., Ber., 64,210,1931.
50. Mathews J.H., J. Am. Chem. Soc., 48,562, 1926.
51. Кабанов В.А., Акутин M.C. и др. Энциклопедия полимеров.-М.: Советская энциклопедия, т. 2,1974.
52. Рабинович В.А., Хавин З.Я. Краткий химический справочник.-Сп.: Химия, 1994.
Похожие рефераты:
Полимерные композиты на основе диальдегилцеллюлозы и полигуанилинметакрилата
Развитие, становление и основные аспекты фармации
Влияние технологических добавок на структуру и свойства резин
Методы анализа лекарственных препаратов
Программа для поступающих в вузы (ответы)
Понятие о пищевых добавках и их характеристика
Химия и технология платиновых металлов
Полимераналогичные превращения хитозана
Перспективы развития экологического сознания школьников при изучении темы "Полимеры" в курсе химии
Разработка источников диффузионного легирования для производства кремниевых солнечных элементов
Получение ферментных препаратов выращенных глубинным способом