| Скачать .docx |
Курсовая работа: Синтез и исследование поливольфрамофенилсилоксанов, содержащих атомы вольфрама в степени окисления +6
Министерство образования и науки Российской Федерации
Государственное образовательное учреждение высшего профессионального образования
Дальневосточный Государственный Университет
Институт химии и прикладной экологии
Кафедра неорганической и элементоорганической химии
|
Синтез и исследование поливольфрамофенилсилоксанов, содержащих атомы вольфрама в степени окисления +6
Оглавление
Введение
1. Литературный обзор
1.1 Методы синтеза полиметаллоорганосилоксанов
1.2 Некоторые свойства полиметаллоорганосилоксанов
2. Методика эксперимента
3. Обсуждение результатов
4. Выводы
5. Список литературы
Приложение
Кремнийорганические полимеры, содержащие в своей структуре гетеросилоксановую группировку Si-O-Э (под символом Э подразумевается гетероатом, за исключением атомов водорода и углерода), носят название полигетеросилоксаны. Если элемент является металлом, они классифицируются как полиметаллоорганосилоксаны (ПМОС). Первые полученные в 50г ХХ века, исследования были доведены до промышленного внедрения [1].
Интерес к химии полигетеросилоксанов обусловлен специфическими свойствами и реакционной способностью силоксановой связи и группировки Si–O–M, спектр свойств которых достаточно широк. Ранее было показано, что полигетеросилоксаны, содержащие в своем составе d-элементы обладают высокой термостойкостью, а также выступают в качестве эффективных термостабилизаторов полидиметилсилоксанового каучука (СКТН) и катализаторов некоторых органических реакций [2-4]. Так же полиметаллоорганосилоксаны используются в качестве стойких антикоррозийных покрытий, защитных лаков, катализаторов в нефтеперерабатывающей промышленности [5].
Свойства ПМОС могут зависеть как от природы, так и от степени окисления металла, входящего в состав силоксановой цепи. Достаточно мало изученными являются полигетеросилоксаны содержащие в своем составе металл в степени окисления +5 и выше. В то же время такие полимеры могут быть эффективными термостабилизирующими добавками к силиконовым каучукам. С этой точки зрения несомненный интерес могут представлять вольфрамсодержащие полимеры.
Ранее было показано, что совместный гидролиз фенилтрихлорсилана и вольфрамата натрия приводит к образованию поливольфрамфенилсилоксанов. Однако содержание вольфрама в них не превышает 1 %.
Целью данной работы является исследование возможности получения поливольфрамфенилсиликонатов на основе фенилсиликоната натрия и вольфрамата натрия в водно-органических средах.
1. Литературный обзор
1.1 Методы синтеза полиметаллоорганосилоксанов
В данное время существует пять основных путей формирования гетеросилоксановой группировки: реакции гидролитической и гетерофункциональной поликонденсации, взаимодействие органилсиланолятов щелочных металлов с галогенидами металлов, расщепление силоксановой связи оксидами элементов и методом механохимической активации. Методы были описаны авторами [1, 6-12]
1. Метод гидролитической поликонденсации
Самым простым и удобным в препаративном отношении способом получения ПМОС является гидролитическая поликонденсация. Он заключается в совместном гидролизе кремнийорганических функциональных соединений с солями металлов и дальнейшей их конденсацией по схеме:
Rn Si(OH)4- n + y M(OH)x → {RSi(O)4- n /2 MOx /2 }n + 4- n /2 H2 O(1)
Взаимодействие проводится в системе органических растворителей, добавка бутанола повышает выход полимеров [13].
Водородный показатель реакционной среды должен быть близок к pH образовавшегося гидроксида данного металла, иначе образующиеся полимеры металла не содержат [14].
В последнее время данный метод практически не используется, так как из-за побочных процессов, связанных с гомоконденсацией образующихся гидроксисоединений кремния и металла, выходы растворимых и термопластичных полимеров, удовлетворяющих условиям получения материалов на их основе, не превышают 60%.
Соотношение кремния к металлу в них резко отличается от вводимого [15], так как металл может полностью выводиться из сферы реакции в виде гидроксидов [14]. Данные процессы проходят по следующим схемам:

Скорость реакций гомоконденсации по данным схемам в подавляющем числе случаев намного выше, чем скорость гетероконденсации.
2. Метод гетерофункциональной поликонденсации
Метод является более надежным методом синтеза ПМОС. Он основан на взаимодействии относительно устойчивых и реакционноспособных производных кремния и металлов. Чаще всего используют различные функциональные пары, находящиеся у атома кремния и металлов, такие как алкокси-гидрокси, алкокси-ацетокси, а так же галоген-ацетокси, галоген-гидрокси и некоторые другие. Наиболее гладко протекает взаимодействие между алкоксидами металлов и гидроксилсодержащими кремнийорганическими соединениями по следующей схеме:
mR2 Si(OH)2 +M(OR)x →[-(R2 SiO)m -M(OR)(x-2m) -O-]n +xROH+m-x H2 O (5)
Полимеры, синтезированные данным методом, получаются с соотношением кремния к металлу равным заданному. Основным недостатком данного метода синтеза является труднодоступность исходных реагентов и их крайняя гидролитическая неустойчивость. [16]
Ранее было показано, что по схеме реакции гетерофункциональной конденсации α-, ω-дихлорперметилолигосиланов с ацетатами металлов, возможно образование металлосилоксанового фрагмента в полисилоксановой цепи. В процессе взаимодействия α-, ω-дихлорперметилолигосиланов с молибдатом натрия происходит формирование металлосилоксанового фрагмента по схеме обращенной обменной реакции: -RSi-O-Mo(O)2 -. При этом одновременно происходит окисление фрагментов –SiR2 -SiR2 - до силоксановых связей –SiR2 -O-SiR2 -. В результате образуются металлоорганосилоксаны, содержащие в составе одной молекулы атомы Mo в различной степени окисления:
O2 Mo{(V)}-O-(SiR2 -O)2 -Mo{(VI)}O2 -O-(SiR2 -O)2 Mo{(V)}O2
Предложена двухстадийная схема протекающих превращений. Проведенные расчеты с применением структурного моделирования показали, что образование циклических молибдатсилоксанов возможно для соединений подобного типа, содержащих в своем составе не менее пяти –SiMe2 -O- фрагментов [17].
Реакцией гетерофункциональной поликонденсации между ацетилацетонатами железа, меди, алюминия и кремнийорганическими диолами, получены как низкомолекулярные, так и высокомолекулярные металлоорганосилоксаны [18].
Проведение взаимодействия органилхлорсиланов с неорганическими солями, содержащими металл в высшей степени окисления [19]. Триметилсилилперренат получен при взаимодействии перрената серебра с триметилхлорсиланом по схеме:
(CH3 )3 SiCl + AgReO4 → (CH3 )3 SiO ReO3 + AgCl (6)
Гетеросилоксаны, содержащие группировку Si-O-W, впервые были описаны авторами [20]. Взаимодействием дифенилхлорсилана с молибдатом или вольфраматом натрия в водно – ацетоновой среде получены соответствующие полиметаллодифенилсилоксаны. Эти соединения хорошо растворяются в смесях дегидролиналоола с углеводородами, что позволило испытать их в качестве катализаторов перегруппировки диалкилэинилкарбинолов в β-непредельные альдегиды.
Реакция замещения хлора при атоме кремния в фенилтрихлорсилане молибдат-ионами исследована авторами [21]. В результате выделена растворимая и нерастворимая фракции. Согласно данным элементного анализа состав растворимой фракции отвечает формуле Ph2 Si2 (MoO3 )4 . На основе данных элементного анализа, ИК-спектроскопии, гель-хроматографии, термического анализа и химического тестирования предложена трициклическая структура растворимой фракции молибден (VI) фенилсилоксана.

На основе экспериментальных данных было установлено, что наиболее отчетливо перегруппировка наблюдается в случае, когда в структуре силоксановой цепи находится атом переходного металла [22].
Показано, что движущей силой перегруппировки является координационная ненасыщенность металла, находящегося в структуре силоксановой цепи. Предложена схема, объясняющая протекание перегруппировки, включающая стадию образования координационного переходного комплекса.
Рассмотрены экстремальные варианты перегруппировки, находящиеся в полном соответствии с предложенной схемой:
а) глубокое протекание перегруппировки, приводящие к выведению металла в форме оксида из силоксановой матрицы;
б) торможение этого процесса в случаях, когда достижимо заполнение координационной сферы металла за счет "внутренних ресурсов". Показано, что наиболее эффективное торможение перегруппировки достигается при заполнении координационной сферы металла атомами кислорода, входящими в состав группировки Si-O-M, а также силанолят-анионами Si-O- .
Проведен сравнительный анализ состава природных металлосиликатов, в результате которого установлено, что закономерности, выведенные при изучении химии МОС, могут быть приложены к описанию некоторых геохимических процессов образования минералов.
Авторами [23] была предпринята попытка синтеза поливольфрамофенилсилоксанов, содержащих металл в высшей степени окисления, взаимодействием оксихлорида вольфрама (W+6 ) с полифенилсиликонатом натрия. В результате получен поливольфрамофенилсилоксан с соотношением кремния к металлу равным 14. Резкое отличие соотношения кремния к металлу от заданного в растворимых в органических растворителях продуктах реакции авторы объясняют тем, что окончательное формирование полимерной структуры происходит при температуре кипения растворителей. Учитывая высокую функциональность мономера, это может приводить к образованию сшитых структур, что подтверждается образованием нерастворимых гетеросилоксанов с высоким содержанием металла.
3. Взаимодействие органилсиланолятов щелочных металлов с хлоридами металлов
Наиболее удобным в препаративном отношении и универсальным методом синтеза ПМОС является метод, основанный на взаимодействии хлоридов металлов с органилсиланолятами щелочных металлов [24-27]. Данный способ практически незаменим для получения ПМОС циклолинейного строения.
Данный метод образования полимеров отражен следующими схемами:
RSi(OH)2 ONa+MYx →M[O(OH)2 SiR]x +xNaY (7)
M[O(OH)2 SiR]x →{[RSi(O)1.5 MOx/2 }+xH2 O (8)
Методика получения ПМОС состоит из двух стадий: сначала при действии дозированного количества щелочи на органосилоксан получают органосиланолят, далее с помощью обменной реакции органосиланолята и галогенида поливалентного металла формируют металлосилоксановый фрагмент Si-O-M-O-Si, при этом металл "встраивается" в силоксановую цепь. Несмотря на кажующуюся простоту данных схем, соотношение кремния к металлу в получаемых полигетеросилоксанах часто отличается от исходного, они неоднородны по составу, что указывает на сложность процессов полимерообразования. Предложены методы синтеза в водно-органических средах: в этом случае соотношение кремния к металлу в полимерах зачастую сильно завышены относительно исходного и они неоднородны по составу [25,28].
По мнению ряда других авторов при проведении процесса в водно-органических средах преобладающее влияние оказывает гидролиз исходных соединений: реакция по своему характеру мало чем отличается от согидролиза [29].
Методом, основанным на взаимодействии хлоридов металлов с мононатровыми солями органилсилантриолов в безводной среде удается достигнуть значительно лучших результатов. При проведении процесса в среде инертного растворителя, выход полимера значительно улучшается в присутствии бутилового спирта, вероятно вследствие гомогенизации системы [29]. Но данный способ является технологически более трудоемким из-за трудностей получения безводных хлоридов металлов. Однако и в этом случае в реакционной системе будет содержаться некоторое количество воды [30].
Для исключения влияния побочных процессов был предложен новый метод получения ПМОС в среде диметилсульфоксида (ДМСО), который эффективнее чем вода сольватирует ионы металлов [31]. Насыщая координационную сферу металла, ДМСО препятствует протеканию нежелательных побочных процессов, что приводит к получению ПМОС более регулярного строения. Предложенный метод не требует использования в синтезе ПМОС безводных галогенидов металлов и абсолютных растворителей. В полученных полимерах сохраняются соотношения кремния к металлу и они практически однородны по составу.
Метод получения каркасных и полимерных металлоорганосилоксанов, в котором использовали для синтеза полиметаллоорганосилоксанов не силаноляты натрия, полученные щелочным расщеплением предварительно синтезированных полиорганосилоксанов, а мономерные органотриалкоксисиланы предложен авторами [32]. Суть метода заключается в том, что органотриалкоксисилан обрабатывают водно-метанольным раствором едкого натра, причем количество воды должно обеспечивать полный гидролиз алкоксигрупп.
4. Расщепление силоксановой связи оксидами металлов
Одним из путей формирования гетеросилоксановой связи является взаимодействие оксидов элементов с полиорганилсилоксанами по схеме:
![]()
Реакции расщепления силоксановой связи под действием некоторых оксидов металлов подробно изучены авторами [8-9]. В качестве полимерных кремнийорганических производных наиболее часто использовались полидиметилсилоксан (ПДМС) и циклический октаметилциклотетрасилоксан (D4).
При расщеплении органосилоксанов кислотами Льюиса [8-9,33] наблюдается перенос галоида металла к атому кремния одновременно сопровождается формированием связи Si-O-M. При взаимодействии органохлорсиланов с оксидом поливалентного металла возможен обратный процесс – перенос атома галогена от кремния к металлу с образованием галоидметаллоорганосилоксанов. Образующийся галоидметаллоорганосилоксан претерпевает межмолекулярную перегруппировку. Ступенчатое протекание перегруппировки приводит к увеличению длины силоксановой цепи через образование циклических и паркетообразных структур.
Позднее было показано, что одним из перспективных методов модифицирования цепи этих полимеров является реакция расщепления связи Si-O-M под действием неорганических и органических производных пятивалентного фосфора [34].
Также исследовались реакции расщепления связи Si-O-Si в силоксанах под действием органических окисей и гидроокисей металлов, при этом получали полимеры, выходы которых были количественные, и были однородными по составу [35].
5. Метод механохимического синтеза
Все большее значение в качестве одного из перспективных методов получения новых соединений приобретает метод механохимического (твердофазного) синтеза. [36-41]
Преимущество механохимического метода синтеза заключается в его экологической частоте, а также в том, что в ряде случаев возможность упрощения технологической схемы процесса. Механообработка реагентов позволяет добиться смешения компонентов реакционной смеси практически на атомарном уровне и исключить использование в подавляющем большинстве случаев органических растворителей в синтезах химических соединений. Это позволяет избежать влияния органических растворителей на состав полученных полимеров и избавиться от проблемы утилизации растворителей, и создать более эффективные в экологическом отношении способы производства элементорганических полимеров и мономеров.
1.2 Некоторые свойства полиметаллоорганосилоксанов
Химические и физические свойства гетеросилоксанов черезвычайно разнообразны. Они зависят как от природы атома металла (его атомного радиуса, электроотрицательности, наличия и характера вакантных орбиталей, неподеленных электронных пар и свободных валентных электронов), так и от окружения атомов кремния и металла, составляющих гетеросилоксановую группировку. Эти факторы определяют распределение электронной плотности (полярность и порядок связей Si-O и O-M) в гетеросилоксановой группировке, а так же ее склонность к координации с нуклеофильными и электрофильными реагентами и к самоассоциации.
Большое влияние на свойства полимеров оказывает структура главных цепей молекул. Введение атомов металла в полимерную цепь может привести, к нарушению циклолинейной структуры силоксановой цепи. Поэтому значительное число работ посвящено изучению строения фрагментов, образование которых сопровождается введением того или иного металла.[1,42-43]
Андрианов предложил следующую структуру основных цепей молекул:
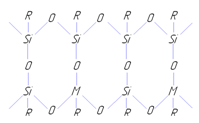
Полимеры состава [(RSiO1.5 )m MOm /2 ] имеют незавершенную циклолинейную структуру и в зависимости от метода получения и условий синтеза способны переходить в нерастворимое состояние [8].
Так как полимеры содержат в своем составе 4-5% гидроксильных групп, то для них была предложена циклоразветвленная структура [12]
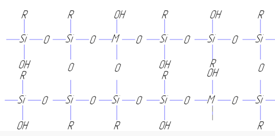
Такая структура хорошо объясняет свойства частиц по форме близкой к сферической, но степень завершенности реакции в исследуемых полимерах выше, чем следует из приведенной выше формулы.
Строение поллиметаллофенилсилоксанов зависит от состава и структуры исходного фенилсиликоната натрия [10].
Более высокая полярность связи O-M в группировках Si-O-M по сравнению с группой Si-O-Si в изоструктурных силоксанах обуславливает повышенную склонность гетеросилоксанов к гетеролитическим (ионным) реакциям, в частности, гидролизу. Когда электроотрицательность кремния и металла резко отличаются, гетеросилоксановая группировка Si-O-Mn гидролитически неустойчива. При действии воды она может либо обратимо диссоциировать на ионы Si-O- и M+ (при n=1 и M – щелочной металл), либо обратимо или необратимо гидролизоваться с первичным образованием фрагментов SiOHHOMn . По мнению авторов [44] механизм гидролиза связи M-O-Si заключается в образовании координационного переходного комплекса между молекулой воды и молекулой гидролизуемого вещества с последующим распадом по схемам:

Важным свойством ПМОС является устойчивость к процессу термоокисления, которая зависит от многих факторов, а именно, от природы органических радикалов, связанных с кремнием, структуры макромолекул и типа металла [45-47]. При изучении устойчивости полимеров типа [(RSiO1.5 )n MOn /2 ]x к действию 10%-ного раствора соляной кислоты было показано, что устойчивость в зависимости от природы металла и радикала у атома кремния уменьшается в ряду:
Ti> AL> SnC6 H5 > C2 H5
Систематическое исследование гидролитической устойчивости полиметаллоорганосилоксанов показало, что устойчивость полимеров возрастает при переходе от линейных структур к циклоразветвленным и сетчатым.
Характер влияния металла зависит от его электронного строения: к р- или d- типу он относится. С увеличением содержания в полимерах p-металлов термоокислительная деструкция ПМФС возрастает, снижаются температуры максимального развития процесса и значения кажущейся энергии активации. У полимеров, содержащих d-металлы, распад характеризуется более высокими значениями указанных величин, причем, наиболее устойчивы соединения с большим содержанием d-металла. В присутствии в цепи типичного комплексообразователя d-метала и с увеличением его содержания возрастает эффект межцепных взаимодействий, приводящих к образованию термически устойчивых надмолекулярных структур. В случае полимеров, содержащих в цепи р-металл, процесс термоокисления определяется основностью металла. Увеличение основности металла приводит к увеличению доли ионности связи во фрагментах Si-O-M, возрастают межцепные взаимодействия электростатической природы, что так же приводит к образованию устойчивых к термоокислению структур [48].
Введение атома металла в силоксановую цепь увеличивает термостойкость полимеров с метильными радикалами и несколько снижает устойчивость полимеров с фенильными радикалами по сравнению с ПОС. уменьшение устойчивости фенильных и метильных радикалов связано с индуктивным влиянием металла, под действием которого вызывается относительное уменьшение поляризации связи кремний – радикал, тогда как в случае метильного радикала полярность связи увеличивается [49].
При изучении термостабильности ПМОС линейного и циклолинейного строения было показано, что основная часть летучих продуктов, как и в случае полиорганосилоксанов составляет гексаметилциклотрисилоксан.
Повышение функциональности и координационной способности металла ведет к увеличению термостойкости, а возрастание основности и уменьшение значения энергии связи металл – кислород вызывает понижение термостойкости ПМОС [50].
2. Методика эксперимента
2 .1 Синтез полифенилсилоксана (ПФС)
В трехгорлую колбу, снабженную механической мешалкой, обратным холодильником и капельной воронкой, помещали 800 мл воды и 400 мл диэтилового эфира. При охлаждении и энергичном перемешивании вводили в реакционную колбу 250 мл (1 моль) фенилтрихлорсилана в 250 мл диэтилового эфира так, чтобы не происходило сильного разогревания реакционной среды, охлаждали колбу льдом. После чего смесь перемешивали еще в течение 2 часов. В делительной воронке отделяли водный слой от эфирного, последний промывали водой до нейтральной реакции по универсальному индикатору и сушили над свежепрокаленным хлористым кальцием. Растворитель отгоняли при 80˚C/10 мм рт.ст., ПФС сушили до постоянного веса. Получили 127г ПФС, что составляет 98,4% от теоретического выхода.
2.2 Синтез мононатровой соли фенилсилантриола
К раствору 20г (0,16моль) ПФС в 83мл ацетона прибавляли 6,2г (0,16 моль) едкого натра и 8,3мл воды. Смесь нагревали на водяной бане при энергичном перемешивании до начала эндотермической реакции, при этом выпадал белый аморфный осадок. По окончании реакции смесь снова нагревалит до кипения и по каплям прибавляли воду до полного растворения осадка.
Раствор охлаждали, выпавший кристаллический осадок мононатриевой соли отфильтровывали на воронке Бюхнера и промывали ацетоном. Полученная соль содержит до 3,5 молекул кристаллизационной воды. Выход 90%.
2.3 Синтез кристаллосольвата фенилсилантриолята натрия с водой (ФСТН)
К раствору 11,6г (0,019моль) полифенилсилоксана в 260 мл смеси толуол – этанол 1:1 прибавили 10,8г (0,27моль) гидроксида натрия и нагревали с обратным холодильником до полного растворения гидроксида натрия. Частично отогнали растворитель (t= 75°C) до начала выпадения белых кристаллов. Кристаллы отделили на фильтре Шотта и сушили до постоянного веса в вакууме при температуре 40°Cи давлении 12 мм.рт.ст. (выход составляет 98,6%).
Исследование взаимодействия мононатриевой соли с вольфрамовой кислотой в растворе.
2.4 Синтез-1а
К раствору 6г (0,046моль) ПФС в 25мл ацетона прибавляли 1,85г (0,046моль) едкого натра и 2,5мл воды. Смесь нагревали на водяной бане при энергичном перемешивании до начала эндотермической реакции, при этом выпадал белый аморфный осадок.
Затем вводили при энергичном перемешивании 7,59г (0,023моль) вольфрамата натрия растворенного в 20 мл воды и 18 мл 0,1н серной кислоты. Синтез вели в течение 2 часов. Нерастворившийся осадок отделяли центрифугированием, высушивали в вакуумном шкафу. Масса осадка составила 2,66г. Из раствора выделены растворимые соединения, которые сушились до постоянного веса. Масса составила 6,72 г. Полученный полимер представлял собой твердое вещество белого цвета (выход 89%).
2.5 Синтез-1б
Синтез вели аналогично синтезу 1-а, масса нерастворимого в воде соединения составила 2,6г. Из раствора выделены растворимые соединения, масса которых составила 6,8 г. Полученный полимер представлял собой твердое вещество белого цвета (выход 89%).
2.6 Синтез-2
Синтез вели аналогично синтезу 1-а, но в гетерогенной среде при перемешивании с добавлением 50 мл этилацетата и 50 мл 0,1н серной кислоты. Разделяли водный и органический слой экстрагированием. Растворимые в органическом слое соединения сушили до постоянного веса, их масса составила 5,79 г. Полученный полимер представлял собой твердое вещество белого цвета.
Водный слой оставляли на некоторое время, отстояться, выпавший в нем осадок центрифугировали, масса осадка составила 1,9 (выход 73%).
2.7 Синтез-3
К раствору 9г (0,046моль) мононатриевой соли в 25мл ацетона прибавляли 1,85г (0,046моль) едкого натра и 2,5мл воды. Смесь нагревали на водяной бане при энергичном перемешивании до начала эндотермической реакции, затем вводили 7,59 г (0,023моль) вольфрамата натрия, растворенного в 20мл воды и 18 мл 0,1н серной кислоты. Синтез вели в течение 2 часов. Из раствора выделены растворимые соединения, которые сушили до постоянного веса. Полученный полимер массой 5,89 г представлял собой твердое вещество белого цвета.
Водный слой оставляли на некоторое время, отстояться, выпавший осадок центрифугировали, масса осадка составила 0,84 г. (выход 70%).
2.8 Синтез – 4
К раствору ФСТН 6г (0,0144моль) в 60мл воды прибавили 7,128г (0,0216моль) вольфрамата натрия при энергичном перемешивании. В соотношении кремния к вольфраму 0,67:1. В раствор постепенно прикапывали 110мл 0,1н серной кислоты (что соответствует содержанию натрия в исходных продуктах). Затем прилили 50 мл хлороформа. Синтез вели в течение 2 часов.
Для выделения целевого соединения раствор экстрагировали хлороформом. Экстракт отделяли от воды путем азеотропной отгонки. Полимер сушили до постоянного веса 20°Cи давлении 12 мм.рт.ст. до постоянного веса. Масса, которого составила 2,03г (44,4%). Не всё количество полимера удалось экстрагировать, поэтому все водорастворимые продукты после экстракции, включая сульфат натрия, были выделены путем удаления воды на роторном вакуумном испарителе. С учетом массы сульфата натрия, количество гетеросилоксана в водорастворимой форме составила 2,27г (49,56%). Суммарный выход составляет 94%.
2.9 Синтез – 5
Синтез – 5 был проведен аналогично четвертому, но с другим соотношением кремния к вольфраму 1:1. К раствору ФСТН 5,5г (0,0183моль) в 60мл воды прибавили 6,04 (0,0274моль) вольфрамата натрия. Как и синтезе 4 была получена растворимая в хлороформе фракция, масса которого составила 2,4г (36,33%). Масса водорастворимой формы с вычетом сульфата натрия составляет 3,7г (56,51%). Суммарный выход 93%.
2.10 Синтез – 6
Данный синтез проводили в тех же условиях, что и предыдущих два, но изменением соотношения кремния к вольфраму (2:1). К раствору ФСТН 6г (0,0144моль) в 60мл воды прибавили 2,376 (0,072моль) вольфрамата натрия. Выделенный продукт из растворимой в хлороформе фракции составил по массе 2,11г (59,8%), а из водорастворимой 1,73 г (32,9%). Суммарный выход 93%.
Анализ мононатровой и тринатровой соли фенилтригидроксисилана.
Навескумононатриевой соли массой 0,2г помещали в коническую колбу прибавляли 25 мл 0,1 н раствора соляной кислоты. Раствор нагревали до кипения и титровали раствором щелочи с точно известным титром. В качестве индикатора использовали метилоранж, переход окраски от розовой в желтую. Процентное содержание натрия рассчитывли по формуле:
 ,
,
а – навеска вещества, г;
ЭNa – эквивалент натрия, г.
Состав анализируемой соли отвечал следующей бруттоформуле [PhSi(OH)2 ONa]*3.5H2 O
Полученный осадок представляет сумму оксидов вольфрама и кремния. Оксид вольфрама от оксида кремния отделили обработкой остатка смесью 5 мл плавиковой кислоты. Реакционную смесь упарили досуха и прокалили до постоянного веса при T = 1000ºC. Данные элементного анализа приведены в таблице.
Элементный анализ на вольфрам проводился на атомно – эмиссионном спектрометре параллельного действия с индуктивно связанной плазмой ICPE – 9000 фирмы Shimadzu.
Предварительно было сделано ощелачивание. К навеске 0,2г анализируемого вещества прибавили 2,5г иодата калия и 20 мл серной кислоты. Анализируемую смесь упарили досуха. После охлаждения добавляем раствор щелочи (3 г гидроксида натрия на 100 мл воды) и кипятили до полного растворения смеси. Разбавление делали 1:2000. Прибор выдал концентрацию в размерности мкг/л.
Гель – проникающая хромотография проводилась на колонке длиной 970 мм с внутренним диаметром 12 мм, заполненной сополимером полистирола и 2% дивинилдибензола, диаметр зерен 0,08 – 0,1мм. Навеску вещества (0,2г) растворяла в 2 мл толуола и пропускала через колонку. Свободный объем колонки – 30 мл. Фракции раствора собирали по 3 мл на предварительно взвешенные часовые стекла. Растворитель сушила при T= 100 – 110ºC, стекла повторно взвешивала. Процент извлечения полимера определяла по привесу.
Колонка предварительно откалибрована веществами с различными молекулярными массами. Элюентом служил толуол, скорость потока составляла 1 мл/мин.
ИК – спектры регистрировались на приборе SPEKTRUM 1000 BX-║KBr и тонком слое.
3. Обсуждение результатов
Ранее было показано, что реакция совместного гидролиза фенилтрихлорсилана с вольфраматом натрия в различных условиях в водно - органических средах не протекает согласно предполагаемой схеме:
2PhSiCl3
+ Na2
WO4
![]() (PhSiO1.5
)2
*WO3
+2NaCl+HCl (1)
(PhSiO1.5
)2
*WO3
+2NaCl+HCl (1)
На первой стадии происходит гидролиз фенилтрихлорсилана с образованием гидроксилпроизводных исходного фенилтрихлорсилана по следующей схеме:
органилсиланолятор расщепление поливольфрамфенилсилоксан ацетоновый

Образующаяся соляная кислота взаимодействует с вольфраматом натрия с образованием соответствующих гидроксилпроизводных вольфрама:
![]()
Затем протекает ряд параллельных и конкурирующих реакций. В дальнейшем может протекать гомоконденсация силанольных групп с образованием фенилсилоксановых фрагментов:

и гомоконденсация образующейся гидроксилпроизводной вольфрама с образованием оксида вольфрама (VI):
![]()
Полученные гетеросилоксаны содержат вольфрам, количество которого не превышает 1%.
Реакции гомоконденсации исходных соединений выводят их из сферы взаимодействия и получения желательных гетеросилоксановых структур, которые могут происходить лишь по схеме:

Необходимо отметить, что вольфрамовая кислота (или гидратированный оксид вольфрама (VI) ) нерастворим в воде и поэтому легко выводится из сферы взаимодействия реагентов. Полученные результаты также указывают на то, что WO3 не может расщеплять силоксановую связь с образованием гетеросилоксановых фрагментов.
Учитывая ранее приведенные схемы и характер вводимых в реакцию соединений, скорость гидролиза фенилтрихлорсилана и гомоконденсации образующихся соединений выше, чем аналогичные превращения приводящие к образованию оксиду вольфрама (VI) по схеме (5), и намного превышает скорость образования гетеросилоксановых фрагментов (7) и (6). Чтобы уравнять скорость гидролиза исходных соединений и снизить долю процессов гомоконденсации образующихся соединений, нами был проведен ряд синтезов с использованием фенилсиликоната натрия (ФСКН):
2(PhSi(O)ONa)*n H2
O + Na2
WO4
![]() (PhSiO1.5
)2
*WO3
(7)
(PhSiO1.5
)2
*WO3
(7)
Исходный ФСКН может быть получен в водно - ацетоновой среде. В определенных условиях возможно его выделение в кристаллическом состоянии. В наших синтезах возможно использование как непосредственно водно – ацетонового раствора ФСКН, так и после его выделения в кристаллическом состоянии с последующим растворением только в воде. Синтез 1 и 2 были проведены в водно - ацетоновой среде.
Нами были проведены предварительные опыты устойчивости водно-ацетоновых систем ФСКН в присутствии дополнительного количества воды, в результате которых было установлено, что образование коллоидного раствора (конус Тиндаля) происходит при прибавлении воды в количестве 50мл на 0,046 моль полифенилсилоксана. Даже половинного количества воды хватает для растворения вольфрамата натрия.
Синтез-1 был проведен в данных условиях с последующим выделением образующихся соединений экстракцией этилацетатом. В результате синтеза образовывались нерастворимые как в воде, так и в этилацетате вещества, которые были отделены центрифугированием. Синтез был проведен дважды, данные синтеза приведены в таблице 1 Ia и Iб.
Синтез-2 отличается тем, что этилацетат сразу прибавляли в реакционную систему. Выделение продуктов проводилось аналогично. Обращает на себя внимание снижение суммарного выхода полигетеросилоксана, а особенно его растворимой части (фактически на 10%). На наш взгляд это связанно с тем, что образующиеся полигетеросилоксаны содержащие фенилсилоксановые блоки уже склонны к растворимости в органических растворителях и поэтому значительную роль начинает играть именно образование силоксановой группировки (по схеме 5), что и препятствует образованию гетеросилоксановых фрагментов.
Синтез-3 был осуществлен с предварительным выделением мононатровой соли фенилсилантриола в условиях аналогичному синтеза-2. Данные приведены в таблице 1. Как видно из приведенных данных они хорошо согласуются с данными синтеза-2, поэтому нет необходимости в предварительном выделении фенилсиликаната натрия в кристаллическом состоянии. И на наш взгляд оптимальными для получения полимеров являются условия синтеза-1. Все выделенные продукты представляют вещества белого цвета. Выделенные из органической части соединения хорошо растворимы в большинстве органических растворителей за исключением предельных углеводородов. Их молекулярная масса ≥ 5000. Нерастворимые в воде фракции всех полученных полимеров растворимы в толуоле только при нагревании.
В ИК - спектрах (рис.) полученных соединений присутствуют полосы поглощения характерные для связи Si - Ph1131см-1 и 1429см-1 ; 1600см-1 скелетные колебания связи С - С в фенильном радикале, триплет в области 3000см-1 - 3100см-1 отвечает колебаниям связи C – H в ароматических системах. В области проявления силоксановой связи 1000-1130 см-1 ик-спектры полученных соединений имеют сложную колебательную структуру, что указывает на неоднородность полученных полимеров по строению. Колебания связи Si – O (W) четко не проявляются и лежат, по-видимому, в той же области.
Устойчивыми в водно – органических средах являются так же тринатровые соли фенилсилантриола (ТНФС). Их использование предполагает получение полигетеросилоксанов с более высоким содержанием вольфрама, кроме того, позволяет варьировать соотношение кремния к вольфраму, так образование силоксановой связи легко протекает по схеме (4).
Нами были проведены синтезы в разных соотношениях кремния к вольфраму с использованием (ТНФС):
x(PhSi(ONa)3
)*mH2
O + Na2
WO4
*2Н2
O![]() [(PhSiO1.5
)x
*WO3
]n
(6)
[(PhSiO1.5
)x
*WO3
]n
(6)
x = 0,67;1; 2
Синтез – 4 был проведен в соотношении кремния к вольфраму 0,67:1. В качестве растворителя использовалась вода. В результате синтеза был получен гомогенный раствор, образование водорастворимых соединений в процессе синтеза не наблюдалось. Учитывая, что оксид вольфрама, который мог бы образоваться по схеме (5), нерастворим в воде, можно предположить, что образовался водорастворимый поливольфрамофенилсилоксан. В результате реакции также образуется сульфат натрия. Для выделения целевых соединений нами была предпринята попытка их экстракция хлороформом. Однако нам не удалось экстрагировать весь полимер. Поэтому все водорастворимые продукты после экстракции, включая сульфат натрия, были выделены удалением воды на роторном вакуумном испарителе. Данные синтеза и элементный анализ продуктов приведены в таблице 1. Данные элементного анализа водорастворимых соединений приведены за вычетом образовавшегося в процессе реакции сульфата натрия.
Последующие синтезы 5 и 6 были проведены в аналогичных условиях. Полученные данные и элементный анализ соединений представлен в таблице 1. Полученные вещества представляют аморфные соединения белого цвета. Выделенные продукты из органической фракции труднорастворимы в большинстве органических растворителей и нерастворимы в предельных углеводородах. Молекулярная масса растворимых в толуоле веществ ≥ 5000.
Водорастворимая часть полученных полимеров содержит как сульфат натрия, так и гетеросилоксан. К сожалению, разделить их не удалось. Попытка экстракции органической составляющей при помощи органических растворителей не привела к положительным результатам. Экстракция полученной смеси с водой в расчете на то, что сульфат натрия экстрагируется, тоже не привела к положительному результату. Полученная смесь растворилась в воде полностью. Интересно отметить, что затем выделенные продукты сохраняют растворимость в воде в течение продолжительного времени. На наш взгляд это связано с тем, что в процессе выделения водорастворимых продуктов произошло образование вольфрамоксидных связей по схеме (5). В процессе экстракции произошло их разрушение и как следствие переход полученных гетеросилоксанов в водорастворимую форму, что совершенно нехарактерно для оксида вольфрама (VI). ИК – спектры полученных соединений (рис.) мало отличаются от ранее описанных. Связь Si – O (W) четко не проявляется, однако область проявления силоксановой связи (1000 – 1100 см-1 ) имеет более сложную колебательную структуру, по сравнению с ранее описанными спектрами, что свидетельствует о более нерегулярном строении полученных полимеров. Нами были проведены исследования некоторых образцов методом рентгенофазового анализа (рис.). Также приведены данные для ПФС и оксида вольфрама (VI). На рис. синтезов 1 и 2 растворимой и нерастворимой фракции видно, что межплоскостные расстояния исходного оксида вольфрама резко изменяются, что уже само по себе говорит об образовании новых соединений отличных от оксида вольфрама. На рентгенограммах растворимых в органических растворителях продуктов (рис.) несколько увеличиваются межцепные расстояния по сравнению с ПФС, но практически не изменяются внутрицепные расстояния, хотя галло внутрицепных расстояний сопровождается вплоть до 4,27Å, что говорит о неоднородности полученных соединений по строению. В нерастворимых фракциях с более высоким соотношением кремния к вольфраму наблюдаются те же межплоскостные расстояния, но с гораздо меньшей интенсивностью. В тоже время они не отвечают и данным рентгенофазового анализа оксида вольфрама (VI), т.е. действительно образуются новые соединения и подтверждают ранее сделанные предварительные выводы. Рентгенограммы синтезов 4 - 6 приведены на рис. Данные рентгенофазового анализа указывают на то, что полимеры, полученные на основе фенилсилантриолята натрия, имеют более регулярное строение, на что указывает незначительная разница в межплоскостных расстояниях как водорастворимых, так и выделенных из хлороформа соединений. В них присутствует лишь межцепные расстояния, которые соответствует 12,4Å, внутрицепные расстояния также остаются неизменными в пределах 4,5Å. Что также согласуется с ранее сделанными выводами.
4. Выводы
1) Разработан метод синтеза поливолфрамфенилсилоксана в степени окисления +6 в водно – органических средах.
2) Показано, что синтез поливольфрамфенилсилоксанов в данных условиях возможен с применением соответствующих фенилсиликонатов натрия.
3) Использование поливольфрамфенилсилоксанов приводит к полимерам более регулярного состава и строения, кроме того, позволяет варьировать соотношения кремния к вольфраму в широких пределах.
5. Список литературы
1 Андрианов, К.А. Технология элементоорганических мономеров и полимеров./ К.А. Андрианов, Л.М. Хананашвили – М. : Химия, 1973. – 400с.
2 Соболевский, М.В. Свойства и области применения кремнийорганических продуктов./ М.В.Соболевский, О.А. Музовская, Г.С. Попелева. – М. : Химия, 1975. – 295с
3 Каталитическая активность магнийорганосилоксанов. И.М. Колесников, Г.М. Панченков, К.А. Андрианов, А.А. Жданов, Н.Н. Белов, М.М. Левицкий : Изв.АН ССР. Сер.хим., 1976. - №6, 473 – 474с.
4 Свидерский, В.А. деструкция и стабилизация полимеров : тезисы докладов 9-ой конференции./ В.А. Свидерский, Н.А. Ткач. – М. : 2001. – 172–173с.
5 Талашкевич, Е.А. Твердофазный синтез полиметаллооргансилоксанов : международная научно – практическая конфренция./ Е.А. Талашкевич, Е.Ю. Гаденко, Л.В. Шевченко. – Находка. : 1999. – 32–33.
6 Андрианов, К.А. Методы элементоорганической химии. Кремний. / К.А. Андрианов. – М : Наука, 1976. – 560с.
7 Жданов, А.А. Новые проблемы в синтезе и изучении свойст полиметаллоорганосилоксанов.: Тез.док. Всерос. Конф. "Кремний органические соединения. Синтез, свойства, применение". / А.А. Жданов. – М : 2000. – 113с.
8 Воронков, М.Г. Гетеросилоксаны. / М.Г. Воронков, Е.А. Малетина, В.К. Роман. – Новосибирск. : Наука, 1984. – 495с.
9 Воронков, М.Г. Силоксановая связь. / М.Г. Воронков, В.П. Милешкевич, Ю.А. Южелевский. – Новосибирск. : Наука, 1976. – 414с.
10 Борисов, С.Н. Кремнеэлементоорганические соединения./ С.Н. Борисов, М.Г. Воронков, Э.Я. Лукевиц. - Л.:.Химия, 1966. – 542с.
11 Талашкевич Е.А. Получение полиметаллорганосилоксанов методом механохимической активации и исследование их свойств : Автореф. Дис. кан. хим. наук. / Е.А. Талашкевич. – Владивосток : 2000. – 28с.
12 Синтез и исследование дикалиевых производных олигодиорганилсилоксан-α, ω-диолов. / Н.П. Шапкин, А.А. Капустина, Н.И. Симанчук, Е.В. Моисеева. – Известия вузов. Химия и хим.техн., 1995. – Т.38, Вып.3. 24-29с.
13 Андрианов, К.А. Синтез некоторых полиметаллоорганосилоксанов и изучение их свойств в зависимости от химического состава и строения : Труды Всесоюзн. Электротехн. Института. / К.А. Андрианов, Э.З. Аснович –1966. – 7-82с.
14 Борисов, С.Н. Полидиметилстанносилоксаны./ С.Н. Борисов, Н.Г. Свиридова, - ВМС, 1961. – т.3.№1. 50-55с.
15 Аснович Э.З. Автореф. Дис. канд. хим. наук. / Э.З. Аснович. – М. : ВЭИ. 1964. – 26с.
16 Андрианов, К.А. V Всесоюзная конференция по химии и применению кремнийорганических соединений : Тезисы докладов./ К.А. Андрианов, М.А. Сипягина, Н.А. Дюдина, Е.Н. Воронина. - М.:.НИИТЭХИМ, 1980. – 237с.
17 Капустина, А.А. Синтез металлоорганосилоксанов : Хим. и хим. образование, сборник науч. Трудов. / А.А. Капустина, Н.П. Шапкин. – 19-20с.
18 Левицкий, М.М. От полисиланов к полиметаллоорганосилоксанам Тез. Докладов 2-й Всероссийский Карг. Симп. / М.М. Левицкий, Б.Г. Завин, А.И. Чернявский. – 2000. – 2-94с.
19 Schmidt, M. Inorg. / M. Schmidt, H. Schmidbaur. – Chem.,1967. – v.9. 149-151p.
20 Барашенков, Г.Г. полиметаллодифенилсилоксаны./ Г.Г. Барашенков, Н.Я. Деркач. – ЖОХ, 1978. – Т.48, вып.5, 1110-1113с.
21 Шапкин, Н.П. Синтез трициклического молибден (VI) фенилсилоксана./ Н.П. Шапкин, С.В. Гардионов. // Хим. и хим. образование, сборник науч. трудов. – 2002. – 338-339с.
22 Левицкий, М.М. Металлоорганосилоксаны и металлосиликаты. Аналоги в особенностях формирования структуры. / М.М. Левицкий, Б.Г. Завин, А.Н. Биляченко.// Хим. и хим. образование, сборник науч. трудов. – 24-25с.
23 Аликовкий, А.В. Синтез поливольфрамафенилсилоксана, содержащего металл в высшей степени окисления. 4-й международный симпозиум./ А.В. Аликовский, С.Г. Красицкая, М.И. Баланов, М.В.Щеблыкина.// Хим. и хим.образование, сборник науч. трудов. – 24-25с.
24 Жданов, А.А. Синтез и исследование свойств полиметаллоорганосилоксанов. / А.А. Жданов, К.А. Андрианов, М.М. Левицкий.// ВМС. – 1976. – т.18. №10. 2264-2269с.
25 Шапкин, Н.П. Дис. канд.хим.наук./ Н.П. Шапкин. – Владивосток, 1971. – 155с.
26 Щеголихина, Н.А. Дис. канд.хим.наук./ Н.А. Щеголихина. – Иркутск, 1981. – 122с.
27 Шапкина, В.Я. Дис. канд.хим.наук./ В.Я. Шапкина. – Владивосток, 1983. – 146с.
28 Андрианов, К.А. Синтез полиферроорганосилоксанов и полиферроалюмоорганосилоксанов./ К.А. Андрианов, Т.Н. Ганина, Н.Н. Соколов.// ВМС. – 1962. – т.4.№5.678-682с.
29 Жданов, А.А.Исследование в области полиэлементоорганосилоксанов: Дис. докт.хим.наук./ А.А. Жданов.. – Москва. ИНЭОС. 1983. – 146с.
30 Жданов, А.А. Особенности синтеза металлосилоксанов каркасной структуры./ А.А. Жданов, О.И. Щеголихина, Ю.А. Молодцова. // Изв.АН РФ. Сер. хим. – 1993. - №5. 957-961с.
31 Воронков, М.Г. Новый способ получения полиметаллофенилсилоксанов. / М.Г. Воронков, А.В. Аликовский, Г.Я. Золотарь.// Докл. АН СССР. – 1985. – т.281.№4. 858-860с.
32 Жданов А.А. Новый метод синтеза каркасных и полимерных металлосилоксанов. / А.А. Жданов, Н.В. Сергиенко, Е.С. Транкина. // Изв. АН РФ, сер. хим. – 1998. - №12. 2530-2532с.
33 Завин, Б.Г. Темплантный синтез полиорганосилоксанов на основе галогенметаллосилоксанов./ Б.Г. Завин, А.Ю. Рабкина, В.С. Папков, М.М. Левицкий, Л.И. Кутейникова. // Всерос. Симпозиум, посвященный 80-летию академика Воронкова: Тез. Док. Иркутск, 2001. – 21с.
34 Шапкин, Н.П. Исследование взаимодействия натриевых солей дибутилфосфиновой кислоты и фенилсиликоната с хлоридами некоторых d - металлов. / Н.П. Шапкин, А.В. Аликовский, В.Я. Шапкина. //ЖОХ. – 1987. – т.57, вып.2. 107-110с.
35 Аликовский, А.В. О взаимодействии алкилокисей олова с полиорганилсилсесквиоксанами / А.В. Аликовский, Е.Т. Данько, Г.Я. Золотарь. // Изв. вузов. Химия и хим.техн. – 2001. – т.44. вып.1. 66-69с.
36 Шапкин, Н.П. Влияние механохимической активации на синтез полиметаллорганосилоксан / Н.П. Шапкин, А.А. Капустина, Е.А. Талашкевич// ЖНХ – 2000. – т.45. №4. 675-678с.
37 Типикин, Д.С. Примеры механохимической стабилизации интермедиатов химических реакций. // Ж. Физ.химии. – 2002. – т.76. №3. 518-520с.
38 Капустина, А.А. Возможность синтеза полигермано- и полиоловоорганосилоксанов в условиях механохимической активации. / А.А. Капустина, Н.П. Шапкин, Е.Б. Иванова, А.А. Ляхина // ЖОХ. – 2005. – т.75. вып.4. 610-614с.
39 Капустина, А.А. Синтез полидиалкилоловоорганосилоксанов методом механохимической активации./ А.А. Капустина, Н.П. Шапкин, С.В. Вернер.// Изв.вузов. химия и хим техн. – 2004. – т.47. вып.7. 45-50с.
40 Капустина, А.А. Синтез полиметаллофенилсилоксанов методом механохимической активации. / А.А. Капустина, Н.П. Шапкин, Н.И. Гаврилова, Е.Б. Иванова.// Международный симпозиум "петербургские встречи". – С-Пб .: тезисы докладов, 2002. – 350с.
41 Талашкевич, Е.А. Синтез полиферро- и полихромдиметилсилоксанов на основе 1,7- дикалийоксиоктаметилтетрасилоксана в условиях мехаохимической активации. / Е.А. Талашкевич, Н.П. Шапкин, А.А. Капустина// Изв.вузов. химия и хим.техн., 2004. т.47. вып.4. 93-96с.
42 Жданов, А.А. Элементоорганические металлосодержащие парамагнитные и ферромагнитные полимеры. Сообщение 1. Полиферро- и поликобальтсилоксаны, структура и магнитные свойства. / А.А. Жданов, М.М. Левицкий, О.И. Щеголихина, А.Д. Колбановский, Р.А. Стукан, А.Г. Книжник, А.Л. Бучаченко.// Изв. АН СССР. Сер.хим., 1990. – 2512-2518с.
43 Жданов, А.А. Элементоорганические металлосодержащие парамагнитные и ферромагнитные полимеры. Сообщение 3. Магнитные свойства продуктов термической конденсации полиметаллоорганосилоксанов. / А.А. Жданов, А.Л. Бучаченко, О.И. Щеголихина, М.М. Левицкий. // Изв. АН СССР. Сер.хим.,1991. – 778-781с.
44 Андрианов, К.А. Полиорганоалюмосилоксаны./ К.А. Андрианов, Т.Н. Ганина. // Изв. АН СССР. Отд.хим.наук.,2004. – т.47. вып.4. 93-96с.
45 Верхотин, М.А. Термическая деструкция некоторых полиметаллорганосилоксанов. / М.А. Верхотин, К.А. Андрианов, А.А. Жданов, Н.А. Курашева, С.Р. Рафиков, В.В. Роде.// ВМС., 1976. – т.8, №7. 1226-1230с.
46 Аликовский, А.В. Синтез и исследование полиметаллофенилсилоксанов на основе фенилсилантриолята натрия. / А.В. Аликовский, В.И. Бессонова, Г.Я. Золотарь, С.Г. Краситская. // Изв.Вузов. химия и хим.тех., 1999. – т.42.№4. 107-110с.
47 Аликовский, А.В. Термоокислительная деструкция полиметаллофенилсилоксанов. / А.В. Аликовский, В.И. Бессонова, С.Г. Краситская. // Изв.Вузов. химия и хим.тех., 1993. – т.36. вып.9. 58-60с.
48 Шапкин, Н.П. Полигетеросилоксаны. Химия: строение и свойства./ Н.П. Шапкин, В.И. Бессонова, Г.Я. Золотарь, А.В. Аликовский, С.Г. Краситская, Е.Т. Данько. // Бутлеровские сообщения., 2006. – т.9. №4. 49-59с.
49 Щеблыкина, М.В. Исследование возможности синтеза полиметаллофенилсилоксанов, содержащих металлы в высшей степени окисления.// дипломная работа, 2007. 20с.
50 Жинкин, Л.Н. Поли-бис(8-хинолинокси)-титанооксиметил-фенилсилоксаны / Л.Н. Жинкин, В.В. Северский, Т.Ф. Алтухова.// Пластмассы, 1969. - №1. 26-29с.
Приложение
ИК-спектр нерастворимого вещества синтеза 1а
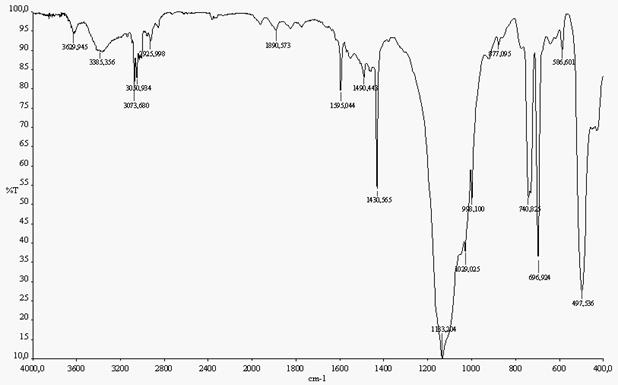
ИК-спектр органического слоя синтеза 1б
