| Скачать .docx |
Курсовая работа: Получение алкилсиланов взаимодействием металлоорганических соединений с алкилхлорсиланами
министерство образования республики беларусь
Белорусский государственный университет
Химический факультет
Курсовая работа
ПОЛУЧЕНИЕ АЛКИЛСИЛАНОВ ВЗАИМОДЕЙСТВИЕМ МЕТАЛЛООРГАНИЧЕСКИХ СОЕДИНЕНИЙ С АЛКИЛХЛОРСИЛАНАМИ
Исполнитель
студентка 2 курса 6 группы
Шпилевская А.Л
Минск 2010г.
Введение
Технический прогресс в значительной степени зависит от использования новых материалов и технологий. Поэтому в последнее время в промышленно развитых странах стали уделять все больше внимания композиционным материалам, получаемым из алкилсиланов: кремнийкарбидной высокотемпературной керамике, SiC покрытиям, C-SiC композитам различных модификаций. Такие материалы находят применение в космической, атомной, авиационной, электронной промышленности и точном машиностроении.
Алкилсиланы, по сравнению с алкилгалогенсиланами, дают возможность получения не содержащих галогена чистых SiC материалов, не загрязняют атмосферу галогенсодержащими выбросами при получении карбида кремния и композитов на его основе, позволяют использовать оборудование из обычных не коррозионностойких материалов при работе с ними и при их термическом разложении. Кроме того, алкилсиланы устойчивы даже в атмосфере влажного воздуха, не взаимодействуют с водой и существенно менее токсичны.
1. Свойства алкилсиланов
В настоящей работе рассматриваются алкилсиланы, содержащие хотя бы одну связь Si-H. Они имеют общую формулу:
Alk4.n SiHn где AIk=CH3 , С2 Н5 , С3 Н7 , С4 Н9 и т.п., п=1-3.
Химические свойства алкилсиланов обусловлены наличием реакционной связи Si-H, тогда как связь между кремнием и углеродом в этих соединениях можно назвать инертной. Гидролиз алкил(гидро)силанов (АГС) в кислой среде протекает медленно, а в щелочной быстро.
Алкилсиланы по связи Si-H реагируют с органическими кислотами, спиртами, аммиаком, аминами, фосфинами, галогенами и т.п. Спирты расщепляют эту связь в присутствии алкоголятов, амины - в присутствии амидов щелочных металлов.
Характерной реакцией связи Si-H так же является присоединение по двойной связи С=С, - гидросилилирование.
Алкилсиланы являются восстановителями. Они восстанавливают концентрированную серную и азотную кислоты, перманганат калия, многие соли и оксиды переходных металлов (ртути, меди)
Реакционная способность рассматриваемых веществ в химических реакциях изменяется в соответсвии с приведенным ниже рядом:
RSiH3 >R2 SiH2 >R3 SiH
Низшие алкилсиланы, такие как метилсилан, диметилсилан, этилсилан при комнатной температуре являются газами, а диэтилсилан - уже жидкостью. При воздействии на организм человека они не токсичны, при контакте с кожным покровом не вызывают ожогов, не раздражают верхние дыхательные пути.
2. Способы получения алкилсиланов
В литературе описаны многочисленные способы получения алкилсиланов. Наиболее важными являются следующие:
· взаимодействие металлоорганических соединений с алкилхлорсиланами;
· взаимодействие гидридов металлов с алкилхлорсиланами;
· каталитическое диспропорционирование соединений, содержащих алкилгидридсилановый фрагмент;
· гидрирование алкилхлорсиланов и тетраалкилсиланов.
2.1 Получение алкилсиланов взаимодействием металлоорганических соединений с алкилхлорсиланами
Впервые о получении алкилсиланов сообщили A.Stok и C.Somieski в 1919 году. Они заявили о «возможности взаимодействия паров хлорсиланов с парами алкилметаллов. При комнатной температуре в присутствии метилцинка были получены самые простые производные. Они спонтанно не воспламеняются, имеют слабый тяжело-сладковатый запах и свойства, средние между SiRi и СН4 .
RMcGregor предложил синтезировать метилсилан (МС) взаимодействием монохлорсилана с диметилцинком по реакции:
2SiH3 Cl + Zn(CH3 )2 —> 2SiH3 (CH3 ) + ZnCl2
а также рассмотрел возможность получения метилсилана с использованием алюмогидрида лития, но при этом отметил, что способ является неприемлемым в настоящее время из-за высокой стоимости алюмогидрида лития.
Широко используемый в синтезе алкилсиланов метод Гриньяра в случае алкилирования алкил(гидро)хлорсиланов общей формулы Rcln SiH3 *n (п=1,2) иногда затрагивает связи Si-H.
Н.Н. Корнеев с сотрудниками применили вместо Mg-органических реагентов А1-органические:
nR2 AlH + R'SiH3 .n R"n —>nR2 AlR + R'SiH3
где n=2,3 R=C2 H5 ,1-С4 Н9 ; R'=CH3 , C2 H5 ;
R"=Cl,OCH3 ,OC2 H5 .
Так, диизобутилалюминийгидрид взаимодействует с метилдихлорсиланом в присутствии хлорида алюминия и триалкилалюминия с образованием метилсилана:
2(iBu)2 AlH + CH3 SiHCl2 —> CH3 SiH3 + 2(Bu)2 AlCl
Синтез осуществляли следующим образом: в реактор с мешалкой загружали последовательно технический диалкилалюминиигидрид и хлорид алюминия. Суспензию перемешивали в течение 1,5-2 часов и затем дозировали в реактор алкилхлорсилан или алкилалкоксисилан, при этом поддерживали температуру реакционной массы в интервале 30-40С. Продукт, образовавшийся в процессе реакции конденсировали в ловушке, охлаждаемой жидким азотом, затем переконденсацией собирали во вторую ловушку, также охлаждаемую жидким азотом и определяли массу сконденсировавшегося алкилсилана. Данных по качеству полученного алкилсилана не приводится. При взаимодействии метилдиэтоксисилана с диизобутилалюминийгидридом, взятым в 10% мольном избытке, в присутствии большого избытка триизобутилалюминия и 20% мольной добавки хлорида алюминия максимальный выход метилсилана достигал 96%. Однако данные по чистоте продукта не приводятся.
В американском патенте был предложен подобный способ получения метилсилана, однако авторам не удалось синтезировать продукт с выходом более 85%.
Необходимо отметить, что все рассмотренные выше способы получения алкилсиланов взаимодействием алкильных производных металлов с хлор(гидро)силанами являются пожаро-взрывоопасными, зачастую многостадийными. Во всех случаях образуются опасные отходы.
2.2 Получение алкилсиланов взаимодействием гидридов металлов с алкилхлорсиланами
A.Finholt, A.Bond, K.Wilzbach, H.Schlesinger описали способ получения алкильных и арильных производных кремния взаимодействием алюмогидрида лития (LiAlH4 ) с соответствующими алкильными или арильными хлорсиланами. Ими были синтезированы этилсилан, диэтилсилан, н-пропилсилан, ди(н-пропил)силан, н-бутилсилан, а также моносилан и дисилан. Сравнительные эксперименты по применению LiAlR4 и гидрида лития для превращения тетрахлорида кремния в моносилан показали, что в случае LiAlF4 реакция (4) протекает в диэтиловом эфире уже при температуре 0С с количественным выходом моносилана.
LiAlH4 + SiCl4 —> SiR· + АІСІз + LiCl
С выходом 87% в диэтиловом эфире из гексахлордисилана при 15% избытке ЛАГ был получен дисилан Si2 H6 .
Взаимодействие гидрида лития с тетрахлоридом кремния в диэтиловом эфире проходит по следующей реакции:
LiAlН4 + SiCl4 —> SiH4 + 4LiCl
При этом наибольший выход моносилана (89%) достигнут при большом избытке гидрида лития. Процесс при этом протекает с более низким выходом при сравнении с использованием LiAlН4 , что объясняется гетерогенностью процесса.
Диэтилсилан синтезировали из диэтилдихлорсилана и гидрида лития в диоксане при кипячении реакционной массы в течение нескольких часов. Выход целевого продукта составил около 66%. При замене гидрида лития на гидрид натрия диэтилсилан не выделялся даже при продолжительном кипячении реакционной массы, лишь добавление хлорида алюминия позволило получить диэтилсилан в этом процессе с выходом около 25%. Эти же авторы синтезировали диэтилсилан из диэтилдихлорсилана и алюмогидрида лития, но не привели данных по выходу целевого продукта.
Для исследования зависимости давления насыщенного пара метилсилана от температуры R. Shade и G.Cooper использовали метилсилан, полученный взаимодействием метилтрихлорсилана с алюмогидридом лития в среде н-дибутилового эфира:
CH3 SiCl3 + LiAIH4 ==> CH3 SiH3 + LiCl+AlCl3
Однако проведенный хроматографический анализ такого метилсилана показал, что в нем содержатся примеси не только исходного метилтрихлорсилана, но и метилдихлорсилана, диметилсилана и триметилсилана. Наличие этих примесей напрямую указывает на недостаточное количество гидрида, а также на низкое качество исходного алкилхлорсилана.
Авторы работы для превращения алкенилхлорсиланов в алкенилсиланы вместо LiAlH4 использовали гидрид лития, так как в случае алюмогидрида лития, образующийся в процессе хлорид алюминия приводил к полимеризации непредельных алкенильных групп. Аллилсилан был получен с выходом 37% из аллилтрихлорсилана и гидрида лития в диизоамиловом эфире при кипячении реакционной массы в течение двух дней.
В аналогичных условиях из диаллилдихлорсилана и гидрида лития был синтезирован диаллилсилан с таким же выходом - 37%.
С использованием суспензии гидрида лития в диизоамиловом эфире и гексилтрихлорсилана или диэтилдиэтоксисилана были получены гексилсилан и диэтилсилан с выходами 65% и 25% соответственно, а из дипропилдихлорсилана, в тех же условиях, был получен дипропилсилан с 37% выходом.
В работе описан способ получения метилсилана в тетрагидрофуране взаимодействием метилтрихлорсилана с гидридом натрия и гексагидроалюминатом натрия. Реакция описывается уравнением:
3CH3 SiCl3 + Na3 AlH6 + NaH —> 3CH3 SiH3 + 6NaCl + AlCl3
Синтез осуществляли стандартным методом. При этом в колбу с обратным холодильником, капельной воронкой, термометром и магнитной мешалкой, продутую сухим аргоном, загружали Na3 AlH6 с NaH и тетрагидрофуран. Затем из капельной воронки постепенно добавляли CH3 SiCI3 .
Реакция протекла с сильным разогревом, температура поднималась до 50-60С. Выделявшийся газ проходил через обратный холодильник и систему ловушек, охлаждаемых жидким азотом. Выход продукта по данным авторов составил 97%.
В работе приведен способ получения н-гептилсилана из н-гептилтрихлорсилана и алюмогидрида лития с выходом около 80%:
C7 H15 SiCl3 + LiAlH4 —> C7 H15 SiH3 + LiCl + AlCl3
В данном случае гептилтрихлорсилан прибавляли в течение 1 часа к раствору алюмогидрида лития в диэтиловом эфире, и затем реакционную смесь нагревали в течение 2 часов. Затем её обрабатывали разбавленной соляной кислотой, органический слой промывали водой, сушили. Фракционной перегонкой был выделен н-гептилсилан с температурой кипения 140,7С.
Взаимодействием метилтрихлорсилана с гидридом натрия при 250С получили метилсилан в соответствии со следующей реакцией:
CH3 SiCl3 + 3NaH —> CH3 SiH3 + 3NaCl
При этом пары метилтрихлорсилана пропускали через суспензию мелко раздробленного гидрида натрия в минеральном масле, находящуюся в цилиндрическом реакторе, снабженным скоростной мешалкой (1800 об/мин) и электрообогревом. Основным продуктом реакции в этом случае является метилсилан (93%) с примесями метилхлорсилана (3,5%) и метилдихлорсилана (3,5%).
Попытка получения алкил(гидро)силанов по реакции Вюрца, как правило, приводила лишь к незначительному выходу продукта.
3RCl + SiHCl3 +6Na —> HSiR3 + 6NaCl
2.3 Получение алкилсиланов каталитическим диспропорционированием соединений, содержащих алкилгидридсилановый фрагмент
Ранние примеры реакций диспропорционирования кремнийорганических соединений, приводящих к АГС, обобщены в известных работа.
Для получения алкилсиланов E.Zichy применил реакцию, известную в химии углеводородов, некоторые из которых при нагреве выше 100С и контакте с раствором, содержащим низший спирт и металлический калий в количестве не менее 10%, расщепляются на соединения с меньшей молекулярной массой. Таким способом за счет миграции атомов водорода между атомами кремния некоторых силоксанов под воздействием щелочного металла можно получить алкилсиланы, например:
(R2 HSiO)2 SiHR —> H3 RSi + H2 R2 Si + (RSiO 5 )x
где R=СНз Реакцию проводили в атмосфере сухого аргона в среде тетрагидрофурана, содержащего исходный силоксан и металлический калий.
В американском патенте Ottlinger и др. разработали метод получения метилсилана диспропорционированием метилдихлорсилана (CH3 SiHCl2 ) в присутствии катализаторов - нерастворимых в реакционной среде соединений, содержащих функциональные группы NR2 или NRX, где R- одинаковые или разные алкильные, арильные или алициклические группы, которые могут содержать гетероатомы в своем кольце, X - хлорид, бромид или йодид ион. В этом случае реакция проходит по уравнению:
3CH3 SiHCl2 —> CH3 SiH3 + 2CH3 SiCl3
Для осуществления процесса предварительно готовили катализаторы двух типов. Подготовка катализатора (тип А) проходила следующим образом: стеклянные кольца Рашига (внешний диаметр 6 мм и 6 мм высота) были покрыты ионообменной смолой (Lewatit MP 35 производства компании Bayer AG, Leverkusen, FRG) путем погружения колец в раствор смолы с отвердителем. Затем их вынимали из раствора и полностью выпаривали растворитель.
Другой катализатор (тип Б) готовили из сферических частиц кремния диаметром 4-6 мм путем их погружения на несколько часов в раствор N,N -диэтиламинопропилтриэтоксисилана во влажном толуоле. Смесь фильтровали для отделения толуола и сушили при температуре 100ºС в вакуум-сушильном шкафу.
Диспропорционирование CH3 SiHCl2 вели в аппарате колонного типа, который был изготовлен из стали и состоял из трех последовательно связанных между собой частей. Общая высота аппарата составляла 2,5 м, а внутренний диаметр 50 мм. Верхняя часть колонны была снабжена холодильником, а также дополнительным оборудованием, необходимым для удаления целевого продукта в накопитель. Метилдихлорсилан с помощью дозирующего насоса непрерывно поступал из емкости для хранения CH3 SiHCl2 в испаритель аппарата. Из испарителя, находящегося в укрепляющей части колонны, при давлении 20 бар газ вводился в нижнюю часть колонны, наполненную катализатором типа А (кольцами Рашига ), затем поступал во вторую часть колонны, заполненную функциональным катализатором типаБ, где происходило разделение реакционной массы. Высококипящий метилтрихлорсилан стекал в нижнюю часть аппарата. Его собирали в сосуде под давлением после вывода из испарителя с помощью дозирующего насоса. Низкокипящие компоненты поднимались в третью часть колонны, наполненную катализатором типа А. Затем смесь паров конденсировалась в установленном в верхней части колонного аппарата холодильнике, и конденсат направлялся в аппарат для дистилляции. После охлаждения продукт собирали в баллоны.
Методом газовой хроматографии в метилсилане было обнаружено значительное количество разнообразных примесей, в том числе метилхлорсилан - 5% и метилдихлорсилан -1%.
S.Xin, C.Aitken, J. Harrod и др. предложили способ получения метилсилана каталитическим диспропорционированием метилдиэтоксисилана в присутствии диметилтитаноцена, протекающий по уравнению:
3MeSiH(OEt)2 —> MeSiH3 + 2MeSi(OEt)3
Процесс проводили следующим образом: метилдиэтоксисилан загружали в реактор, предварительно продутый сухим аргоном, а затем добавляли диметилтитаноцен. Реактор нагревали до 50ºС и выделяющийся газ собирали в приемник, охлаждаемый жидким азотом. Через 30 минут реакция прекращалась, а конденсат дважды перегоняли путем нагрева приемника до температуры -10ºС и последующей конденсацией газа в новом приемнике при температуре кипения жидкого азота. Полученный дистиллят по результатам анализа представлял собой метилсилан. Выход продукта составил 87%.
Е.Н. Лебедев, Н.Н. Корнеев и др. предложили способ получения метилсилана диспропорционированием метилдиэтоксисилана в присутствии катализатора в соответствии с уравнением.
Реакцию проводили при температуре от -5ºС до +40ºС и времени пребывания реакционной массы 0,5-10 час. При непрерывном режиме осуществлялась подача метилдиэтоксисилана и раствора катализатора. В качестве катализатора использовали этилат или метилдиэтоксисиланолят натрия или калия в виде растворов в метилтриэтоксисилане с концентрацией 1-3%.
Так, в реактор, снабженный обратным холодильником, мешалкой, датчиком контроля температуры и предварительно продутый сухим аргоном, из двух расходных емкостей одновременно подавали 2% раствор этилата натрия (5,4 г) и метилдиэтоксисилан (50 г). Процесс проводили при комнатной температуре в течение часа. После десорбции растворенного в жидких продуктах реакции метилсилана и конденсации его в сборнике выход целевого продукта составил около 93%.
Анализируя процессы каталитического диспропорционирования кремнийорганических эфиров необходимо отметить, что выход целевого продукта составляет менее 10% от количества исходного реагента, а на 1 кг продукта образуется 8-10 кг побочных кремнийсодержащих соединений, требующих утилизации. В случае применения алкил(гидро)галогенсиланов целевой продукт в значительной степени загрязнен побочными продуктами диспропорционирования.
2.4 Получение алкилсиланов гидрированием алкилхлорсиланов и тетраалкилсиланов
В одном из патентов описан процесс замещения атомов хлора в алкилхлорсиланах на водород. Приведены экспериментальные примеры, в частности, пары метилтрихлорсилана вместе с водородом пропускали через смесь алюминиевых гранул с медным порошком при температуре около 400ºС. Продукты реакции представляли собой жидкость с плотностью, отличающейся от плотности исходного реагента.
При пропускании паров тетрахлорида кремния с водородом (соотношение 1:1) через алюминиевые гранулы при температуре 400ºС и конденсации выходящего газа в ловушке с сухим льдом получили смесь продуктов: 3-5% дихлорсилана, 25% трихлорсилана и исходный тетрахлорид кремния. Моносилан, образовавшийся в ходе гидрирования, не был сконденсирован в ловушке с сухим льдом.
Гидрированием тетраэтилсилана с использованием алюмосиликатных катализаторов при температуре 550ºС получили триэтилсилан с выходом 32%.
Вышеприведенные примеры демонстрируют низкую эффективность таких способов получения алкилсиланов.
2.5 Получение алкилсиланов взаимодействием гидридсилана и олефина в присутствии катализатора
В 2003 году стал известен способ получения алкилсиланов путем взаимодействия гидридсилана и олефина в присутствии платиносодержащего катализатора (КТ) при повышенной температуре и перемешивании с последующим выделением целевого продукта отличающийся тем, что КТ и полностью или частично гидридсилан смешивают при 20°С, полученную смесь нагревают, после чего выдерживают в течение >0,5 ч без дополнительного нагрева и вводят оставшуюся часть реагентов.
SiH4 + CH2 =CH2 → Si(C2 H5 )4
Целевой продукт выделяют вакуумной перегонкой. Выход целевого продукта составляет 95-99%. Процесс проводят при эквимолярном соотношении олефина и гидридсилана или при небольшом избытке одного из реагентов. КТ вводят в количестве, исходя из мольного соотношения олефин: платина, равного 1(10-7 -10-4 ). Предложенный способ дает возможность проводить процесс гидросилирования в легко контролируемом режиме, используя общедоступные платиновые КТ и олефины с низкой реакционной способностью, позволяя при этом получать алкилсиланы с высокими выходами. Кроме того данный способ позволяет вводить в реакцию гидросилирования в жидкой фазе те олефины, которые при нормальных условиях находятся в газообразном состоянии, без "пневматического удара" (резкого повышения давления за короткий промежуток времени), используя стандартную аппаратуру низкого давления (р<5 атм) без продувки азотом и создания инертной атмосферы что значительно но упрощает и удешевляет технологический процесс.
3. Применение алкилсиланов
В отличие от моносилана, алкилсиланы не взрываются и самопроизвольно не возгораются на воздухе, тем самым обеспечивая значительно более высокую пожаро - взрывобезопасность при проведении работ.
Открытие К.А.Андриановым в 1937 году способности алкил- и арилалксисиланов при гидролизе превращаться в полимерные кремнийорганические соединения привело к получению принципиально новых соединений, имеющих весьма отдаленную аналогию с природными полимерами.
Большая перспективность использования органических соединений кремния в технике была отмечена еще в 1923 году Б.А. Долговым.
Композиционные материалы с карбидокремниевой матрицей, полученные из алкилсиланов, перспективны для использования в теплонагруженных узлах изделий ракетно-космической техники (насадков радиационного охлаждения, неохлаждаемых сопловых насадков, камер сгорания ЖРД и т.д.).
Ряд разработанных покрытий на основе SiC, полученного разложением высокочистого метилсилана, использован в США для покрытия карбидом кремния сопловых блоков и разгонных блоков космических аппаратов.
Материалы, полученные из алкилсиланов газофазным осаждением, отличаются превосходными свойствами при использовании в качестве высокотемпературных резисторов в электронных схемах и как материалов оптических устройств. Благодаря высокой термостойкости эти материалы находят применение в микроэлектронных и микроэлектромеханических высокочастотных устройствах, например радарах.
Из метальных производных силанов путем плазмо-обменного (PECVD) или озон-совмещенного химического разложения паров также получают содержащие водород оксикремнийкарбидные пленки (H:SiOC) с низкой диэлектрической постоянной. Такие пленки находят применение в производстве полупроводниковых устройств и имеют диэлектрическую постоянную, равную 3,6 или менее.
Проводятся всесторонние исследования применения алкилсиланов в многочисленных направлениях науки и техники, например для низкотемпературного эпитаксиального покрытия кубическим карбидом кремния субмикронных изделий, а также нанесения тонких фоточувствительных пленок, изучения пленок C-SiC методом электронного циклотронного резонанса, нанесения диэлектрических покрытий и так далее.
Таким образом, алкилсиланы являются перспективными химическими материалами, необходимыми для создания высококачественных карбидокремниевых керамических материалов и покрытий с высокими показателями по окислительной и коррозионной стойкости, сохраняющими эксплуатационные свойства при высоких температурах в течение длительного времени.
Алкилсиланы зарубежного производства очень дороги. Стоимость чистых метилсиланов производства корпорации "Dow Corning" США находится на уровне 4000 долларов за 1кг. В США эти продукты производятся только для нужд космической промышленности и микроэлектроники. В Европе технология этих соединений не освоена и их промышленный выпуск отсутствует.
В качестве субстратов хроматографических колонок предложено использовать триалкилсиланы, включающие С1 —10 -углеводородную цепь, на одном конце которой находится триалкилсилановая группа с≥2 алкильными группами и на другом — силил, содержащий гидролизуемую группу, связанную с Si-атомом силила. По крайней мере одна из алкильных групп триалкилсилана может быть замещена галогеном или перфторалкилом.
Силановые добавки могут частично или полностью заменить применяемые диалкилдитиофосфаты цинка.
Композиция (КМ) для изготовления зубных слепков, содержит отверждающееся соединение, сшивающий агент, КТ, ненасыщеный силан формулы R2 (R3 )С=С(R1 )АSiR3 , ингибитор отверждения и др. добавки (пигменты, загустители, ПАВ и т д.). Наличие силана в КМ позволяет снизить количество выделяющегося H2 .
Теоретически исследовано влияние температуры и длины алкильных цепей на селективность НФ для хиральных разделений в ВЭЖХ с обращенными фазами на основе модифицированных алкилсиланами полимерных или мономерных частиц Показано, что при использовании длинных цепочек (с 30 атомами С), может быть достигнута большая упорядоченность НФ, в меньшей степени зависящая от химического связывания, температуры, площади ПВ полимерной подложки Длинноцепочечные алкилсиланы могут быть перспективны при разрботке НФ для разделений изомерных ВМС, например, каротиноидов.
Алкилсиланы, по сравнению с алкилхлорсиланами, предпочтительны в технологическом отношении при получении SiC покрытий, так как дают возможность получать высококачественную свободную от примесей хлора карбидокремниевую керамику и обеспечить экологическую безопасность производства.
Изменяя строение кремнийорганических полимеров и варьируя в них соотношение кремния, кислорода и углерода, удалось получить продукты с разнообразными свойствами. По строению полимерных цепей различают несколько типов кремнийорганических полимеров.
Так же мало устойчивы и очень реакционноспособны хлорпроизводные силанов: хлорсилан SiH3 Cl, трихлорсилан SiHCl3 (силанохлороформ), четыреххлористый кремний SiCl4. Все эти вещества энергично гидролизуются с водой. Так, с цинк- и магнийорганическими соединениями они дают кремнийорганические соединения – алкилсиланы:
C2 H5 MgBr+СlSiH3 → C2 H5 SiH3
SiCl4 + CH 3 MgJ > CH3 -SiCl3 + CH 3 MgJ > (CH3 )2 -SiCl2 + CH 3 MgJ > (CH3 )4 Si
Практически вместо магнийгалоизоорганических соединений применяют галоидный алкил и магний:
SiCl4 +C 2 H 5 Br+Mg > C2 H5 -SiCl3 +C 2 H 5 Br+Mg (CH3 )2 -SiCl2
Более устойчивыми являются алкилсиланы, в которых нет атомов водорода при кремнии, - тетраалкилсиланы.
Кремнийорганические соединения получили разнообразное техническое применение. Они придают материалам гидрофобность (стеклу, керамике, бетону, текстилю), образуют на поверхности самых различных материалов пленки, отталкивающие воду. Так, диметилдихлорсилан, адсорбированный на поверхности керамического материала, при гидролизе водой образует пленку толщиной 1,9-10-5 см, состоящую примерно из 300 молекул. Причина гидрофобности заключается в ориентации молекул кремнийорганического полимера: углеводородные радикалы направлены наружу, а кислород – в сторону гидрофильной поверхности.
Гидрофобизация стекла (обычно метилхлорсиланами) повышает точность и воспроизводимость результатов при работе и лабораторной посудой и уменьшает обледенение стекол самолетов и автомашин.
Гидрофобизация строительных материалов (бетона, известняка, кирпича) предохраняет их от преждевременного разрушения под влиянием атмосферных условий, а в некоторых случаях является непременным условием их применения (гипс, гипсосилановый бетон). Хорошие результаты дают водные растворы алкилсиликонатов натрия.
Текстильные материалы после гидрофобизации не смачиваются и не пропускают воду, однако сохраняют проницательность для воздуха и водяных паров. Влагопоглощение понижается примерно в 20 раз при расходе 1,5-2,5% кремнийорганического соединения от массы текстиля.
Кренийорганические теплоносители (мономерные и полимерные эфиры кремниевой кислоты) термоустойчивы, не коррозируют большинство материалов, почти негорючи и поэтому с успехом заменяют такие распространенные теплоносители, как воду, водяной пар, топочные газы.
Алкилсиланы служат исходными веществами в производстве силиконов. Силиконовые жидкости (полимерные метилсилоксаны, метилдифенил-силоксаны) вследствие малой зависимости вязкости от температуры успешно применяются в качестве гидравлических масел. В пределах от +500ºС до –700ºС минеральные масла изменяют вязкость в 400 раз, а метилсилоксаны – в 29 раз.
Полиметилфенилсилоксаны образуют термоустойчивые смазки различных трущихся металлических поверхностей. Метилсиликоновые масла являются эффективными пеногасителями, они химически инертны и применяются в минимальных концентрациях (1:1000, 1:10000).
Силиконовые смолы используют в качестве изоляционных лаков, защитных покрытий, стойких и к высокой температуре, и к химическим воздействиям. Их обычно получают из метилтрихлорсилана, диметилдихлорсилана, финилтрихлорсилана, дифенилдихлорсилана, которые гидролизуются и поликонденсируются при нагревании в инертных растворителях. Смешанные с термостойкими наполнителями, они выдерживают нагревание в течение нескольких часов при 5000ºС и нескольких суток до 2500ºС.
Кремнийорганические соединения выгодно отличаются от каучуков: а) прежде всего незначительной изменчивостью свойств в широком интервале температур и, следовательно, высокой морозостойкостью (при рабочих температурах до 2000ºС их механические свойства мало меняются, при –600ºС они также сохраняют упругость); б) значительной химической стойкостью, особенно к кислороду и озону, гидрофобностью; в) негорючестью при нагревании без соприкосновения с пламенем; г) диэлектрическими свойствами.
Силиконовые каучуки (состоят из полимера, наполнителя и вулканизатора) представляют собой обычные линейные полидиметилсилоксаны с относительной молекулярной массой 250000-450000. Нагревание приводит к сшивке линейных полимеров поперечными связками.
Наполнители, например, различные типы аэрогелей оксида кремния (IV), улучшают механические свойства полимеров, повышают их прочность при растяжении и придают способность к удлинению до 60%. Вулканизацию проводят в присутствии перекисей. Силиконовые каучуки применяют в качестве электроизоляционного материала, прокладок различной аппаратуры и электродвигателей.
Кремнийорганические соединения получают из алкилхлорсиланов или аркилхлорсиланов. Это SiCl2 (СН2 )2 , Si(С2 Н5 )2 Cl2 , С6 Н5 SiCl3 . Схема последовательного гидролиза и поликонденсации при получении кремнийорганических полимеров следующая:
СН3 СН3
| |
Cl-Si-C + 2Н2О → НО-Si-ОН + 2НCl ;
| |
СН3 СН3
СН3 СН3 СН3 СН3
| | | |
НО-Si-ОН + НО-Si-ОН → НО-Si-О-Si-ОН + Н2О
| | | |
СН3 СН3 СН3 СН3
И так дальше до образования полимера, имеющего формулу

Стеклопласты
Стеклопласты – пластические массы, у которых связующим веществом служат синтетические полимеры, а наполнителем или армирующим материалом – стеклянное волокно или стеклянная ткань, придающие стеклопластикам особую прочность.
Большинство изделий из стеклопластиков изготавливают с применением в качестве связующих ненасыщенных полиэфиров – полиэфирмалоинатов или полиэфиракрилатов, а также эпоксидных и кремнийорганических полимеров.
В зависимости от взятого связующего стеклопластики могут перерабатываться в изделия при обычной температуре без давления или при небольшом давлении. Наибольшее значение приобретают стеклопластики, которые могут перерабатываться в изделия методом так называемого «контактного» формования с постепенным нанесением слоев связующего на каркас из армирующего материала.
Стеклопластики могут применяться для изготовления таких крупногабаритных изделий, как корпуса мелких судов, шлюпки, кузова автомобилей, крыши железнодорожных вагонов и т.п. Пока изделия можно изготавливать только с помощью «контактного» метода формования, т.е. по существу вручную, но нет сомнения, что в ближайшем будущем производство таких изделий будет механизировано и стеклопластики благодаря своей исключительной прочности и дешевизне найдут самое широкое применение во многих отраслях народного хозяйства. В зависимости от вида армирующего материала стеклопластики делятся на следующие группы:
А) Стеклотекстолиты – пластики, армированные стеклянными тканями. Изделия получаются обычно методом «контактного» формования.
Б) Стекловолокниты – пластики, в которых армирующим наполнителем служит войлок из стеклянного волокна. Перерабатываются методом литья или прессования.
В) Анизотропные стеклопластики – пластики с армирующим материалом в виде однонаправленной стеклянной нити. Изделия получают методом намотки стеклянного волокна, предварительно обработанного синтетическим полимером.
Г) Изотропные стеклопластики – пластики, армированные стекломатами (рубленое стеклянное волокно). Перерабатываются методом контактного формования.
Химические соединения, вырабатываемые промышленностью основного органического синтеза служат полупродуктами для производства пластических масс, синтетических волокон, синтетических каучуков, синтетических моющих средств и многого другого.
Состав люминесцирующего жидкостного фильтра
Предложен состав люминесцирующего жидкостного фильтра для неодимомых лазеров, содержащий в качестве растворителя - алкилсиланы формулы R2 Si(OR')2 , где: R, R' - алкильные радикалы с числом углеродных атомов от 1 до 6, а в качестве люминесцирующей добавки - 1,8-нафтоилен[1',2']бензимидазола в концентрации 10-4 -10-3 моль/л, позволяющий снизить токсичность и коррозионную активность, при сохранении фотостабильности и эффективности преобразования излучения накачки.
Жидкостные теплоносители для лазеров (В. М. Подгаецкий, В. М. Волынкин И. В. Комлев, А. В. Резниченко)
В данной статье даются представление о составе и свойствах жидкостных теплоносителей для лазерной, световой и телевизионной техники. Приведятся результаты исследований оптотермодинамических и физико-химических процессов в жидкостях, находящихся под действием мощного широкополосного излучения, которые позволили предложить новый метод диагностики критического состояния жидкостей и растворов. Исследования спектрально-люминесцентных явлений в жидкостях, работающих в лазерных системах, позволили значительно увеличить КПД и ресурс неодимовых лазеров.
Одним из рассматриваемых теплоносителей являются кремнийорганические соединения.
«На следующем этапе поиска органических растворителей для лазерных ЖТ мы обратились к изучению обширного класса кремнийорганических соединений, включающего органосиланы R4nSi(OR)n общей структурной формулы
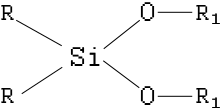
где: R, R1 — алкилы и алкилены линейной и разветвленной структур и циклические производные.
Такие бесцветные жидкости характеризуются гидрофобностью, низкой температурой застывания, высокой сжимаемостью, химической инертностью, малым изменением вязкости с температурой, высокой термической, термоокислительной и фотостабильностью. Эти соединения являются хорошими диэлектриками. По этим причинам кремнийорганические соединения находят широкое применение в промышленности в качестве гидравлических — жидкостей и теплоносителей, пеногасителей, гидрофобизаторов, смазочных масел и консистентных смазок, способных длительно работать в интервале температур (-100;250)°С.
Отбор соединений, проведенный по комплексу параметров (спектральные и вязкостно-температурные характеристики, фото- и термостойкость, токсичность, сырьевая база и др.) на основании данных научно-технической литературы и собственных экспериментов, позволил остановиться на диметилдиалкилоксисилане (ДМДАОС).
Высокая химическая прочность связей Si-CH3 (314 кДж/моль) этого соединения обусловливает стойкость ЖТ, созданных на его основе, к действию длительного нагрева и мощного облучения. ДМДАОС малотоксичен: ЛД50 > 10 г/кг, ПДК в воздухе рабочей зоны 10 мг/м3, что обусловливает его отнесение к четвертому классу опасности.
Нами разработана технология синтеза особо качественного ДМДАОС с высоким выходом продукта (> 90 %), освоено его производство. На его основе были созданы ЖТ (в том числе фильтрующие и люминесцирующие) типа РМ.»
алкилсилан гидрирование соединение металлоорганический
Вывод
В работе были рассмотрены важнейшие способы получения алкилсиланов:
· взаимодействие металлоорганических соединений с алкилхлорсиланами;
· взаимодействие гидридов металлов с алкилхлорсиланами;
· каталитическое диспропорционирование соединений, содержащих алкилгидридсилановый фрагмент;
· гидрирование алкилхлорсиланов и тетраалкилсиланов.
У каждого из них есть свои недостатки.
1. Синтез через металлоорганические соединения
Использование металлоорганических соединений вызывает необходимость их получения непосредственно перед синтезом магнийорганические и цинкорганические реагенты). Кроме того, растворы алюминийорганических веществ в нефрасе содержат целую гамму различных углеводородных примесей, которые переходят в целевой продукт и затем требуют тщательного отделения.
Как правило, использование элементоорганических соединений часто приводит к получению значительных количеств побочных продуктов. Так, например, при взаимодействии растворенных диэтилалюминийгидрида и тетрахлорида кремния в углеводородном растворителе в автоклаве при 50ºС наряду с моносиланом образуются примеси этана и монохлорсилана.
2. Каталитическое диспропорционирование:
Недостатками такого метода являются получение не индивидуального, а ряда соединений, что неизбежно приводит к появлению дополнительных стадий очистки, а также необходимость применения катализатора, и ограниченное по времени воздействие катализатора на реагент.
Следует отметить, что выход целевого продукта из кремнийорганических эфиров составляет менее 10% от количества исходного реагента, а на 1 кг продукта образуется 8-10 кг побочных кремнийсодержащих соединений, требующих утилизации. Кроме того, из-за нестабильности реагента существует проблема получения этого исходного в чистом виде в достаточном количестве.
3. Гидрирование:
Такой способ характеризуется низким выходом. Применение водорода, высоких температур (выше 400ºС) и катализатора также следует отнести к недостаткам.
4. Восстановление хлор- или алкоксисиланов гидридами металлов
Недостатками такого способа являются использование растворителя, необходимость его регенерации.
Кроме того, в случае использования акил(алкокси)силанов возникает необходимость их получения непосредственно перед синтезом.
Поскольку для получения карбидокремниевых материалов и композитов в основном используются гидридсодержащие алкилсиланы, то наибольшее практическое значение для получения алкилсиланов имеет метод с использованием гидридов металлов по следующим причинам:
· Взаимодействие между реагентами проходит с высокой скоростью и высоким выходом, вплоть до количественного.
· При взаимодействии алкилхлорсиланов с гидридами металлов выделяется только целевой продукт с незначительным содержанием посторонних примесей, что существенно при дальнейшем способе очистки для достижения высокой чистоты алкилсилана.
· Высокое содержание водорода в гидридах, а особенно в комплексных гидридах, позволяет получать алкилсиланы с незначительным расходом гидрирующих агентов, что положительно отражается на сырьевой составляющей стоимости целевого продукта и не вызывает больших проблем с утилизацией образовавшихся хлоридов металлов.
Использованная литература
1. Способ получения алкилсиланов. Пат. 2219126 Россия, МПК7 С 01 В 33/04, С 07 Р 7/08 Федеральное гос. унитарное предприятие НИИ синтетич каучука. Николаев Г. А., Егоров А. Г., Плашкин В. С, Хорошавина Ю. В., Колокольцева И. Г.
2. Molecular dynamics simulations ot alkylsilane stationary-phase order and disorder. 2. Effects of temperature and chain length Lippa Katrice A., Sander Lane C, Mountain Raymond D. (Analytical Chemistry Division and Physical and Chemical Properties Division, Chemical Sciences and Technology Laboratory, National Institute of Standards and Technology, 100 Bureau Drive, Gaithersburg, Maryland 20899).
3. Получение алкилсиланов высокой чистоты Сидоров Д. В., Стороженко П. А., Шутова О. Г., Кожевников Б. Е.
4. Жидкостные теплоносители для лазеров. В. М. Подгаецкий, В. М. Волынкин И. В. Комлев, А. В. Резниченко
5. Состав люминесцирующего жидкостного фильтра. Пат. 2069429, Московское научно-производственное объединение "НИОПИК". Ветчинкин М.Н.; Комлев И.В.; Матюшин Г.А.; Михайлов Ю.Н.; Подгаецкий В.М.; Сливка Л.К.; Стрункин В.А.; Тавризова М.А.; Толстая С.Б.; Хролова О.Р.
6. Органическая химия. З. Гауптман, Ю. Грефе, Х. Ремане. М.: ХИМИЯ, 1979.