| Скачать .docx |
Курсовая работа: Курсовая работа: Ультразвуковая экстракция полисахаридов льна
Министерство образования и науки Российской Федерации
Курсовая работа
На тему
УЛЬТРАЗВУКОВАЯ ЭКСТРАКЦИЯ ПОЛИСАХАРИДОВ ЛЬНА
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
1 ПРИМЕНЕНИЕ УЛЬТРАЗВУКА В ПРОЦЕССАХ ЭКСТРАГИРОВАНИЯ
1.1 Ультразвук в химической технологии. Общий обзор
1.2 Экстрагирование в системе твердое тело - жидкость
1.2.1 Экстракция. Основные понятия
1.2.2 Экстрагирование биологически активных веществ из растительного сырья
1.2.3 Интенсификация экстракционных процессов под действием ультразвука
2 ХАРАКТЕРИСТИКА РАСТИТЕЛЬНОГО СЫРЬЯ
2.1 Лен посевной (лен обыкновенный)
2.2 Препараты и применение в медицине
2.2.1 Льняное семя
2.2.2 Слизь семян льна
2.2.3 Лигнаны семени льна
3 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3.1 Оборудование и материалы
3.2 Изучение ультразвукового воздействия на процесс получения экстрактов семян льна
3.3 Определение оптимальных параметров ультразвукового воздействия
3.4 Методы анализа и контроля процесса экстракции
3.4.1 Получение контрольных экстрактов полисахаридов льна
3.4.2 Использование методов ИК-спектроскопии
ЗАКЛЮЧЕНИЕ
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
Введение
Главным источником многих биологически активных соединений все еще остается натуральное сырье, как животного, так и растительного происхождения, несмотря на то, что современная химия достигла впечатляющих успехов в области синтеза большого числа таких веществ. Следовательно, особого внимания заслуживает изучение и интенсификация процесса экстрагирования разнообразных ценных компонентов из природного сырья.
К сожалению, традиционные методы экстрагирования являются достаточно длительными, трудоемкими и, что самое неприятное, довольно малоэффективными.
Сложившаяся на сегодняшний день довольно сложная экологическая обстановка диктует новые подходы к переработке природного сырья: необходимы пути его наиболее полного использования. В частности, возникает вопрос наиболее рационального выбора технологических аппаратов для осуществления процесса экстрагирования. Одним из новых и перспективных методов является использование ультразвукового воздействия в процессе экстракции разнообразных биологически активных веществ из природных материалов. Для достижения максимального выхода ценных компонентов в жидкую фазу при сохранении ими своей нативной структуры необходим индивидуальный подход к выбору оптимальных режимов ультразвуковой обработки для каждого вида сырья.
1. ПРИМЕНЕНИЕ УЛЬТРАЗВУКА В ПРОЦЕССАХ ЭКСТРАГИРОВАНИЯ
1.1 Ультразвук в химической технологии. Общий обзор
Применение ультразвуковых колебаний в химической технологии является весьма перспективным: во многих случаях оно обеспечивает исключительно высокую интенсивность технологического процесса, не достижимую с помощью таких широко распространенных методов как механическое перемешивание, применение высоких температур и давлений и т.п. Поэтому проблема применения ультразвука в процессах химической технологии заслуживает серьезного внимания.
Началом работ в этой области можно считать двадцатые годы прошлого столетия, когда Р. Вудом была показана возможность ультразвуковой интенсификации ряда физико-химических процессов. В настоящее время трудно назвать область химической технологии, в которой б не находил применения ультразвук [1].
Ультразвуком принято называть колебания, распространяющиеся в упругой среде со сверхзвуковой частотой, иначе говоря, с частотой, превышающей верхний порог слышимости человеческого уха – 20 000 Гц.
Ультразвуковые волны могут распространяться в любых упругих телах: жидких, твердых и газообразных.
Акустические колебания воздействуют на химико-технологические процессы через так называемые эффекты первого порядка (частота, интенсивность, скорость акустических колебаний) и эффекты второго порядка, т.е. нелинейные эффекты, развивающиеся в жидкости при распространении мощных акустических волн. К эффектам второго порядка относятся кавитация (разрыв сплошности жидкости), акустические течения (звуковой ветер), пульсация газовых пузырьков и др.[2].
Раньше полагали, что для интенсификации технологических процессов необходимы колебания высоких частот (не менее 300-500 кГц). В последнее время успешно применяют акустические колебания как средней (от долей Вт/см![]() до нескольких Вт/см
до нескольких Вт/см![]() ), так и большой (10 Вт/см
), так и большой (10 Вт/см![]() и выше) интенсивности.
и выше) интенсивности.
Таким образом, современная техника практически использует упругие механические колебания весьма широкого диапазона и интенсивностей.
Сознательное изменение скорости процесса, в частности путем воздействия на него упругих колебаний, требует понимания механизма и кинетики этого процесса. Объектом воздействия должна быть, прежде всего, лимитирующая стадия процесса. Естественно, что для эффективного воздействия на нее необходимо располагать сведениями о зависимости направления и скорости этой стадии от параметров акустического поля. Поэтому, наряду с исследованием влияния ультразвука на разного рода сложные технологические процессы, необходимо глубокое изучение его влияния на «элементарные» явления, составляющие эти процессы.
В настоящее время применение ультразвуковых колебаний в химической технологии развивается в двух основных направлениях:
контроль технологических процессов и качества продукции;
интенсификация производства [1].
1.2 Экстрагирование в системе твердое тело – жидкость
1.2.1 Экстракция. Основные понятия
Экстракцией в широком смысле называют процессы извлечения одного или нескольких компонентов из растворов или твердых тел с помощью избирательных растворителей (экстрагентов) [3].
Экстрагирование в системе твердое тело – жидкость - один из важнейших технологических процессов, нашедших широкое распространение в химической, химико-фармацевтической, пищевой и других отраслях промышленности.
Движущей силой процесса экстракции является разница концентраций экстрагируемого вещества в жидкости, заполняющей поры твердого тела, и в основной массе экстрагента, находящегося в контакте с поверхностью твердых частиц. Механизм экстрагирования в общем случае включает следующие стадии:
проникновение экстрагента в поры твердого материала;
растворение целевых компонентов;
перенос экстрагируемого вещества из глубины твердой частицы к поверхности раздела фаз: в элементарных случаях с помощью молекулярной диффузии, а при осложнении этого механизма другими явлениями (растворением, набуханием) – помощью массопроводности;
перенос вещества от поверхности раздела фаз вглубь экстрагента с помощью конвективной диффузии (массоотдачи) [1].
При экстрагировании в системе твердое тело – жидкость процесс может лимитироваться следующими стадиями:
внешнедифузионной – скорость процесса определяется скоростью диффузии в объеме при условии, что концентрация растворителя в порах и на поверхности твердого материала меньше его концентрации в объеме;
внутридиффузионной – скорость процесса определяется скоростью диффузии в порах вещества;
внутренней кинетической – при условии, что пористый материал обладает относительно низкой химической активностью, а концентрация растворителя в порах равна концентрации в объеме;
внешней кинетической – реагент имеет относительно высокую химическую активность, вследствие чего реакция проходит на поверхности пористого материала при условии, что скорость реакции лимитирует скорость всего процесса (при малой пористости вещества) [4].
Эффективность процесса экстрагирования зависит от большого числа параметров, например, от формы нахождения извлекаемого компонента, характера взаимодействия твердого тела с извлекаемым компонентом, различия в избирательной способности экстрагента по отношению к компонентам, содержащимся в твердой фазе, от структуры пористого материала [5].
1.2.2 Экстрагирование биологически активных веществ из растительного сырья
Главная особенность процесса экстрагирования из пищевого и растительного сырья состоит в том, что физические свойства сырья в значительной степени изменяются в процессе экстрагирования, и это оказывает существенное влияние на все стадии процесса.
Экстрагирование БАВ – главная, но и наиболее продолжительная стадия переработки сырья. Сложность изучения процессов твердофазного экстрагирования обусловлена, во-первых, неопределенностью изменения структуры твердой фазы во время извлечения из нее целевых компонентов, во-вторых, полидисперсностью твердой фазы. Кроме того, возникают определенные трудности при выборе избирательного экстрагента [1].
На большинстве заводов экстрагирование ведется малоэффективными методами, такими как: мацерация, перколяция, выпаривание, настаивание, отваривание [4]. Мацерация представляет собой обычное вымачивание, при котором происходит разрушение клеточных стенок растительного сырья и растворение экстрагируемых веществ. Длительность процесса достигает 14 дней. При перколяции, или просачивании, растворитель просачивается через слой измельченного сырья и «вымывает» целевые компоненты. Основные физические явления, обуславливающие процесс перколяции, - гравитация, вязкость, адгезия, трение, осмос, поверхностные, капиллярные явления и растворение [5].
Но все используемые в данное время методы экстракции довольно неэкономичны, что приводит к их ограниченному применению.
1.2.3 Интенсификация экстракционных процессов под действием ультразвука
Применение различных электрофизических методов (в частности, ультразвука) позволило по-новому построить технологический процесс, значительно ускорить его, повысить выход и улучшить качество продукции. Доказана целесообразность широкого применения ультразвука не только в пищевой и фармацевтической промышленности, но и для воздействия на различные технологические процессы [6].
Большое количество исследований в области ультразвуковой интенсификации различных гомо- и гетерогенных процессов посвящено выделению из смесей, сплавов необходимых веществ, а также очистке вод, почв и воздуха. Так, описаны ультразвуковая экстракция диметионата [7], экстракция антител из клеток [8], экстракция гербицидов из почвы с использованием ультразвука [9], эндоскопическая экстракция жировой массы с помощью ультразвукового скальпеля [10], жидкофазная экстракция полициклических ароматических углеводородов из загрязненных вод с помощью ультразвука [11], экстракция полициклических ароматических углеводородов из лесных почв [12]. Ультразвуком также выделяют из микрооранизмов аминокислоты и белки с сырным вкусом для придания вкусовых качеств различным сырам [13], производят выделение из клеток фермента эндонуклеазы [14], осуществляют твердо-жидкостную ультразвуковую экстракцию селена из биологических образцов [15].
Показано, что ультразвуком из сырья растительного происхождения в диапазоне частот 19 кГц – 1 МГц возможно извлекать практически все известные соединения, продуцируемые растениями. Кинетика ультразвуковой экстракции биологически активных веществ зависит от принадлежности к определенной химической группе, а степень извлечения растет в ряду: масла, алкалоиды, фуранохромы, флавоноиды, сапонины, гликозиды [16]. При использовании ультразвука наблюдается не только значительное ускорение процесса, но и увеличение по сравнению с другими способами экстрагирования выхода продукта [17].
Преимущества ультразвуковой экстракции по сравнению с другими способами:
минимальное применение ручного труда;
сокращение времени технологических процессов.
Однако недостатком этого метода является то, что ультразвуковое воздействие, используемое для обработки растительного сырья является, очень мощным и достаточно длительным. Проведение процесса в этих условиях вызывает мощный разогрев раствора, и, следовательно, разрушение некоторых классов БАВ [2].
Можно выделить несколько основных параметров, которые собственно и делают процесс ультразвукового экстрагирования более эффективным по сравнению с традиционными методами экстракции. К числу факторов, способствующих интенсификации, относятся:
увеличение скорости обтекания;
ускорение пропитки твердого тела жидкостью;
увеличение коэффициента внутренней диффузии;
кавитационный эффект, влияющий на структуру пористых тел и приводящий к появлению микротрещин;
свойства звуковых и ультразвуковых колебаний предотвращать экстракцию пористых частиц твердыми инертными примесями [17].
Под действием ультразвуковых колебаний происходит более быстрое и активное разрушение внутриклеточных тканей растительного сырья, что приводит к интенсификации процесса экстракции и дает возможность увеличить содержание биологически активных соединений в растворе.
В акустическом поле, наряду со снятием диффузионных ограничений, большое значение для интенсификации процесса экстракции имеют также другие процессы. Одним из таких важных процессов является диспергирование, другим - нарушение мицеллярной структуры экстрагируемого вещества как в воде, так и в органических растворах.
Показано действие акустических колебаний на увеличение межфазной удельной поверхности реагирующих компонентов. Диспергирование при этом идет как за счет разрушения частичек твердой фазы, так и за счет поверхностного трения между твердыми и жидкими фазами. Уменьшается толщина диффузионного пограничного слоя, увеличивая активацию молекул, в результате чего повышается количество результативных соударений молекул реагирующих компонентов. В результате использования вихревой экстракции в процессах экстракции веществ из корня валерианы привело к заключению, что сочетание механического воздействия (размол, разрыв клеток при ультразвуковой обработке) с турбулизацией среды по обе стороны клеточной перегородки положительно сказывается на изменении внутреннего сопротивления.
При экстрагировании растительного сырья рекомендуется предварительное замачивание, длительность которого зависит от скорости вытеснения воздуха из клетки. Однако многие капилляры заканчиваются в пачках и фибриллах, не выходя наружу. Ультразвук, создавая звукокапиллярный эффект, не только ускоряет вытеснение таких пузырьков воздуха, но и создает условия для растворения его в жидкостях. На концах капилляра возникает разность давлений в результате турбулентного движения пограничного слоя при наложении ультразвука. Протекая с большой скоростью мимо отверстия капилляра, слой проявляет отсасывающий эффект, то есть здесь формируется зона с пониженным давлением [2].
Решающим фактором ускорения процессов, протекающих в ультразвуковом поле, является кавитация, поэтому рассмотрим её подробнее.
При действии акустических волн происходит образование и рост парогазовых пузырьков в жидкости, которые колеблются, пульсируют и схлопываются (быстро сжимаются и могут растворяться в жидкости). Образование и движение такого рода пузырьков принято называть кавитацией – нарушением сплошности жидкости.
Давление внутри образовавшегося кавитационного пузырька в начальный момент весьма мало по сравнению с давлением в жидкости. Жидкость устремляется при этом к центру, и пузырек схлопывается. В этом случае, так же, как и при фокусировке сходящейся ударной волны, осуществляется концентрирование энергии. Радиальная скорость стенки пузырька и давление в нем возрастают по мере уменьшения радиуса пузырька. При схлопывании пузырька в момент достижения минимального размера в центральной области образуется пик давления и в направлении от центра формируется и распространяется в жидкости сферическая ударная волна. Результаты изучения динамики развития кавитационного поля показали, что при одновременном воздействии ультразвуковых волн двух различных частот (22-44 кГц и 1 МГц) наблюдается значительное повышение эффективности кавитации, гораздо большее, чем при линейном суммировании действия каждого из полей различных частот. Этот факт можно объяснить различием резонансных радиусов при высоких и низких звуковых частотах: существование крупных кавитационных пузырьков при низкой частоте приводит к их эффективному «размножению» при действии высоких частот, а образование вследствие этого большого числа зародышей кавитации способствует их эффективному росту при низкочастотных ультразвуковых колебаниях. Следовательно, низкие частоты увеличивают средний радиус пузырьков, а высокие частоты – их стационарную концентрацию [18]. При рассмотрении звуковых волн приходится считаться с тем, что упругая среда, в которой происходят колебания, обладает вязкостью, т.е. в среде имеются вполне определенные потери энергии. Учитывая поглощение звука, обусловленное вязкостью среды, Стокс дал уравнение распространения плоской волны в следующем виде:
![]() = С
= С![]()
![]() +
+![]()
![]()
![]() , (1)
, (1)
где ![]() - коэффициент динамической вязкости;
- коэффициент динамической вязкости;
С – скорость распространения звука;
![]() - потенциал скорости;
- потенциал скорости;
![]() - температура.
- температура.
Но поглощение звука может быть вызвано не только вязкостью, но и теплопроводность среды. Действительно, поскольку процесс распространения звуковых волн является адиабатическим, то температура среды не остается постоянной. Учитывая поглощение от вязкости и теплопроводности, будем иметь:
А = А![]() +А
+А![]() , (2)
, (2)
где А![]() - поглощение звука, вызванное теплопроводностью;
- поглощение звука, вызванное теплопроводностью;
А![]() - поглощение звука, вызванное вязкостью[20].
- поглощение звука, вызванное вязкостью[20].
Необходимо отметить, что использование ультразвука не всегда приводит к положительным результатам. Так, при озвучивании растительных клеток может происходить разрыв клеточных оболочек, свертывание протоплазм, переход в растворимую форму ряда веществ и др. Например, при воздействии ультразвука на свекловичную стружку происходит потеря сахара с жомом, соответственно снижается коэффициент извлечения, что может объясняться образованием оптически активных веществ, вращающих плоскость поляризации противоположно продуктам распада сахарозы. Эти обстоятельства заставляют более осторожно относиться к использованию ультразвука и тщательно изучать его действие на исследуемые объекты [6].
2. ХАРАКТЕРИСТИКА РАСТИТЕЛЬНОГО СЫРЬЯ
2.2 Лен посевной (лен обыкновенный) ( Linum unitatissimum L .)
Однолетнее травянистое растение с тонким стеблем. Листья многочисленные, очередные, узколанцетные, сидячие, покрыты восковым налетом. Цветки в рыхлом раскидистом соцветии (извилина). Венчик свободнолепестный с 5 лепестками голубого цвета с темносиними жилками; тычинки также синие. Плод - шарообразная коробочка с остающейся чашечкой с 10 семенами.
В России лен разводится с самого основания государства; особенно сильно льноводство развито в Псковской, Новгородской, Ярославской, Костромской, Тверской, Вологодской и других областях.
Лен имеет большое хозяйственное и лекарственное значение. Льняное масло считается ценным питательным продуктом. Из надземной части растения вырабатывают полотно, используемое на скатерти, постельное белье, а также батист, холст, технические ткани и бумаги. Из льняной пакли изготавливают шпагат и веревки. Льняное масло используется также для производства олифы, лаков, красок, линолеума, искусственной кожи, зеленого мыла и мыльного спирта, а льняной жмых, в котором до 30% протеина, считается хорошим кормом для скота и птицы.
2.2 Препараты и применение в медицине
2.2.1 Льняное семя (Se men Lini )
Семена льна применяют наружно при различных местных воспалительных процессах в виде компрессов и припарок. Значение слизистых припарок состоит в том, что они замедляют испарение, препятствуют высушиванию тканей, смягчают и умеряют воспаление на месте приложения.
Свежие семена льна применяют также внутрь в качестве нежного слабительного. Разбухая в содержимом желудочно-кишечного тракта, они механически раздражают рецепторы стенки кишечника и тем самым усиливают перистальтику.
Употребление в пищу семени льна нормализует также функцию печени [20].
Основными нутриентами, определяющими биологическую активность льняного семени являются: жирное масло, белковые вещества, витамины, ферменты, слизь, углеводы, органические кислоты и др. жирное масло, в состав которого входят глицериды линоленовой (35-45%), линолевой (25-35%), олеиновой (15-20%), стеариновой (8-9%) , белок (18-33%), углеводы (12-26%), органические кислоты, витамин А [21].
В оболочках семян находятся высокомолекулярные соединения, дающие при гидролизе линокофеин, линоцимарин. Кроме того, семена включают макроэлементы (мг/л) – калий (до 15), кальций (до 5), магний (около 4), железо (около 0,1); микроэлементы – марганец, медь, цинк, хром, алюминий, селен, никель, йод, свинец, бор [20].
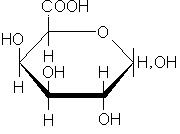
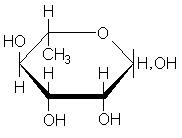
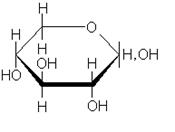
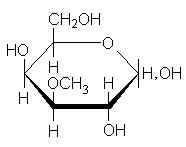
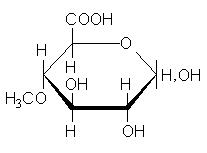
Углеводы льна образуют устойчивые коллоиды - слизи. Слизи образуются в растениях в процессе естественного развития и выполняют роль резерва углеводов, воды, а также защитного биоколлоида. В семенах они, по-видимому, играют роль резервуаров для удерживания воды, чтобы защитить семена от обезвоживания. В химическом отношении в слизях преобладают пентозаны (до 90%). Из физических свойств для слизей характерна их полная растворимость в воде. Слизистые вещества льняных семян представляют собой сложные химические соединения моносахаридов, показано, что они содержат цепи из чередующихся остатков D-галактуронововой кислоты и L-рамнозы, к которым присоединены боковые цепи, состоящие из остатков 3-О-метил-D-галактозы, D-галактозы, L-рамнозы и D-ксилозы, а также 4-О-метил-D- глюкуроновой кислоты:
 |
 |
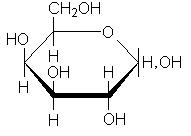 |
| D-галактуроновая кислота | L-рамноза | D-галактоза |
 |
 |
 |
| D-ксилоза | 3-О-метил- D-галактоза |
4-О-метил-D-глюкуроновая кислота |
Полисахариды льняного семени представляют практический интерес, так как могут выступать в качестве водоудерживающих агентов, текстураторов и связующих в производстве хлебобулочных изделий, оказывая при этом протекторное действие на пищеварительную систему [22].
Терапевтическая активность семян льна обусловливается наличием слизи и гликозида линамарина. Линамарин биологически весьма активен и оказывает влияние на различные системы и органы: регулирует секреторную и моторную функции кишечника [20].
2.2.2 Слизь семян льна (Mucilago seminis Lini)
Слизь семян льна обладает обволакивающими и смягчающими свойствами, умеряет местнораздражающее действие различных веществ. Обволакивающие свойства семян препятствуют всасыванию различных веществ, принятых внутрь или нанесенных местно на кожу и слизистые оболочки. Слизь семян применяют внутрь: для уменьшения раздражения при воспалительных и язвенных процессах на слизистых оболочках, особенно в желудочно-кишечном тракте (язвенная болезнь желудка и двенадцатиперстной кишки), при колитах (в последнем случае, помимо применения внутрь, назначают также в клизмах по 50 мл) [23].
Слизистая оболочка желудка способна вырабатывать слизь, которая предназначена для защиты стенки желудка от воздействия соляной кислоты и других раздражающих факторов. При различных заболеваниях желудочно-кишечного тракта секреция слизи снижается и желудочная стенка становится незащищённой перед агрессивной средой, что приводит к развитию патологических изменений в ней и поддерживанию воспаления. Поэтому дополнительное введение слизистых веществ - очень важная составляющая коррекции нарушений функций ЖКТ [22].
Принятая внутрь, она покрывает слизистой пленкой пищевые массы и слизистую оболочку пищеварительного тракта. Этим она препятствует раздражающему действию пищи, создает дополнительный слизистый покров в пищеварительном тракте и снижает возможность раздражения слизистых оболочек ротовой полости, пищевода, желудка, кишечника; уменьшает боль.
Слизь назначают также при отравлении различными прижигающими веществами, при катарах дыхательных путей, для смягчения вкуса различных острых и кислых веществ, для замедления всасывания различных растворимых веществ в целях более продолжительного действия.
Кроме того, слизь препятствует всасыванию токсических веществ из пищеварительного тракта в кровь, снижает уровень холестерина в крови.
Слизь применяют при заболеваниях верхних дыхательных путей, бронхите, воспалении слизистой полости рта.
Слизь семян льна относится к пребиотикам.
Пребиотики (пищевые волокна) обладают многочисленными физиологическими эффектами, что определяет их значение для нормального функционирования организма.
Пребиотики являются важными регуляторами состава кишечной микрофлоры. Слизи семян льна устойчивы к воздействию энзимов желудочно-кишечного тракта и поступая в нижние отделы кишечника частично ферментируются и реализуются интестинальной микрофлорой, которая получает таким образом энергетический и пластический материал. С другой стороны, короткоцепочечные жирные кислоты, образующиеся в результате активности микрофлоры, необходимы для нормального функционирования эпителия толстой кишки. Нормальный состав микрофлоры и нормальное функционирование колоноцитов обеспечивают физиологические процессы в толстой кишке и ее нормальную моторику [24].
Слизь семян льна удерживает воду, влияя тем самым на осмотическое давление в просвете желудочно-кишечного тракта, электролитный состав кишечного содержимого, стимулируя в конечном итоге моторику желудочно-кишечного тракта.
Отсутствие пищевых волокон в диете может привести к ряду патологических состояний, многие из которых так или иначе связаны с нарушением состава микрофлоры кишечника. С дефицитом пищевых волокон в пище связывают развитие ряда заболеваний и состояний, таких, как рак толстой кишки, синдром раздраженного кишечника, запоры, желчно-каменная болезнь, сахарный диабет, ожирение, атеросклероз, ишемическая болезнь сердца, варикозное расширение и тромбоз вен нижних конечностей и многие другие.
Необходимо отметить, что слизи семян льна богаты макро- и микроэлементами, такими как калий, кальций, магний, железо, марганец, медь, цинк, хром, алюминий, селен, никель, йод, свинец, бор [22].
Наружно слизь употребляют при трофических язвах, после рентгеновского облучения, в виде компрессов и припарок при фурункулах и различных заболеваниях кожи [20].
В медицине слизи широко используют в качестве оболочек таблеток.
Хотя пероральный путь введения лекарственных препаратов широко распространен в медицине, в желудочно-кишечном трактате существуют несколько серьезных барьеров для доставки препарата к месту действия. Чтобы успешно действовать именно в том отделе желудочно-кишечного тракта, где это необходимо, препарат должен быть защищен от поглощения в верхнем отделе ЖКТ, а лишь затем быстро активизироваться на том участке, который считают оптимальным для преследуемой цели применения лекарства. Это особенно актуально при лечении таких заболеваний как болезнь Крона, язвенный колит, злокачественные опухоли. Некоторые полисахариды растений, в том числе и полисахариды льна, остаются незатронутыми в присутствии желудочно-кишечных ферментов, что позволяет использовать их в качестве оболочек таблеток и способствует доставке лекарственного препарата к участку ЖКТ, ради которого и применятся данное лекарственное средство.
Преимущества таких полисахаридных оболочек - уменьшение побочных эффектов, более низкая доза препарата, доставка препарата в неповрежденной форме близко, насколько возможно, к целевому участку [25].
Таким образом, водорастворимая группа нутриентов льняного семени представляет собой набор ценных питательных веществ которые могут быть использованы для обогащения продуктов питания.
2.2.3 Лигнаны семени льна
Лигнаны - класс фенилпропаноидных метаболитов широко представленный в растительном мире, особенно у покрытосеменных и голосеменных видов; встречаются как в свободном состоянии, так и в форме гликозидов, чаще всего это димеры [26] и, редко, олигомеры [27].
В научной литературе акцентируется внимание обычно на следующих свойствах лигнанов: антиоксидантных, бактерицидных, фунгицидных, антивирусных, инсектицидных, фитотоксичности.
Многие лигнаны обладают важными фармакологическими эффектами. Лигнаны лимонника, элеутерококка, можжевельника, льна, кунжута, лопуха и др. растений положительно влияют на обмен веществ в клетках, активируя трофические процессы в тканях, обладают сильным стимулирующим действием. Но особое внимание ученых привлекают гормоноподобные, а именно эстрогенные свойства лигнанов, которые в связи с этим, наряду с изофлавоноидами, получили название фитоэстрогены . Известны примеры применения лигнанов для профилактики и лечения гормонозависимых форм рака, так, например, подофиллотоксин используется для лечения тестикулярных опухолей и острой формы лейкоцитарной лейкемии и т.д.
Исследовательские работы по изучению лигнанов интенсивно ведутся во многих странах мира, особенно Канаде, Японии, США, Китае и Южной Корее.
Органы растений в которых присутствуют лигнаны - это семена, корни, древесина. Химическая структура лигнанов и вероятный путь их биосинтеза в растениях показаны на рис. 1.
В научной литературе акцентируется внимание обычно на следующих свойствах лигнанов: антиоксидантных [28, 29], бактерицидных [30], фунгицидных [31], антивирусных [32], инсектицидных [33], фитотоксичности [34], и, возможно, цитокинин-подобном действии [35].
По структуре фитоэстрагены имеют определенное сходство с эндогенными эстрогенами животных и близки с ними по молекулярной массе. Известны примеры применения лигнанов для профилактики и лечения гормонозависимых форм рака, так, например, подофиллотоксин используется для лечения тестикулярных опухолей и острой формы лейкоцитарной лейкемии [36].
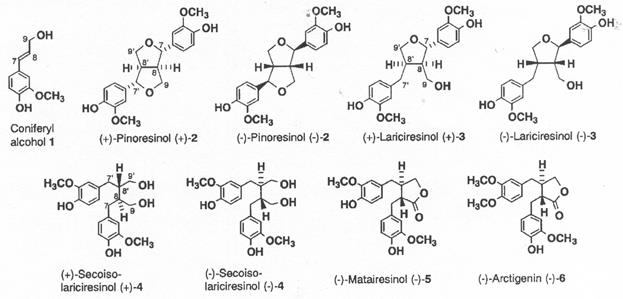 |
Вероятный путь биосинтеза в Forsythia intermedia (форзиция промежуточная): конифериловый спирт (1) ---> пинорезинол(2)--->ларицирезинол(3)---> секоизоларицирезинол(4)--->матаирезинол(5) |
| Рисунок 1 - Химическая структура лигнанов и вероятный путь их биосинтеза |
Известно также, что, население стран Юго-Восточной Азии с преобладающей долей растительной пищи в ежедневном рационе питания меньше подвержено таким заболеваниям, как рак груди и простаты, в отличии от жителей западных стран, чей рацион в большей мере состоит из животного белка и жира [37]. Вероятно, это связано с тем, что, употребление вегетарианской пищи, обогащенной пищевыми волокнами, увеличивает содержание в сыворотке "животных" лигнанов – энтеролактона и энтеродиола [38, 39]. Установлено также, что, у больных раком груди [40, 41] уменьшено содержание "животных" лигнанов в моче. Энтеролактон и энтеродиол, очевидно, снижают вероятность возникновения рака груди и простаты у людей, рацион которых обогащен пищевыми волокнами [42], за счет модулирования синтеза стероидных гормонов [43]; предполагается, что оба лигнана формируются при употреблении растительной пищи в результате интестинального метаболизма [44]. Установлено также, что метаболиты природных лигнанов (-)-арктигенин и (-)-трахелогенин ингибируют in vitro репликацию вируса человеческого иммунодифицита (HIV-1) [45], оба лигнана подобны «животным" лигнанам и, вероятно, формируются из секоизоларицирезинола и матаирезинола [44, 46].
Средняя концентрация (мкг/100 г) изофлавонов и лигнанов в растительных продуктах питания приведена в таблице 1.
Биологическая активность фитоэстрагенов в сотни и тысячи раз ниже активности эндогенных эстрогенов, однако постоянное потребление человеком растительной пищи, а также таких продуктов, как молоко и мясо травоядных животных, может приводить к значительной концентрации фитоэстрогенов в организме. Так, в сперме человека и быка, слюне, грудном молоке, жидкости овавриальных кист, соке предстательной железы лигнаны энтеролактон и энтеродиол обнаружены в количествах превышающих концентрацию эндогенных эстрогенов до 5000 раз [47]. Слишком низкие или высокие концентрации энтеролактона и энтеродиола в плазме приводят к возрастанию риска рака груди [48].
Наряду с пользой употребления лигнанов, необходимо помнить, что фитоэстрогены могут вызвать неблагоприятные эффекты, такие как бесплодие и гиперэстрогенемия [50, 51].
Все эти факты свидетельствуют о тесной взаимосвязи вегетарианской диеты, животных лигнанов и гормонозависимых заболеваний.
Средняя концентрация (мкг/100 г) изофлавонов и лигнанов в растительных продуктах питания, определенное в лаборатории Отдела клинической химии Университета Хельсинки после гидролиза гликозидов с помощью комбинированной газовой хроматографии - масс-спектрометрии - Таблица 1
| Анализируемый продукт | Генистеин | Даидзеин | СЕКО* | Матаирезинол |
Мука соевых бобов** Соевыйнапиток (First Alternative) Соевое молоко (Jevity Isotonis) Семена льна Семена льна измельченные и обезжиренные Семена клевера*** Семена подсолнуха Семена мака Семена тмина Пшеница (целые зёрна) Белая пшеничная мука Отруби пшеницы Мука овса Отруби овса Ячмень (целые зёрна) Отруби ячменя Ржаная мука (Amando, из целых зёрен) Отруби ржи (Amando) Зёрна фасоли°° Пророщенные зёрна фасоли°°° Семена тыквы Соевое масло Китайский соевый соус Морковь Чеснок Спаржевая капуста Клюква Арахис Чёрный чай Earl Grey Японский зелёный чай Кофе Arabica Шампиньоны |
96900 2100 310 0 0 323 13,9 6,7 8,0 0 Сл. 6,9 0 0 7,7 16,3 0 0 365 1902 1,53 0,4 Сл. 1,7 1,45 6,6 0 82,6 0 Н.о. 0 117 |
67400 700 30 0 0 178 8,0 17,9 0,14 0 Сл. 3,5 0 0 14,0 6,4 0 0 9,7 745 0,56 0,02 20,5 1,6 2,08 4,7 0 49,7 29,0 Сл. 0 20,2 |
130 0 0 369900 546000 13,2 610 14,0 221 32,9 8,1 110 13,4 23,8 58,0 62,6 47,1 132 172 468 21370 1,2 26,9 192 379 414 1510 333 1590 2460 716 8,3 |
0 0 0 1087 1300 3,8 0 12,1 5,7 2,6 0 0 0,3 155 0 0 65,0 167 0,25 0,87 0 0,2 0 2,86 3,62 23,1 0 Сл. 197 186 Н.о. Н.о. |
Таблица с сокращениями взята из статьи (Adlercreutz, Mazur, 1997)
Сл. - Присутствуют в следовых количествах.
Н.о. - Не определено из-за низкой концентрации и примесей других веществ
* - Секоизоларицирезинол
** - В муке также обнаружено 30 мкг/100 г формонентина и 70 мкг/ 100 г биосхенина А.
*** - Также (мкг/100 г): 1270 - формонентина, 381 - биосхенина А, 5,3 - кумэстрола.
°° - Также (мкг/100 г): 7,5 - формонентина, 14,1 - биосхенина А, 1,8 - кумэстрола.
°°° - Также 1032 мкг/100 г кумэстрола.
До недавних пор, единственными предшественниками энтеролактона и энтеродиола считали секоизоларицирезинол и матаирезинол [52,53,54]. В 2001-2003 годах были идентифицированы такие предшественники энтеролактона [55, 56], как пинорезинол, ларицирезинол, сирингарезинол, 7- гидроксиматаирезинол и арктигенин, и на основании растительного биосинтетического пути для секоизоларицирезинола и матаирезинола предложена возможная метаболическая схема для пинорезинола, в которой предполагается образование животных лигнанов из ларицирезинола и секоизоларицирезинола [55]. Дигликозид пинорезинол – основа традиционного антигипертезивного средства [57].
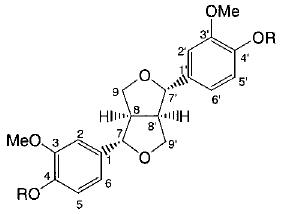
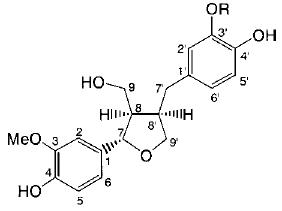
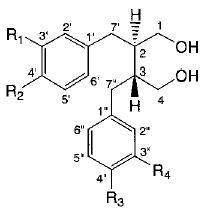
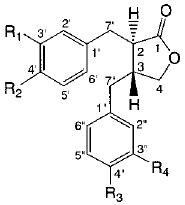
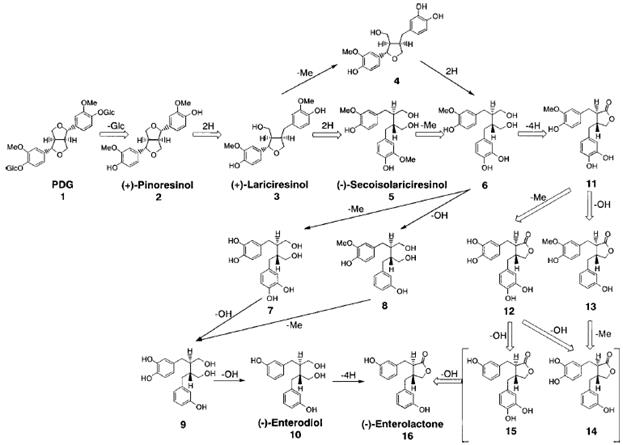
Структура и возможные пути трансформации пинорезинола дигликозида (PDG) (1 ) и его метаболитов (2 – 16 ) интестинальной микрофлорой человека показаны на рис. 2, 3).
 |
 |
||||||||
| R | R | ||||||||
| 1. | PDG | Glc | 3. | (+)-Lariciresinol | CH3 | ||||
| 2. | (+)-Pinoresinol | H | 4. | H | |||||
 |
 |
||||||||
| R1 | R2 | R3 | R4 | R1 | R2 | R3 | R4 | ||
| 5. | OCH3 | OH | OH | OCH3 | 11. | OCH3 | OH | OH | OH |
| 6. | OCH3 | OH | OH | OH | 12. | OH | OH | OH | OH |
| 7. | OH | OH | OH | OH | 13. | OCH3 | OH | H | OH |
| 8. | OCH3 | OH | H | OH | 14. | OH | OH | H | OH |
| 9. | OH | OH | H | OH | 15. | OH | H | OH | OH |
| 10. | OH | H | H | OH | 16. | OH | H | H | OH |
| Рисунок 2 - Структура пинорезинол дигликозида (1 ) и его метаболитов (2 - 16 ) | |||||||||
 |
|||||||||
| Рисунок 3 - Возможные пути трансформации пинорезинола дигликозида (1 ) интестинальной микрофлорой человека | |||||||||
Лигнаны могут быть условно разделены на несколько различных структурных подгрупп [26]. Наиболее известными являются дибензилбутаны (например, секоизоларицирезенол), дибензилбутиролактоны (например, матаирезинол , арктигенин), фурофураны (например, пинорезинол , медиорезинол), арилнафталены (например, хиненсин) и арилтетрагидронафталены (например, подофиллотоксин ).
3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3.1 Оборудование и материалы
Для выделения полисахаридов льна и контроля процесса ультразвуковой экстракции необходимы следующие приборы, лабораторная посуда и материалы:
ультразвуковой диспергатор IKASONICU 50 control;
Фурье-спектрометр «ИНФРАЛЮМ ФТ»;
шкаф сушильный;
весы аналитические;
весы технические;
стеклянные стаканы объемом 100 мл;
стеклянные воронки;
пипетки объемом 1, 2, 5, 10 мл;
тигли фарфоровые;
марлевая ткань для фильтрования.
Используемое сырье:
вода дистиллированная;
семена льна.
3.2 Изучение ультразвукового воздействия на процесс получения экстрактов семян льна
Получение экстрактов проводили при комнатной температуре, с помощью ультразвукового диспергатора и воды в качестве экстрагента. Для экстракции было взято соотношение сырьё: экстрагент 1:10 (по весу).
Применение в качестве экстрагента воды связано с её пищевой и фармацевтической применимостью.
Ультразвуковая обработка экстрактов проводилась с помощью прибора IKASONICU 50 control. Он генерирует продольные механические колебания с частотой 30 кГц. Прибор регулируется вручную, но возможен и компьютерный контроль генерируемой мощности ультразвука. Благодаря сменным насадкам возможно получение получить следующий диапазон мощностей: от 12,5 Вт/см![]() до 460 Вт/см
до 460 Вт/см![]() . Для длительной обработки среды прибор крепится к стенду (штативу), для чего предусмотрен специальный держатель.
. Для длительной обработки среды прибор крепится к стенду (штативу), для чего предусмотрен специальный держатель.
При работе с IKASONICU 50 control следует придерживаться стандартной инструкции по работе с электроприборами. Во время работы прибора нельзя допускать контакта насадки с чем -либо, кроме обрабатываемой среды. Данная частота (30 кГц) не является опасной для здоровья человека, но не рекомендуется работа прибора «вхолостую» (насадка не погружена в какую-либо среду).
До экстракции сырье не подвергалось никакой предварительной обработке. Ультразвуковое воздействие на твердое растительное сырье (семена льна) проводилось с и интенсивностью 230 – 322 Вт/см![]() в течении 8-20 минут.
в течении 8-20 минут.
Дальнейшее увеличение времени ультразвуковой обработки не приводит к увеличению содержания биологически активных веществ в растворе, а вызывает их разрушение и инактивацию.
Ультразвуковая обработка проводилась следующим образом: ультразвуковой генератор настраивается по интенсивности воздействия, навеску растительного сырья (5 г) насыпают в химический стаканчик и заливают 50 мл дистиллированной воды, после чего насадку генератора погружают в этот стаканчик и проводят обработку сырья.
Во время ультразвуковой обработки среда нагревается до 32 – 37 0 С ( в зависимости от мощности ультразвука и продолжительности воздействия), что не приводит к инактивации полисахаридов.
После завершения обработки раствор отфильтровывали (необходимо удалить семена льна).
Затем проводилось измерение вязкости полученного раствора с помощью вискозиметр Убеллоде, а также определялся сухой остаток.
Вязкость растворов измеряли сразу после фильтрования, через 5 минут, через 10 минут, через 1 час и через сутки.
Полученный сухой остаток взвешивали и повторно растворяли в объеме воды равном исходному (взятому для экстракции). При этом вязкость растворов полисахаридов восстанавливается, что важно при практическом использовании сухих полисахаридов.
Полученные полисахариды представляют собой тонкие хрупкие пленки, которые хранят в чистой, плотно закрытой посуде.
Принципиальная схема экспериментов представлена на рисунке 4.
Полученные результаты представлены в таблицах 2-5.
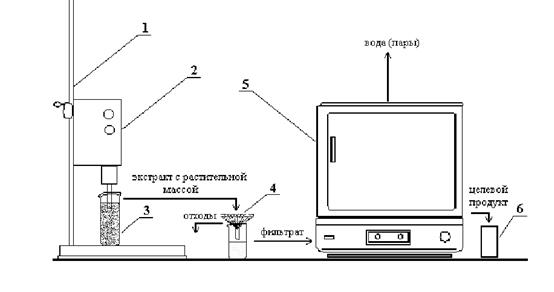
1 – штатив; 2 – ультразвуковой диспергатор; 3 – стаканчик с обрабатываемой средой; 4 – фильтр;
5 – сушильный шкаф; 6 – емкость для целевого продукта
Рисунок 4 – Принципиальная схема ультразвуковой экстракции полисахаридов льна
Первая серия опытов.
Зависимость вязкости от времени ультразвукового воздействия - Таблица 2
| № опыта | вязкость, Па с | ||||||
| УЗ Вт/см |
вр.обраб, мин. | 0 мин | 5 мин | 10 мин | 60 мин | 1440 мин | |
| 1 | 230 | 8 | 4,7 | 4,9 | 4,9 | 6,1 | 6,8 |
| 2 | 230 | 10 | 5,3 | 5,5 | 5,6 | 6,8 | 7,8 |
| 3 | 230 | 12 | 5,7 | 6,0 | 6,0 | 7,3 | 9,0 |
| 4 | 230 | 14 | 6,2 | 6,5 | 6,5 | 7,6 | 9,2 |
| 5 | 230 | 16 | 6,6 | 7,2 | 7,2 | 8,0 | 10,0 |
| 6 | 230 | 18 | 7,2 | 7,6 | 7,8 | 8,7 | 10,8 |
| 7 | 230 | 20 | 7,0 | 7,2 | 7,2 | 7,3 | 8,6 |
Зависимость концентрации экстрагируемых веществ от времени ультразвукового воздействия - Таблица 3
№ опыта |
УЗ, Вт/см |
вр.обраб. мин |
Плотность г/см |
осадок, г |
% |
| 1 | 230 | 8 | 0,95 | 0,0008 | 0,016 |
| 2 | 230 | 10 | 0,96 | 0,0010 | 0,020 |
| 3 | 230 | 12 | 0,96 | 0,0013 | 0,027 |
| 4 | 230 | 14 | 0,96 | 0,0017 | 0,035 |
| 5 | 230 | 16 | 0,96 | 0,0024 | 0,049 |
| 6 | 230 | 18 | 0,96 | 0,0026 | 0,054 |
| 7 | 230 | 20 | 0,96 | 0,0032 | 0,066 |
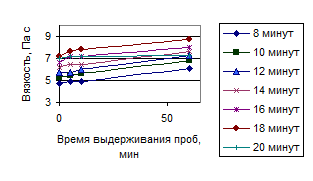
Рисунок 5 – Зависимость восстановления вязкости полученных растворов полисахаридов от времени обработки ультразвуком (230 Вт/см2 )
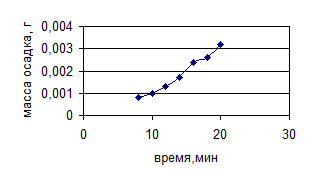
Рисунок 6 – Зависимость массы сухого остатка от времени обработки ультразвуком (230 Вт/см2 )
Вторая серия опытов.
Зависимость вязкости от времени ультразвукового воздействия - Таблица 4
№ опыта |
вр.обраб. мин |
вязкость, Па с | |||||
| УЗ Вт/см |
0 мин | 5 мин | 10 мин | 60 мин | 1440 мин | ||
| 1 | 276 | 8 | 4,8 | 5,0 | 5,1 | 5,3 | 18,5 |
| 2 | 276 | 10 | 5,9 | 6,0 | 6,0 | 6,0 | 19,8 |
| 3 | 276 | 12 | 7,2 | 7,2 | 7,2 | 7,4 | 21,0 |
| 4 | 276 | 14 | 10,0 | 10,4 | 10,7 | 11,4 | 27,2 |
| 5 | 276 | 16 | 10,4 | 10,5 | 10,7 | 11,5 | 27,9 |
| 6 | 276 | 18 | 7,0 | 7,1 | 7,2 | 7,6 | 22,9 |
| 7 | 276 | 20 | 5,7 | 6,0 | 6,0 | 6,3 | 21,7 |
Зависимость концентрации экстрагируемых веществ от времени ультразвукового воздействия – Таблица 5
№ опыта |
УЗ Вт/см2
|
вр.обраб. мин |
плотность, г/см |
осадок, г |
% |
| 1 | 276 | 8 | 0,97 | 0,0016 | 0,032 |
| 2 | 276 | 10 | 0,96 | 0,0022 | 0,045 |
| 3 | 276 | 12 | 0,96 | 0,0051 | 0,105 |
| 4 | 276 | 14 | 0,96 | 0,0052 | 0,107 |
| 5 | 276 | 16 | 0,96 | 0,0054 | 0,112 |
| 6 | 276 | 18 | 0,96 | 0,0056 | 0,116 |
| 7 | 276 | 20 | 0,96 | 0,0058 | 0,120 |
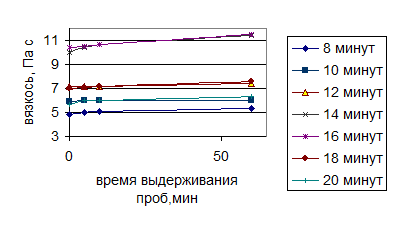
Рисунок 7 – Зависимость восстановления вязкости полученных растворов полисахаридов от времени обработки ультразвуком (276 Вт/см2 )
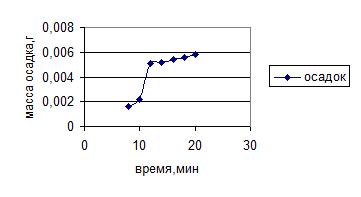
Рисунок 8 – Зависимость массы сухого остатка от времени обработки ультразвуком (230 Вт/см2 )
Третья серия опытов.
Зависимость вязкости от времени ультразвукового воздействия - Таблица 6
вр.обраб мин. |
вязкость, Па с | ||||||
| № опыта | УЗ, Вт/см |
0 мин | 5 мин | 10 мин | 60 мин | 1440 мин | |
| 1 | 322 | 8 | 7,3 | 7,6 | 7,6 | 7,8 | 8,7 |
| 2 | 322 | 10 | 8,2 | 8,4 | 8,5 | 8,7 | 10,7 |
| 3 | 322 | 12 | 8,9 | 9,0 | 9,2 | 9,6 | 11,6 |
| 4 | 322 | 14 | 8,1 | 8,4 | 8,4 | 8,5 | 10,9 |
| 5 | 322 | 16 | 7,1 | 7,3 | 7,3 | 7,5 | 10,0 |
| 6 | 322 | 18 | 6,8 | 7,0 | 7,1 | 7,3 | 7,7 |
| 7 | 322 | 20 | 6,6 | 6,7 | 6,7 | 6,9 | 7,4 |
Зависимость концентрации экстрагируемых веществ от времени ультразвукового воздействия - Таблица 7
№ опыта |
УЗ, Вт/см |
вр.обраб. мин |
плотность, г/см |
осадок, г |
% |
| 1 | 322 | 8 | 0,96 | 0,0059 | 0,0012 |
| 2 | 322 | 10 | 0,96 | 0,0062 | 0,0012 |
| 3 | 322 | 12 | 0,97 | 0,0063 | 0,0013 |
| 4 | 322 | 14 | 0,96 | 0,0065 | 0,0013 |
| 5 | 322 | 16 | 0,95 | 0,0065 | 0,0013 |
| 6 | 322 | 18 | 0,95 | 0,0066 | 0,0014 |
| 7 | 322 | 20 | 0,95 | 0,0073 | 0,0015 |
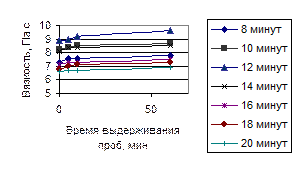
Рисунок 9 – Зависимость восстановления вязкости полученных растворов полисахаридов от времени обработки ультразвуком (322 Вт/см2 )
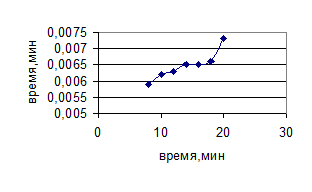
Рисунок 10 – Зависимость массы сухого остатка от времени обработки ультразвуком (322 Вт/см2 )
3.3 Определение оптимальных параметров ультразвукового воздействия
Для определения оптимальных параметров ультразвукового воздействия (время и интенсивность) воспользуемся зависимостями вязкости полученных растворов полисахаридов и массы сухого остатка от интенсивности ультразвука и от времени обработки.
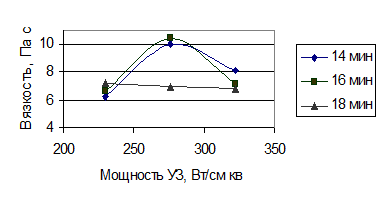
Рисунок 11 – Зависимость вязкости полученных растворов полисахаридов от интенсивности ультразвука
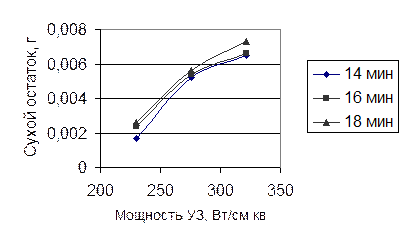
Рисунок 12 – Зависимость массы сухого остатка от интенсивности ультразвука
Следует подчеркнуть, что увеличение вязкости в каждой серии опытов имеет экстремум. Время появления экстремума сокращается по мере увеличения интенсивности УЗ воздействия. Концентрационная зависимость экстремума не имеет, что свидетельствует о нарастании количества экстрагируемых веществ с увеличением интенсивности и времени УЗ воздействия. Сопоставление этих двух зависимостей и дает оптимальные условия: нарастание концентрации и уменьшение вязкости после оптимальной точки свидетельствует о деструкции нативных полисахаридов.
Оптимальные параметры процесса ультразвуковой экстракции полисахаридов льна: мощность 276 Вт/см2 и продолжительность 16 минут.
При данном ультразвуковом воздействии выход полисахаридов составляет 0,22 г (4,4 % по отношению к исходному сырью).
3.4 Методы анализа и контроля процесса экстракции
Как уже отмечалось выше, полученный сухой остаток повторно растворяли в объеме воды равном исходному (взятому для экстракции). При этом вязкость растворов полисахаридов полностью восстанавливается, что свидетельствует о сохранении полисахаридами нативной формы.
3.4.1 Получение контрольных экстрактов полисахаридов льна
Контрольные экстракты полисахаридов льна (кислотная и солевая формы) выделяли по стандартной методике .
Для получения кислых полисахаридов в кислотной форме 20 г чистых семян льна заливают 80 мл дистиллированной воды. Смесь оставляют на 24 часа, а затем нагревают на паровой бане до 800 С, прибавляют 16 мл 12%-ной НСl и продолжают нагревание в течение 3 минут. Горячий раствор быстро фильтруют через воронку Бюхнера с несколькими слоями ткани и семена дважды промывают водой. Фильтрат немедленно прибавляют к 5 объемам спирта. Белый волокнистый осадок, который поднимается на поверхность, отделяют и помещают в новую порцию спирта. Растворитель удаляют фильтрованием на воронке Бюхнера, осадок промывают спиртом и диэтиловым эфиром и сушат [24].
Для выделения нейтральных полисахаридов в солевой форме пользуются этой же методикой, но фильтрат прибавляют к 5 объемам ацетона.
Из выделенных полисахаридов были приготовлены растворы концентрацией 0,112% (соответствует концентрации, получаемой при оптимальном ультразвуковом воздействии) и снята зависимость вязкости этих растворов от температуры. Результаты представлены в таблице 7 и на рисунках 10-11.
Зависимость вязкости полисахаридов от температуры - Таблица 8
| Температура, 0 С | Вязкость Па с |
|
Полисахариды в солевой форме |
Полисахариды в кислой форме |
|
| 25 | 2,42 | 1,53 |
| 30 | 2,32 | 1,44 |
| 35 | 2,13 | 1,4 |
| 40 | 1,99 | 1,3 |
| 45 | 1,83 | 1,1 |
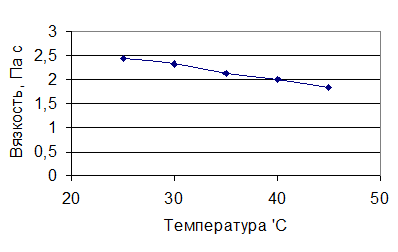
Рисунок 13 - Зависимость вязкости нейтральных полисахаридов в солевой форме от температуры.
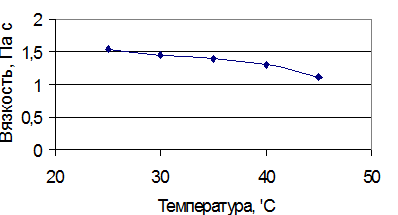
Рисунок 14 - Зависимость вязкости кислых полисахаридов в кислой форме от температуры.
Для иллюстрации эффективности применения ультразвука с целью интенсификации процесса экстракции полисахаридов из семян льна был проведен опыт по получению полисахаридов традиционным настаиванием. Установлено, что для получения такой же вязкости и такого же сухого остатка, что и при оптимальных параметрах ультразвукового воздействия, необходимо настаивание семян льна с водой в течение 25 часов.
3.4.2 Использование методов ИК-спектроскопии
Экстракты анализировались методом ИК-спектроскопии с использованием прибора Фурье-спектрометра «ИНФРАЛЮМ ФТ» (НПФ АП «ЛЮМЭКС», 1999 г.).
Назначение . Инфракрасный фурье-спектрометр «ИНФРАЛЮМ ФТ» предназначен для регистрации спектров поглощения или пропускания жидких, твердых и газообразных веществ в средней инфракрасной области, т.е. в диапазоне 500…4500 см-1 .
Подготовка образцов: сушка в вакуум-эксикаторе - 48 часов; эмульсия в вазелиновом масле; окошко – КBr [58,59].
Основные технические данные и характеристики ИНФРАЛЮМ-ФТ– Таблица 9
| Характеристика | Параметры |
| Полный спектральный диапозон | 350…6000 см-1 ; 1,7…28,6 мкм 500…6000 см-1 ; 1,7…20 мкм |
| Спектральный диапозон с нормированными фотометрическими характеристиками | 550…4500 см-1 2,2…18 мкм |
| Спектральное разрешение | 0,25; 0,5; 1 (1,25); 2; 4; 8; 16 см-1 |
| Предел допускаемой абсолютной погрешности измерений по шкале волновых чисел | Не более ± 0,05 см-1 |
| Уровень шумов линии 100% пропускания в спектральном диапозоне 2000±50 см-1 при разрешении 4 см-1 | Не более 0,02 % пропускания |
| Скорость сканирования оптической разности хода | 2,5; 3,3; 5,0; 7,8 кГц по частоте интерферограммы синхронизирующего лазера |
| Время измерения одной интерферограммы | 2,5 с (при разрешении 1 см-1 ) 0,3 с (при разрешении 16 см-1 ) |
| Тип интерферометра | Устойчивый к разъюстировкам, герметичный и осушаемый интерферометр ДКГ |
| Оптическая схема | Однолучевая |
| Светоделитель | Пластина из бромистого калия (или селенида цинка) со светоделительным покрытием из германия |
| Источник излучения Высокотемпературный керамический излучатель | |
| Детектор | Пироэлектрический (LiTaO3 ) |
| Синхронизация отсчетов | С помощью гелий-неонового лазера |
| Управление усилителем | автоматическое |
| Мощность, потребляемая спектрометром | Не более 0,1 кВа |
Результаты ИК-спектроскопии
Параметры регистрации спектра:
границы диапозона: нижняя 500 см-1 ;
верхняя 4500 см-1 .
Разрешение 1 см-1
При расшифровке спектров полисахаридов льна руководствовались следующими исходными данными (таблица 10)[60].
Частоты колебаний функциональных групп полисахаридов льна – таблица 10
| Функциональная группа | Частота колебаний, см-1 |
| С-Н | 2920-2850 |
| С=0 | 1740 |
| СООН | 1598 |
ИК-спектры полисахаридов льна, полученные традиционным настаиванием и при ультразвуковой экстракции представлены на рисунке 15.
Заключение
Ультразвуковое воздействие с интенсивностью от 230 Вт/см2 до 320 Вт/см2 может быть успешно использовано для интенсификации процесса экстракции полисахаридов из семян льна.
Определены оптимальные параметры ультразвукового воздействия для достижения максимального выхода нативных полисахаридов в раствор (мощность 276 Вт/см2 и продолжительность 16 минут).
Установлено, что увеличение вязкости экстракта симбатно нарастанию мощности ультразвукового воздействия до определенного предела (оптимума). Дальнейшее увеличение мощности приводит к деградации полисахаридных цепей.
Список использованных источников
1. Гинстлинг А. М., Барам А.А. Ультразвук в процессах химической технологии.- Л.: ГОСХИМИЗДАТ, 1960.-96 с.
2. Новицкий Б. Г. Применение акустических колебаний в химико-технологических процессах. –М.: Химия, 1983. –192 с.
3. Касаткин А. Г. Основные процессы и аппараты химической технологии. -М.: Химия, 1971.- 784 с.
4. Лысянский В. М., Гребенюк С. М. Экстрагирование в пищевой промышленности. – М.: Агропромиздат, 1987. – 188 с.
5. Романков П. Г., Курочкина М. И. Экстрагирование из твердых материалов. -М.: Химия, 1983. –244 с.
6. Жарова Е. Я. Применение ультразвука при кристаллизации глюкозы (Обзор).-М.: Центр НИИИиТЭИ пищ.пр-сти, 1974. –32 с.
7. Karamfilov V.K., Fileman T.W., Evans K.M., Mantoura R.F.C. Determination of Dimethoate and Fenitrothion in Estuarine Samples by C-18 Solid-Phase Extraction and High-Resolution Gas-Chromatography with NitrogenPhosphorus Detection // Anal chim acta. – 1996. – V. 335, Iss. 1-2. – P. 51-61.
8. Tikkanen K., Haataja S., Finne J. The Galactosyl-(Alpha-1-4)-Galactose-Binding Adhesin of Streptococcus-Suis - Occurrence in Strains of Different Hemagglutination Activities and Induction of Opsonic Antibodies // Infec immunity. – 1996. – V. 64, Iss. 9. - P.3659-3665.
9. Schneider R.J. Evaluation of an Extraction Method for Triazine Herbicides from Soils for Screening Purposes // Agribiol res. – 1995. – V. 48, Iss. 3-4. - P. 193-206.
10. Sawaizumi M., Maruyama Y., Onishi K., Iwahira Y. Endoscopic Extraction of Lipomas Using an Ultrasonic Suction Scalpel // Ann plastic surg. – 1996. – V. 36, Iss. 2. - P. 124-128.
11. Manoli E., Samara C. Polycyclic Aromatic-Hydrocarbons in Waste-Waters and Sewage-Sludge – Extraction and Cleanup for HPLC Analysis with Fluorescence Detection // Chromatographia. – 1996. – V. 43, Iss. 3-4. – P. 135-142.
12. Hartmann R. Polycyclic Aromatic-Hydrocarbons (PAHs) in Forest Soils - Critical-Evaluation of a New Analytical Procedure // Int j environ anal chem. – 1996. – V. 62, Iss. 2. - P. 161-173.
13. Engels W.J., Visser S. Development of Cheese Flavor from Peptides and AminoAcids by Cell-Free-Extracts of Lactococcus-Lactis Subsp Cremoris B78 in a Model System // Neth milk dairy. – 1996. – V. 50, Iss. 1. - P. 3-17.
14. Korolev S., Samko O., Eldarov M., Kalugin A. Site-Specific Endonuclease Bcuai from Bacillus-Cereus-A // Bioorg khim. – 1996. – V. 22, Iss. 7. - P. 528-531.
15. Mierzwa J., Adeloju S., Dhindsa H. Ultrasound Accelerated Solid-Liquid Extraction for the Determination of Selenium in Biological Samples by Electrothermal Atomization Atomic-Absorption Spectrometry // Anal sci. – 1997. – V. 13, Iss. 2. - P. 189-193.
16. А. с. SU 1286232 А1 В 01 D 11/02. Способ экстрагирования из твердого тела / А. А. Долинский, В. Н. Мудриков, Р. Н. Корчинский (СССР). - №3936068/31-26; Опубл. 08.08.1985, Б. И. № 22.
17. Гершал Д. А., Фридман В. М. Ультразвуковая аппаратура. –М.: Энергия, 1967. –300 с.
18. Бабиков О. И. Ультразвук и его применение в промышленности.-М.: Гос.издат.физико-математ.лит-ры, 1958. – 260 с.
19. Маргулис М. А. Основы звукохимии. - М.: Высш. Шк., 1984 – 272 с.
20. Карпович В.Н., Беспалова Е.И. Фармакогнозия. – М.: Медицина, 1977. – 448 с.
21. Кьосев П.А. Полный справочник лекарственных растений. - М.: Эксмо-пресс,2000-992 с.
22. Методы химии углеводов/Под ред. Кочеткова Н.К. – М.: Мир, 1967 – 515с.
23. Муравьева Д.А. Фармокогнозия. - М.: Медицина, 1978.- 656 с.
24. Кочетков Н.К. Химия углеводов. – М.: Химия, 1967.-672 с.
25. Chourasia M.K.,Jain S.K. Pharmaceutical approaches to colon targeted drug delivery system// Pharm. Sci. – 2003,6, 33-36
26. Ayres D.C., and Loike, J.D. (1990) Lignans: Chemical, Biological and Clinical Properties, 402 pages Cambridge University Press, Cambridge, United Kingdom.
27. Sakakibara, A., Sasaya, T., Miki, K., and Takahashi, H. (1987) Holzforsckung 41, 1-11.
28. Faure, M., Ussi, E., Tbrres, R., and Videla, L.A. (1990) Photochemistry 29, 3773-3775.
29. Osawa, T., Nagata, M., Namiki, M., and Fukuda, Y. (1985) Agric. Biol . Churn. 49, 3351-3352.
30. Hattori, M., Hada, S., Watahiki, A., Ihara, H., Shu, Y.-Z., Kakjuchi, N., Mizuno, T., and Namba, T. (1986) Chem. Pharm Bull 34, 3885-3893.
31. Belmares, H., Barrera, A., Castillo, E., Ramos, L. P., Hernandez, R. and Hernandez. V. (1979) Ind. Eng, Chem. Prod . Res. Deu 18, 220-226.
32. Markkanen, T., Makinen, M. L., Maunuksela, E., and Himanen, P. (1981) Drugs Eiptl. Clin. Res. 7, 711-718.
33. Harmatha, J., and Nawrot, J. (1984) Buxhem Syst. Ecoi 12, 95-98.
34. Elakovich, S. D., and Stevens, K. L. (1985) J. Chem. Ecol 11, 27-33.
35. Binng, A. N., Chen, R. H., Wood, H N., and Lynn, D. G (1987) Proc. Natl. Acad. Sci. U. S A. 84, 980-984.
36. Rahman, M. M. A., Dewick, P. M., Jackson, D E., and Lucas, J. A. (1990) Phytochemistry 28, 1841-1846.
37. Adlercreutz H., Lancet Oncology, 3, 364—373 (2002).
38. Juntunen K. S., Mazur W. M., Liukkonen K. H., British .J. Nutr,, 84, 839—846 (2000).
39. Jacobs D. R., Jr., Percira M. A., Stumpf K., Pins J.J., Adlercreutz H., British J. Nutr., 88, 111—116 (2002).
40. Adlercreutz H., Fotsis T., Bannwart C., Wahala K., Makela T., Brunow G., Hase T., J. Steroid Biochem., 25, 791—797 (1986).
41. Ingram D., Sanders K., Kolybaba M., Lopez D., Lancet, 350, 990— 994 (1997)
42. Adlercreutz, H. (1984) Gastroentorology 86, 761-764.
43. Adlercreutz, H. (1991) in Nutrition, Tenacity and Cancer (Rowland, I. R . ed), pp. 137-195, CRC Press, Boca Raton, FL.
44. Borriello, S. P., Setxhell, K. D. R., Axelson, M., and Lawaon, A M (1985) J. Appl. Bacterial. 58, 37-43.
45. Schroder. H. C., Merz. H., Steffen, R., Muller, W.E.G., Sarin. P.S , Trumm, S.,Schulz, J., and Eich, E. (1990) Z. Naturforsch. 45c, 1215-1221.
46. Ozawa, S., Davin, L.B., and Lewia, N.G. (1993) Phytochemistry 32, 643-652.
47. Finlay K. M., Wilson D. W., Aldercreutz H., Griffiths K. The identification and measurement of phytoestrogens in humen saliva, plasma, breast aspirate or cyst fluid and prostatic fluid using gascromatography-mass spectrometry. Endocrinology, 12(49), (1991).
48. Hulten K., Winkvist A., Lenner P., Johansson R., Adlercreutz H., Hall-mans G., Euro. J. Nutr., 41, 168—176 (2002).
49. Price K. R., Fenwick G. R. Naturally occuring oestrogens in foods. Rewiwe. Food Addit. Contam. 2, 73 – 106 (1985).
50. Rickard S.E., Thompson L. U. Phitoestrogens and lignans: effects on reproduction and chronic disease. In: Antinutrients and Phytochemicals in food (Shahidi F., ed.), 273 – 293. American Chemical Society, Washington, DC.
51. Axelson M., Sjovall J., Gustafsson B.E., Setchell K.D.R., Nature (London), 298, 659—660 (1982).
52. Borriello S. P., Setchell K. D. R., Axelson M., Lawson A. M., J. Appl. Bacteriol., 58, 37—43 (1985).
53. Wang L. Q., Meselhy M. R., Li Y., Qin G. W., Hattori M., Chem. Pharm. Bull., 48, 1606—1610 (2000).
54. Heinonen S., Nurmi T., Liukkonen K., Poutanen K., Wahala K., Deyama T., Nishibe S., Adlercreutz H., J. Agric. Food Chem., 49, 3178—3186 (2001).
55. Xie L. H., Aim E. M., Akao T., Abdel-Hafez A. A., Nakamura N.. Hattori M., Chem. Pharm. Bull., 51, 378—384 (2003).
56. Sih C.J., Ravikumar P. R., Huang F.C., Buckner C., Whitlock H., Jr., J. Am. Chem. Sac., 98, 5412—5413 (1976).
57. Owen R.W., Mier W., Giacosa A., Hull W. H., Spiegelhalder B., Bartsch H., Clin. Chem ., 46, 976—988 (2000).
58. Библиотека Фурье-ИК спектров фирмы Алдрич.
59. Kacurakova M,Wilson R.H. Developments in mid-infrared FT-IR spectroscopy of selected carbohydrates. Carbohydrate Polymers 44 (2001) 291 - 303.
60. Le-Tien C.,Miiiette M., Mateescu M.A., Lacroix M.- Modified alginate and chitosan for lactic acid bacteria immobilization – Biotechnol. Appl.Biochem (2004),39 347-354.