| Скачать .docx |
Реферат: Вода в химической промышленности
Вода в химической промышленности
Использование воды, свойства воды
Химическая промышленность - один из крупных потребителей воды. Вода используется почти во всех химических производствах для разнообразных целей. На отдельных химических предприятиях потребление воды достигает 1млн м3 в сутки. Превращение воды в один из важнейших элементов химического производства объясняется:
• наличием комплекса ценных свойств (высокая теплоемкость, малая вязкость, низкая температура кипения);
• доступностью и дешевизной (затраты исключительно на извлечение и очистку);
• не токсичностью;
• удобством использования в производстве и транспортировке.
В химической промышленности вода используется в следующих направлениях:
1. Для технологических целей в качестве:
- растворителя твердых, жидких и газообразных веществ;
- среды для осуществления физических и механических процессов (флотация, транспортировка твердых материалов в виде пульпы);
- промывной жидкости для газов;
- экстрагента и абсорбента различных веществ.
2. Как теплоноситель (в виде горячей воды и пара) и хладагента для обогрева и охлаждения аппаратуры.
3. В качестве сырья и реагента для производства различной химической продукции (водорода, ацетилена, серной и азотной кислот.).
Воды морей и океанов - источники сырья для добычи многих химических веществ: из них извлекаются NaС1, МgСl, Br, I и др. продукты. Так например, содержание элементов в водах океана составляет: К-3.8 *10-2%, V- 5*10-8 %, Аu -4*10-10 %, Аg -5*10-9 %. Приняв массу воды на планете-1.4 *1018 , получим соответственно содержание в ней Аu-5.6 * 106 т.
Масштабы потребления воды химической промышленностью зависят от типа производства. Так, расходный коэффициент по воде (м3 /т продукции) составляет: для азотной кислоты - 200, аммиака- 1500, синтетического каучука-1600. Например, завод капронового волокна расходует такое же количество воды, как город с населением 400тыс. человек. Общее количество воды на Земле составляет 1.386 *1018 м3
Природную воду принято делить на 3 вида, сильно различающихся по наличию примесей:
Атмосферная вода - вода дождевых и снеговых осадков, содержит минимальное количество примесей, главным образом, растворенные газы СО2 , О2 а в промышленных районах N0х, SОх. Почти не содержит растворенные соли.
Поверхностная вода - речные, озерные, морские, содержат различные минеральные и органические вещества, природа и концентрация которых зависят от климата, геоморфологических и гидротехнических мероприятий.
Подземная вода — вода артезианских скважин, колодцев, ключей, гейзеров. Для них характерно высокое содержание минеральных солей, выщелачиваемых из почвы и осадочных пород и малое содержание органических веществ.
Морская вода представляет многокомпонентный раствор электролитов и содержит все элементы, входящие в состав литосферы.
Вода, используемая в химической промышленности должна удовлетворять по качеству определенным требованиям. Качество воды определяется совокупностью физических и химических характеристик, к которым относятся: цвет, прозрачность, запах, общее солесодержание, жесткость, рН, окисляемость. Для промышленных вод важнейшими из этих характеристик являются солесодержание, жесткость, рН, содержание взвешенных веществ.
Жесткостью называется свойство воды, обусловленное присутствием в ней солей Са и Мg. В зависимости от природы анионов различают временную жесткость (устранимую, карбонатную), удаляемую при кипячении - Жв и постоянную (некарбонатную) - Жп. Сумма Жв и Жп называется общей жесткостью воды
Жо = Жв + Жп
Принята следующая классификация по жесткости: мягкая (Са и Мg до 3 мгэкв/л), умеренно- жесткая(3-6 мгэкв/л) и жесткая (более 6 мгэкв/л).
В зависимости от солесодержания природные воды делятся на пресные (с/с менее 1г/кг), солоноватые (с/с от 1 до 10 г/кг) и соленые (с/с более 10г/кг.
Окисляемость воды обусловлена наличием в воде органических примесей и определяется количеством мг перманганата калия, израсходованного при кипячении 1л воды.
РН воды характеризует ее кислотность щелочность.
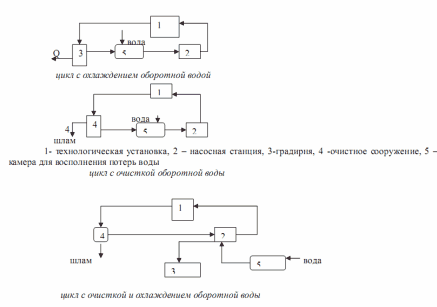
Водооборотные циклы химико-технологических производств являются важным фактором рационального использования водных ресурсов. В этих циклах осуществляется многократное использование воды без выброса загрязненных стоков в водоемы, а потребление свежей воды для ее восполнения ограничено только технологическими превращениями и естественными потерями. В химических производствах используется 3 схемы водооборота в зависимости от технологических изменений, которые вода претерпевает в процессе производства.
Вода только нагревается и д.б. перед возвратом охлаждена в бассейне или градирне.
Вода только загрязнена и д. б. перед возвращением очищена в специальных очистных сооружениях.
Вода нагревается и загрязнена. Это комбинация 1 -го и 2 -го типа ВОЦ.
Промышленная водоподготовка
вода химический коллоидный водоподготовка
Вредное влияние примесей, содержащихся в промышленной воде, зависит от их химической природы, концентрации, дисперсного состояния, а также технологии конкретного производства использования воды. Все вещества, присутствующие в воде, могут находиться в виде истинного раствора (соли, газы, некоторые органические соединения в коллоидном состоянии) и во взвешенном состоянии (глинистые, песчаные, известковые частицы).
Растворенные в воде вещества образуют при нагревании накипь на стенках аппаратуры и вызывают коррозионное разрушение ее. Коллоидные примеси вызывают загрязнение диафрагмы электролизеров, вспенивание воды. Грубодисперсные взвеси засоряют трубопроводы, снижают их производительность, могут вызвать их закупорку. Все это вызывает необходимость предварительной подготовки воды, поступающей на производство- водоподготовку.
Промышленная водоподготовка представляет собой комплекс операций, обеспечивающих очистку воды - удаление из нее вредных примесей, находящихся в молекулярно-растворенном, коллоидном и взвешенном состоянии. Основные операции водоподготовки: очистка от взвешенных веществ отстаиванием и фильтрованием, умягчение, в отдельных случаях - обесцвечивание, нейтрализация, дегазация и обеззараживание.
Процесс отстаивания позволяет осветлять воду вследствие удаления из нее грубодисперсных веществ, оседающих под действием силы тяжести на дно отстойника. Отстаивание воды проводится в непрерывно- действующих отстойных бетонированных резервуарах. Для достижения полноты осветления и обесцвечивания декантируемую из отстойника воду подвергают коагуляции с последующим фильтрованием.
Коагуляция - высокоэффективный процесс разделения гетерогенных систем, в частности, выделение из воды мельчайших глинистых частиц и белковых веществ. Осуществляют коагуляцию введением в очищаемую воду небольших количеств электролитов Al2 (S04 )3 > FеS04 и др. соединений, называемых коагулянтами. Физико-химическая сущность этого процесса в упрощенном виде состоит в том, что коагулянт в воде превращается в агрегат несущих заряд частиц, которые взаимодействуя с противоположно заряженными частицами примесей, обуславливают выпадение нерастворимого коллоидного осадка. Так, А12 (Б04 )3 в результате гидролиза и взаимодействия с солями кальция и магния, растворенными в воде, образует хлопьевидные положительно заряженные частицы А1(0Н)3
А12 (Б04 ) 3 +6 Н2 0 = 2А1(0Н) 3 +3Н2 0 Н2 S04 + Са(НС03 )2 = СаS04 +2Н2 0 +2С02
Взаимодействие положительно заряженных частиц гидроокиси алюминия и несущих отрицательный заряд примесей приводит к быстрой коагуляции. Одновременно идет процесс адсорбции на поверхности осадка органических красящих веществ, в результате чего вода обесцвечивается. Обеззараживание воды обеспечивается ее хлорированием или озонированием. Дегазация — удаление из воды растворенных газов достигается химическим способом, при котором газы поглощаются химическими реагентами, например, в случае диоксида углерода:
СО2 + Са(ОН)2 = СаСО3 +Н2 О,
или физическими способами - термической деаэрацией на воздухе или в вакууме. Одной из основных и обязательных операций водоподготовки технологической воды является ее умягчение.
Схема промышленной водоподготовки
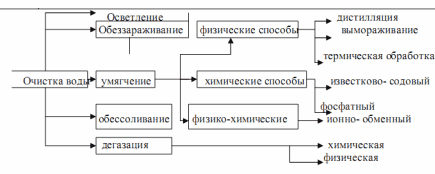
Умягчением называется обработка воды для понижения ее жесткости, т.е. уменьшения концентрации ионов кальция и магния различными физическими, химическими и физико-химическими методами.
При физическом методе воду нагревают до кипения, в результате чего растворимые гидрокарбонаты кальция и магния превращаются в их карбонаты, выпадающие в осадок:
Са(НСО3 )2 = СаСО3 + Н2 О +СО2 .
Этим методом удаляется только временная жесткость.
К химическим методам умягчения относятся фосфатный и известково-содовый, заключающийся в обработке тринатрийфосфатом или смесью гидроксида кальция и карбоната натрия. В первом случае протекает реакция образования нерастворимого трикальцийфосфата, выпадающего в осадок:
3СаS04 + 2 Na3 Р04 = 3Nа2 S04 + Са3 (Р04 ) 2
Во втором случае протекают две реакции. Бикарбонаты кальция и магния реагируют с гидроксидом кальция, чем устраняется временная жесткость: Са(НС03 )2 + Са(0Н)2 = 2 СаС03 +2 Н2 0 , а сульфаты, нитраты и хлориды - с карбонатом натрия, чем устраняется постоянная жесткость:
СаS04 + Nа2 С03 = Са С03 +Nа2 Б04 .
Обессоливание применяется в тех производствах, где к воде предъявляются особо жесткие требования по чистоте, например, при получении полупроводниковых материалов, химически чистыхреактивов, фармацевтических препаратов. Обессоливание воды достигается методом ионного обмена, дистилляцией, электродиализом.
Метод ионного обмена основан на свойстве некоторых твердых тел (ионитов) поглощать из раствора ионы в обмен на эквивалентное количество других ионов того же знака. Иониты подразделяются на катиониты и аниониты. Катиониты содержат подвижные катионы натрия или водорода, а аниониты подвижные ионы гидроксила. В качестве катионитов применяют сульфоугли, алюмосиликаты, искусственные смолы, в качестве анионитов искусственные смолы.
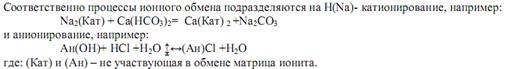
Поскольку процесс ионного обмена обратим, установление равновесия в системе означает прекращение процесса обессоливания. Поглощающая способность ионита характеризуется его обменной емкостью, равной количеству ионов кальция и магния, которое может поглотить единица объема или массы ионита, выраженное грамм-эквивалентах: гэкв/м3 и гэкв/кг. От величины обменной емкости при данном объеме ионита зависит время рабочего цикла ионитовых фильтров. При насыщении ионита он может быть регенерирован промывкой растворами для Н катионитов кислоты, Na катионитов хлорида натрия и для анионитов раствором щелочи. В приведенных выше примерах работы анионитов при этом протекают реакции:
![]()
Полное обессоливание воды обеспечивается ее дистилляцией (термическое обессоливание) обычно после того, как вода предварительно очистится с помощью ионитовых фильтров.
Схема обессоливания воды методом ионного обмена
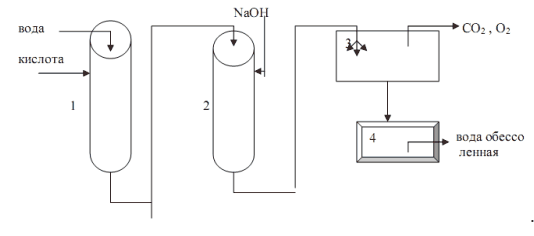
Вода последовательно проходит через катионитный и анионитный фильтры и поступает, распыляясь в дегазатор, где из нее удаляются растворенные диоксид углерода, кислород и другие газы. Для регенерации катионита в фильтр периодически подается кислота или раствор хлорида натрия, для регенерации анионита - раствор щелочи.
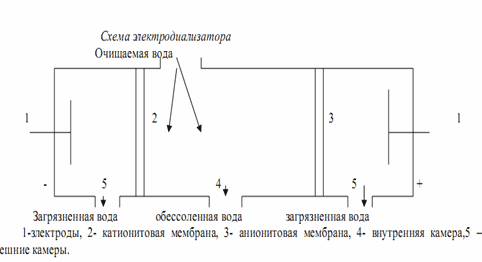
Электродиализом называется процесс диализа под воздействием электрического поля. При этом выделение солей из диализумого раствора происходит в результате перемещения ионов через пористые мембраны, содержащие катионит у катода и анионит у анода, с последующим их разрядом на электродах.
Водоподготовка в химическом производстве представляет весьма трудоемкий процесс и требует больших капитальных и эксплуатационных затрат. На современных химических предприятиях доля капитальных затрат на водоподготовку составляет 10-15% общего объема расходов на производство химической продукции.
Современные схемы промышленной водоподготовки включают все основные операции: осветление в грубых и коагуляционных отстойниках, фильтрование через зернистый материал, умягчение методом ионного обмена, дегазацию.