| Скачать .docx |
Реферат: Обмен углеводов 2
План
1. Химический состав и биологическая роль углеводов
2. Характеристика классов углеводов
3. Обмен углеводов в организме человека
4. Расщепление углеводов в процессе пищеварения и их всасывание в кровь
5. Уровень глюкозы в крови и его регуляция
6. Внутриклеточный обмен углеводов
7. Обмен углеводов при мышечной деятельности
1. Химический состав и биологическая роль углеводов
Углеводы — главные энергетические субстраты для ресинтеза АТФ при интенсивных и длительных физических нагрузках. От их содержания в скелетных мышцах и печени зависит физическая работоспособность, развитие процессов утомления. Углеводы занимают важное место в питании спортсменов, поскольку должны постоянно поступать в организм. Рассмотрим строение и функции отдельных классов углеводов, их внутритканевой обмен и влияние на энергетику мышечной деятельности.
Углеводы — это класс органических веществ, в состав которых входят атомы углерода (С), водорода (Н) и кислорода (О) в соотношении 1:2:1. Общая формула углеводов — СnН2nОn или (СН2О)n, где n — 3—9 атомов углерода. Согласно Международной классификации, углеводы называются глицидами, однако такое название употребляется редко. В состав отдельных углеводов могут входить и другие химические элементы, например азот, сера, фосфор.
По химическому строению углеводы являются альдегидоспиртами (альдозы) или кетоспиртами (кетозы). Альдозы содержат одну альдегидную функциональную группу
О
-С-Н
при первом углеродном атоме и несколько гидроксильных групп (-ОН) при других атомах углерода. Кетозы содержат одну кетогруппу
О
--С---
при втором углеродном атоме и гидроксильные группы. Примером альдоз является глюкоза, а кетоз — фруктоза.
Содержание углеводов в организме человека относительно небольшое и составляет до 2—3 % общей массы тела. Они откладываются в виде гликогена в печени (от 5 до 10 % общей массы), скелетных мышцах (1—3 %) и сердце (до 0,5 %). Запасы гликогена в организме взрослого человека с массой тела 70 кг составляют в среднем 500 г. Кроме гликогена, в организме присутствует свободная глюкоза, содержание которой в крови относительно невелико — около 5 г. В углеводах запасается примерно 2000 ккал энергии, за счет которой организм может физически интенсивно работать в течение 30 мин — 1 ч, а не интенсивно — в течение нескольких часов (до 12).
В организме человека углеводы синтезируются только в незначительном количестве в процессе глюконеогенеза, поэтому основное их количество поступает в организм с продуктами питания. Углеводы находятся преимущественно в продуктах растительного происхождения, так как их первичный синтез осуществляется в зеленых растениях в процессе фотосинтеза:
6СО2 + 6Н2О -----------------С6Н12О6 + 6О2
Хлорофилл
В отдельных растениях, например в злаках, содержание углеводов достигает 80 % их сухой массы. Суточная потребность человека в углеводах составляет 300—400 г, а спортсменов — 400—700 г.
В организме человека углеводы выполняют следующие биологические функции: энергетическую, пластическую, питательную, специфическую, защитную, регуляторную.
• Энергетическая. При распаде углеводов высвобождаемая энергия рассеивается в виде тепла или накапливается в молекулах АТФ. Углеводы обеспечивают около 50—60 % суточного энергопотребления организма, а при мышечной деятельности на выносливость — до 70 %. При окислении 1 г углеводов выделяется 17 кДж энергии (4,1 ккал). В качестве основного энергетического источника в организме используется свободная глюкоза или запасенные углеводы в виде гликогена.
• Пластическая. Углеводы (рибоза, дезоксирибоза) используются для построения АТФ, АДФ и других нуклеотидов, а также нуклеиновых кислот. Они входят в состав некоторых ферментов. Отдельные углеводы являются структурными компонентами клеточных мембран. Продукты превращения глюкозы (глюкуроновая кислота, глюкозамин и др.) входят в состав полисахаридов и сложных белков хрящевой и других тканей.
• Запас питательных веществ. Углеводы накапливаются (запасаются) в скелетных мышцах, печени и других тканях в виде гликогена. Запасы гликогена зависят от массы тела, функционального состояния организма, характера питания. При мышечной деятельности запасы гликогена существенно снижаются, а в период отдыха после работы восстанавливаются в основном за счет продуктов питания. Систематическая мышечная деятельность приводит к увеличению запасов гликогена, что повышает энергетические возможности организма.
• Специфическая. Отдельные углеводы участвуют в обеспечении специфичности групп крови, выполняют роль антикоагулянтов, являются рецепторами ряда гормонов или фармакологических веществ, оказывают противоопухолевое действие.
• Защитная. Сложные углеводы входят в состав компонентов иммунной системы; мукополисахариды находятся в слизистых веществах, которые покрывают поверхность сосудов носа, бронхов, пищеварительного тракта, мочеполовых путей и защищают от проникновения бактерий и вирусов, а также от механических повреждений.
• Регуляторная. Клетчатка пищи не расщепляется в кишечнике, но активирует перистальтику кишечника, ферменты пищеварительного тракта, улучшает пищеварение, усвоение питательных веществ.
2. Характеристика классов углеводов
В зависимости от сложности строения молекул углеводы классифицируются на три основных класса: моносахариды, олисахариды (в основном дисахариды) и полисахариды. Общая характеристика их представлена в табл. 1.
ТАБЛИЦА 1
Классы углеводов и их основные характеристики
 Полисахариды (С6Н10О5)
Полисахариды (С6Н10О5)
| Простые | Образованные двумя моносахаридами | Образованные многими моносахаридами |
| Основные представители | ||
| Глюкоза и фруктоза (С6) | Сахароза | Крахмал и клетчатка в растениях |
| Рибоза и дезоксирибоза (С5) | Мальтоза | Гликоген в тканях человека и животных |
| Глицериновый альдегид и диоксиацетон (С3) | Лактоза | Гиалуроновая кислота Гепарин |
Моносахариды
К моносахаридам относятся простые углеводы, которые при гидролизе не распадаются на более простые молекулы. В зависимости от числа атомов углерода в молекуле моносахариды делятся на триозы (С3Н6О3), тетрозы (С4Н8О4), пентозы (С5Н10О5), гексозы (С6Н12О6) и гептозы (С7Н14О7). Другие моносахариды в природе не встречаются, но могут быть получены синтетически.
Наиболее важную роль в организме человека выполняют представители гексоз — глюкоза и фруктоза, пентоз — рибоза и дезоксирибоза и триоз — глицериновый альдегид и диоксиацетон.
Глюкоза и фруктоза. Это основные энергетические субстраты организма человека. Они имеют одинаковый молекулярный состав (С6Н12О6), но разную структуру молекулы, так как различаются наличием функциональных групп. Глюкоза содержит альдегидную группу, а фруктоза — кетогруппу, т. е. они являются изомерами по положению карбонильной группы
О
--С---
Альдегидная группа
| С | Н-С-ОН |
| Н- С-ОН | С=О Кетогруппа |
| НО- С-Н | НО-С-Н |
| Н- С-ОН | Н-С-ОН |
| Н- С-ОН | Н-С-ОН |
| Н- С-ОН | Н-С-ОН |
Глюкоза Фруктоза
Для моносахаридов характерна также пространственная изомерия, или стереоизомерия, поскольку они содержат асимметрические атомы углерода (отмечены *), которые связаны с четырьмя различными атомами или группами атомов. Выделяют D-форму и L-форму изомеров глюкозы и других моносахаридов. В них гидроксильная группа при четвертом атоме углерода занимает разное пространственное положение:
| С | Н-С-ОН |
| Н- С-ОН | С=О Кетогруппа |
| НО- С-Н | НО-С-Н |
| Н- С-ОН | Н-С-ОН |
| Н- С-ОН | Н-С-ОН |
| Н- С-ОН | Н-С-ОН |
| D-глюкоза | L-глюкоза |
Организм человека может усваивать только D-форму моносахаридов, в то время как аминокислоты используются организмом только в виде L-изо-меров. Внутритканевые ферменты способны различать оптические изомеры веществ. Стереоизомерами глюкозы являются галактоза и манноза:
| Н | Н | Н |
| С=О | С=О | С=О |
| Н---С---ОН | Н--С—ОН | НО-С-Н |
| НО-С---Н | НО--С—Н | НО--С-Н |
| Н---С---ОН | НО-С—Н | Н---С-ОН |
| Н---С---ОН | Н--С-ОН | Н---С-ОН |
| Н---С---ОН | Н--С-ОН | Н---С-ОН |
| Н | Н | Н |
| Глюкоза | Галактоза | Манноза |
Галактоза входит в состав лактозы — основного дисахарида молока. В печени она под действием ферментов может превращаться в глюкозу.
В водной среде глюкоза и фруктоза находятся в основном в циклической форме. Циклизация молекулы происходит за счет внутримолекулярного взаимодействия альдегидной группы в молекуле глюкозы или кетогруппой в молекуле фруктозы с одной гидроксильной группой этого же моносахарида:

Циклические формы моносахаридов приобретают биологически реактивную гидроксильную группу при С1- или С2- атоме углерода, которая называется гликозидным гидроксилом. Она играет важную роль в химических превращениях этих моносахаридов, в частности участвует в образовании ди- и полисахаридов, фосфорных эфиров. Так, глюкоза участвует в мене веществ и энергии в виде фосфорного эфира глюкозо-1-фосфат, пускающего процесс распада глюкозы и синтеза полисахаридов. Для моносахаридов характерно образование и других фосфорных эфиров: глюкозо-6-фосфата, фруктозо-1,6-фосфата, фруктозо-1,6-дифосфата:

Фосфорилированные формы глюкозы и фруктозы в процессе их метаболизма способны взаимопревращаться, а также распадаться до триоз — фосфоглицеринового альдегида и фосфодиоксиацетона:

Из моносахаридов при замещении гидроксильных групп на аминогруппу (-NH2) образуются аминосахара. В организме человека наиболее важными аминосахарами являются глюкозамин и галактозамин:

Они входят в состав сложных углеводов мукополисахаридов, которые выполняют защитную и специфические функции, характерные для слизей, стекловидного тела глаз, синовиальной жидкости суставов, системы свертывания крови и др.
Из глюкозы в процессе ее восстановления или окисления образуются многие функционально важные вещества: аскорбиновая кислота (витамин С), спирт сорбит, глюконовая, глюкуроновая, сиаловые и другие кислоты.
Рибоза и дезоксирибоза. Эти углеводы в свободном виде встречаются редко. Чаще они входят в состав сложных веществ, т. е. используются в организме в пластических процессах. Рибоза участвует в биосинтезе нуклеотидов (АТФ, АДФ, АМФ и др.) и РНК, а также многих ко-ферментов (НАД, НАДФ, ФАД, ФМН, КоА). Дезоксирибоза участвует в биосинтезе дезоксирибонуклеотидов, которые являются структурным компонентом ДНК. Спирт рибитол, производное рибозы, входит в состав витамина В12 и некоторых дыхательных ферментов.
Рибоза и дезоксирибоза являются альдозами. В молекуле дезоксирибозы отсутствует атом кислорода при втором атоме углерода. Изомером положения функциональной карбонильной группы в рибозе является рибулоза:
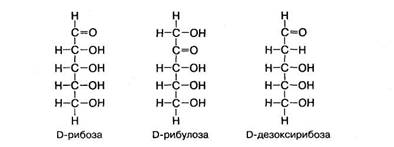
В организме рибоза и другие пентозы находятся также в циклической D-форме:

Рибоза и рибулоза синтезируются в тканях организма при окислении глюкозы в пентозном цикле. Дезоксирибоза образуется из рибозы при ее дезоксигенировании.
Глицериновый альдегид и диоксиацетон. Образуются они в тканях организма в процессе катаболизма глюкозы и фруктозы. Являясь изомерами, эти триозы способны к взаимопревращению:

В тканях организма в процессе метаболизма углеводов и жиров образуются фосфорные эфиры глицеринового альдегида и фосфодиоксиацетона. Фосфоглицериновый альдегид является высокоэнергетическим субстратом биологического окисления. В процессе его окисления образуется молекула АТФ и такие продукты окисления, как пировиноградная (ПВК) и молочная кислоты:

Дисахариды являются основной группой олигосахаридов, состоящих из небольшого количества (от 2 до 10) моносахаридов. В дисахаридах два остатка моносахаридов соединены между собой 1,4- или 1,2-гликозидными связями. Основными дисахаридами являются сахароза, мальтоза и лактоза. Их молекулярная формула — C12H22O11.
Сахароза состоит из остатка глюкозы и фруктозы, соединенных между собой 1,2-гликозидной связью, которая образуется при взаимодействии гидроксильной группы в первом атоме углерода глюкозы и гидроксильной группы при втором атоме углерода фруктозы:
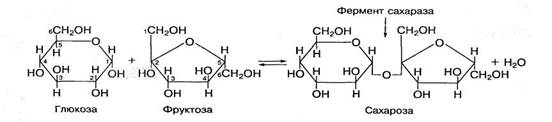
Сахароза является основным компонентом пищевого сахара. В процессе пищеварения под воздействием высокоспецифического фермента сахаразы она распадается на глюкозу и фруктозу.
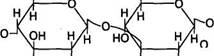
Мальтоза состоит из двух остатков глюкозы, соединенных между собой 1,4-гликозидной связью:
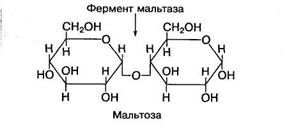
Мальтоза образуется в желудочно-кишечном тракте в процессе гидролиза крахмала или гликогена пищи. При пищеварении она расщепляется на молекулы глюкозы под воздействием фермента мальтазы. Много мальтозы содержится в солодовых экстрактах злаковых, проросших зернах.
Лактоза (молочный сахар) состоит из остатков глюкозы и галактозы, которые соединены между собой 1,4-гликозидной связью:

Лактоза синтезируется в молочных железах в период лактации. В коровьем молоке содержание ее составляет 5 %, в женском молоке — около 6%. В системе пищеварения человека лактоза расщепляется под воздействием фермента лактазы на глюкозу и галактозу. Поступление лактозы в организм с пищей способствует развитию молочнокислых бактерий, подавляющих в кишечнике развитие гнилостных процессов. Однако у людей, имеющих низкую активность фермента лактазы, который еще называется галактозидаза, развивается интолерантность к молоку.
Рассмотренные дисахариды, особенно сахароза (пищевой сахар), имеют сладкий вкус и высокую питательную ценность. Поэтому они не рекомендуются для питания людей, страдающих ожирением и диабетом. Их заменяют искусственными веществами, например сахарином, которые имеют сладкий вкус, но не усваиваются организмом.
Полисахариды
Полисахариды — это сложные углеводы, состоящие из многих сотен или тысяч связанных между собой остатков моносахаридов, в основном остатков глюкозы. Различают гомополисахариды, состоящие из остатков одинаковых моносахаридов, например глюкозы, и гетерополисахариды, состоящие из остатков разных моносахаридов и их производных.
Основными гомополисахаридами, которые выполняют важную биологическую роль и состоят из молекул глюкозы, являются крахмал и клетчатка в растениях, гликоген у человека и животных. Эти полисахариды не обладают сладким вкусом, плохо растворяются в воде, образуя коллоиды. Они имеют общую молекулярную формулу (С6Н10О5)n однако различаются количественным составом и строением молекул.
Крахмал — резервный полисахарид растений, состоящий из большого числа остатков D-глюкозы (до 300). Он является основным полисахаридом пищи, поставщиком глюкозы в организм человека. Молекулярная масса крахмала большая — от 50 000 до 300 000. По строению он неоднороден и представляет собой смесь спиралевидных цепей амилозы (10—20 %) и разветвленных цепей амилопектина (80—90 %). Остатки глюкозы в амилозе связаны между собой 1,4-гликозидной связью, а в точках ветвления амилопектина— 1,6-гликозидными связями (рис. 1,а,б).
Амилоза хорошо растворяется в воде, тогда как амилопектин не растворяется и образует коллоидный раствор — клейстер. При частичном разрушении структуры крахмала образуются соединения с меньшей молекулярной массой (декстрины), которые также хорошо растворяются в воде. Основными ферментами, расщепляющими крахмал пищи, являются амилазы слюны и сока поджелудочной железы.
Гликоген — основной резервный полисахарид тканей организма человека и животных. Состоит он из большого количества молекул глюкозы (до 30 000), соединенных между собой гликозидными связями (рис.1,в). Его молекулярная масса достигает 1—10 млн. Молекула гликогена имеет структуру, подобную амилопектину крахмала, но с большей степенью разветвления. Благодаря такой структуре гликоген способен растворяться в воде.
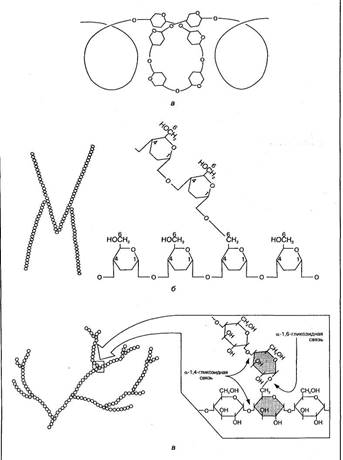
Рис. 1 Схема строения цепей крахмала — амилозы (а), амилопектина (6) и участка молекулы гликогена (в)
Накапливается (депонируется) гликоген преимущественно в печени (около 100 г) и скелетных мышцах (около 400 г), создавая запас глюкозы в организме.
Его концентрация в тканях зависит от состава пищи, характера мышечной деятельности, факторов окружающей среды (жара, гипоксия). При недостаточном поступлении углеводов с пищей или интенсивной мышечной деятельности запасы гликогена снижаются. При избыточном поступлении глюкозы с пищей запасы гликогена восстанавливаются. Гликоген печени используется для поддержания уровня глюкозы в крови в периоды между приемом пищи или интенсивном ее окисле-ми, а гликоген скелетных мышц — для энергообеспечения самих мышц (рис. 2).
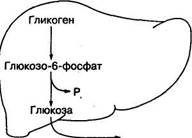
Глюкоза крови
Глюкозо-6-фосфат

Рис. 2 Использование гликогена печени и скелетных мышц
Клетчатка (целлюлоза) — это структурный полисахарид растений, придающий им прочность и эластичность. Это неразветвленный полимер, состоящий из большого числа остатков глюкозы. В организме человека клетчатка не расщепляется, однако она необходима для регуляции перистальтики и активности ферментов тонкого кишечника.
Пектиновые вещества относятся к гомополисахаридам, которые состоят из остатков производных галактуроновой кислоты. Образуются они в астениях. Различают два основных вида пектиновых веществ — протопектины и пектины. Протопектины не растворяются в воде, так как представляют собой соединение пектина с целлюлозой. Пектины растворяются в воде, превращаясь в желеобразную коллоидную массу. Благодаря своему строению они способны адсорбировать различные токсические соединения, в том числе тяжелые металлы, например свинец. В организме ни выполняют роль природного сорбента: очищают желудочно-кишечный тракт от пищевых шлаков. Следовательно, пектиновые волокна необходимы для организма человека.
Гетерополисахариды представлены в организме преимущественно мукополисахаридами. Мукополисахариды — это большая группа полисахаридов разного химического состава и строения, которые содержатся в коже, сухожилиях, хрящах, оболочках клеток, межклеточной и синовиальной жидкости. К наиболее важным для организма относятся гиалуроновая кислота, хондроитинсерная кислота и гепарин.
Гиалуроновая кислота является неразветвленным полимером глюкуроновой кислоты и глюкозамина:
Гиалуроновая кислота
СООН СН2ОН
Н ОН Н NH-C-СНз
Глюкуроновая Ацетилглюкозамин кислота
Она участвует в связывании воды в организме, придает внутрисуставной жидкости смазочные свойства, уменьшая трение при сгибании суставов, а также регулирует проницаемость клеточных мембран, выполняя роль биологического фильтра, который задерживает микробы и препятствует их проникновению в клетку.
Хондроитинсерная кислота является полимером глюкуроновои кислоты и сернокислого эфира ацетилгалактозамина.
В комплексе с белком коллагеном она входит в состав костей, хрящей, сердечных клапанов, стенок кровеносных сосудов, кожи и выполняет в организме опорную функцию.
Гепарин является полимером глюкуроновои кислоты и глюкозамина.
Впервые он был выделен из печени, поэтому и получил такое название. Обнаружен гепарин также в клетках легких, соединительной ткани и других органов. Из них он выделяется в кровь и межклеточную жидкость. Гепарин относится к природным антикоагулянтам (предотвращает свертывание крови), поэтому в клинике его применяют при переливании крови, а также для предупреждения и лечения тромбообразования в циркулирующей крови. Кроме того, гепарин обладает противовоспалительным действием, влияет на обмен калия и натрия, выполняет антигипоксическую функцию.
3. Обмен углеводов в организме человека
Обмен углеводов занимает центральное место в обмене веществ и энергии. Основные этапы обмена представлены на рис. 3. Сложные углеводы пищи подвергаются расщеплению в процессе пищеварения до моносахаридов, в основном глюкозы. Моносахариды всасываются из кишечника в кровь и доставляются в печень и другие ткани, где включаются в промежуточный обмен. Часть поступившей глюкозы в печени и скелетных мышцах откладывается в виде гликогена либо используется для других пластических процессов. При избыточном поступлении углеводов с пищей они могут превращаться в жиры и белки. Другая часть глюкозы подвергается окислению с образованием АТФ и выделением тепловой энергии. В тканях возможны два основных механизма окисления углеводов — без участия кислорода (анаэробно) и с его участием (аэробно).

Рис.3. Основные этапы обмена углеводов в организме человека
Анаэробное окисление глюкозы, которое называется гликолизом, включает реакции постепенного превращения ее молекулы в пировиноградную кислоту, а затем при недостаточности кислорода в тканях — в молочную кислоту. Этот процесс сопровождается образованием АТФ и выделением тепловой энергии. Гликолиз протекает преимущественно в скелетных мышцах при интенсивных физических нагрузках или в условиях гипоксии. Образовавшаяся молочная кислота из мышц поступает в кровь, доставляется в печень, где аэробно окисляется или используется для новообразования глюкозы.
Аэробное окисление глюкозы — многостадийный процесс распада ее молекулы до конечных продуктов метаболизма СО2 и Н2О с высвобождением энергии. Это основной механизм энергообразования во многих тканях, особенно в мозге, для которого глюкоза является главным энергетическим субстратом.
Глюкоза может окисляться по пентозофосфатному пути, который генерирует энергию в виде НАДФН2, используемую для биосинтеза веществ, и приводит к образованию рибозы и других пентоз.
Важным звеном обмена углеводов в тканях организма является процесс новообразования глюкозы из неуглеводных веществ (глюконеогенез).
4. Расщепление углеводов в процессе пищеварения и их всасывание в кровь
Расщепление сложных углеводов пищи начинается в ротовой полости под действием ферментов амилазы и мальтазы слюны. Оптимальная активность этих ферментов проявляется в щелочной среде. Амилаза расщепляет крахмал и гликоген, а мальтаза — мальтозу. При этом образуются более низкомолекулярные углеводы — декстрины, частично — мальтоза и глюкоза.
В желудке расщепление углеводов пищи не происходит, так как отсутствуют специфические ферменты гидролиза углеводов, а кислая среда желудочного сока (рН 1,5—2,5) подавляет активность ферментов слюны. В тонком кишечнике происходит основной распад углеводов пищи. В двенадцатиперстной кишке под действием фермента амилазы сока поджелудочной железы сложные углеводы постепенно расщепляются до дисахаридов. Далее дисахариды под действием высокоспецифических ферментов мальтазы, сахаразы и лактазы расщепляются до моносахаридов, в основном глюкозы, фруктозы, галактозы. Эти ферменты находятся на щеточной кайме эпителия слизистой оболочки кишечника, поэтому распад углеводов происходит не только в полости кишечника, но и на мембранах клеток слизистой оболочки.
В организм человека поступает большое количество клетчатки (целлюлозы). В тонком кишечнике она не расщепляется, так как отсутствуют ферменты, необходимые для ее гидролиза. Частичное расщепление клетчатки происходит до целлобиозы и глюкозы в толстом кишечнике под действием бактериальных ферментов. Образовавшиеся углеводы используются микроорганизмами для своей жизнедеятельности. Микроорганизмы также используют клетчатку для биосинтеза витаминов К, В12, фолиевой кислоты. Нерасщепившаяся целлюлоза выводится из организма.
Всасывание образовавшихся моносахаридов (глюкозы, фруктозы) стенками тонкого кишечника и поступление их в кровь происходит путем активного транспорта с участием белка-переносчика, градиента Na+ и АТФ. Ионы Na+ активируют АТФ-азу, которая ускоряет распад АТФ и освобождение энергии, необходимой для проникновения этих моносахаридов через стенки кишечника. Всасывание других моносахаридов осуществляется посредством пассивной диффузии, так как их содержание в крови низкое. Скорость всасывания отдельных моносахаридов неодинакова.
Так, если скорость всасывания глюкозы принять за 100 %, то скорость всасывания галактозы составит 110 %, фруктозы — 43, маннозы — 19, пентозы — 15, арабинозы — 9 %.
Процесс всасывания моносахаридов в кишечнике регулируется нервной и гормональной системами. Под действием нервной системы может измениться проницаемость кишечного эпителия, степень кровоснабжения слизистой оболочки кишечной стенки и скорость движения ворсинок, в результате чего меняется скорость поступления моносахаридов в кровь воротной вены. Всасывание глюкозы активируется гормонами коры надпочечников, гипофиза, щитовидной и поджелудочной желез и подавляется адреналином.
Интенсивная мышечная деятельность замедляет всасывание углеводов, а легкая и непродолжительная работа усиливает всасывание глюкозы. Повышение температуры окружающей среды до 35—40 °С угнетает, а понижение до 25 °С — усиливает всасывание углеводов, что связано, по-видимому, со стимуляцией энергетического обмена углеводов.
5. Уровень глюкозы в крови и его регуляція
Концентрация глюкозы в крови взрослого человека в норме поддерживается в пределах 4,4—6,0 ммоль л-1, или 80—120мг% (в 100 мл крови) несмотря на значительные изменения ее потребления и поступления в течение дня (рис. 4). Постоянный уровень глюкозы в крови регулируется прежде всего печенью, которая может поглощать или выделять глюкозу в кровь в зависимости от ее концентрации в крови и в ответ на воздействие гормонов. Повышение глюкозы в крови после приема углеводной пищи активирует ферментативный процесс синтеза гликогена в печени, а понижение ее уровня усиливает распад гликогена в печени до глюкозы с последующим выделением ее в кровь.
Важную роль в регуляции постоянного содержания глюкозы в крови играют гормоны, главным образом инсулин и глюкагон, проявляющие взаимопротивоположное действие. Инсулин усиленно секретируется поджелудочной железой при повышении глюкозы в крови после приема пищи и стимулирует поступление глюкозы в скелетные мышцы, печень и жировую ткань, что активирует синтез гликогена или жира (в жировой ткани). Глюкагон усиленно выделяется при снижении глюкозы в крови и запускает процесс расщепления (мобилизации) гликогена в печени, выделение глюкозы в кровь. При уменьшении концентрации глюкозы в крови скелетные мышцы и печень в качестве источника энергии начинают использовать жирные кислоты. Это также вносит свой вклад в поддержание определенной концентрации глюкозы в крови.

Рис.4. Схема регуляции уровня глюкозы в крови
При значительном поступлении углеводов с пищей или интенсивном распаде гликогена в печени уровень глюкозы в крови может превышать верхнюю границу нормы и достигать 10 ммоль • л-1 и более, что характеризуется как состояние гипергликемии. Гипергликемия может возникать и при снижении использования глюкозы тканями, что наблюдается при тяжелом заболевании — сахарном диабете. Связано это заболевание со снижением выработки гормона инсулина в поджелудочной железе (гипофункция), который усиливает проникновение глюкозы в ткани, либо с потерей чувствительности инсулиновых рецепторов к гормону. Временное повышение глюкозы в крови сразу после приема пищи, насыщенной углеводами, называется алиментарной, или пищевой гипергликемией. Через 2—3 ч после приема пищи содержание глюкозы в крови нормализуется. Состояние гипергликемии может наблюдаться у некоторых спортсменов перед стартом: оно улучшает выполнение кратковременных физических нагрузок, но ухудшает выполнение длительной работы. Повышение концентрации глюкозы в крови до 8,8—10 ммоль • л-1 (почечный барьер для глюкозы) приводит к появлению ее в моче. Такое состояние называется глюкозурией.
Снижение уровня глюкозы в крови до 3 ммоль л-1 и ниже (гипогликемия) наблюдается очень редко, так как организм способен синтезировать глюкозу из аминокислот и жиров в процессе глюконеогенеза. Гипогликемия может возникнуть при истощении запасов гликогена в печени в результате напряженной длительной физической работы, например при марафонском беге, или длительном голодании. Снижение концентрации глюкозы в крови до 2 ммоль л-1 вызывает нарушение деятельности мозга, эритроцитов, почек, для которых глюкоза является главным энергетическим субстратом. При этом возможна потеря сознания — гипогликемический шок или даже смерть. Для предотвращения такого состояния в практике спорта используется дополнительное углеводное питание во время длительной физической работы.
Глюкоза крови в большей степени (около 70 %) используется тканями как энергетический источник и в меньшей степени (30 %) - для пластических процессов. Более 5 % поступившей с пищей глюкозы депонируется печенью в процессе синтеза гликогена. При малоподвижном образе жизни и значительном потреблении углеводов с пищей до 40% глюкозы превращается в жиры, в том числе в холестерин. Около 90% глюкозы крови потребляет мозг, где глюкоза служит основным энергетическим субстратом. При мышечной деятельности, особенно при длительной работе, ее больше используют скелетные мышцы, в которых запас углеводных ресурсов истощается.
6. Внутриклеточный обмен углеводов
Внутриклеточный обмен углеводов включает процессы синтеза и распада гликогена в скелетных мышцах и печени, распад и окисление глюкозы с высвобождением энергии и новообразование глюкозы из веществ неуглеводной природы.
Биосинтез гликогена — депонирование углеводов
Избыточное количество глюкозы, поступившей с кровью, откладывается про запас главным образом в печени и скелетных мышцах. Синтез и накопление гликогена называется депонированием углеводов. Гликоген является основным углеводным энергетическим резервом организма. От запасов его в скелетных мышцах и печени зависит длительность выполнения мышечной работы, поэтому в практике спорта используются специальные методы накопления гликогена в тканях.
Синтез гликогена из молекул глюкозы осуществляется с помощью гликогенсинтетазы и уридинтрифосфата (УТФ) как источника энергии. Этому процессу предшествует несколько реакций превращения глюкозы, представленных на рис. 5. Глюкоза с участием фермента гексокиназы и АТФ превращается в глюкозо-6-фосфат, который под воздействием фермента фосфоглюкомутазы переходит в глюкозо-1 -фосфат. Из глюкозо-1 -фосфата с участием УТФ образуется активная форма УДФ-глюкозы, которая под воздействием фермента гликогенсинтетазы присоединяется к последнему остатку гликогена:
Гликогенсинтетаза
(C6H10O5)n + УДФ-глюкоза -------------(Сбн10О5)п+1 + УДФ
Гликоген
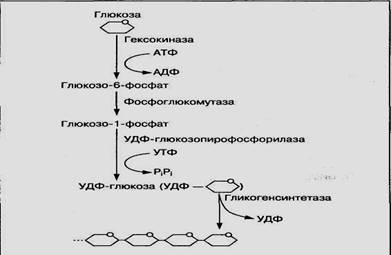
Рис.5. Схема биосинтеза гликогена
Таким образом молекула гликогена увеличивается на один остаток глюкозы. Синтез гликогена с участием гликогенсинтетазы возможен только при наличии небольшого количества гликогена — так называемой затравки. С удлинением молекулы гликогена активность фермента увеличивается. Ветвление ее осуществляется ферментом трансгликогеназой.
Синтез гликогена требует затрат энергии АТФ, УТФ и пирофосфата. При удлинении молекулы гликогена только на один остаток глюкозы используется 41 кДж энергии. Поэтому этот процесс в тканях интенсивно протекает в аэробных условиях за счет АТФ, образующейся путем окислительного фосфорилирования. В печени он накапливается при усиленном питании, а в мышцах — после истощения его запасов, например после длительной физической нагрузки. Наибольшая скорость синтеза гликогена наблюдается в период отдыха на 30—40-й минуте после приема углеводной пищи. Это необходимо учитывать при построении режима питания во время соревнований, с тем чтобы усилившийся процесс синтеза не затормозил использование гликогена при мышечной деятельности.
Усиливается синтез гликогена под воздействием гормона поджелудочной железы — инсулина, который регулирует поступление глюкозы в ткани, а ингибируется адреналином, так как он угнетает активность фермента гликогенсинтетазы. Уровень гликогена в печени и других тканях может увеличиваться только до определенного предела, поскольку высокие концентрации его в тканях угнетают активность гликогенсинтетазы.
Распад гликогена — мобилизация углеводов
Процесс распада гликогена до молекул глюкозы называется мобилизацией углеводов. Расщепление гликогена происходит в основном путем фосфоролиза с участием фермента гликогенфосфорилазы и фосфорной кислоты (Н3РО4). От гликогена отщепляется молекула глюкозы в виде глюкозо-1 -фосфата:
(С6Н10О5)n + Н3РО4 Фосфорилаза глюкозо-1-фосфат + (С6Н10О5)n-1
Гликоген
Образовавшийся глюкозо-1-фосфат быстро превращается в глюкозо-6-фосфат. В печени он расщепляется ферментами фосфатазами на свободную глюкозу и фосфорную кислоту. Молекулы свободной глюкозы легко поступают в кровь и используются многими тканями организма как энергетический субстрат. В скелетных мышцах такие фосфатазы отсутствуют, поэтому гликоген в них используется только для собственных нужд.
Скорость распада гликогена в мышцах зависит от их функциональной активности, а в печени — от уровня глюкозы в крови. При мышечной деятельности скорость мобилизации гликогена в печени зависит от интенсивности выполняемой нагрузки: при умеренной работе она возрастает в 2—3 раза, а при интенсивной — в 7—10 раз по сравнению с состоянием покоя.
Распад гликогена в печени продолжается и в период отдыха. Образующаяся глюкоза способствует восстановлению запасов гликогена в сердечной и скелетной мышцах, т. е. происходит перераспределение углеводов между отдельными тканями.
Гликолиз
Извлечение метаболической энергии из углеводов происходит почти во всех клетках организма человека и включает две основные фазы — бескислородное (анаэробное) окисление, которое протекает в цитозоле преимущественно скелетных мышц и называется гликолизом, и кислородное (аэробное) окисление, протекающее в митохондриях на ферментах цикла лимонной кислоты и дыхательной цепи.
Гликолиз — это постепенный распад молекулы глюкозы или гликогена (гликогенолиз) до двух молекул пировиноградной кислоты, которая в анаэробных условиях превращается в молочную кислоту. Он включает десять химических реакций. Этот процесс можно разделить на две основные стадии — подготовительную и окислительную. В подготовительной стадии молекула глюкозы постепенно распадается до двух молекул 3-фосфоглицеринового альдегида, при этом используется две молекулы АТФ. В окислительной стадии происходит дальнейшее их окисление с образованием пирувата и четырех молекул АТФ. Начинается гликолиз с активации молекулы глюкозы в присутствии АТФ с образованием глюкозо-6-фосфата или фосфоролиза гликогена с отщеплением глюкозо-1-фосфата. Реакция фосфорилирования глюкозы катализируется ферментом гексокиназой и требует наличия ионов Мg2+. Гексокиназа — это регуляторный аллостерический фермент, активность которого зависит от содержания АТФ в клетке. При низкой концентрации АТФ фермент активен, а при высокой ее концентрации — не активен и процесс гликолиза «выключается», так как энергия в данный момент не используется. Далее глюкозо-6-фосфат превращается в фруктозо-6-фосфат с участием фермента глюкозофосфатизомеразы. Фруктозо-6-фосфат фосфорилируется с использованием энергии АТФ, в результате чего образуется фруктозо-1,6-дифосфат. Реакция катализируется ферментом фосфофруктокиназой (ФФК).
Фосфофруктокиназа является ключевым аллостерическим ферментом, регулирующим скорость гликолиза. Его активность зависит от концентрации АТФ и других метаболитов (молочной кислоты, цитрата), которые влияют на его активность. Так, в мышцах в состоянии покоя концентрация АТФ относительно высокая и процесс гликолиза не активен. Во время работы мышцы интенсивно расходуется АТФ, что повышает активность ФФК и приводит к усилению гликолиза. Однако накопление молочной кислоты — конечного продукта анаэробного гликолиза — ингибирует этот фермент и скорость гликолиза.
Первый этап гликолиза завершает реакция расщепления фруктозо-1,6-дифосфата на две триозы — фосфоглицериновый альдегид и фосфодиоксиацетон под воздействием фермента альдолазы. Образовавшиеся триозы являются изомерами и способны взаимопревращаться. В последующие реакции гликолиза вступают две модели 3-фосфоглицеринового альдегида.
Окислительная стадия начинается с окисления 3-фосфоглицеринового альдегида при участии дегидрогеназы, содержащей кофермент НАД, и фосфорной кислоты. Кофермент НАД в этой реакции присоединяет водород и превращается в НАДН2. В аэробных условиях НАДН2 может передать водород на кислород с образованием ЗАТФ. Образовавшаяся 1,3-дифосфоглицериновая кислота содержит макроэргетическую связь и способна вступить в реакцию перефосфорилирования с АДФ, ведущую к образованию АТФ и 3-фосфоглицериновой кислоты. Такой процесс образования АТФ называется субстратным фосфорилированием. Он катализируется ферментом фосфоглицераткиназой.
3-Фосфоглицериновая кислота под влиянием фермента фосфоглицеромутазы превращается в 2-фосфоглицериновую кислоту. Последняя при участии фермента энолазы теряет молекулу воды и превращается в фосфоэнолпировиноградную кислоту. В результате внутримолекулярного окислительно-восстановительного процесса у второго углеродного атома этой кислоты образуется макроэргическая связь, при разрыве которой с участием фермента пируваткиназы происходит перенос фосфорного остатка от фосфоэнолпировиноградной кислоты на АДФ (второе субстратное фосфорилирование), а также образование двух молекул пировиноградной кислоты и двух молекул АТФ.
Гликолиз в анаэробных условиях завершается реакцией восстановления пировиноградной кислоты до молочной под воздействием фермента лактатдегидрогеназы. Источником водорода служат молекулы НАДН2, образующиеся при окислении 3-фосфоглицеринового альдегида. Таким образом, конечным продуктом анаэробного гликолиза является молочная кислота. В аэробных условиях пировиноградная кислота не превращается в молочную и окисляется далее в цикле лимонной кислоты до конечных продуктов обмена. Суммарное уравнение процесса гликолиза можно представить в виде
С6Н12О6 + 2АТФ + 2АДФ + 2Н3РО4 + 2НАД —- 2С3Н6О3 + 4АТФ +.2НАДН2 + 2Н2О
∆Q0 = -196 кДж • моль-1
61 кДж аккумули- 135 кДж рассеивается в АТФ виде тепла
В процессе гликолиза постепенно высвобождается 196 кДж энергии. Большая часть ее рассеивается в виде тепла (135 кДж), а меньшая — накапливается в макроэргических связях двух молекул АТФ. Эффективность запасания энергии в форме АТФ при гликолизе составляет 40%. Основная часть энергии, аккумулированной в молекуле глюкозы (2880 кДж), остается в продукте гликолиза — двух молекулах молочной кислоты и может высвобождаться только при их аэробном окислении. В гликолизе образуются многие вещества, необходимые для пластических процессов в клетках. Особенно много при этом накапливается молочной кислоты, которая быстро диффундирует из скелетных мышц в кровь и влияет на кислотно-основное состояние организма. Уровень молочной кислоты в крови только до некоторой степени отражает интенсивность гликолиза в мышцах, поскольку кислота частично метаболизирует в них. В норме концентрация молочной кислоты в крови находится в пределах 1— 1,5 ммоль • л-1.
Молочная кислота в водной среде диссоциирует на протон водорода (Н+) и анион кислотного остатка:
СН3 СН3
Н-С-ОН —► Н-С-ОН + Н+
СООН COO-
Анион кислотного остатка молочной кислоты в водной среде способен взаимодействовать с катионами металлов (Na+, K+) и образовывать соли — лактаты. Поэтому часто молочную кислоту называют лактат.
Гликолиз и гликогенолиз играют важную роль при мышечной деятельности анаэробного характера. Они обеспечивают энергией интенсивную работу в пределах от 30 с до 2—5 мин.
Молочная кислота образуется в мышцах с наибольшей скоростью в течение 40—45 с интенсивной физической нагрузки за счет максимального включения анаэробного гликолиза. Уровень молочной кислоты при этом повышается в 4—5 раз и после напряженной работы в течение 1—5 мин может достигать 10 ммоль л-1 и более. Это приводит к закислению среды организма (ацидозу). Если емкость буферных систем исчерпывается, рН крови может изменяться от 7,34 до 7,0 или даже 6,8 при истощающих нагрузках. Такое закисление среды организма влияет на функции нервной системы и скелетных мышц, приводит к снижению работоспособности и развитию утомления. Поскольку концентрация молочной кислоты в крови зависит от интенсивности гликолиза в мышцах, а последний — от интенсивности выполняемых физических нагрузок и уровня тренированности организма, показатель содержания молочной кислоты в крови широко используется в биохимическом контроле функционального состояния спортсмена.
После прекращения работы около 55—70% молочной кислоты используется тканями, в том числе мышцами, как источник энергии, около 5—7% выводится с мочой, а остальная часть используется в печени для новообразования глюкозы и восполнения гликогена в мышцах. Выведение молочной кислоты из мышц, ее окисление после прекращения работы ускоряется при активном отдыхе.
Аэробное окисление углеводов
Аэробное окисление глюкозы — это многостадийный процесс распада ее молекулы до конечных продуктов обмена СО2 и Н2О с образованием 38 молекул АТФ и выделением тепловой энергии (рис. 6). Протекает оно при участии кислорода, который доставляется в ткани с участием белка гемоглобина.

Рис.6. Схема аэробного окисления глюкозы и энергетическая эффективность этого процесса
Этот процесс окисления углеводов — один из главных механизмов образования АТФ в тканях организма. Он включает такие основные стадии:
• гликолитический распад молекулы глюкозы до двух молекул пировиноградной кислоты (ПВК);
• превращение ПВК в ацетил-КоА;
• окисление ацетил-КоА в цикле лимонной кислоты и на дыхательной цепи.
Процесс распада молекулы глюкозы до пировиноградной кислоты протекает одинаково в анаэробных и аэробных условиях, как описано выше (см. "Гликолиз"). Образовавшаяся в гликолитической стадии пировиноградная кислота подвергается далее окислительному декарбоксилированию, в результате чего образуются макроэргическое вещество ацетил-КоА, восстановленная форма НАДН2 и одна молекула СО2. Если в процессе гликолиза образовалась молочная кислота, то в аэробных условиях она превращается в пировиноградную кислоту.
Ацетил-КоА далее включается в цикл лимонной кислоты, где расщепляется до СО2 и Н2О. Вода образуется на системе дыхательных ферментов при взаимодействии водорода, образовавшегося в реакциях биологического окисления, с атомарным кислородом вдыхаемого воздуха. Суммарное уравнение аэробного окисления молекулы глюкозы можно представить таким образом:
С6Н12О6 + 6О6 + 36Н3РО4 + 36АДФ—6СО2 + 42Н2О + 36АТФ
∆Q0 = -2880 кДж • моль-1
1311 кДж аккумули- 1569 кДж рассеивается в АТФ виде тепла
Химические реакции окисления молекулы ацетил-КоА в цикле лимонной кислоты рассмотрены в лекции № 5.
Энергетическая эффективность аэробного окисления молекулы глюкозы
При полном окислении одной молекулы глюкозы до СО2 и Н2О энергия накапливается в виде 10 НАДН2 (2 из них образуются в гликолизе, 2 — при превращении ПВК в ацетил-КоА и 6 — в цикле лимонной кислоты), а также 2ФАДН2, 2 молекулы ГТФ, равноценные АТФ и 2 АТФ в процессе гликолиза (см. рис. 64). Передача водорода по системе дыхательных передатчиков от НАДН2 на кислород сопряжена с образованием трех молекул АТФ, а от ФАДН2 — двух молекул АТФ. Следовательно, из 10НАДН2 образуется 30 АТФ, а из 2ФАДН„ — 4 АТФ. Суммарный выход АТФ на одну молекулу глюкозы составляет 38 АТФ (табл. 2).
ТАБЛИЦА 2
Накопление энергии на отдельных стадиях окисления молекулы глюкозы
| Стадия окисления | Аккумуляция энергии | Выход АТФ |
| Гликолиз | 4АТФ образуется 2АТФ используется 2НАДН, | 2АТФ накапливается 6АТФ |
| Превращение ПВК в ацетил-КоА | 2НАДНг | 6АТФ |
| В цикле лимонной кислоты и окислительном фосфорилировании | 6НАДН2 2ФАДН2 2ГТФ | 18АТФ 4АТФ 2АТФ |
| Общий выход АТФ | 38АТФ |
Однако в мышечной и нервной тканях 2 молекулы НАДН2, которые образуются в цитоплазме в процессе гликолиза, сами в митохондрии не поступают, а передают водород на переносчик ФАД, поэтому в дыхательную цепь водород уже передается от 2 ФАДН2, что сопровождается образованием не 6 АТФ, а только 4 АТФ. Поэтому в скелетных мышцах при полном окислении молекулы глюкозы образуется 36 АТФ.
Аэробный метаболизм глюкозы по накоплению АТФ в 19 (18) раз более эффективен, чем анаэробный. Он имеет большой коэффициент полезного действия (около 45%), так как из 2880 кДж свободной энергии окисления глюкозы 1311 кДж аккумулируется в АТФ. Аэробное окисление углеводов — основной механизм энергообеспечения аэробной мышечной работы в течение нескольких часов.
Пентозный цикл окисления углеводов
В некоторых тканях организма (печени, эритроцитах, жировой ткани) возможен и другой аэробный путь прямого окисления углеводов, который называется пентозным циклом. В этом цикле накапливается энергия в виде НАДФН2, которая используется в биосинтетических процессах, а также образуются пентозы (рибоза и др.), необходимые для синтеза нуклеотидов (АТФ, НАД, ФАД, нуклеиновые кислоты), и глицериновый альдегид, который может превращаться в пировиноградную кислоту или включаться в гликолиз. Суммарное уравнение пентозного цикла имеет следующий вид:
6 глюкозо-6-фосфат + 12НАДФ + 7Н2О----------5 глюкозо-6-фосфат + 12НАДФН2 + 6СО2 + Н3РО4
В процессе этого цикла молекула глюкозо-6-фосфата полностью окисляется до СО2.
Глюконеогенез
Процесс новообразования глюкозы в тканях организма из веществ неуглеводной природы называется глюконеогенезом. Глюкоза может синтезироваться из пировиноградной и молочной кислот, а также из ацетил-КоА, глицерина и аминокислот. Все они, кроме глицерина, проходят через стадию образования пировиноградной кислоты. Многие реакции глюконеогенеза представляют собой обращение соответствующих реакций, имеющих место в процессе гликолиза. Однако имеются дополнительные обходные реакции, например образование фосфоенолпировиноградной и пировиноградной кислот.
Процесс новообразования глюкозы активно протекает в печени, почках, а при физических нагрузках — и в скелетных мышцах. Благодаря этому процессу предотвращается резкое снижение уровня глюкозы в крови и гликогена в печени (например, при длительной мышечной работе).
Важное значение в восстановлении уровня глюкозы и гликогена в печени и скелетных мышцах имеет процесс превращения молочной кислоты в глюкозу, который называется циклом Кори. Постепенное превращение многих аминокислот через аминокислоту аланин в молекулы глюкозы обеспечивает также другой цикл — глюкозоаланиновый (рис. 7).
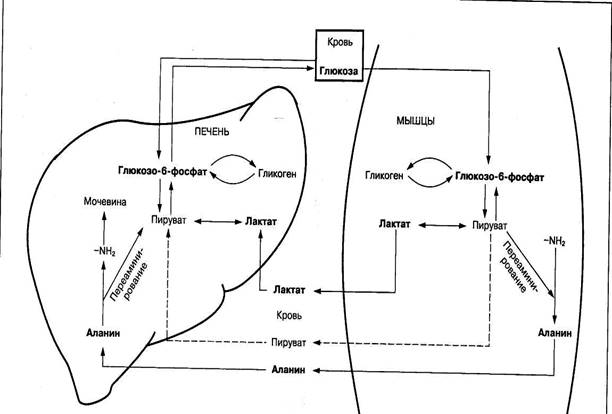
Рис. 7. Цикл молочной кислоты (цикл Кори) и глюкозоаланиновый цикл
Особенность этих циклов заключается в том, что молочная кислота и аланин, образуясь в скелетных мышцах, кровью транспортируются в печень, где превращаются в глюкозу. Это энергозависимый процесс. Из печени глюкоза поступает в кровь и снова используется мышцами для восстановления запасов гликогена. Данный процесс имеет существенное значение в организме при мышечной деятельности. Благодаря ему предотвращается резкое снижение запасов гликогена в мышцах и уровня глюкозы в крови.
7. Обмен углеводов при мышечной деятельности
Гликоген мышц и глюкоза крови являются важным субстратом для образования АТФ в сокращающихся мышцах при продолжительных физических нагрузках субмаксимальной и большой мощности, например при беге на 400, 800, 1000 и 10 000 м. Длительность работы зависит от запасов гликогена в скелетных мышцах (рис. 8, а).

При физических нагрузках усиливается распад гликогена (мобилизация) и окисление глюкозы (гликогенолиз) в мышечных волокнах. Скорость распада его зависит от интенсивности физических нагрузок (рис. 8, б). При неинтенсивной велоэргометрическои нагрузке (30 % МПК) запасы гликогена в широкой мышце голени снижаются только на 20—30% в течение двух часов работы, тогда как при интенсивной работе (60% МПК) — на 80%.
Гликоген в мышцах наиболее быстро распадается в первые минуты мышечной работы. При длительной работе скорость распада гликогена в мышцах снижается из-за уменьшения его запасов.
Скорость распада гликогена или мобилизации глюкозы по-разному изменяется в быстросокращающихся (БС) и медленносокращающихся (МС) типах мышечных волокон под воздействием физических нагрузок различной мощности (рис. 8, в). Так, при средней мощности работы (в пределах 60—75% МПК) усиление распада гликогена происходит в медленно-сокращающихся мышечных волокнах, а с увеличением мощности физических нагрузок — в быстросокращающихся, у которых активность ферментов гликогенолиза выше, чем у медленносокращающихся.
Усиление мобилизации углеводов обусловлено повышением активности ферментов,- катализирующих реакции распада и синтеза гликогена. При отдельных видах мышечной работы активность гликогенфосфорилазы в мышцах нижних конечностей увеличивается в 2,4 раза, а гликогенсинтетазы — почти в 2 раза. Степень изменения активности ферментов зависит от длительности, интенсивности и типа нагрузки. Регулируется активность этих ферментов многими механизмами, ё том числе гормонами (адреналин), циклическим АМФ, ионами Са2+, обмен которых изменяется при мышечной деятельности. Систематическая мышечная деятельность приводит к увеличению концентрации гликогена и активности ферментов его обмена в мышцах, что улучшает их энергетический обмен при физических нагрузках.
Для процессов энергообразования мышцы используют также глюкозу крови. В состоянии покоя они поглощают около 20% общего количества глюкозы, поступившей в кровь, а при нагрузке мощностью 60% МПК — более 80 % глюкозы крови. Связано это с усилением ее доставки кровотоком, повышением скорости транспорта через мембраны мышц и утилизации мышцами.
На степень потребления мышцами глюкозы крови влияет вид выполняемой нагрузки, уровень тренированности, питание, половые особенности, метаболическое состояние организма. Высокий уровень гликогена в мышцах, что характерно для высокотренированных спортсменов на выносливость, а также повышенное содержание свободных жирных кислот в крови снижают потребление мышцами глюкозы крови. Гипоксия стимулирует поступление глюкозы в скелетные мышцы. У женщин распад гликогена и окисление глюкозы при мышечной работе менее выражены, чем у мужчин.
При мышечной деятельности возрастает мобилизация глюкозы из печени, где она депонируется в виде гликогена. Гликоген распадается до глюкозы, которая выходит в кровь, что препятствует развитию гипогликемии. Выход глюкозы из печени в кровь усиливается в 2—3 раза при мышечной деятельности умеренной интенсивности и в 7—10 раз — при напряженной работе. Высокий уровень глюкозы в крови благодаря гомеостатической функции печени при мышечной деятельности поддерживается до тех пор, пока в печени не исчерпается запас гликогена. За счет запасов гликогена печени мышцы могут выполнять работу большой мощности в течение 20—40 мин.
При напряженной мышечной работе запас гликогена в печени существенно уменьшается уже через 1—2 ч, что приводит к снижению уровня глюкозы в крови. С увеличением продолжительности работы определенный вклад в поддержание глюкозы крови вносит процесс глюконеогенеза.
В процессе глюконеогенеза, который активен в печени и почках, глюкоза синтезируется из аминокислот, глицерина, молочной и пировиноградной кислот, что предупреждает исчерпание гликогена в тканях. При этом вклад глюконеогенеза в поддержание глюкозы крови при кратковременной работе незначительный (10—20%), а при продолжительной работе (в течение нескольких часов) возрастает до 50% по отношению к общей глюкозе, образующейся в печени.
Литература
1. Волков, Н.И. Биохимия мышечной деятельности / Н.И.Волков, Э.Н.Несен, А.А.Осипенко, С.Н.Корсун. – К: Олимпийская литература, 2000. – 504 с.
2. Ленинджер, А. Основы биохимии / А.Ленинджер. – М.: Мир, 1985.