| Скачать .docx | Скачать .pdf |
Реферат: Методы определения С-концевой аминокислоты
Березов Т.Т., Коровкин Б.Ф.
Для определения природы С-концевой аминокислоты часто используют ферментативные методы. Обработка полипептида карбоксипептидазой, которая разрывает пептидную связь с того конца пептида, где содержится свободная СООН-группа, приводит к освобождению С-концевой аминокислоты, природа которой может быть идентифицирована методом хроматографии.
Предложен также химический метод Акабори (S. Akabori), который основан на гидразинолизе полипептида:
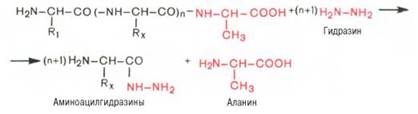
Гидразин, вызывая распад чувствительных к нему пептидных связей полипептида, реагирует со всеми аминокислотами, за исключением С-концевой аминокислоты, поскольку ее карбоксильная группа не участвует в образовании пептидной связи. При этом образуется смесь аминоацил-гидразинов и свободной С-концевой аминокислоты. Последнюю после обработки всей смеси ДНФБ отделяют и идентифицируют хроматографи-чески, для чего образовавшиеся динитрофенилпроизводные аминоацил-гидразинов предварительно экстрагируют уксусно-этиловым эфиром.
С-концевую аминокислоту идентифицируют также путем обработки полипептида восстанавливающим агентом, например боргидридом натрия. В простейшей форме эту процедуру можно представить в следующем виде:
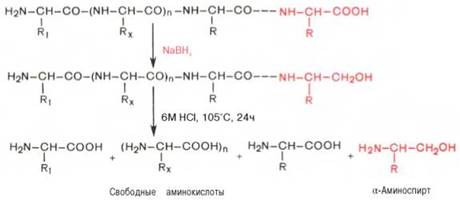
Видно, что в указанных условиях только одна, а именно С-концевая, аминокислота будет превращаться в α-аминоспирт, легко идентифицируемый методом хроматографии. Таким образом, при помощи указанных методов определяют природу N- и С-концевых аминокислот.
Следующий этап работы связан с определением чередования (последовательности) аминокислот внутри полипептидной цепи. Для этого сначала проводят избирательный, частичный (химический и ферментативный), гидролиз полипептидной цепи на короткие пептидные фрагменты, последовательность аминокислот в которых может быть точно определена описанными ранее методами.
Химические методы избирательного и неполного гидролиза основаны на применении таких химических реактивов, которые вызывают селективный, высокоспецифический разрыв пептидных связей, образованных определенными аминокислотами, оставляя незатронутыми остальные пептидные связи. К этим избирательно гидролизующим веществам относятся цианогенбромид, CNBr (по остаткам метионина), гидроксиламин (по связям между остатками аспарагиновой кислоты и глицина), N-бромсукцинамид (по остаткам триптофана). Метионина в составе белков содержится обычно меньше, чем других аминокислот, поэтому обработка CNBr предпочтительнее, так как при этом образуется небольшое число пептидов, первичную структуру которых определяют с помощью рассмотренных ранее методов, всякий раз начиная с определения природы N- и С-концевых аминокислот.
Ферментативные методы гидролиза основаны на избирательности действия протеолитических (вызывающих распад белков) ферментов, расщепляющих пептидные связи, образованные определенными аминокислотами. В частности, пепсин ускоряет гидролиз связей, образованных остатками фенилаланина, тирозина и глутаминовой кислоты, трипсин – аргинина и лизина, химотрипсин – триптофана, тирозина и фенилаланина. Ряд других ферментов, например папаин, субтилизин, проназа и другие бактериальные протеиназы, также используется для неполного гидролиза белков. В результате полипептидная цепь расщепляется на мелкие пептиды, содержащие иногда всего несколько аминокислот, которые отделяют друг от друга сочетанными электрофоретическими и хроматографическими методами, получая своеобразные пептидные карты. Далее определяют чередование аминокислот в каждом индивидуальном пептиде. Завершается работа воссозданием первичной структуры полной полипептидной цепи на основании определения последовательности аминокислот в отдельных пептидах.
Метод составления пептидных карт, получивший образное название «метод отпечатков пальцев», используется при определении сходства или различия гомологичных белков по первичной структуре. Белок инкубируют с каким-либо протеолитическим ферментом. Часто порции белка инкубируют как с пепсином, так и с трипсином. При этом вследствие гидролиза строго определенных пептидных связей образуется смесь коротких пептидов, легко разделяемых с помощью хроматографии в одном направлении и электрофореза – в другом , под углом 90° от первого (пептидная карта).
Дальнейшие задачи – установление последовательности расположения аминокислот в каждом из выделенных пептидов (фенилтиогидантоиновым или другими методами), сопоставление полученных данных и установление первичной структуры всей молекулы.
Возможность применения рентгеноструктурного анализа для определения последовательности аминокислот в белковой молекуле была рассмотрена ранее. Следует отметить совершенно новый подход к решению этой важной проблемы – определение последовательности аминокислот в белковой молекуле с использованием данных о комплементарной нуклеотидной последовательности ДНК. Этому способствуют как методы быстрого секвенирования ДНК, так и техника изолирования и доступности самого гена.
В настоящее время выяснение первичной структуры белков является вопросом времени и технического оснащения лабораторий. Полностью выяснена первичная структура многих природных белков и прежде всего инсулина, содержащего 51 аминокислотный остаток [Сэнджер Ф., 1954]. Более крупным белком с выясненной первичной структурой оказался иммуноглобулин, в четырех полипептидных цепях которого насчитывается 1300 аминокислотных остатков. За эту работу Дж. Эдельман и Р. Портер были удостоены Нобелевской премии (1972).
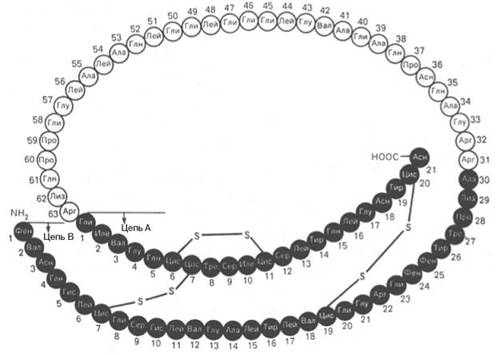
Рис. 1.14. Структура проинсулина.
Расшифрованы первичные структуры миоглобина человека (153 аминокислотных остатка), α-цепи (141) и β-цепи (146) гемоглобина человека, цитохрома С из сердечной мышцы человека (104), лизоцима молока человека (130), химотрипсиногена быка (245) и многих других белков, в том числе ферментов и токсинов. На рис. 1.14 представлена последовательность аминокислотных остатков проинсулина. Видно, что молекула инсулина (выделена темными кружками), состоящая из двух цепей (А – 21 и В – 30 аминокислотных остатков), образуется из своего предшественника – про-инсулина (84 аминокислотных остатка), представленного одной полипептидной цепью, после отщепления от него пептида, состоящего из 33 аминокислотных остатков. Строение молекулы инсулина (51 аминокислотный остаток) схематически можно представить следующим образом:
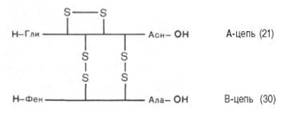
Между цепями А и В и внутри А-цепи инсулина образуются дисуль-фидные (—S—S—) связи. Выяснена первичная структура более 18 инсулинов, выделенных из разных источников. Близкими по первичной структуре оказались инсулины из поджелудочной железы человека, свиньи и кашалота. Единственным отличием инсулина человека является нахождение треонина в положении 30 В-цепи вместо аланина.
Вторым белком, первичная структура которого расшифрована С. Муром и У. Стейном, является рибонуклеаза (рис. 1.15) из поджелудочной железы, катализирующая расщепление РНК. Фермент состоит из 124 аминокислотных остатков с N-концевым лизином и С-концевым валином, между остатками цистеина образуются дисульфидные (—S—S—) связи в 4 участках.
Полностью расшифрована последовательность аминокислот полипептидной цепи фермента лизоцима, имеющего важное защитное и медицинское значение, так как он вызывает лизис ряда бактерий, расщепляя основное вещество их клеточной оболочки. Лизоцим белка куриного яйца содержит 129 аминокислот (рис. 1.16) с N-концевым лизином и С-концевым лейцином.
Отечественными исследователями установлена первичная структура многих белков и полипептидов, в том числе крупного белка РНК-полимера-зы (в частности, последовательности ее β- и β1-субъединиц, 1342 и 1407 аминокислотных остатков соответственно фактора элонгации G из Е.coli (701 аминокислота) (Ю.А. Овчинников и др.), фермента аспартатамино-трансферазы, состоящей из 412 аминокислотных остатков (А.Е. Браун-штейн, Ю.А. Овчинников и др.), леггемоглобина, белка L25 из рибосом E.coli, нейротоксинов из яда кобры (Ю.А. Овчинников и др.), пепсиногена и пепсина (В.М. Степанов и др.), L-липотропина и лактогенного гормона быка (Н.А. Юдаев, Ю.А. Панков) и др.
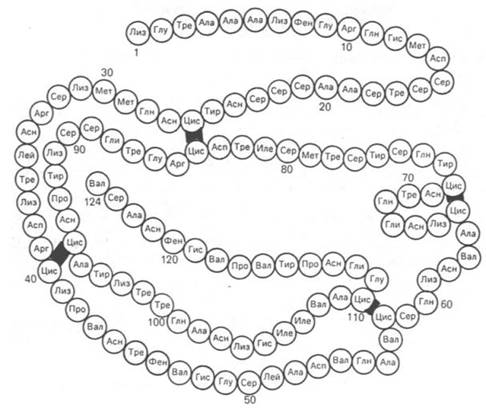
Рис. 1.15. Первичная структура РНКазы. Цветом выделены четыре дисульфидные связи.
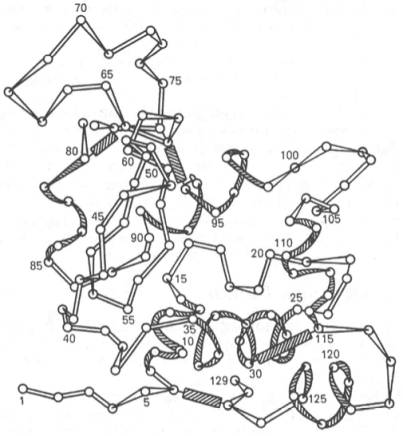
Рис. 1.16. Первичная структура полипептидной цепи лизоцима (схема).
Исследования первичной структуры α- и β-цепей гемоглобина способствовали выяснению структуры необычных, так называемых аномальных, гемоглобинов, встречающихся в крови больных гемоглобинопатиями. Иногда развитие болезни, как и изменение пространственной структуры гемоглобина человека, обусловлено заменой лишь одной какой-либо аминокислоты в структуре β-цепей (реже α-цепей) гемоглобина (см. главу 2).
Анализ данных о первичной структуре белков позволяет сделать следующие общие выводы.
1. Первичная структура белков уникальна и детерминирована генетически. Каждый индивидуальный гомогенный белок характеризуется уникальной последовательностью аминокислот: частота замены аминокислот приводит не только к структурным перестройкам, но и к изменениям физико-химических свойств и биологических функций.
2. Стабильность первичной структуры обеспечивается в основном глав-новалентными пептидными связями; возможно участие небольшого числа дисульфидных связей.
3. В полипептидной цепи могут быть обнаружены разнообразные комбинации аминокислот; в полипептидах относительно редки повторяющиеся последовательности.
4. В некоторых ферментах, обладающих близкими каталитическими свойствами, встречаются идентичные пептидные структуры, содержащие неизменные (инвариантные) участки и вариабельные последовательности аминокислот, особенно в областях их активных центров. Этот принцип структурного подобия наиболее типичен для ряда протеолитических ферментов: трипсина, химотрипсина и др. (см. главу 4).
5. В первичной структуре полипептидной цепи детерминированы вторичная, третичная и четвертичная структуры белковой молекулы, определяющие ее общую пространственную конформацию.