| Скачать .docx | Скачать .pdf |
Реферат: Ферменты
Ферменты - белки, обладающие каталитической активностью.
Ферменты являются функциональными единицами клеточного метаболизма.
Ферменты специфичны, т.е. катализируют только определенные реакции с участием специфических субстратов.
Для работы всех ферментов необходимы специфические pH, температура.
Для работы некоторых ферментов достаточно полипептидной цепи из которой они состоят (рибонуклеаза поджелудочной железы), для работы других необходимы кофакторы - неорганические вещества (например, ионы Fe2+,Mn2+,Zn2+), или органические вещества - коферменты, или и то и другое.
Простетическая группа - коферменты прочно соединяющиеся с ферментом (гем гемоглобина).
Холофермент - каталитически активный фермент со всеми полипептидными цепями, кофакторами и коферментами.
Апофермент - белковая часть фермента без кофакторов и коферментов.
Кофакторы некоторых ферментов.
| ионы | фермент |
| Fe2+ или Fe3+ | цитохромоксидаза, каталаза, пероксидаза |
| Cu2+ | цитохромоксидаза |
| Zn2+ | ДНК-полимераза, карбоангидраза, алкогольдегидрогеназа |
| Mg2+ | гексокиназа, глюкозо-6-фосфатаза |
| Mn2+ | аргиназа |
| K+ | пируваткиназа (+Mg2+) |
| Ni2+ | уреаза |
| Mo | нитратредуктаза |
| Se | глутатионпероксидаза |
Классификация ферментов.
В соответствии с международной номенклатурой все ферменты делятся на шесть классов согласно их функции:
1. Оксиредуктазы - осуществляют перенос электронов.
2. Трансферазы - осуществляют реакции с переносом функциональных групп.
3. Гидролазы - реакции гидролиза (перенос функциональных групп на молекулу воды).
4. Лиазы - присоединение групп по двойным связям и обратные реакции.
5. Изомеразы - перенос групп внутри молекулы с образованием изомерных форм.
6. Лигазы - образование С-С, С-S, C-O и С-N связей за счет реакций конденсации, сопряженных с распадом ATP.
Каждый класс разделяется на подклассы и подподклассы обозначаемые цифрой через точку.
Зависимость скорости реакции от концентрации субстрата
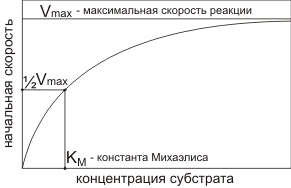
При повышении концентрации субстрата скорость реакции сначала возрастает линейно, затем выходит на плато.
Максимальная скорость наступает когда субстрата слишком много и фермент не успевает с ним справиться. Максимальная скорость недостижима, поэтому используют величину равную половине максимальной скорости. Концентрация субстрата при которой начальная скорость равна половине от максимальной называется константой Михаэлиса.
Константы Михаэлиса некоторых ферментов
| фермент | субстрат | Км, мМ |
| каталаза | H2O2 | 25 |
| гексокиназа | ATP | 0,4 |
| D-глюкоза | 0,05 | |
| D-фруктоза | 1,5 | |
| карбоангидраза | HCO3- | 9 |
| химотрипсин | глицил-тирозинил-глицин | 108 |
| N-бензоилтирозинамид | 2,5 | |
| b-галактозидаза | D-лактоза | 4,0 |
| треониндегидратаза | L-треонин | 5,0 |