| Скачать .docx | Скачать .pdf |
Реферат: Микробная биодеградация ксенобиотиков и токсикантов
СОДЕРЖАНИЕ
| Введение |
3 |
| 1. Факторы, определяющие влияние поллютантов на экосистемы |
4 |
| 1.1. Свойства ксенобиотиков, определяющих их токсичность |
4 |
| 1.2. Способность ксенобиотиков к биодеградации |
4 |
| 2. Биодеградация ксенобиотиков с помощью микроорганизмов |
9 |
| 3. Метаболические пути биодеградации ксенобиотиков, созданные методами генной инженерии |
20 |
| 3.1. Перенос плазмид |
21 |
| 3.2. Изменение генов |
22 |
| 4. Механизмы ускорения биодеградации поллютантов в окружающей среде |
26 |
| Заключение |
28 |
| Список использованных источников |
29 |
ВВЕДЕНИЕ
С развитием химической промышленности в биосферу стало поступать более тысячи различных ксенобиотиков и токсикантов, которые в значительной степени загрязняют окружающую среду. Известно, что соединения, вносимые человеком в окружающую среду в последнее время (инсектициды, гербициды, детергенты и другие ксенобиотики) помимо того, что очень токсичны, ещё и устойчивы в среде (что представляет опасность для человека и животных). В настоящее время нагрузка на естественные процессы самоочищения биосферы является избыточной, и параллельно с деструкцией загрязнений идёт их постепенное накопление в окружающей среде [1].
Возможности микробных сообществ в отношении деградации многих токсичных соединений значительны. Доказано, что при повторном попадании в среду многих химических соединений адаптационный период микроорганизмов к данному субстрату значительно короче, по сравнению с первым попаданием этого соединения. В течение этого периода микроорганизмы селектируются по способности деградировать данный субстрат. В результате естественным путем возникают микробные популяции, способные сохраняться в почве в течение нескольких месяцев после полной деградации токсиканта. Поэтому к началу нового поступления этого соединения в почву в ней уже присутствуют адаптированные микроорганизмы, способные атаковать токсикант. Повышение деградирующей способности возможно также в результате стимуляции естественной почвенной микрофлоры, уже адаптированной к токсикантам[2].
Таким образом, деградация ксенобиотиков микроорганизмами является одной из важных проблем защиты биосферы [1].
Цель данной работы состоит в рассмотрении свойств ксенобиотиков, определяющих их токсичность, определении возможности и исследовании путей биологической деградации ксенобиотиков и токсикантов микроорганизмами, механизмов ускорения биодеградации поллютантов в окружающей среде.
1. ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ ВЛИЯНИЕ ПОЛЛЮТАНТОВ НА ЭКОСИСТЕМЫ
Среди наиболее значимых факторов, определяющих экологическую опасность загрязняющих веществ, можно выделить:
● токсичность соединения;
● способность вещества к биодеградации [2].
1.1. Свойства ксенобиотиков, определяющих их токсичность
Токсичность разных веществ не одинакова. Поскольку она проявляется во взаимодействии ксенобиотика с биологической системой, ее величина зависит от свойств как самого токсиканта, так и биосистемы, и в конечном итоге определяется:
1. Способностью вещества достичь структуры-мишени, взаимодействие с которой инициирует токсический процесс;
2. Характером и прочностью связи, образующейся между токсикантом и структурой-мишенью;
3. Значением структуры-мишени для поддержания гомеостаза в организме [3].
Строение вещества определяет размеры молекулы, ее массу, растворимость, летучесть, агрегатное состояние при нормальных условиях и химическую активность. Все эти свойства влияют на токсичность вещества, вместе с тем ни одно из них не является единственно значимым [3].
1.2. Способность ксенобиотиков к биодеградации
В зависимости от стабильности поллютантов в окружающей среде их можно разделить на три группы:
1. Биодеградабельные токсиканты, относительно легко разрушающиеся в окружающей среде под влиянием как абиотических, так и биотических факторов. К ним относятся вещества биологического происхождения и некоторые органические соединения небиологического генезиса (n-алканы нефти, спирты, альдегиды и т. д.) [3].
Экологическая опасность поллютантов данного типа определяется скоростью их поступления в экосистемы, способностью накапливаться в компонентах биогеоценозов, а также хроническим действием сублетальных концентраций [3].
Экотоксикологическое значение многих ксенобиотиков определяется не только их токсичностью и способностью к биодеградации, но также скоростью поступления этих поллютантов в экосистемы. Если скорость поступления разлагаемых поллютантов превышает скорость их естественной биодеградации, то это может вызвать нарушения в составе и структуре экосистем [4].
Большую опасность представляет собой биоаккумуляция загрязняющих веществ, например, липофильных соединений, в живых организмах. В результате может усиливаться их токсическое воздействие и ухудшаться качество кормовой базы для организмов вышестоящих трофических уровней. Многие поллютанты могут накапливаться в экосистеме, сорбируясь на частицах почвы и взаимодействуя с гумусом. Например, некоторые пестициды (тиофос), которые в водном растворе малоустойчивы, связываются с почвенными частицами и длительно сохраняются в природной среде. Затем, по мере минерализации гумуса, связанные с ним молекулы токсиканта освобождаются и могут оказывать повреждающее действие на организмы данной экосистемы [3].
Присутствие в экосистемах загрязняющих веществ в незначительных (сублетальных) количествах также не свидетельствует об их безопасности:
■ хроническое отравление малыми дозами поллютантов может способствовать снижению репродуктивной способности популяции;
■ сублетальные концентрации токсикантов могут нарушать регуляцию эколого-биохимических взаимодействий, опосредованных различными хеморегуляторами;
■ сублетальные концентрации могут оказывать неодинаковое воздействие на конкурирующие виды, нарушая тем самым естественный баланс в экосистемах;
■ сублетальные дозы некоторых ксенобиотиков могут стимулировать воспроизводство популяции нежелательных видов, что также может способствовать нарушению видовой структуры агроценозов и естественных экосистем [3].
 |
2. Персистентные ксенобиотики - очень устойчивые соединения, разлагающиеся крайне медленно. Среди этой группы соединений наибольшую известность получили хлорорганические пестициды, в частности ДДТ (рис. 1).
Запрет на применение ДДТ обусловлен следующими причинами:
● высокая и неспецифическая токсичность;
●появление новых рас сельскохозяйственных вредителей, устойчивых к пестициду;
●способность вещества концентрироваться в трофических цепях до значений, превышающих санитарно-гигиенические нормативы;
●высокая устойчивость молекулы к внешним воздействиям различной природы - по некоторым оценкам период полуразложения ДДТ в биосфере составляет порядка 100 лет [3].
Персистентность ксенобиотиков определяется, прежде всего, особенностями их молекулярной структуры. Можно выделить несколько факторов, достоверно повышающих стабильность молекулы токсиканта:
■ гидрофобность вещества, определяющая устойчивость молекулы к действию большинства ферментов;
■ содержание хлора (либо других галогенов) — с повышением количества атомов хлора в молекуле поллютанта увеличивается химическая устойчивость данного соединения в биосфере;
■ наличие эпоксигрупп не только увеличивает биологическую активность вещества, но и снижает скорость его распада;
■ конформация молекул - многие ксенобиотики, являющиеся по отношению друг к другу оптическими изомерами, могут существенно отличаться по степени устойчивости.
3. Рекальцитранные ксенобиотики - соединения, которые практически не разлагаются, либо вообще в принципе не могут разлагаться. К ним, в первую очередь, относятся тяжелые металлы и радионуклиды с большим периодом полураспада [3].
В естественных условиях металлы встречаются в форме руд и минералов. Выплавка металлов из руд и использование в самых разнообразных отраслях человеческой деятельности привели к существенному увеличению их содержания в окружающей среде. Наибольшее токсикологическое значение имеют ртуть, кадмий, хром, мышьяк, свинец, бериллий, цинк, медь, таллий и др. Помимо промышленной деятельности происходит естественное поступление тяжелых металлов в биосферу вследствие выветривания горных пород и выноса реками [3].
Источником поступления радионуклидов в биосферу являются производство и испытание ядерного оружия, ядерная энергетика, а также использование радиоактивных изотопов в медицине и научных исследованиях [3].
Можно выделить следующие общие черты токсикантов:
1. Химическое загрязнение крайне разнообразно и включает в себя многие классы химических соединений;
2. Уровень поллютантов увеличен в регионах повышенной концентрации населения;
3. Биологическое действие нескольких поллютантов может быть неаддитивным и давать синергический эффект;
4. С биохимической точки зрения воздействию токсикантов
могут подвергаться различные структурно-функциональные системы клетки - генетический аппарат, биомембраны, белки;
5. Биотрансформация поллютантов может приводить к появлению более персистентных и более токсичных соединений, чем исходные вещества;
6. Многие загрязняющие вещества (гидрофобные соединения, тяжелые металлы, радионуклиды) способны аккумулироваться в организмах в более высоких концентрациях, чем в окружающей среде;
7. Экологическую опасность представляют даже низкие, сублетальные концентрации поллютантов, которые могут снижать воспроизводство и приводить к вымиранию популяции [3].
2. БИОДЕГРАДАЦИЯ КСЕНОБИОТИКОВ С ПОМОЩЬЮ МИКРООРГАНИЗМОВ
Ксенобиотики – чужеродные для организмов соединения (пестициды, ПАВ, красители, лекарственные вещества и пр.), которые практически не включаются в элементные циклы углерода, азота, серы или фосфора. Ксенобиотики временно или постоянно накапливаются в окружающей среде и вредно влияют на все живое. Широкое и повсеместное применение пестицидов, в том числе неразлагаемых, накопление различных отходов в огромных количествах привело к широкому распространению загрязнения окружающей среды – недр, воды, воздуха. Накопление ксенобиотиков представляет огромную опасность для человека, употребляющего в пищу крупную рыбу или высших животных [2].
Судьба химических соединений, попадающих в окружающую среду, определяется комплексом физических, химических и, особенно, биологических факторов. Деградация ксенобиотиков может происходить в результате физических и химических процессов и существенно зависит от типа почвы, ее структуры, влажности, температуры и т.п. Биологическая трансформация соединений, попавших в окружающую среду, может протекать в различных направлениях, приводя к минерализации, накоплению и полимеризации [2].
Так, полимерные значения коэффициента увеличения концентрации ДДТ (дихлордифенилтрихлорэтана) таковы:
| Водная среда |
100 |
|
|
|
| Фитопланктон |
|
|
|
|
| Зоопланктон |
|
|
|
|
| Мелкая рыба |
106 |
|
|
|
| Крупная рыба |
|
|
|
|
| Хищные птицы |
108 |
Большинство пестицидов, попадающих в окружающую среду в результате использования их для обработки сельскохозяйственных культур, расщепляются бактериями и грибами. Превращение исходного пестицида в менее сложное соединение достаточно эффективно происходит под воздействием микробных сообществ. Доказана возможность полной минерализации ДДТ в ходе сопряженного метаболизма. Высокая токсичность ряда пестицидов может утрачиваться уже на первой стадии микробной трансформации. Это позволяет разрабатывать относительно простые микробиологические методы для борьбы с ксенобиотиками [2].
Ксенобиотики, которые подвергаются полной деградации, то есть минерализуются до диоксида углерода, воды, аммиака, сульфатов и фосфатов, используются микроорганизмами в качестве ростовых субстратов и проходя полный метаболический цикл. Частичная трансформация соединений происходит, как правило, в процессах кометаболизма или соокисления и не связана с включением образуемых продуктов в метаболический цикл микроорганизмами. Наконец, некоторые ароматические углеводороды и синтетические полимеры вообще не поддаются биологической трансформации:

Поведение ксенобиотика в природе зависит от многих взаимосвязанных факторов: структуры и свойств самого соединения, физико-химических условий среды и ее биокаталитического потенциала, определяемого микробным пейзажем. Все эти факторы в совокупности определяют скорость и глубину трансформации ксенобиотика. Нельзя забывать о том, что биологическая деградация ксенобиотиков оправдана только тогда, когда происходит их полная минерализация, разрушение и детоксикация. Это может быть достигнуто в результате всего одной модификации структуры соединения. Однако часто в ходе деградации происходит серия последовательных модификаций исходного соединения с участием нескольких микробных видов. Важную роль в удалении ксенобиотиков из окружающей среды играют разнообразные типы микробного метаболизма. В природных условиях на ксенобиотики воздействую микробные сообщества. В них проявляются различные типы взаимодействия: кооперация, комменсализм, взаимопомощь. Именно благодаря гетерогенности природных микробных сообществ ксенобиотики в принципе могут подвергаться биодеградации, а наличие в микробных сообществах взаимосвязанных метаболических путей разрушения токсинов является основой для борьбы с загрязнением окружающей среды. Есть два пути для борьбы с загрязнением биосферы ксенобиотиками: сбор и детоксикация ксенобиотиков до момента попадания в окружающую среду и трансформация или удаление ксенобиотиков, попавших в среду [2].
После попадания в окружающую среду ксенобиотиков из почвы можно выделить микробные виды, способные деградировать конкретные ксенобиотики и далее вести селекцию на увеличение скорости деградации. Это возможно различными путями:
- отбором конструктивных мутантов;
- отбором на генную дупликацию;
- на основе механизма переноса генов [2].
При попадании новых веществ в окружающую среду может происходить природное генетическое конструирование, в результате которого возникают микробные формы с новыми катаболическими функциями. Огромная роль в процессах межорганизменного переноса генетической информации, приводящих к биохимической изменчивости популяций, принадлежит плазмидам – внехромосомным генетическим элементам. Катаболические, или деградативные плазмиды, кодирующие реакции минерализации или трансформации ксенобиотиков, придают микроорганизмам способность перераспределять между собой пул деградативных генов [5].
Описаны опыты успешного применения ферментов (гидролаз, эстераз, ациламидаз и фосфоэстераз) для проведения первичного гидролиза пестицидов и увеличения степени их последующей деградации [2].
В биодеградации сложной органической молекулы обычно участвуют несколько разных ферментов. Кодирующие их гены могут иметь хромосомную локализацию, но чаще входят в состав крупных (50-200 т.п.н.) плазмид (табл.1), а иногда обнаруживаются как в хромосомной, так и в плазмидной ДНК [5].
Таблица 1
Плазмиды Pseudomonas , их размер и соединения, за разрушение которых отвественны кодируемые ими ферменты*
| Плазмида1 |
Деградируемое соединение |
Размер плазмиды, т.п.н. |
| SAL |
Салицилат |
60 |
| SAL |
Салицилат |
72 |
| SAL |
Салицилат |
83 |
| TOL |
Ксилол и толуол |
113 |
| pjP1 |
2,4-дихлорфеноксиуксусная кислота |
87 |
| pjP2 |
2,4-дихлорфеноксиуксусная кислота |
54 |
| pjP3 |
2,4-дихлорфеноксиуксусная кислота |
78 |
| CAM |
Камфора |
225 |
| XYL |
Ксилол |
15 |
| pAC31 |
3,5-дихлорбензоат |
108 |
| pAC25 |
3-хлорбензоат |
102 |
| pWWO |
Ксилол и толуол |
176 |
| NAH |
Нафталин |
69 |
| XYL-K |
Ксилол и толуол |
135 |
* - [5]
1 – плазмиды с одинаковым названием кодируют ферменты одного и того же катаболического пути, хотя могут быть получены в разных лабораториях и иметь разные размеры.
Одной из крупнейших групп загрязнителей природы являются галогенсодержащие ксенобиотики, которые характеризуются высокой токсичностью и плохой деградируемостью. Причина токсичности и устойчивости этих соединений определяется наличием в них трудно расщепляемой галоген-углеродной связи. Однако, как оказалось, ряд галогенсодержащих соединений являются природными образованиями и представляют собой метаболиты бактерий, грибов, водорослей. Наличия данной природной предпосылки для полной деградации ксенобиотика, однако, недостаточно. Для эффективной трансформации родственного ксенобиотического соединения необходима адаптация микроорганизма, включая его генетическую изменчивость. Длительные исследования путей деградации галогенсодержащих ксенобиотиков показали, что для получения суперштамма, нужно модифицировать существующий катаболический механизм деградации ароматических соединений [2].
Бактерии, разрушающие негалогенированные ароматические соединения, как правило, превращают их в катехол (рис. 2) или протокатехоат (рис. 3), а затем, в ходе нескольких реакций окислительного расщепления, - в ацетил-СоА и сукцинат (рис. 4) или пируват и ацетальдегид (рис. 5). Эти последние соединения метаболизируются практически всеми микроорганизмами. Галогенированные ароматические соединения, основные компоненты большинства пестицидов и гербицидов, с помощью тех же ферментов разрушаются до катехола, протокатехоата, гидрохинона или их галогенированных производных, причем скорость их деградации обратно пропорциональна числу атомов галогена в исходном соединении. Дегалогенирование (отщепление замещающего атома галогена от органической молекулы), необходимое для детоксикации соединения, часто осуществляется в ходе неспецифической диоксигеназной реакции, путем замещения галогена в бензольном кольце на гидроксильную группу. Эта реакция может происходить как в ходе биодеградации исходного галогенированного соединения, так и потом [5].
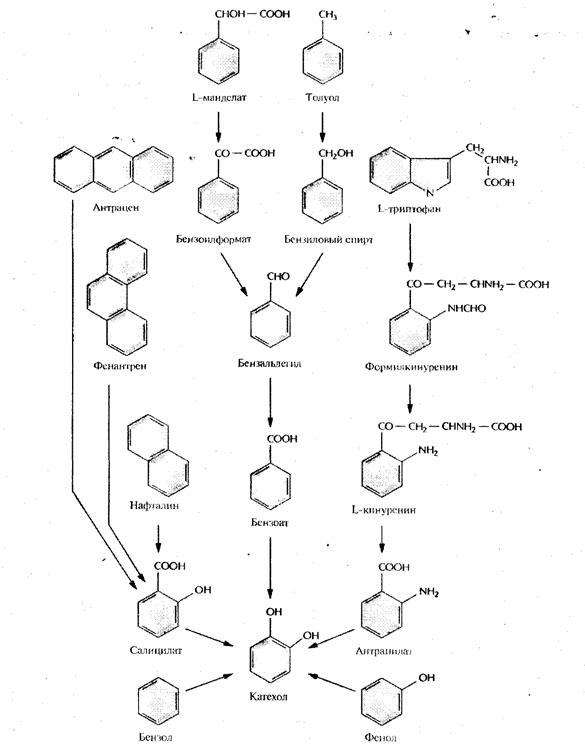
Рис. 2. Пути ферментативного превращения ароматических соединений в катехол бактериями, разрушающими ксенобиотики

Рис.3. Пути ферментативного превращения ароматических соединений в протокатехоат бактериями, разрушающими ксенобиотики

Рис. 4. Путь орто -расщепления при ферментативном превращении катехола и протокатеохата в ацетил-СоА и сукцинат

Рис.5. Путь мета- расщепления при ферментативном превращении катехола и протокатеохата в пуриват и ацетальдегид
Биологические методы также применимы для очистки природной среды от нефтяных загрязнений, представляющих собой как сточные воды нефтяной промышленности, так и непосредственное загрязнение в результате разлива нефти. Сточные воды нефтяной промышленности очищают биологическими методами после удаления большей части смеси различных углеводородов физическими методами. Для этого применяют аэрируемые системы биоочистки с активным илом, содержащим адаптированное к компонентам нефти сообщество. Скорость деградации зависит от качественного состава и концентрации углеводородов, а также температуры и степени аэрации среды. Наиболее эффективно биодеградация осуществляется, когда нефть эмульгирована в воде. Особую проблему представляют выбросы и аварийные разливы нефти на поверхность почвы. Это приводит не только к загрязнению пахотных земель, но также и источников питьевой воды. В почве содержится много микробных видов, способных деградировать углеводороды, но их активность часто низка, в том числе и в результате дефицита отдельных биогенных элементов. В таких случаях эффективным является внесение в почву так называемых «олеофильных удобрений», в состав которых входят соединения азота, фосфаты и другие минеральные элементы, концентрации которых в почве достаточно низки и лимитируют рост микроорганизмов. После внесения этих соединений в почву концентрация микроорганизмов-деструкторов существенно возрастает, и возрастает скорость деградации нефти [2].
С помощью генетического конструирования создан «супермикроб», способный утилизировать большинство основных углеводородов нефти (рис. 6). Многие природные штаммы Pseudomonas putida несут катаболические плазмиды, каждая из которых кодирует фермент для расщепления одного класса углеводородов - плазмида ОСТ обуславливает расщепление октана, гексана, декана; XYL - ксилола и толуола; САМ - камфары, NAH - нафталина. Плазмиды САМ и NAH сами способствуют своему переносу, стимулируя спаривание бактерий [2].
В результате последовательных скрещиваний был получен «суперштамм», несущий плазмиды XYL и NAH и гибридную плазмиду, содержащую части плазмид ОСТ и САМ. Такая мультиплазмидная бактерия растет, утилизируя неочищенную нефть. Однако возможность эффективного применения такого организма в естественных условиях требует доказательства [2].

Рис. 6. Суперштамм, полученный на основе последовательных скрещиваний четырех штаммов Pseudomonas putida . Штамм содержит XYL и NAH плазмиды, гибридную САМ/ОСТ, т.к. изолированные плазмиды Сам и ОСТ не способны существовать в одной клетке
Использование методов генетического конструирования микробных штаммов-деструкторов ксенобиотиков для практического применения находится на ранней стадии. Одна из основных проблем при конструировании микроорганизмов на основе природных катаболических плазмид -стабильность. Стабильность систем «хозяин-вектор» особенно важна при интродукции штаммов в естественную среду. При возвращении микроорганизма с новой катаболической функцией в исходную природную среду ему приходится конкурировать с хорошо адаптированной к данным условиям среды естественной микрофлорой, сталкиваться с огромным разнообразием источников углерода, в том числе высокотоксичных. При этом совершенно неясны перспективы сохранения стабильности новой катаболической функции и, следовательно, самого штамма [2].
Пока существует большой разрыв между достижениями, полученными в конструировании микроорганизмов, и возможностями их практического применения. Вероятно, в будущем наиболее перспективными для детоксикации ксенобиотиков будут биологические системы, состоящие из микробиологической консорции индивидуальных организмов и микробных сообществ, полученных методами клеточной и генетической инженерии [4].
Таким образом, природные генетические механизмы обмена информации позволяют получать эффективные штаммы-деструкторы ксенобиотиков. Это тем более важно, так как общепринятые методы работы с рекомбинантными ДНК, применяемые для клонирования чужеродной ДНК с небольшим числом генов, имеют существенные ограничения при клонировании метаболических путей деградации ксенобитиков, кодируемых десятками генов. Ограничения также обусловлены недостатком знаний о механизмах деградации и структуре метаболических путей, а также возможностями риска, связанного с попаданием сконструированных организмов в среду. Методы генетической инженерии могут быть полезными для усовершенствования уже существующих деградативных способностей микробных клеток [2].
3. МЕТАБОЛИЧЕСКИЕ ПУТИ БИОДЕГРАДАЦИИ КСЕНОБИОТИКОВ, СОЗДАННЫЕ МЕТОДАМИ ГЕННОЙ ИНЖЕНЕРИИ
Некоторые микроорганизмы обладают природной способностью к деградации различных ксенобиотиков, однако следует иметь в виду, что:
1) ни один из них не может разрушать все органические соединения;
2) некоторые органические соединения в высокой концентрации подавляют функционирование или рост деградирующих их микроорганизмов;
3) большинство очагов загрязнения содержит смесь химикатов, и микроорганизм, способный разрушать один или несколько ее компонентов, может инактивироваться другими компонентами;
4) многие неполярные соединения адсорбируются частицами почвы и становятся менее доступными;
5) биодеградация органических соединений часто происходит довольно медленно. Часть этих проблем можно решить, осуществив конъюгационный перенос плазмид, которые кодируют ферменты разных катаболических путей, в один реципиентный штамм (рис.7). Если две плазмиды содержат гомологичные участки, то между ними может про изойти рекомбинация с образованием гибридной плазмиды, которая имеет больший размер и обладает свойствами исходных плазмид. Если же две плазмиды не содержат гомологичных участков и относятся к разным группам несовместимости, то они могут сосуществовать в одной бактерии [5].

Рис. 7. Создание бактериального штамма, способного разрушать камфару, октан, ксилол и нафталин. Штамм А, несущий плазмиду САМ (она детерминирует разрушение камфары), скрещивают со штаммом В, несущим плазмиду ОСТ (разрушение октана). При этом образуется штамм Е, который содержит гибридную плазмиду, образовавшуюся в результате гомологической рекомбинации между исходными плазмидами и обладающую функциями каждой из них. Штамм С, содержащий плазмиду XYL (разрушение ксилола), скрещивают со штаммом D, содержащим плазмиду NAH (разрушение нафталина), и получают штамм F, который несет обе плазмиды. Наконец, скрещивают штаммы Е и F, в результате чего образуется штамм G, содержащий плазмиды САМ/ОСТ, XYL и NAH.
3.1. Перенос плазмид
Большинство разрушающих ксенобиотики бактерий, модифицированных путем переноса плазмид, являются мезофильными микроорганизмами (хорошо растут при 20-400 С), а температура воды в загрязненных реках, озерах и океанах обычно лежит в диапазоне от 0 до 200 С. Чтобы проверить, можно ли создать бактерию, обладающую более широкими катаболическими возможностями и в то же время способную расти и развиваться при низких температурах, плазмиду TOL (детерминирует разрушение толуола) мезофильного штамма Pseudomonas putida перенесли с помощью конъюгации в психрофильный (с низким температурным оптимумом) штамм, утилизирующий салицилат при температуре, близко к 00С . Трансформированный штамм содержал введенную в него плазмиду TOL и собственную плазмиду SAL, детерминирующую разрушение салицилата, и был способен утилизировать как салицилат, так и толуол в качестве единственного источника углерода при ОХ. Психрофильный штамм дикого типа (нетрансформированный) не мог расти при любой температуре, если единственным источником углерода, был толуол (толуат). Эта работа показала принципиальную возможность создания психрофильных штаммов бактерий, эффективно разрушающих ксенобиотики в природных условиях, но для их реального получения необходимо провести дополнительные исследования [5].
3.2. Изменение генов
Объединение разных метаболических путей в одном микроорганизме с помощью конъюгации - это лишь один из способов создания бактерий с новыми свойствами. Расширить их катаболические возможности можно и другим путем, модифицируя гены, кодирующие ферменты того или иного метаболического пути. Осуществимость этого подхода проверяли на примере плазмиды pWWO, 12 генов которой кодируют мета-расщепление толуола и ксилола. Обладающие этой плазмидой псевдомонады могут использовать в качестве источника углерода алкилбензоаты [5].
Детальный биохимический и генетический анализ показал, что несущие pWWO-плазмиду бактерии могут расщеплять 4-этилбензоат только до 4-этилкатсхола, который инактивирует один из основных ферментов данного метаболического пути, катехол-2,3-диоксигеназу, являющуюся продуктом гена xylE, и поэтому не разрушается и накапливается в среде. Кроме того, 4-этилбензоат, в отличие от остальных алкилбензоатов, не активирует XylS-белок; поэтому, если он является единственным субстратом, хуl-оперон не транскрибируется. Для усовершенствования природной системы летиорасщепления алкилбензоатов необходимо решить две основные задачи:
1) предотвратить инактивацию катеход-2,3-диоксигеназы 4-этил-бензоатом;
2) индуцировать транскрипцию генов хуl -оперона в том случае, если единственным субстратом является 4-этилбензоат[5].
Для решения второй задачи был проведен поиск мутантной плазмиды. Для этого в плазмиду, несущую ген устойчивости к ампициллину, встроили ген устойчивости к тетрациклину, находящийся под контролем Рт -промотора. В другую плазмиду, несущую ген устойчивости к канамицину, встроили ген xylS. Полученными конструкциями трансформировали E . coli, отобрали клетки, содержащие обе плазмиды, по признаку устойчивости к ампициллину и канамицину (рис. 8, А), обработали их мутагеном этилметансульфонатом и вырастили на среде, содержащей тетрациклин и 4-этилбензоат. Растущие на этой среде клетки содержат мутантный ген xylS и продуцируют измененный XylS-белок (S*), который способен взаимодействовать с 4- этилбензоатом и активировать транскрипцию гена устойчивости к тетрациклину. Чтобы решить проблему инактивации катехол - 2,3 -диоксигеназы, мутантный ген xylS встроили в плазмиду с широким кругом хозяев, несущую ген устойчивости к канамицину, и ввели ее в клетки P. putida, содержащие плазмиду pWWO (рис. 8, Б). Трансформированные клетки высеяли с высокой плотностью на чашки с минимальной средой, содержащей 4-этилбензоат в качестве единственного источника углерода, канамицин для отбора клеток с плазмидой и этилметансульфонат. Клетки, растущие на этой среде, вырабатывают измененную катехол-2,3-диоксигеназу, которая не ингибируется 4-этил-катехолом. Дополнительный анализ подтвердил, что в гене катехол-2,3-диоксигеназы pWWO действительно произошла мутация и что два мутантных гена обеспечивают расщепление 4-этилбензоата [5].
Оба модифицированных гена участвуют в процессе деградации всех субстратов данного метаболического пути. Поэтому стратегия, использованная для повышения эффективности расщепления 4-этилбензоата, применима и в случае других соединений. Таким образом, проведенная работа показывает, что вполне реально усовершенствование того или иного катаболического пути с помощью технологии рекомбинантных ДНК, традиционного мутагенеза и соответствующих методов отбора [5].
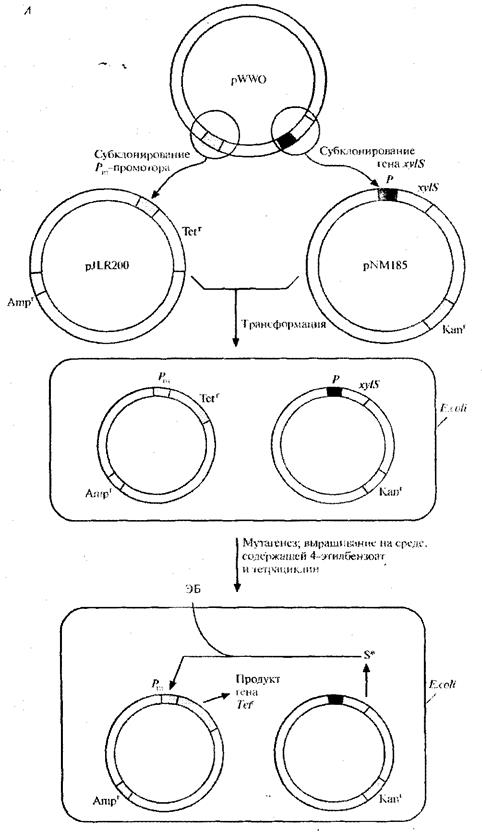
Рис.8, А. Создание системы синтеза белка XylS-белка, активируемого 4-этилбензоатом
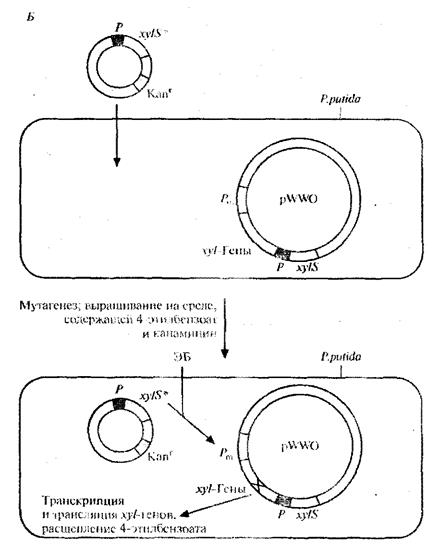
Рис.8, Б. Создание системы синтеза модифицированной катехол-2,3-дикосигеназы, которая не ингибируется 4-этилкатехолом
4.МЕХАНИЗМЫ УСКОРЕНИЯ БИОДЕГРАДАЦИИ ПОЛЛЮТАНТОВ В ОКРУЖАЮЩЕЙ СРЕДЕ
Биодеградация персистентных поллютантов в природе может длиться десятки лет, вызывая нарушение функционирования биоценозов. Бурное развитие экологической биотехнологии как науки и формирование рынка экологических биотехнологий в развитых странах вселяют некоторый оптимизм относительно решения в будущем проблемы глобального загрязнения окружающей среды [6].
Поскольку биодеградация загрязнителей осуществляется, в основном, в результате жизнедеятельности бактерий и грибов, пополнение знаний о функционировании этих организмов позволяет разрабатывать новые подходы к осуществлению ускоренной и более полной деградации ксенобиотиков [6].
Уже традиционными стали технологии биоремедиации загрязненной почвы, основанные на стимуляции естественной деструктивной микрофлоры или интродукции высокоактивных штаммов микроорганизмов. Однако среди ученых не утихают споры по поводу экологической и коммерческой оправданности внесения чужеродных организмов в сформировавшиеся природные ценозы. Не вызывает сомнения необоснованность рекомендаций по повсеместному использованию нефтеокисляющих биопрепаратов. Более экологичными можно считать способы стимуляции аборигенных микроорганизмов in situ. Проведенные нами исследования и анализ многочисленных публикаций в ведущих научных изданиях показывают сопоставимость эффективности названных приемов. Что же касается стоимости, стимуляция имеет неоспоримые преимущества, хотя и в этом случае требуется строгий токсикологический контроль за состоянием ремедиируемого участка [6]..
Последнее десятилетие характеризуется всплеском развития фиторемедиации - технологии, основанной на использовании растений. Известно, что растительная ризосфера за счет ее насыщенности ассоциативными и симбиотическими микроорганизмами является зоной повышенной биохимической активности, что и служит причиной ускорения процессов биодеградации поллютантов в почве под растениями. Вместе с тем, фиторемедиация является эффективной, экономически выгодной и эстетически привлекательной технологией, наиболее принимаемой обществом. Однако по конечному результату она сопоставима с другими экологическими биотехнологиями [6].
В научных публикациях последних лет появилась новая зеленая технология - трансгенная ремедиация, которую можно считать самым эффективным приемом очистки почвы на сегодняшний день. Использование трансгенных растений позволяет повысить деградацию поллютантов в сотни раз. Однако представляется маловероятным широкое использование этой технологии в обозримом будущем [6].
ЗАКЛЮЧЕНИЕ
Биодеградация – это процесс разрушения микроорганизмами веществ, загрязняющих окружающую среду [5].
Микробная деградация играет существенную роль в процессах детоксикации устойчивых поллютантов, загрязняющих среду в результате деятельности человека. Особенно важное значение процессы микробной биоконверсии имеют при деградации галогенированных ксенобиотиков, для токсикации которых термальные и физико-химические методы непригодны, так как приводят к образованию более токсичных соединений типа диоксинов и бензофуранов [7].
Многие бактерии рода Pseudomonas несут плазмиды, кодирующие ферменты, которые катализируют расщепление ароматических и галогенсодержащих органических соединений. В большинстве случаев одна плазмида содержит гены ферментов одного специфичного катаболического пути. Объединяя плазмиды разных штаммов в одном хозяине, можно создать организм, способный к деградации нескольких соединений. Кроме того, с помощью генетических манипуляций можно расширить спектр субстратов, разрушаемых с помощью определенного ферментативного пути [5].
Полученные результаты по изучению особенностей деградации ксенобиотиков, разработка способов интенсификации разложения поллютантов, возможность на основании полученных данных по пространственной структуре молекул методом направленного мутагенеза получать ферменты с заданной/измененной субстратной специфичностью позволяют создать высокоэффективные бактериальные или ферментные препараты для очистки территорий, а также оптимизировать процессы биоремедиации почв и очистки промышленных стоков, содержащих галогенированные поллютанты [7].
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Биодеградация серусодержащего полимера в процессе очистки сточных вод химических производств / Е.В.Перушкина [и др.] // Химическая промышленность сегодня. – 2008. - № 7. – с. 42-49. ISSN 0023 110Х
2. Волова, Т.Г. Биотехнология / Т.Г. Волова. – Новосибирск : Издательство Сибирского отделения РАН, 1999. – 252 с. ISBN 5-7692-0204-1
3. Саловарова, В.П. Введение в биохимическую экологию : учеб.пособие / В.П. Саловарова, А.А. Приставка, О.А. Берсенева. – Иркутск : Издательство Иркутского государственного университета, 2007. – 159 с. ISBN 978-5-9624-0224-6
4. Карасевич, Ю.Н. Основы селекции микроорганизмов, утилизирующих синтетические органические соединения / Ю.Н. Карасевич. – М. : наука, 2002. – 144 с. ISBN 5-76802-386-8
5. Глик, Б. Молекулярная биотехнология. Принципы и применение : [пер.с англ.] / Б. Глик, Дж. Пастернак. – М. : Мир, 2002. – 589 с., ил. ISBN 5-03-003328-9
6. Механизмы ускорения биодеградации поллютантов в окружающей среде [Текст] / О.В. Турковская // Международная научная конференция «Микроорганизмы и биосфера» : тезисы. – М. : ИНМИ РАН. – 2007 г. – Библиограф. : с. 130.
7. Физико-биохимические основы бактериальной деградации ксенобиотиков [Текст] / Л.А. Головлева [и др.] // Международная научная конференция «Микроорганизмы и биосфера» : тезисы. – М. : ИНМИ РАН. – 2007 г. – Библиограф. : с. 31.