| Похожие рефераты | Скачать .docx | Скачать .pdf |
Реферат: Инфекционно-токсический шок. Этиология, патогенез, клиника, лечение
ИНФЕКЦИОННО-ТОКСИЧЕСКИЙ ШОК
Тяжелые пневмонии иногда заканчиваются летальными исходами. Смерть чаще наступает от острой сердечно-сосудистой недостаточности. Смертельные поражения легких у больных пневмонией встречаются сравнительно редко.
Практически во всех случаях при пневмониях в той или иной степени выражены симптомы интоксикации. Крайняя степень токсемии возникает вследствие всасывания продуктов жизнедеятельности микроорганизмов, либо бактерий, что проявляется ИНФЕКЦИОННО-ТОКСИЧЕСКИМ ШОКОМ - одним из тяжелых осложнений пневмоний, при котором летальность составляет 30-50%.
Патогенез шока при пневмонии.
Вначале несколько общих понятий о шоке. Шок - это острое нарушение гемодинамики, характеризующееся критическим расстройством тканевой перфузии, которое ведет к дефициту кислорода в тканях, повреждению клеток и органов. Одним из важнейших патофизиологических звеньев шока является нарушение капиллярного кровообращения, приводящее к дефициту кислорода, нарушениям обмена веществ и в конечном итоге - к необратимому состоянию.
Следует подчеркнуть, что МОС при шоке не может быть показателем перфузии тканей, о чем свидетельствуют наблюдения высокого выброса при септическом шоке. Дело в том что, при выраженной вазоконстрикции и артерио-венозном шунтировании минутный кровоток может быть распределен так, что большая часть органов и тканей пострадает от дефицита перфузии при относительно нормальной или даже увеличенной работе сердца как насоса. Следовательно, при шоке может наблюдаться как низкий, так и высокий МОС.
Инфекционно-токсический шок - развивается в результате воздействия эндотоксинов и бактериальных продуктов на клеточные мембраны, компоненты свертывания крови и комплемент, что приводит к повышению свертываемости, повреждению клеток и нарушению кровотока, особенно микроциркуляции.
Система комплемента состоит не менее чем из 20 различных самоустанавливающихся протеинов и может быть активирована каким-либо одним из по меньшей мере двух пусковых факторов. Во время активации ранее синтезированные биологически активные протеины превращаются в гуморальные медиаторы воспаления и альтерации тканей. Активация комплемента происходит ступенчато, наподобие каскада свертывания крови. Образование полного комплемента приводит к лизису мембраны клеток бактерий, эритроцитов и других тканей. Высвободившиеся во время активации комплемента фрагменты пептидов активируют другие клеточные и гуморальные эффекторные системы. Известны два пути активации системы комплемента: классический и альтернативный. Альтернативная активация (называемая также пропердиновой) может произойти под влиянием неиммунологических факторов, независимо от антител. В литературе имеются данные об активации комплемента липополисахаридами (эндотоксины). Активация комплемента приводит к образованию низкомолекулярных пептидов - факторов комплемента С3,С4 и С5, опосредующих клеточные и гуморальные реакции. Фрагменты С3а, С4а и С5а называют анафилотоксинами. Они стимулируют высвобождение гистамина из тучных клеток и базофилов, вызывают сокращение гладких мышц и увеличивают проницаемость сосудов. Считается, что фрагмент С2 обладает кининовой активностью, вызывая увеличение проницаемости сосудов. Фрагмент С5а, взаимодействуя со специфическими высокоаффинными рецепторами гранулоцитов и тромбоцитов, вызывает агрегацию клеток, усиление прилипания, хемотаксис и активацию клеток. Активированные таким образом нейтрофилы высвобождают метаболиты арахидоновой кислоты, бескислородные радикалы и лизосомальные ферменты, вызывающие воспалительные изменения в тканях и увеличивающие проницаемость капилляров. Данный механизм может иметь определенное значение в возникновении дыхательной недостаточности и вазодилатации при септическом состоянии, вызванном грамотрицательными микроорганизмами.
Литературные данные, полученные в последнее время свидетельствуют также о том, что под влиянием эндотоксинов и других бактериальных продуктов выделяются эндогенные цитокины, основными мишенями для которых являются лейкоциты, эндотелий и сердце. Появляющиеся медиаторы воспаления и сами эндогенные цитокины оказывают большое воздействие на вазомоторный тонус, проницаемость мелких сосудов и агрегацию лейкоцитов и тромбоцитов. Происходит перестройка в терминальном отделе системы кровообращения. В результате этого возникает утрата тонуса как сосудов сопротивления (артериальных), так и объемных (венозных). Кровь может скапливаться в капиллярном русле, а белки плазмы пропотевают в интерстициальную жидкость. В венозной системе также отмечается депонирование крови. В результате стимуляции b-рецепторов открываются артериовенозные шунты конечной части кровотока.
Достаточно важное значение в патогенезе инфекционно-токсического шока в настоящее время придается также образованию в организме нитратов. При воспалительной реакции в организме ключевую роль в образовании нитратов играют макрофаги. Специфический фермент макрофагов - NO-синтаза (макрофагальная, которая локализуется в макрофагах, миокарде и гладкой мускулатуре) превращает аргинин в NO, из которого затем могут образовываться нитриты и нитраты. Главная функция NO, который синтезируется макрофагами, состоит в обеспечении их цитотоксического действия. При активации бактериальными эндотоксинами или Т-лимфоцитами макрофаги усиливают синтез NО-синтазы, которая превращает аргинин в NO. Выделяясь из макрофагов, NO быстро проникает в бактерии и клетка погибает. Таким образом, NO играет важную роль в иммунной защите организма. Кроме того NO способствует снижению активности пограничных воспалительных клеток, тормозит агрегацию тромбоцитов и улучшает местное кровообращение. Патогенное же влияние образования NO в организме при воспалении может заключаться в следующем. При воспалительных процессах в организме могут образовываться активные формы кислорода, которые являются одной из важных молекулярных мишеней для NO. NO связывается с кислородом, образуя пироксинитриты, по токсичности во много раз превосходящие NO. Они то и играют важную роль во многих патофизиологических процессах, включая септический шок, а также ишемические и язвенные поражения органов. Пироксинитрит вызывает повреждение белков и липидов клеточных мембран, повреждает сосудистый эндотелий, увеличивает агрегацию тромбоцитов, участвует в процессах эндотоксемии. Сама NO, избыточно накапливаясь в клетке, может вызывать повреждение ДНК и обладать провоспалительным действием при септическом шоке.
Механизм сосудорасширяющего действия NO
| TNF, IL-1, LPS | ||
| Активация ГЦ | NO | NO-синтаза |
| Накопление цГМФ | Расслабление мышечной клетки | |
| Мышечная клетка |
Принципиальная схема патогенеза инфекционно-токсического шока
| ИНФЕКЦИЯ | ||
| макрофаги, Т клеточные медиаторы, ИЛ-1, 2; ТНФ; МДФ, макрофагальная NO- синтаза | ||
| депрессия миокарда | действие на эндотелий | активация ПМЯ лейкоцитов |
| снижение сосудистого сопротивления, гипотензия | ||
| МНОЖЕСТВЕННАЯ ОРГАННАЯ НЕДОСТАТОЧНОСТЬ, СМЕРТЬ | ||
Примечание: ТНФ - туморнекротизирующий фактор; ИЛ-1,2 -интерлейкин 1, 2; ПМЯ - полиморфноядерные лейкоциты; МДФ - циркулирующий миокардиально-депрессирующий фактор.
Последовательность событий, ведущая к агрегации гранулоцитов и лейкостазу в легких и нарушению функций сердечно-сосудистой системы
| ГРАНУЛОЦИТЫ | |
| Активация комплемента | Лейкоагглютинины |
| АГРЕГАЦИЯ | |
| ЛЕЙКОСТАЗ В ЛЕГКИХ | |
Простагландины Лейкотриены |
Лизосомальные ферменты Свободные радикалы О2 |
ПОВРЕЖДЕНИЕ ЭНДОТЕЛИЯ ПОВЫШЕННАЯ ПРОНИЦАЕМОСТЬ ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ |
|
Патогенез инфекционно-токсического шока
| Грам отрицательные микроорганизмы | Эндотоксин | Туморнекротизирующий фактор | Грам положительные микроорганизмы | |
| Патологический липополисахарид | Активация полиморфно-ядерных лейкоцитов | |||
| Активация XII фактора | Повышение адгезии эндотелиальных клеток | |||
| Формирование капиллярных тромбов | Синтез макрофагальных изоформ NO-синтазы на действие инфектагента с синт-м в клетке NO | |||
| Повышенная проницаемость сосудов | Повышенный выброс радикалов О2 | NO связ-ся с акт. формами О2 , | Миокардиально-депрессирующий фактор | |
| Истощение системы свертываемости крови | Выброс энзимов | образуя пироксинитриты | ||
| ДВС-синдром | Пропотевание крови | Активация фосфолипазы клеточной мембраны | ||
| Геморрагии и кровотечения | Увеличение синтеза арахидоновой кислоты | Снижение силы выброса и гипоксия миокарда | ||
| Увеличение содержания ПГЕ; ИЛ-1; ИЛ-2. | ||||
| Бронхоспазм | ||||
| Острая дыхательная недостаточность | Централизация кровообращения | |||
| Артериальная гипотензия | ||||
| Острая почечная недостаточность | ||||
| Адгезия тромбоцитов | ||||
| СМЕРТЬ | Нарушение тканевого метаболизма | Снижение периферического сопротивления | Тканевая гипоксия | |
Таким образом, на начальном этапе развития заболевания под воздействием эндотоксинов происходит в первую очередь расширение стенок мелких сосудов (в основном венул), а также значительно повышается проницаемость сосудистой стенки. В результате всего вышеизложенного, несмотря на отсутствие абсолютного дефицита объема, венозный возврат к сердцу уменьшается (относительная гиповолемия). В ответ на это происходит рефлекторное симпатическое сужение вен. Но активное сужение вен эффективно уменьшает венозное кровенаполнение только в том случае, если вены хорошо наполнены и растянуты. Если же трансмуральное давление достаточно низко, чтобы привести вены в полуспавшееся состояние, даже сильные сокращения гладкой мышцы вен оказывают только незначительное влияние на количество крови в них. При такой ситуации сужение вен может даже несколько увеличить местную емкость вен, так как оно делает стенку более жесткой, в результате чего просвет становится большим и приобретает более круглую форму, несмотря на то, что просвет окружности уменьшается. В результате снижения венозного возврата повышается активность симпатической нервной системы, что наряду с непосредственным влиянием эндотоксинов ведет к сокращению пре- и посткапиллярных сфинктеров (стимуляция a-рецепторов). В результате кровоснабжение тканей становится недостаточным, минутный объем сердца в эту фазу большей частью нормальный или даже повышенный (т. е. МОС нормальный или увеличенный, ЧСС увеличивается, общее периферическое сопротивление уменьшается и снижается АД). Артерио-венозная разница по кислороду и обеспечение периферии кислородом понижены.
В дальнейшем по мере дальнейшего развития шока происходит формирование рокового порочного круга. Прекапиллярные артериальные сфинктеры более чувствительны к токсическим влияниям (в том числе ацидозу), поэтому их спазм быстро сменяется парезом. Посткапиллярные (венулярные) сфинктеры более устойчивы к метаболическим нарушениям и длительное время остаются в состоянии тонического напряжения. Таким образом, кровь, притекающая в капиллярное русло депонируется, в связи с чем нарастает тканевая гипоксия, усугубляется метаболический ацидоз, пропотевает плазма с нарастающей компрессией капилляров, что наряду с застоем крови в венозном русле, способствует дальнейшему уменьшению венозного возврата и увеличению относительной гиповолемии.
В результате возникает следующая причинно-следственная связь: стаз в капиллярах - висцеральный застой - уход воды - повышение вязкости крови - агрегация красных и белых кровяных телец, образование красного и белого тромба - истощение факторов свертывания и тромбоцитов вследствие диссеминированного внутрисосудистого свертывания - возникновение изнуряющей коагулопатии с повышенной предрасположенностью к кровотечению.
В пораженных областях аэробные энергетические пути переключаются на анаэробный гликолиз. Переключение окислительного обмена на гликолитический путь значительно увеличивает потребление глюкозы при одновременном уменьшении выхода АТФ. Это снова ведет к снижению уровня глюкозы. Биосинтез белка при шоке ограничен. Это особенно быстро влияет на синтез тех белков, которые имеют короткое время полужизни, например, факторы свертывания. Таким образом, нарушение свертывания крови еще более усиливается. При шоке начинается выход калия из клеток. Метаболический ацидоз возникает в результате увеличенной продукции лактата, а также пирувата, a-кетоглутарата и кетоновых тел. Ацидоз частично компенсируется усиленным дыханием. В результате повышения концентрации Н+ в плазме наблюдается следующее: отрицательное инотропное действие на сердце; снижение чувствительности прекапиллярных сфинктеров в смысле вазомоторных реакций с образованием отеков; повышение выброса катехоламинов; активирование свертывающей системы в качестве одной из причин диссеминированного внутрисосудистого свертывания. Некоторые вещества, образующиеся при шоке (в частности и сами цитокины), обладают отрицательным инотропным действием. Длительное действие этих факторов ведет к расширению сердца и сердечной недостаточности, тем самым, к уменьшению МОК.
Особенно чувствительна к недостатку кислорода РЭС. Токсические вещества, например, эндотоксины кишечника, перестают улавливаться РЭС (главным образом печени) и с кровотоком попадают в сердце и легкие. Этот механизм считается одним из главных, способствующих переходу шока в необратимую фазу частично в связи с развитием необратимого коллапса периферических сосудов.
Почки. По причине эфферентного сокращения сосудов при шоке уменьшается давление гломерулярной фильтрации, в результате чего развивается олигурия (4-20 мл/ч) или анурия (4 мл/ч). Сужение почечных сосудов сохраняется еще долгое время после нормализации давления крови. Ишемия вызывает прогрессирующий некроз канальцев вследствие гломерулярной, а затем тубулярной недостаточности с образованием цилиндров в дистальных канальцах. Признаком почечной недостаточности является увеличение содержания в крови таких, обычно выделяющихся с мочой соединений, как мочевина и креатинин.
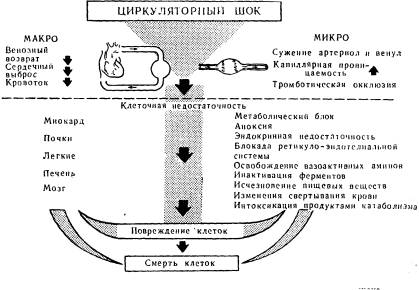
Взаимосвязь между макро- и микроциркуляцией при шоке.
| Уменьшение объема крови, острая сердечная недостаточность, нарушения в периферических сосудах | |||
| Свертывание | |||
| Шокогенные медиаторы | Повышенная проницаемость | Отек, некроз, освобождение ферментов | Сниженный венозный рефлюкс |
| Повышение вязкости | |||
| Повреждение шокогенных органов | Сосудистые реакции | Изнуряющая коагулопатия | Сниженный минутный объем сердца |
| Молочнокислый ацидоз | Гипоксия | ||
| Метаболический ацидоз | Гипотензия | ||
Таким образом, одним из основных патофизиологических механизмов в развитии инфекционно-токсического шока при пневмониях следует считать развитие гиповолемии вследствие секвестрации крови в микроциркуляторном русле и выхода ее в ткани из-за повышения проницаемости капилляров.
Нарушения гемодинамики и их связь с общими нарушениями при шоке |
Клиническая картина : шок развивается на фоне нарастания интоксикации: у больного появляется озноб, за которым следует резкий подъем температуры, часто наблюдается тошнота, рвота, диарея, состояние прострации.
В клиническом плане выделяют следующие группы симптомов, определяющих степень тяжести и прогноз.
| № | Критерии септического синдрома |
| 1. | Клинические признаки инфекции |
| 2. | Температура тела выше 38о С или ниже 36о С |
| 3. | Частота дыхания > 20 в минуту |
| 4. | Число сердечных сокращений > 90 в минуту |
| 5. | Количество лейкоцитов больше 12,0х109 /л или меньше 4,0х109 /л или при 10% незрелых форм |
| 6. | 1 или более изменений со стороны следующих органов: - нарушение сознания; - Ро2 < 70 мм рт. ст.; - олигоурия < 30 мл/час; - увеличение уровня лактата. |
К числу ранних признаков начинающегося ИТШ относятся гипервентиляция, вызывающая респираторный алкалоз, и церебральные нарушения в виде беспокойства или заторможенности. Эти первые симптомы шока часто не привлекают внимание, что приводит к запоздалой диагностике и ухудшает прогноз. По мере развития болезни усиливается тахикардия, одышка, артериальная гипотензия, а иногда тенденция к гипертензии, наблюдается бледность конечностей с акроцианозом. Кожные покровы теплые и сухие («теплый шок»).
При исследовании в этот период определяется: снижение ОПСС и могут появляться ранние признаки снижения фракции выброса (нормализуется на 7-10 сутки), увеличение сердечного выброса, ЧСС, частоты дыханий и Ро2 смешанной венозной крови (из-за артериовенозного сброса)
При прогрессировании шока развивается артериальная гипотензия, нарастает олигурия. При исследовании у этих больных отмечаются низкие значения центрального венозного давления (ЦВД), низкий объем циркулирующей крови (ОЦК) и сердечный выброс, отмечается повышение ОПСС, ЛСС, альвеолярно-артериального градиента Ро2 , уменьшение рН и Ро2 в артериальной крови т. е. гиподинамическая реакция системного кровообращения, нарастает олигурия и молочнокислая ацидемия. Возникает полиорганная недостаточность (СН, острая почечная недостаточность, РДСВ, печеночная недостаточность, ДВС-синдром).
Основные признаки инфекционно-токсического шока
| Система | Патология |
| ЦНС | Энцефалопатия |
| ЖКТ | Холестатическая желтуха Эрозии желудка |
| Кровь | Ранняя нейтропения, затем нейтрофилия ДВС, особенно при грам «-» бактеримии Тромбоцитопения в 50% |
| Почки | Протеинурия Фокальный пролиферативный гломерулонефрит Острый тубулонекроз |
| Метаболизм | Гипер-, гипогликемия Костно-мышечный протеолизис Гипертриглицеридемия Молочный ацидоз |
| Органы дыхания | Респираторный алкалоз Повышение альвеолярно-артериального градиента Ро2 Респираторная мышечная недостаточность |
Прогноз относительно благоприятный, если быстро начата надлежащая терапия.
По мере развития шока отмечается дальнейшее снижение артериального давления, цвет кожных покровов серый, конечности холодные. При исследовании определяется увеличение показателей ЦВД, выраженный метаболический ацидоз и очень высокая концентрация молочной кислоты. Прогноз очень неблагоприятный.
В дальнейшем артериальное давление падает до 50-20 мм рт. ст. и ниже, а часто не определяется. У некоторых больных отсутствует температурная реакция и даже наблюдается гипотермия. У больных низкие показатели ЦВД, низкий ОЦК, сердечный выброс и выраженная молочнокислая ацидемия, которую не компенсирует респираторный алкалоз. Изменяются электролиты крови, отмечается тенденция к гипонатриемии и гипокалиемии. На ЭКГ могут регистрироваться изменения, иногда трудноотличимые от таковых при остром инфаркте миокарда. У таковых больных наступает кома. Летальность при таких проявлениях достигает 100%.
Причины смерти: полиорганная недостаточность(50%), стойкая артериальная гипотензия (40%), тяжелая сердечная недостаточность (10%).
В основе рационального лечения при ИТШ лежит тщательное наблюдение за больным. Весьма полезна непрерывная регистрация клинических данных. У постели больного особенно важно следить за некоторыми основными показателями:
1. Состояние легочного кровотока (и желательно функцию левого желудочка) контролируют с помощью катетера Свана-Ганца. При его отсутствии необходимо измерять центральное венозное давление (ЦВД). Введение катетера в крупные вены или в правое предсердие позволяет получить точные данные о связи между состоянием правого желудочка и объемом циркулирующей крови, что дает возможность регулировать объем вводимой жидкости. ЦВД выше 12-14 см вод. ст. указывает на некоторую опасность продолжения введения жидкостей и угрозу развития внезапного отека легких.
2. Пульсовое давление позволяет оценить величину ударного объема сердца.
3. Сужение кожных сосудов свидетельствует о сопротивлении периферических сосудов, хотя и не отражает полностью нарушения кровотока в почках, мозге или кишечнике.
4. Почасовое измерение объема выделенной мочи позволяет контролировать уровень кровотока во внутренних органах и степень их перфузии. Обычно для этого необходимо введение постоянного мочевого катетера.
Лечение: обязательным терапевтическим мероприятием для данной категории больных является соблюдение ПОСТЕЛЬНОГО РЕЖИМА! (учитывая наличие недостаточного венозного возврата, что может усугубляться в вертикальном положении).
Большое значение в проведении лечебных мероприятий у больных с ИТШ имеет, наряду с активной АНТИБИОТИКОТЕРАПИЕЙ, инфузионная терапия . При проведении инфузионной терапии необходимо учитывать, что при пневмониях, чаще вирусно-бактериальных на фоне имеющихся изменений в легких внутривенное введение растворов, в особенности физиологического и 5% глюкозы, может привести к отеку легких, а в некоторых случаях и к отеку мозга. Поэтому проводить инфузионную терапию необходимо строго дифференцированно с учетом конкретных показаний и под постоянным контролем за общим состоянием, уровнем гемодинамики, диурезом, показателями ЦВД, а также за объективными данными со стороны легких. Обычно у больных с острой сердечно-сосудистой недостаточностью инфузию начинают с полиглюкина, после проведения пробы на реактогенность: в течении 1-й минуты вводят объемвосстанавливающий (замещающий) раствор со скоростью 10-15 кап/м, затем делается 3 минутный перерыв - оценка самочувствия больного; 2-я минута - 20-30 кап/м, затем 3 мин перерыв - оценка самочувствия больного. Если состояние не ухудшилось, производится в/в капельное введение препарата с необходимой скоростью, но не более 60-80 капель в мин. Полиглюкин вводится если уровень АД менее 100 мм рт. ст. Если давление составляет 100-110 мм рт. ст. можно вводить реополиглюкин, который дает не только гемодинамический и дезинтоксикационный эффект, но и улучшает микроциркуляцию, устраняет стаз в капиллярах, снижает адгезию и агрегацию тромбоцитов, что лежит в основе его антитромботического действия. Обычно вводится 400 мл полиглюкина и 400-600 мл реополиглюкина. Если эффект недостаточен, используется плазма, альбумин. При отсутствии вышеперечисленных препаратов в/в в течение 5 минут вводят 200 мл 0,9% NaCl или раствор Рингера с лактатом. В отсутствие эффекта дополнительно вводят 1-1,5 л растворов за 20 минут. Если симптомы шока сохраняются, показан инвазивный мониторинг гемодинамики и введение 2-4 литров инфузионных растворов за 1 час. При тяжелом шоке, а также при отеке легких показаны вазопрессорные средства.
Вазопрессорные средства. Дофамин, 5-20 мкг/кг/мин в/в; в отсутствии эффекта добавляют норадреналин, 0,5-30 мкг/ мин в/в, по возможности уменьшая дозу дофамина до «почечной» (2-4 мкг/кг/мин).
Инотропные средства. При низком сердечном выбросе к инфузии дофамина или норадреналина добавляют добутамин, 5-20 мкг/кг/мин.
К побочным реакциям вышеперечисленных препаратов относят эктопические нарушения ритма, тошноту и рвоту и иногда тахикардию. Они обычно нивелируются при уменьшении дозы препарата.
Эффективность кортикостероидов для выведения больных из самого инфекционно -токсического шока в настоящее время не доказана , хотя, возможно, какое-то положительное действие на биологические мембраны они могут оказать. В частности, в литературе имеются указания на то, что выработка NO может замедляться или исчезать под влиянием глюкокортикостероидов.
Экспериментальные методы: применение больших доз налоксона, НПВП, моноклональных антител к эндотоксинам и фактору некроза опухолей, антагонистов рецепторов интерлейкина-1 и антагонистов оксида азота.
Для коррекции гемостаза (в том числе и борьба с ДВС синдромом) рекомендуется гепарин в суточной дозе около 20000 ЕД, который также является ингибитором биологически активных веществ, участвующих в воспалении.
Что касается введения антибиотиков, то препараты следует вводить внутривенно, при этом желательно использовать бактерицидные антибиотики. В разгар инфекционно-токсического шока антибактериальная терапия должна осуществляться по сокращенной программе - разовые и суточные дозы антибактериальных препаратов должны быть уменьшены по крайней мере в 2 раза. При сопутствующих заболеваниях сердечно-сосудистой системы возможно применение бактериостатических антибиотиков.
Полезным может оказаться применение курантила или изоптина (финоптина) как средств защиты миокарда от гипоксии. Весьма эффективным может оказаться компламин и трентал. Больным, у которых несмотря на повышенное ЦВД или давление в сосудах легких, сохраняется гипотензия, могут помочь сердечные гликозиды (коргликон, строфантин, дигоксин или изоланид), при условии отсутствия добутамина. Показано также введение препаратов, оказывающих положительное влияние на венозный тонус (водорастворимая камфора - сульфокамфокаин, кордиамин и т. д.). Весьма важно поддерживать мочеотделение с тем, чтобы предупредить некроз почечных канальцев. По восстановлении объема циркулирующей крови при стабилизации артериального давления добавляются при необходимости мочегонные препараты (20-60 мг лазикса, буфенокс или 200 мл 10% маннитола (при наличии сердечной недостаточности).
У многих больных с ИТШ Ро2 артериальной крови заметно снижено. В связи с этим им с самого начала важно обеспечить свободное дыхание и поступление кислорода через носовой катетер, маску или трахеостому.
При нормальном или несколько сниженном АД, но выраженной общей интоксикации и гипертермии инфузионная терапия является преимущественно дезинтоксикационной с применением гемодеза (200-400 мл в течение 2 дней). При обширном воспалительном процессе в легких (поражение доли, 3 сегментов) рекомендуется применение нестероидных противовоспалительных препаратов (индометацин, вольтарен по 100-125 мг/сутки).
С целью объективизации показаний к проведению инфузионной терапии у больных пневмониями можно использовать таблицу подсчета суммы диагностических коэффициентов. При этом чем больше сумма диагностических коэффициентов превышает порог принятия решения (+30), тем выраженнее интоксикация и нарушение гемодинамики, следовательно, целесообразно более интенсивное проведение инфузионной терапии, заметно повышающей лечебный эффект у данной категории больных.
В ряде случаев течение острой пневмонии может осложняться развитием ОСТРОЙ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ в результате расстройства легочного газообмена, основными из которых могут быть следующие:
I - вентиляционный - определяется недостаточной вентиляцией всех или большинства респиронов, в результате наблюдается затруднение как оксигенации крови, так и выведение углекислоты; это приводит к артериальной гиперкапнии и гипоксемии;
II тип, паренхиматозный - обусловлен местными изменениями в паренхиме легких и возникающим несоответствии между вентиляцией и кровотоком в сосудах респиронов.
Повышение общей вентиляции в ответ на гипоксемию приводит к достаточному и даже избыточному выведению углекислого газа, в силу более высокой диффузионной способности углекислого газа по сравнению с кислородом; развивается артериальная гипоксемия на фоне нормального или сниженного напряжения углекислого газа. Вентиляционные расстройства могут быть вызваны нарушением деятельности дыхательного центра, функциональной недостаточностью дыхательных мышц в результате спазма или воспаления большинства бронхиол. Паренхиматозные нарушения могут быть обусловлены несоответствием между вентиляцией и кровотоком в отдельных участках легкого. Паренхиматозная ОДН возникает при задержке бронхиального секрета на фоне нарушенного механизма его удаления, а также при наличии патологического состояния легкого, заключающегося в его уплотнении, связанном с заполнением воздухоносных пространств альвеол, бронхов, бронхиол жидкостью и клетками. Классический пример уплотнения - пневмония.
Паренхиматозная ОДН может утяжелять вентиляционные расстройства или, постепенно прогрессируя, приводить к смешанному типу ОДН. При наличии выраженной плевральной боли нарушается ритм дыхания, затрудняется откашливание бронхиального секрета, возникает препятствие частой смене положения в постели и уменьшается возможность физиологической аэрации. В свою очередь, гиперкапния увеличивает спазм бронхов, вязкость и количество бронхиального содержимого и тем самым еще больше ухудшает механические свойства легких, что в свою очередь ухудшает вентиляцию. Прогрессирующее выключение бронхов и бронхиол ведет к максимальному уменьшению отношения вентиляция - кровоток. В артериальной крови вместе с прогрессирующей гипоксемией определяется гиперкапния, свидетельствующая о значительном поражении легочной паренхимы.
Основные клинические симптомы дыхательной недостаточности.
Наиболее известным и вместе с тем не всегда легко диагностируемым симптомом гипоксемии является цианоз, который лучше всего определяется по окраске слизистой оболочки рта. К сожалению, выявление этого симптома зависит от множества факторов - освещения, содержания гемоглобина, окраски кожи и слизистых оболочек, наличия пигментации. Уточнению диагноза может помочь проба с вдыханием кислорода. Если при этом синюшная окраска исчезает, факт наличия цианоза сомнений не вызывает. Признаками гиперкапнии являются головная боль, тремор, периферическая вазодилятация, повышение АД, усиленная потливость, нарушение ритма сна (бодрствование ночью и сонливость днем), депрессия ЦНС от дремоты и легкой спутанности сознания до возникновения комы с подавлением всех рефлексов.
Принципы лечения ОДН диктуют необходимость:
а) постоянного поддержания проходимости дыхательных путей и удаления секрета;
б) осуществления дополнительной оксигенации в случае гипоксемии;
в) борьбы с инфекцией;
г) при необходимости проведения искусственной вентиляции легких.
Лечебные меры, направленные на удаление секрета, предусматривают несколько возможностей. Большое значение имеет адекватная гидратация больного. Необходимо обеспечить увлажнение вдыхаемого воздуха, что в сочетании с обильным питьем или в/в инфузией обеспечивает разрыхление и разжижение мокроты. Если угнетение дыхания связано с болевыми проявлениями, показано применение аналгетиков. Для облегчения выделения мокроты при кашле больному нужно придать положение, в котором мокрота дренируется в крупные бронхи. Выделение мокроты значительно улучшается при массаже грудной клетки. Борьба с инфекцией является одним из важнейших вопросов лечения больных с дыхательной недостаточностью.
Прибегая к кислородной терапии, следует помнить, что этот метод, помимо благоприятного влияния, способен оказать и некоторые нежелательные а иногда даже опасные воздействия.
Во-первых, с этой точки зрения всех больных, страдающих дыхательной недостаточностью, можно подразделить на две группы: с нарушениями центральной регуляции дыхания и без них. В первом случае у больных чаще всего наблюдается сочетание гиперкапнии с гипоксемией. Причем чувствительность дыхательного центра к углекислоте значительно снижена и при наличии повышенного напряжения углекислого газа до 60 и даже 70 мм рт. ст. реакция дыхательного центра на гиперкапнию практически отсутствует. У таких больных роль центрального стимулятора дыхания играет гипоксемия. Обогащение вдыхаемого воздуха кислородом уменьшает или корригирует гипоксемию, что устраняет ее эффект, возбуждающий дыхательный центр. Как только это происходит, наступает опасное снижение объема вентиляции с прогрессирующим нарастанием гиперкапнии, вплоть до возникновения комы. Подобный механизм вредного влияния оксигенотерапии может встретиться у больных с хроническими заболеваниями легких, у которых ОДН наступает в результате обострения их основного заболевания. Применять кислородную терапию у таких больных следует с большой осторожностью. Начальная концентрация кислорода во вдыхаемой смеси не должна превышать 25%. При отсутствии описанного ухудшения состояния больного ее можно увеличить до 30-35% внимательно наблюдая за больным. Что касается больных с сохраненной центральной регуляцией дыхания, то в подобных предосторожностях они не нуждаются и концентрация кислорода во вдыхаемой смеси у них можно не ограничивать.
Во-вторых, длительное дыхание высокой концентрации кислорода, создаваемой большим газотоком, приводит к высушиванию слизистой оболочки трахеи и бронхов. Для предупреждения высушивания слизистой оболочки необходимо полноценное увлажнение дыхательной смеси.
В-третьих, постоянная ингаляция высокой концентрации кислорода на протяжении длительного времени (более 1 суток) способна оказать токсическое воздействие на альвеолярный эпителий, поэтому желательно ограничить вдыхаемую концентрацию кислорода до 50-60%. Методы применения оксигенотерапии включают использование масок, носовых катетеров, кислородных палаток, искусственной вентиляции легких.
Борьба с циркуляторными нарушениями в малом круге кровообращения.
Применяется гепарин в начальной дозе 20 000 ЕД в сутки по 5000 ЕД 4 раза в сутки п/к под контролем коагулограммы, тромбоэластограммы. Нарастание дыхательной недостаточности и гипоксии является показанием к увеличению дозы гепарина. При обширных пневмониях, сопровождающихся выраженной гипоксемией, наряду с гепарином показано введение фибринолизина, улучшающего транскапиллярный обмен. Можно рекомендовать начинать с 20 000 ЕД в сутки (по 10 000 ЕД каждые 12 часов), но у наиболее тяжелых больных приходится увеличивать дозу до 30 000 - 40 000 ЕД соответственно повышая дозу гепарина. Одновременно с антикоагулянтной терапией следует применять антиагреганты (трентал, 0,3% раствор аспирина по 200-400 мл в сутки). Терапию направленную на нормализацию легочного кровообращения необходимо проводить длительно до исчезновения воспалительных изменений в легких. Выраженным антибактериальным эффектом обладает растворы гипохлорита натрия (от 0,3 до 1%) вводимые в центральные вены в дозах от 300 до 600 мл в сутки. Кроме того гипохлорит натрия оказывает и выраженное противогрибковое действие. Целесообразно назначение биоксидантов: токоферола, больших доз (до 2 гр. в сутки) аскорбиновой кислоты в сочетании с ретинолом, церулоплазмин по 2-3 мг/ кг в сутки в/в или в/ м. Так как нистатин и леворин не всасываются из желудочно-кишечного тракта их назначение показано только в случаях кишечных кандидозов. Можно рекомендовать низкоэнергетическое лазерное облучение крови.
В патогенезе пневмонии большую роль играет нарушение нормальных соотношений между содержанием воды в сосудистом и внесосудистом секторах легких. Гипертензия малого круга кровообращения, повышение проницаемости биологических мембран из-за интоксикации и гипоксии, нарушениях электролитного баланса (в первую очередь трансминерализация) способствуют развитию интерстициального отека легочной ткани. В связи с этим целесообразно использование глюкокортикоидов (120-180 мг) преднизолона в сутки, а в наиболее тяжелых случаях и более - до 15 мг/ кг, которые не только уменьшают проницаемость мембран, но и обладают десенсибилизирующем действием и в определенной степени способствуют восстановлению нарушений системной гемодинамики. Необходимо также поддержание онкотического давления плазмы введением альбумина, свежезамороженной плазмы (последняя также показана с целью борьбы с ДВС). Однако если у больного прогрессивно повышается ЦВД (центральное венозное давление) или на рентгенограммах выявляется нарастающее усиление легочного рисунка вне зоны воспаления, показано введение салуретиков (лазикс по 20-40 мг в/ в) лучше на фоне применения верошпирона или введения альдактона. При развитии отека легких, помимо диуретической терапии, показано проведение экстракорпоральной ультрафильтрации крови.
Нарастающая гипернатриемия, свидетельствующая об опасности тканевой дегидратации, требует увеличения объема инфузионной терапии, которую необходимо проводить под строгим контролем за ЦВД. Показано введение растворов хлорида калия в глюкозе и исключение препаратов, содержащих натрий.
Если воспалительный процесс в легких несмотря на все применяемые методы лечения, прогрессирует и нарастают явления острой дыхательной недостаточности, необходимо применение искусственной вентиляции легких (ИВЛ).
В общем виде все показания к искусственной вентиляции легких можно подразделить на абсолютные и относительные.
Абсолютные : отсутствие спонтанного дыхания; резкая гиповентиляция или патологические ритмы дыхания.
Относительными показаниями к ИВЛ следует считать признаки дыхательной недостаточности и нарушения газообмена, динамика которых свидетельствует о прогрессирующем ухудшении состояния больного (одышка более 40 в минуту, не исчезающая после снижения температуры; нарушение сознания и психики - сонливость, эйфория, возбуждение, галлюцинации; прогрессирующая гипоксемия со снижением Рао2 ниже 70 мм рт. ст.; присоединение к гипоксемии гиперкапнии с повышением Рсо2 выше 45 мм рт. ст. нарастающий цианоз, повышение, а затем снижение АД, тахикардия, и др.). В число относительных показаний необходимо включить: а) ту или иную степень гиповентиляции, при которой сам больной несмотря на проводимые консервативные мероприятия, неспособен поддерживать нормальный газообмен; б) изменения кровообращения, при которых несмотря на консервативные мероприятия, возникает и поддерживается гипоксемия; в) выраженные сдвиги вентиляционно-перфузионных отношений, сопровождающихся расстройствами газообмена. При сочетании хотя бы двух из них ИВЛ становится абсолютно необходимой.
Вычислительная диагностика показаний для проведения инфузионной терапии у больных пневмониями.
| Клинический признак | Диагностический коэффициент |
Частота дыханий в 1 мин > 16 < или равно 20 > 20 < или равно 25 > 25 < или равно 30 > 30 < или равно 40 |
-8 +1 +2 +9 |
Систолическое АД мм рт. ст. < 90 > 90 < или равно100 > 100 < или равно120 |
+11 +3 - 6 |
Диастолическое АД мм рт. ст. < 60 > 60 < или равно 80 |
+ 8 - 4 |
Число сердечных сокращений > 80 < или равно 90 > 90 < или равно 100 > 100 < или равно 110 > 110 |
- 1 + 1 + 4 + 8 |
Показатель Аллговера > 1,0 < или равно 1,5 |
+ 8 |
| Приглушенность тонов сердца | + 4 |
| Феномен «бесконечного тона» | + 6 |
Температура тела о С > 37о < или равно 38 > 38о < или равно 39 > 39о < или равно 40о > 40о |
- 7 - 3 + 3 + 10 |
Цианоз; есть нет |
+ 7 - 6 |
Кожные покровы: бледные сухие |
+ 3 + 5 |
| Адинамия | + 6 |
Менингизм Рвота Олигурия |
+ 13 + 3 + 7 |
Объективные данные, свидетельствующие о пневмонии: умеренно выражены выражены |
+ 3 + 5 |
Распространенность воспалительного процесса: 2 сегмента доля и более |
+ 1 + 5 |
Примечание: показатель Аллговера = частота пульса (уд/мин) / систолическое АД (мм рт. ст.). Норма 0,6
Похожие рефераты:
Неотложная помощь в невропатологии
Литература - Фармакология (справочник)
Массаж при патологии дыхательной системы
Общая нозология. Типовые патологические процессы
Акушерство. Методические рекомендации кафедры
Физическая реабилитация при ожогах