| Скачать .docx | Скачать .pdf |
Реферат: Современные алгоритмы антибактериальной терапии сепсиса
В.А. Руднов
Необходимость более отчетливой регламентации антибактериальной терапии (АБТ) сепсиса связана с несколькими обстоятельствами: – высоким риском развития неблагоприятного исхода при неадекватном выборе препарата; – принятием решения в условиях дефицита времени; – распространенной в ОРИТ системой дежуранства и различным уровнем подготовки врачей в области терапии инфекций; – наличием доказательств из фармакоэпидемиологических исследований, свидетельствующих об ошибках и нерациональном назначении антибиотиков [1–3].
В последние годы с целью преодоления отмеченных недостатков и совершенствования подходов к терапии данного патологического процесса появился ряд международных и отечественных Рекомендаций и Руководств [4–6].
В отличие от других разделов фармакотерапии сепсиса большинство положений АБТ основаны не на доказательствах высокого уровня, а являются рекомендациями экспертов. Подобная ситуация не является недостатком организации исследований, а отражает сложность сепсиса, как патологического процесса, и особенности антибиотиков, как фармакологических средств, по целому ряду позиций. С целью улучшения восприятия и ускорения внедрения в клиническую практику современных подходов по АБТ сепсиса мы посчитали необходимым конкретизировать в настоящей публикации ряд ключевых положений. Время начала антибактериальной терапии Согласно существующим консенсусным рекомендациям Surviving Sepsis Campaign, объединивших 11 международных Ассоциаций различных медицинских специальностей, АБТ при тяжелом сепсисе должна быть начата в течение первого часа после постановки диагноза и взятия материала для бактериологического исследования [5].
В основу данной рекомендации положены проспективные и ретроспективные исследования, продемонстрировавшие существенно более высокую летальность в случае неадекватного выбора первоначальной схемы АБТ или при запоздалом начале терапии у пациентов с сепсисом и бактериемией, а также госпитальной и внебольничной пневмонией тяжелого течения [1–2].
Быстрая интерпретация тяжести инфекционного процесса может быть выполнена с помощьюиспользования диагностических критериев сепсиса ACCP/SCCM, критериев органной дисфункции (SOFA, MODS, Baue et al.) и/или экспресс–теста на содержание прокальцитонина, уровень которого выше 2 нг/мл, как правило, соответствует сепсису с органной дисфункцией (табл. 1). Алгоритмы выбора схемы антибиотикотерапии Для выбора оптимальной схемы эмпирической АБТ следует принимать во внимание локализацию первичного очага, место возникновения сепсиса (внебольничный, госпитальный, госпитальный в ОРИТ), уровень устойчивости возбудителей госпитальных инфекций (ГИ) к антибиотикам в конкретном отделении, наличие/отсутствие бактериемии. На сегодняшний день в большинстве крупных поливалентных медицинских центров частота грамположительного (Гр+) и грамотрицательного (Гр–) сепсиса оказалась приблизительно равной. Это произошло в результате увеличения роли в патологии таких бактерий, как Streptococcus spp ., Staphylococcus и Enterococcus spp . Инвазивность лечения и рост численности лиц со сниженной антиинфекционной защитой увеличили долю инфекций, вызванных условно–патогенными микроорганизмами, в особенности, S. epidermidis . Среди популяции различных видов стафилококка–возбудителей сепсиса наблюдается неуклонное увеличение метициллин (оксациллин)–резистентных штаммов. Исчезновение доминирующей роли грамотрицательных микроорганизмов сопровождается изменениями этиологической структуры внутри этой группы. Выросла сепсиса, вызываемого неферментирующими грамотрицательными бактериями ( Pseudomonas aeruginosa и Acinetobacter spp .), а также Klebsiella pneumonia продуцентов ? –лактамаз расширенного спектра (БЛРС), а в некоторых лечебных учреждениях – Enterobacter cloacae . Как правило, эти микроорганизмы выступают в роли возбудителей госпитального сепсиса у пациентов ОРИТ. Повышение их значимости в развитии тяжелых инфекций связано с увеличением пропорции больных на длительной ИВЛ и излишне широким использованием в клинической практике цефалоспоринов 3–го поколения и аминогликозидов. Увеличение продолжительности жизни лиц, перенесших критические состояния, популярность схем комбинированной антибиотикотерапии и новые препараты ультраширокого спектра действия обусловили появление прежде крайне редко встречающихся в патологии микробов, таких как Enterococcus faecium , Stenothrophomonas maltophilia , С hryseobacterium spp . и др.. В целом этиологическая структура возбудителей ГИ и уровень их устойчивости к АБП в различных стационарах и отделениях (в особенности в ОРИТ) имеет свое «лицо». Поэтому построение алгоритма АБТ с учетом этиологии и особенностей резистентности к антибактериальным средствам является самым оптимальным подходом. Однако, к сожалению, существование реальных баз данных в ЛПУ, основанных на хорошо организованных микробиологических исследованиях, является пока, скорее, исключением, чем системой. В сложившейся ситуации остается рекомендовать ориентироваться на результаты многоцентровых национальных исследований [7–9].
Взаимосвязь между локализацией очага инфекции и характером микрофлоры, запускающей инфекционно–воспалительный процесс, и местом его развития отображена в таблице 2. Обязательный ракурс оценки состояния пациента – наличие/отсутствие факторов риска смерти у пациента с сепсисом . Под фактором риска смерти понимают какую–либо клинико–лабораторную характеристику (особенность состояния пациента), являющуюся самостоятельным статистически значимым фактором, повышающим риск развития неблагоприятного исхода. В этом отношении наибольшее значение имеют: локализация инфекционного очага, шок и тяжесть ПОН, место возникновения сепсиса (госпитальный, внебольничный), особенности бактериемии (первичная, вторичная, род или вид возбудителя). Эти данные были получены как при рассмотрении когортных исследований, так и в результате выполнения post hoc анализа значительного объема контролируемых испытаний по оценке эффективности отдельных лекарственных средств при сепсисе. В частности, было доказано, что локализация инфекционного очага в брюшной полости и легких сопровождается более высокой смертностью, чем при его нахождении в мочевыводящих путях или коже и мягких тканях при идентичных значениях индексов тяжести состояния пациента [10].
Летальность при вторичной бактериемии превышает таковую при первичной и катетер–ассоциированном сепсисе. А выживаемость при грамотрицательном сепсисес бактериемией ниже, чем при грампозитивном [11].
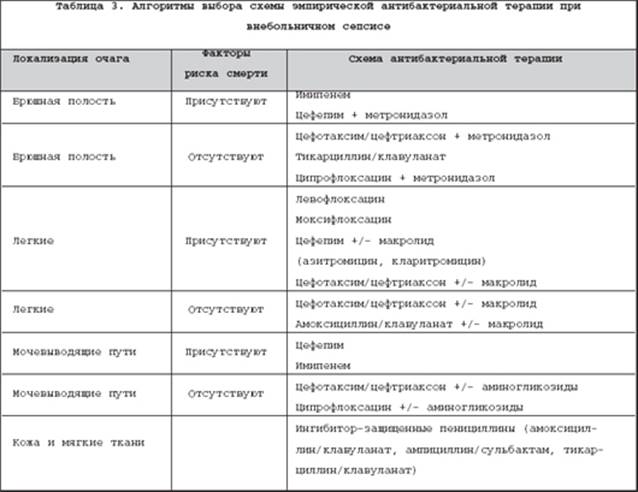
Кроме того, шансы на выживание снижаются у пожилых и престарелых больных, а также у лиц с декомпенсированной хронической сопутствующей патологией (ХПН, ХСН, ХОБЛ, сахарный диабет). В целом алгоритмы выбора схемы АБТ при сепсисе с обозначенных позиций представлены в таблицах 3–4. Подразделение АБТ в зависимости от риска развития неблагоприятного исхода при внебольничном сепсисе обусловлено стремлением максимального снижения вероятности ошибки по выбору препарата и более быстрой эрадикации возбудителя у пациентов в критическом состоянии. Помимо этого, в отношении обозначенных схем выбора в настоящее время имеется обширная клиническая практика, отдельные когортные и контролируемые исследования, свидетельствующие об их высокой эффективности при сепсисе. Вместе с тем, учитывая отчетливую тенденцию к росту устойчивости синегнойной палочки к карбапенемам, следует ограничивать их применение для терапии внебольничного сепсиса в отделениях с высоким уровнем распространенности ГИ и резистентности к ним данного микроорганизма. Анализ применения появившихся в последние годы в арсенале отечественных специалистов респираторных фторхинолонов (левофлоксацин, моксифлоксацин) продемонстрировал их преимущество в плане снижения относительного риска смерти по сравнению с цефалоспоринами 2–3–й генерации в комбинации с макролидами [16].
В силу отсутствия клинических преимуществ и значимого повышения риска нефротоксического действия необходимо отказаться от рутинного добавления аминогликозидов к ? –лактамным АБП как при эмпирической, так и целенаправленной терапии у пациентов с сепсисом (табл. 4) [17].
В общей группе больных не выявлено различий по частоте развития резистентности к АБП, а также бактериальной или грибковой колонизации и суперинфекции. В то время как нефротоксичность при комбинированной АБТ оказалась статистически значимо выше – показатель относительного риска – RR=0,36 (0,28–0,47). С чем могло быть связано такое расхождение между результатами, полученными в эксперименте и в реальной клинической практике? Для АМГ характеренвысокий объем распределения в организме, обусловливающий низкую концентрацию в тканях, в частности, в легких. По–видимому, в этих условиях их содержание в тканях не достигает тех значений минимально подавляющих концентраций (МПК), которые необходимы для эрадикации бактерий. С эти обстоятельством, вероятно, также связано отсутствие доказательств торможения развития устойчивости возбудителей к АБП при добавлении АМГ в схему терапии. Более того, неоправданно широкое использование АМГ привело к росту устойчивости к ним ключевых возбудителей госпитальных инфекций в ОРИТ [14–15].
Логика ориентации на факторы риска смерти при выборе схемы АБТ не может в полной мере быть распространена на госпитальный сепсис в силу большей приоритетной значимости ситуации с локальным уровнем чувствительности ключевых возбудителей к АБП. Именно он должен определять выбор между препаратами разных групп или внутри одной из них. Из–за весьма существенного роста резистентности возбудителей ГИ круг потенциально эффективных препаратов в последние годы заметно сузился. Принимая во внимание результаты многоцентровых исследований в России, можно заключить, что наиболее надежная эмпирическая терапии госпитального сепсиса может быть связана с достаточно узким кругом препаратов – карбапенемами и цефепимом. Назначение ципрофлоксацина без знания особенностей по резистентности в конкретном отделении сопряжено с риском неудач. Добавление ванкомицина или линезолида будет оправданным при ангиогенном сепсисе (АС) или вентилятор–ассоциированной пневмонии (ВАП) в отделениях с высоким уровнем распространения MRSA или у пациентов с нейтропенией. На этиологическую структуру АС влияет несколько факторов: длительность катетеризации, место стояние катетера (верхняя полая или бедренная вена), проводимая АБТ, распространенность MRSA или MRSE в конкретном ОРИТ. При катетеризации более 10 суток и/или нахождении катетера в бедренной вене возрастает риск АС, связанного с P. aeruginosa, Enterococcus spp . и MRSA . Если эти факторы ассоциируют с тяжелым состоянием пациента (шок, ПОН), представляется обоснованной эмпирическая терапия в варианте имипенем (Тиенам) + ванкомицин или линезолид . Подчеркнем, что в результате субпопуляционного анализа установлена идентичная клиническая эффективность монотерапии ? –лактамами и их комбинации с аминогликозидами, в том числе и при сепсисе, связанном с P. aeruginosa (табл. 5) [17].
Возможности проведения деэскалационного режима антибактериальной терапии при сепсисе и септическом шоке Стабилизация гемодинамики, регресс СВР и органной дисфункции при условии надежной идентификации возбудителя и характера его чувствительности к АБП являются необходимыми предварительными условиями для рассмотрения возможности через 3–4 дня перехода на АБП более узкого спектра при первоначальном старте с карбапенемов или с комбинации антибиотиков, перекрывающий спектр возможных патогенов. Переход на антибиотик с более узким спектром действия по результатам бактериологического исследования оправдан как с позиций контроля резистентностипроблемных возбудителей, так и экономии материальных средств. Эффективность и безопасность подобной стратегии недавно была подтверждена в проспективных контролируемых исследованиях, которые касались пациентов с госпитальным сепсисом, осложнившим течение пневмонии. Об исходной тяжести сепсиса свидетельствуют следующие характеристики: 44% больных были в состоянии шока, а 83,5% – требовалось проведение ИВЛ [20].
В качестве стартового режима в данном случае использовался имипенем. Непременными условиями для деэскалационной стратегии использования АБП являются надежность лаборатоных данных и отсутствие бактериемии, связанной с K . pneumonia , Acinetobacter spp ., Enterobacter spp. Дело в том, что в отношении тяжелых инфекций различной локализации с бактериемией, вызванных данными микроорганизмами, существуют исследования, результаты которых демонстрируют значительно более высокую выживаемость при терапии имипенемом , чем цефалоспоринами 3–4–й генерации при чувствительности к ним « in vitro » [12–13].
Поэтому проводить деэскалацию при старте с карбапенемов в данных клинических ситуациях нельзя. Более того, оправдан переход на данный класс АБП при отсутствии клинического эффекта и начальной терапии цефалоспоринами. Путь введения антибактериальных препаратов Всасывание лекарственных веществ у септических больных при внутримышечных инъекциях существенно снижается из–за нарушения периферического кровообращения, метаболического ацидоза, ограниченной подвижности, снижении мышечного тонуса. Более того, наблюдается увеличение объема распределения препаратов при гипергидратации и проведении длительной, активной инфузионной терапии. В результате действия перечисленных факторов снижается концентрация антибиотиков в очаге инфекционного воспаления. В этой связи при сепсисе должен использоваться исключительно внутривенный путь введения АБП. Режим дозирования Развитие тяжелого сепсиса, как правило, сочетается с дисфункцией почек (нередко и печени) и требует более скрупулезного отношения к режиму дозирования АБП. В условиях быстро меняющейся ситуации полезен динамический контроль уровня клиренсакреатинина, который и позволит сделать правильный расчет дозировок АБП на конкретный момент времени. Применения максимально возможных доз требует сепсис, вызванный синегнойной палочкой. Бактерицидность ? –лактамных антибиотиков зависит от времени превышения концентрации препарата в крови/тканях над МПК (минимально подавляющие концентрации) в отношении возбудителей сепсиса. С этих позиций показано определенное преимущество при их введении в виде постоянной внутривенной инфузии после первой нагрузочной дозы в виде болюса [18 и др.].
Такой подход оправдан прежде всего при госпитальном сепсисе, связанном с проблемными микроорганизмами, для которых характерен более высокий уровень МПК ( K . pneumonia , Acinetobacter spp ., P. aeruginosa ). Применения максимально возможных доз антибиотиков требует сепсис, вызванный синегнойной палочкой. Длительность антибактериальной терапии В настоящее время, в свете рассмотрения сепсиса в качестве системной воспалительной реакции (СВР) инфекционного генеза и накапливающихся клинических данных, длительность АБТ для многих его клинических форм должна быть пересмотрена в сторону сокращения. Следует признать устаревшими рекомендации по проведению АБТ до полной нормализации температуры тела или числа лейкоцитов в крови или предлагающие минимальный срок – 10–14 дней [19].
Представляется, что длительность АБТ во многих случаях могла бы быть ограничена 7–10 днями . В первую очередь это касается пациентов с хирургическим сепсисом, у которых выполнена радикальная санация очага инфекта. В основе индивидуального принятия решения должны лежать клинико–инструментальные данные, свидетельствующие о регрессе признаков воспаления в первичном очаге, купировании синдрома системного воспаления, отсутствии признаков присоединения суперинфекции. При госпитальной пневмонии важным подспорьем может служить динамическая количественная оценка возбудителя в нижних дыхательных путях. Отсутствие эффекта от оптимально избранной схемы при внебольничном сепсисе прежде всего является основанием для пересмотра хирургической тактики и поиска не санированных очагов инфекта или рассмотрения альтернативных источников поддержания СВР. В случае госпитального сепсиса, в дополнение к отмеченному, особое внимание необходимо уделить повторному анализу микробиологического диагноза в аспекте «колонизация – инфекция» и заключению о характере чувствительности к АБП.



Список литературы
1. Ibrahim E.H.,Sherman G., Ward S. et al. Chest 2000; 118:146–155.
2. Leibovici L.,Shraga I., Drucker M. et al. J Intern Med 1998;244:379–386.
3. Руднов В.А., Ложкин С.Н., Галеев Ф.С. и др. Клиническая микробиология и антимикробная химиотерапия 2003; 5, №2:144–152.
4. Bochud P.Y.,Glauser M.P., Calandra T. Intensive Care Med. 2001; 27(suppl 1): 33–48.
5. Dellinger R.P., Carlet J.M., Masur H. et al. Suviving Sepsis Campaign guidelines for management of sepsis and septic shock. Crit Care Med 2004 32,4:858–873.
6. Сепсис в начале XXI века.Классификация, клинико–диагностическая концепция и лечение. Патолого–анатомическая диагностика: Практическое руководство.–М.:Издательство НЦССХ им. А.Н.Бакулева РАМН, 2004.–130 с.
7. Сидоренко С.В.,Страчунский Л.С., Ахметова Л.И. и др. Антибиотики и химиотер.1999; 44:7–16.
8. Страчунский Л.С.,Решедько Г.К., Эйдельштейн М.В. и др. Клиническая микробиология и антимикробная химиотерапия 2003; 5, №3:259–274.
9. Страчунский Л.С.,Решедько Г.К., Стецюк О.У. и др. Клиническая микробиология и антимикробная химиотерапия 2003; 5, №1: 36–46.
10. Renaud B. et al. Am J Respir Crit Care Med 2001;163:1584–1590
11. Opal S. et al. Crit Care Med 1999;27:1608 –1615
12. Cisneros J. Clin Infect Dis 1996;22:102 – 108
13. Chow J. Ann Intern Med 1991;115:585–591
14. Бейкин Я.Б. Шилова В.П.,Руднов В.А., Розанова С.М. и др. Микробный пейзаж и антибиотикотеризстентность госпитальной флоры реанимационных отделений Екатеринбурга. Инф.письмо. Екатеринбург, 2004.
15. Решедько Г.К. Микробиологические основы клинического применения аминогликозидов в стационарах России. Автореф дисс... докт мед наук. Смоленск. 2004, 43с.
16. Gleason P., Meeehan T., Fine J. Arch Intern Med 1999; 159:2562–2572.
17. Paul M., Benuri – Silbiger I.,Soares–Veiser K.,Leibovici L. BMJ,doi:10.1136/bmj.308028.520995.63(published 2 March 2004)
18. Craig A.W.,Ebert S.C. Antimicrob Agents Chemother 1992;36:2577–2583.
19. Бочоришвили В.Г. Сепсисология с основами инфекционной патологии.– Тбилиси.:Мецниереба, 1988.–806с.
20. Alvarez–LermaF. etal. Intensive Care Med 2003;29(1S): A250