| Скачать .docx | Скачать .pdf |
Реферат: Основні фармакологічні ефекти кумаринів місного засобу - водного екстракту з трави буркуну
МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я уКРАЇНИ
оДЕСЬКИЙ ДЕРЖАВНИЙ МЕДИЧНИЙ УНІВЕРСИТЕТ
фесюнова Галина Степанівна
УДК 615.322-092.9
Основні фармакологічні ефекти кумаринв місного засобу – водного екстракту з трави буркуну
14.03.05 – фармакологія
Автореферат
дисертації на здобуття наукового ступеня
кандидата біологічних наук
Одеса – 2008
Дисертацією є рукопис.
Робота виконана в Інституті очних хвороб і тканинної терапії ім. В.П. Філатова АМН України
Науковий керівник: доктор медичних наук, професор СОТНІКОВА ОЛЕНА ПЕТРІВНА, Інститут очних хвороб і тканинної терапії ім. В.П. Філатова АМН України, м. Одеса, завідувач лабораторії фармакології і тканинної терапії
Офіційні опоненти: доктор медичних наук, професор РОЖКОВСЬКИЙ ЯРОСЛАВ ВОЛОДИМИРОВИЧ, Одеський державний медичний університет МОЗ України, завідувач кафедри фармакогнозії
доктор біологічних наук, професор МАСЛОВА НАТАЛІЯ ФЕДОРІВНА, Державне підприємство „Державний науковий центр лікарських засобів” МОЗ України, м. Харків, завідувач лабораторії ферментних і антиферментних препаратів
Захист відбудеться “19” березня 2008 року об 1100 годині на засіданні спеціалізованої вченої ради Д 41.600.01 при Одеському державному медичному університеті МОЗ України (65082, м. Одеса, пров. Валіховський, 2).
З дисертацією можна ознайомитись у бібліотеці Одеського державного медичного університету МОЗ України (65082, м. Одеса, пров. Валіховський, 3).
Автореферат розісланий “18” лютого 2008 р.
Вчений секретар
спеціалізованої вченої ради
к.мед.н., доцент В.В. Годован
ЗАГАЛЬНА ХАРАКТЕРИСТИКА ДИСЕРТАЦІЇ
Актуальність теми. Актуальність застосування лікарських рослин незмірно зросла в останні десятиріччя. Висока потреба медицини у відносно нешкідливих препаратах природного походження, що мають специфічну фармакологічну активність, диктує необхідність розробки і впровадження їх у лікувальну практику. Стійкість ряду хронічних хвороб до синтетичних лікарських засобів, а також важкі побічні, у тому числі алергійні реакції на їх застосування, змушують клініцистів все частіше використовувати препарати з рослинної сировини (В.Ф. Корсун та ін., 2003; Т.В.Звягінцева та ін., 2006; І.С. Чекман, 2007).
Збільшується кількість осіб з поєднанною патологією, що потребує одночасного призначення ряду лікарських засобів. Фармакологічна активність лікарських рослин залежить від складу біологічно активних речовин. Перевагу їх становлять мала токсичність і можливість тривалого застосування без істотних побічних явищ. Вони широко використовуються для профілактики і лікування ряду патологічних станів, а також для підвищення терапевтичної ефективності специфічного лікування. Тканинні препарати незамінні при функціональних розладах і начальних формах патології для проведення підтримуючої терапії (Ю.Л. Курако, 2005; О.П. Сотнікова, 2006; А.П. Левицький, 2007).
Найбагатший хімічний склад рослин дозволяє комплексно впливати на весь організм, не порушуючи природного плину фізіологічних процесів, тонко регулюючи патологічні зрушення. Експериментальні дослідження і клінічне застосування лікарських засобів рослинного походження свідчать про велику цінність їх при лікуванні багатьох, особливо хронічних захворювань, коли необхідний тривалий, іноді протягом усього життя прийом лікарських препаратів (І.С. Чекман, 2003; 2007; Н.Ф. Маслова, 2007).
У зв’язку з зазначеним, нашу увагу привернув буркун лікарський - відома лікарська рослина, що має велику кількість БАР та широко використовується в народній медицині. Трава буркуну містить в собі глікозиди, при розщепленні яких звільнюються кумарин, мелілотол, цимарин, мелілотова і кумарова кислоти, а також похідні пурину, холіну, флавоноїди, аскорбінову кислоту, токоферол, каротин, цукри тощо (А.М. Носов, 2005; Н.Н. Сафонов, 2006). Його широко застосовують у вигляді настоїв, відварів як седативний засіб, для лікування застудних захворювань, при алергійних дерматозах та ін. (О.С. Товстуха, 1995; П.А.Кьосев, 2000). Завдяки протизапальним, спазмолітичним властивостям буркун лікарський рекомендують застосовувати при ішемічній хворобі серця – стенокардії, тромбозі коронарних судин і гіпертонії (А.О. Гуков, О.Д. Гукова, 1992; В.Н. Вишнев, 2004). Окремі роботи стосуються вивчення сполук трави буркуну (В.Н. Бубенчикова и др. 1998; В.Н. Бубенчикова, И.Л. Дроздова, 2004), а саме ідентифіковано 18 сполук фенольної природи.
В офіцинальній медицині трава буркуну входить до складу лікарських зборів (детоксифіт, антистрес, кардіофіт), гелів (цикло 3 крем, тигрове око, ревентон). Однак готових лікарських засобів з цієї сировини досі не існує.
Дані літератури про широкий спектр фармакологічних властивостей трави буркуну та наявність вітчизняної сировинної бази з’явились обгрунтуванням для створення нового рослинного препарату, виготовленого за методом академіка В.П. Філатова (1953). Враховуючи, що трава буркуну містить кумариноподібні речовини представляє значний інтерес для лікувальної медицини визначення впливу екстракту буркуну на систему згортання крові, тобто антикоагулянтних властивостей в порівнянні з відомим тканинним препаратом ФіБСом, до складу якого входять синтетичні кумарин і корична кислота.
Зв’язок роботи з науковими програмами, планами, темами. Дисертація виконана в рамках НДР АМН України лабораторії фармакології і тканинної терапії Інститута очних хвороб і тканинної терапіі ім. В.П. Філатова (ІОХіТТ) АМН України за темою: “Изучить специфическую фармакологическую активность и механизм действия экстракта донника” (№ державної реєстрації – 0102U002746). Дисертант є співвиконавцем даної НДР.
Мета та задачі дослідження. Мета роботи – з’ясувати основні фармакологічні ефекти водного екстракту буркуну і експериментально обгрунтувати доцільність застосування його у лікувальній медицині та геріатрії.
Для досягнення поставленої мети вирішувались наступні задачі:
1. Розробити методи ідентифікації екстракту буркуну за вмістом кумаринів.
2. Вивчити гостру і субхронічну токсичність екстракту буркуну і з’ясувати його вплив на ультраструктуру гепатоцитів кролів при тривалому введенні та рівень фармакобіологичної активності на спеціальних біотестах.
3. Дослідити особливості фармакодинаміки та механізм гепатозахисної дії екстракту буркуну.
4. Провести порівняльне вивчення антитоксичних, мембраностабілізуючих та антиоксидантних властивостей екстракту буркуну у кролів різного віку.
5. Визначити антиагрегаційні властивості екстракту буркуну in vitro та вплив на ступінь прояву антикоагулянтної і фібринолітичної дії invivo.
6. Вивчити вплив екстракту буркуну на перебіг експериментальної гіфеми.
Об'єкт дослідження: експериментальна фармакологія фітозасобу– регулятора метаболічних процесів.
Предмет дослідження: основні фармакологічні ефекти кумаринвмісного водного екстракту буркуну в нормі у тварин різного віку та при моделюванні гіфеми, токсичного гепатиту.
Методи дослідження: – фармакологічні, токсикологічні, біохімічні, гематологічні, морфологічні, статистичні.
Наукова новизна отриманих результатів. За допомогою методів хроматографії та спектрофотометрії вперше ідентифіковано та кількісно визначено суму кумаринів, що входять до складу екстракту буркуну. На всіх етапах дослідження встановлено, що за фармакологічними властивостями та біорегулюючою дією екстракт буркуну значно перевищує кумаринвмісний тканинний препарат ФіБС. На фармакологічних тестах для біостимуляторів з природної сировини виявлені антитоксична та антигіпоксична дії. За даними електронно-мікроскопічних досліджень клітин печінки вперше встановлено, що екстракт буркуну підвищує резистентність гепатоцитів шляхом активації білоксинтезуючої та енергоутворюючої функцій.
Вперше встановлено, що екстракт буркуну підвищує детоксикаційну функцію та надає захисну дію тваринам з токсичним ураженням печінки при профілактичному та профілактично-лікувальному застосуванні. Вперше виявлено, що екстракт буркуну надає мембраностабілізуючу дію за рахунок подовження діапазону функціональної стійкості еритроцитів за даними їх осмотичної та перекисної резистентності. Вперше виявлено позитивний біорегулюючий вплив екстракту буркуну на метаболічні процеси старих тварин, що дозволяє віднести його до потенційних геріатричних засобів.
Вперше визначено та експериментально обгрунтовано специфічну фармакологічну активність екстракту буркуну за параметрами впливу на систему гемостазу у кролів. Вперше виявлено високу антиагрегаційну активність екстракту буркуну на крові людини. Встановлено його виразні гіпокоагулянтні властивості за впливом на коагуляційний гемостаз експериментальних тварин. Виявлено, що екстракт буркуну активує фібринолітичну систему, сприяє зниженню фібриногену, чим забезпечує нормалізацію реології та мікроциркуляції крові.
При моделюванні гіфеми у кролів вперше встановлено, що застосування екстракту буркуну підвищує фібринолітичний потенціал слізної рідини, нормалізуючи її коагуляційну активність, що значно скорочує строки розсмоктування крововиливу. При цьому визначено однакову лікувальну ефективність екстракту буркуну незалежно від способу застосування.
Практичне значення отриманих результатів. На підставі експериментальних досліджень обґрунтована доцільність клінічного випробування нового рослинного засобу – екстракту буркуну (Патент України на корисну модель № 3544 „Спосіб одержання водного екстракту буркуну” від 15.11.04 р.), що має специфічні антиагрегаційні, гіпокоагулянтні, фібринолітичні властивості, які є фрагментом матеріалів доклінічного вивчення для подання до Державного фармакологічного центру МОЗ України з метою застосування в офтальмології та геріатрії.
Визначені антиоксидантні і мембраностабілізуючі властивості екстракту буркуну при експериментальному токсичному гепатиті, що дозволить рекомендувати його для комбінованої терапії при зниженні функціональної активності печінки.
Виявлене збільшення детоксикаційної функції печінки та функціональної стійкості еритроцитів у старих тварин надає можливість застосовувати препарат при прискореному старінні, для підвищення резистентності організму до несприятливих впливів зовнішнього середовища.
Отримані дані про механізм дії екстракту буркуну за результатами біологічних методів дослідження впроваджено в практичні заняття кафедри фізіології людини і тварин біологічного факультету ОНУ ім. І.І. Мечнікова.
Особистий внесок здобувача. Автором особисто були здійснені патентно-інформаційний пошук та аналіз наукової літератури за темою дисертації. Визначена мета і задачі дослідження, методичні підходи, опрацьовані моделі, за якими особисто виконані експериментальні дослідження. Здійснена статистична обробка отриманих результатів і оформлення їх у вигляді таблиць та графиків, аналіз і узагальнення результатів, сформульовано висновки, опубліковані основні матеріали дисертації.
Апробація результатів дисертації. Основні положення дисертаційної роботи були представлені і знайшли позитивну оцінку на IV українській науково-практичній конференції з міжнародною участю з клінічної фармакології: “Актуальні питання фармакології” (Вінниця, 2004); XII Російському Національному конгресі “Человек и лекарство” (Москва, 2005); IV національному конгресі геронтологів і геріатрів України (Київ, 2005); XI з’їзді офтальмологів України (Одеса, 2006); сімпозіумі “Рослинні поліфеноли та неспецифічна резистентність” (Одеса, 2006); III національному з’їзді фармакологів України “Фармакологія 2006 – крок у майбутнє” (Одеса, 2006); І-ої науково-практичній конференції „Безопасность лекарств: от разработки до медицинского применения” (Київ, 2007).
Публікації. За темою дисертації опубліковано 20 наукових робіт, з яких 9 статей у наукових журналах, рекомендованих ВАК України, 1 патент України, 10 тез доповідей на наукових форумах різних рівнів.
Структура й обсяг дисертації. Дисертація викладена на 170 сторінках, складається із вступу, огляду літератури, опису матеріалів і методів дослідження, 6 розділів власних досліджень, аналізу і узагальнення результатів дослідження, висновків, списку використаних джерел із 342 найменувань (284 вітчизняних і країн СНД та 58 іноземних). Робота ілюстрована 30 таблицями і 21 рисунком.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріали та методи дослідження. Дослідження проводили в лабораторії фармакології і тканинної терапії (ІОХіТТ) ім. В.П. Філатова АМН України, яка сертифікована ДФЦ МОЗ України (посвідчення № 31 від 2006 р.) у повній відповідності з вимогами Комісії з біоетики ІОХіТТ (протокол № 8 від 7.11.2006 р.) та Методичними рекомендаціями ДФЦ МОЗ України (Київ, 2001).
Роботу виконано на 159 кролях породи Шиншила масою 1,8– 6,0 кг (різного віку), 120 білих щурах лінії Wistar масою 180–220 г, 94 нелінійних білих мишах масою 20–22 г, 35 жабах, вирощених у розплідниках віваріїв Одеського державного медичного університету та ІОХіТТ. Всі тварини були статевозрілі, обох статей, знаходились в умовах віварію ІОХіТТ на стандартному раціоні за встановленими нормами.
Водний екстракт буркуну для ін'єкцій виготовлено з трави буркуну лікарського в лабораторії фармакології і тканинної терапії ІОХіТТ за методом академіка В.П. Філатова, технологію запатентовано (Патент України на корисну модель № 3544 „Спосіб одержання водного екстракту буркуну” від 15.11.04 р.).
В якості референтного препарату використовували тканинний препарат ФіБС, який відноситься до фармакотерапевтичної групи біогенних стимуляторів, що регулюють метаболичні процеси (М.Д. Машковский, 2005).
Визначення в екстракті буркуну кумарину і двох оксікумаринів (скополетин, умбеліферон) проводилося після екстракції їх із препарату хлороформом з наступною хроматографією на пластинках Сорбфіл у суміші розчинників циклогексан Р – ацетон Р – 2–пропанол Р (20:4:1). Наявність кумаринів встановлювалася в УФ світлі при довжині хвилі 366 нм після обробки лужним розчином (ДФУ, 2001). Кількісне визначення суми кумаринів і дослідження спектрів поглинання проводилося на спектрофотометрі СФ–46 у кюветі з товщиною шару 1 см при довжинах хвиль 240–360 нм.
Гостру та субхронічну токсичність вивчали на 3-х видах лабораторних тварин (миші, щури, кролі) згідно Методичним рекомендаціям ДФЦ України (2001). Використовувалися дози з урахуванням максимально припустимих фізичних обсягів введення рідин (К.К. Сидоров, 1973). Для патоморфологічних досліджень тканини міокарда, легень, печінки, нирок були фіксовані в 10 % розчині нейтрального формаліну, піддавалися спиртовій проводці, заливці в парафін. Оглядові препарати фарбувалися гематоксилін-еозином (Г.А. Меркулов, 1969). Ультратонкі зрізи тканини печінки фарбували розчинами уранілацетату і цитрату свинцю. Переглядали і фотографували зразки в електронному мікроскопі ПЭМ–100.
Експериментальні дослідження рівня біологічної активності екстракту буркуну на скринінгових біотестах (дріжджовому, парабіотичному, стрихніновому, антигіпоксичному) виконані відповідно Методичним рекомендаціям ДФЦ України (2001).
Вплив екстракту буркуну і ФіБСу на детоксикуючу функцію печінки оцінювали на моделі гексеналового сну у кролів. Гексенал вводили внутрішньовенно в дозі 35 мг/кг маси у вигляді 5 % водного розчину. Тривалість сну в контрольній групі приймали за 100 %.
Гепатозахисну дію екстракту буркуну і ФіБСу вивчали в умовах токсичного ураження печінки тетрахлорметаном (CCl4 ), який вводили внутрішньошлунково у вигляді 50 % олійного розчину з розрахунку 0,5 мл на 100 г маси тіла протягом двох днів (Ю.И. Губский, 1989).
Для оцінки профілактично-лікувальної дії екстракту буркуну і ФіБСу на хід експериментального токсичного ураження печінки вивчали активність маркерних ферментів цитолізу: аланінамінотрансферази (АлАТ), аспартатамінотрансферази (АсАТ) – за Райтман і Френкель у модифікації В.Г. Колб і В.С. Камишніков (1986), кількість загального білка в сироватці крові – біуретовим методом (А.М. Горячковский, 1998). Антиоксидантну дію препаратів визначали за вмістом дієнових кон’югатів (ДК) (В.А. Костюк та ін., 1984) і малонового діальдегіда (МДА) у сироватці крові (И.Д. Стальная, Т.Г. Гаришвили, 1977).
Антитоксичні та мембраностабілізуючі властивості екстракту буркуну вивчали у кролів різного віку, масою від 3,6–6,0 кг, при 30-денному курсовому введенні. Для оцінки антитоксичної функції печінки використовували бромсульфалеїнову пробу за методикою В.В. Меньшикова (1971), осмотичну за М.А. Базарновою (1982) і перекисну резистентність еритроцитів (М. Mino, 1978). Визначали вміст водо- і жиророзчинних антиоксидантів в крові (J. Glavind, 1963) і активність каталази (М.А. Королюк та ін., 1988) в плазмі крові та печінці.
Вивчення антиагрегаційної активності екстракту буркуну і ФіБСу проведено в дослідах in vitro за методом Борна на багатій тромбоцитами плазмі крові людини на агрегометрі THROMLITE – 1006 А (“Биохиммак”, Росія) на базі Фізико-хімічного інституту ім. А.В. Богатського НАН України. Виражаємо щиру вдячність проф. Карасьовій Т.Л. за надання консультативно-методичної допомоги при виконанні досліду. Суть методу полягає в перевірці здатності досліджуваних об'єктів інгібувати АДФ – викликану агрегацію тромбоцитів крові після їхньої попередньої інкубації з плазмою крові людини (G.V. Born, 1962). Об'єктами даної перевірки були 3 серії екстракту буркуну – лабораторні зразки і препарат порівняння біогенний стимулятор ФіБС з урахуванням розведення в кюветі агрегометра в 7 разів. Антиагрегаційна активність наведена у відсотках інгібування (I %) агрегації тромбоцитів у порівнянні з контролем.
Вивчення впливу екстракту буркунуі ФіБСу на коагуляційний гемостаз при курсовому введеннібуло проведено на 51 кролі породи Шиншила, масою 3,0–4,7 кг, розподілених на 9 піддослідних груп: 3 контрольних (по 5 кролів) і 6 піддослідних (по 5–7 кролів). Показники гемостазу у тварин вивчали до початку досліду (вихідний рівень), на 7, 14, 21 дні введення, через 1 і 2 тижні після закінчення курсу. Екстракт буркуну і ФіБС вводили тваринам підшкірно в дозах: 0,3; 1,0і 3,0 мл/кг для кожної піддослідної групи, відповідно. Контрольним тваринам вводився фізіологічний розчин в аналогічних об’ємах. Визначали наступні показники коагулограми: тромбіновий, протромбіновий, активований парціальний тромбопластиновий час і вміст фібриногену оптичним методом на турбідиметрічному гемокоагулометрі фірми "Солар" (Мінськ) з використанням реактивів фірми "НПО Ренам" (Москва) згідно стандартним методикам (З.С. Баркаган, А.П. Момот, 2001) з урахуванням методичних рекомендацій до приладу (В.В. Дмитриев, 1997). Хагеман-залежний фібриноліз визначали за Kowalski, Kopec, час лізису еуглобулінового зсідка за Kowarzyk, Buluk(З.С. Баркаган, А.П. Момот, 2001) та показник фібринолітичної активності згідно методичним рекомендаціям (Ю.О. Киселевский и др., 1997).
Вплив екстракту буркуну на перебіг експериментальної гіфеми – крововиливу у передню камеру ока (Г.В. Самсонов та ін., 1985) проводили на кролях породи Шиншила, статевозрілих, масою 3,6–5 кг. Усього використано 15 кролів (30 очей), розподілених нарівно на 3 групи: 1 група –контрольна патологія (без лікування); 2 і 3 групи –модель гіфеми з наступним введенням екстракту підкон’юнктивально і підшкірно, відповідно. Екстракт буркуну вводився через 4 години після створення гіфеми в дозі 0,3 мл/кг протягом 10 днів.
Оцінку коагуляційної і фібринолітичної активності слізної рідини проводили за Е.Г. Сомовим, В.В. Бржеским (1992). Внутрішньоочний тиск вимірювали за допомогою тонометра Маклакова масою 7,5 г у ті ж терміни.
Статистичну обробку даних проводили з використанням методів параметричної і непараметричної статистики за допомогою програми ”MicrosoftExcel для Windows – 2000, Statistica5.5 (С. Гланс, 1999).
Результати досліджень та їх обговорення. Наявність кумарину виявляли шляхом зіставлення на хроматограмах зон випробуваного розчину і свідка – синтетичного кумарину. При цьому кумарин виявляється у вигляді зони, що флуоресцирує зеленувато-жовтим кольором. Наявність оксикумаринів підтверджено зіставленням хроматограм випробуваного розчину з достовірними речовинами-свідками – скополетином і умбеліфероном, що подані таким чином: умбеліферон – зона, що флуоресцирує яскраво-блакитним кольором (у середній частині хроматограми), скополетин – зона, що флуоресцирує блакитним кольором (у нижній частині хроматограми).
Спектри поглинання випробуваних розчинів мають виражений максимум, що однозначно дозволяє проводити кількісне визначення кумаринів при довжині хвилі поглинання кумарину, яка дорівнює 272 нм. На підставі фактичних даних встановлено, що вміст суми кумаринів у екстракті буркуну (у перерахунку на кумарин) складає не менше 0,09 %.
Дані, отримані при вивченні гострої токсичності, дозволяють віднести екстракт буркуну до практично нетоксичних препаратів (LD50 >50 мл/кг) за класифікацією К.К. Сидорова (1973).
Тривале введення на протязі 30 днів у дозах 0,3 і 1,0 мл не сприяє будь якому токсичному впливу на організм різних видів піддослідних тварин. Це підтверджується біохімічними показниками крові та відсутністю деструктивно-дистрофічних змін у тканинах внутрішніх органів кролів при гістоморфологічних дослідженнях. Вивчення ультраструктури гепатоцитів проводилось після 21-денного введення екстракту буркуну і ФіБСуу дозі 0,3 мл/кг. Слід зазначити – в гепатоцитах кролів, що отримували екстракт виявлено накопичення кількості рибосом, полісом, мітохондрій, зернистої ендоплазматичної сітки, глікогену, що свідчить про посилення білоксинтезуючої, енергообразуючої функцій печінки, що в цілому відображає активацію метаболічної діяльності, спрямованої на збільшення в клітинах пластичного матеріалу. Підвищення клітинної резистентності під впливом екстракту буркуну є одним з істотних компонентів посилення загальної резистентності організму.
Доклінічна фармакологічна оцінка лікарських засобів з натуральної сировини, призначенних для стимуляції неспецифічної резистентності та адаптаційних можливостей організму, має свої особливості. Це пов’язано, в першу чергу, з наявністю у препаратах названої групи складних комплексів біологічно активних сполук з широким спектром фармакологічної дії. Тому вивчення рівня їх біологічної активності проводять на спеціальних тестах.На дріжджовому тесті встановлено, що екстракт буркунуволодіє високою стимулюючою активністю. Три серії виявляють практично однаковий вірогідно виражений ефект (1050–1100 %). Необхідно відзначити, що рівень біологічної активності ФіБСу складає 110–120 %. Таким чином, у порівнянні з ним рівень біологічної активності екстракту буркунуу 9 разів вище.
На парабіотичному тесті перевірені три серії екстракту буркуну у наступних концентраціях: нативний препарат (per se), 0,1 і 0,01 % розчин. Найбільш високі результати були отримані при перевірці 0,1 % розчину: активність у даній концентрації перевищувала контрольні показники, у середньому, на 48,7 %.
На стрихніновому тесті встановлено, що попереднє введення екстракту буркуну у дозах 0,2; 0,3 і 0,5 мл викликає достовірне збільшення тривалості життя мишей на 86,9; 27,3 і 36,3 %, відповідно. Крім того, на фоні 100 % загибелі контрольних тварин при введенні стрихніну вижило 11; 11 і 22 % тварин, відповідно(р<0,05).
На фоні розвитку гострої гістотоксичної гіпоксії встановлено, що попереднє однократне введення екстракту буркуну у дозі 0,5 мл вірогідно подовжує тривалість життя мишей на 36 % у порівнянні з контролем.
Екстракт буркуну зменшує тривалість гексеналового сну на 20 % у порівнянні з контролем, що свідчить про посилення детоксикуючої функції печінки за рахунок активації мікросомальних ферментів гепатоцитів, метаболізуючих гексенал.
Вивчення гепатозахисних властивостей екстракту буркуну та ФіБСу проводили на моделі токсичного ураження печінки тетрахлорметаном (CCl4 ), генез якого пов’язаний з індукцією вільнорадикального окислення ліпідів.
Гостре отруєння ССl4 характеризувалося значними змінами усіх досліджуваних показників. В групі контрольної патології спостерігалося збільшення масового коефіцієнту печінки, зменшення загального білка, зростання активності трансаміназ у групі контрольної патології АлАТ– на 112,8 % і АсАТ– на 131,9 %, підвищення в сироватці крові проміжних (ДК) і кінцевих (МДА) продуктів окислення ліпідів у 4,3 і 6,7 рази.
Профілактично-лікувальне введення екстракту буркуну сприяло зменшенню коефіцієнта маси печінки та нормалізації загального білка практично до показників інтактних тварин. В групі, яка отримувала ФіБС, коефіцієнт маси печінки був на 25 % вищим (р<0,05).
На фоні попереднього введення екстракту буркуну і ФіБСу активність АлАТ збільшується лише на 62 %, а АсАТ на 74 і 86 %, відповідно (при контрольній патології АлАТ на 112,8 %, АсАТ на 131,9 %) . Профілактично-лікувальне введення вірогідно знижувало цитоліз гепатоцитів. При застосувані екстракту буркуну показники відновилися до рівня інтактних тварин. У групі, що отримувала ФіБС зберігалось достовірне підвищення активності ферментів цитолізу АлАТ і АсАТ на 30 % відповідно (рис. 1).
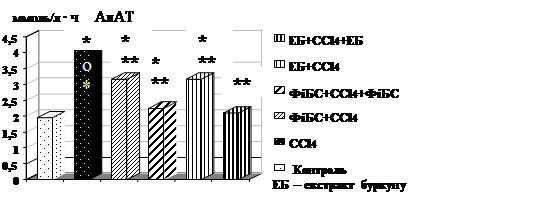

![]()


Рис. 1. Вплив профілактично-лікувального введення екстракту буркуну і ФіБСу на активність АлАТ і АсАТ сироватці крові щурів при гострій інтоксикації CCl4 , n=10
* - вірогідно відносно інтактного контролю (р<0,05);
** - вірогідно відносно групи контрольної патології (р<0,05).
Профілактичне введення досліджуваних препаратів сприяло менш виразному запальному процесу: стосовно контрольної патології екстракт буркуну знижав рівень ДК – у 1,8 (р<0,001) та МДА у 1,5 рази (р<0,01), ФіБС у 1,6 (р<0,001) та 1,3 рази (р>0,1) відповідно.
Профілактично-лікувальне введення екстракту буркуну виявило його виражену антиоксидантну активність, на що вказує достовірне зниження ДК і МДА практично до рівня інтактних тварин, у той час, як при застосуванні ФіБСу вони залишались достовірно підвищеними у 2,3 та 3,3 рази відповідно. Аналіз отриманих результатів показав, що обидва засобу володіють гепатопротекторними властивостями, однак екстракт буркуну виявляє більш виражений гепатозахисний ефект. Стабілізація порушень в гепатоцитах здійснюється завдяки корекції переокиснювання ліпідів.
Антитоксичні та мембраностабілізуючі властивості вивчали у кролів різного віку при 30-денному курсовому введенні екстракту буркуну. Через 30 днів від початку введення у піддослідній групі старих кролів (7 років), відзначено зниження відсотка затримки бромсульфалеїну з 35,8 до 22,3 (р<0,02): виведення фарби відбувалося в 1,6 рази швидше щодо вихідного рівня. У групі молодих кролів (1 рік) відсоток затримки бромсульфалеїну після курсового введення екстракту буркуну склав 11,7 % при 15,3 % вихідного рівня (р<0,02), у 1,3 рази прискорювалося виведення фарби в порівнянні з вихідними даними. Різниця у швидкості виведення фарби у молодих і старих кролів до початку досліду складала 2,3 рази, а після закінчення експерименту скоротилася до 1,9 рази.
Виявлено, що курсове введення екстракту буркуну сприяє підвищенню осмотичної резистентності еритроцитів (ОРЕ). У групі молодих кролів діапазон ОРЕ збільшився: max границя – з 0,29 % до 0,24 %; min границя – з 0,54 % до 0,53 % NaCl. У групі старих тварин, початок гемолізу був зареєстрований при 0,55 % концентрації NaCl, що супроводжувалося руйнуванням 20 % еритроцитарного пула. Повний гемоліз наставав при 0,3 % концентрації NaCl. Підвищення ОРЕ характеризувалося меншою кількістю одночасно зруйнованих клітин (10 %) у момент початку гемолізу при 0,53 % концентрації NaCl, при цьому повний гемоліз відбувався при більш низькій концентрації NaCl (0,24 %). При вивченні перекисної резистентності еритроцитів (ПРЕ) результати дослідження показали, що вихідний рівень перекисного гемолізу еритроцитів у старих кролів на 82 % вище, ніж у молодих. Стійкість еритроцитів до перекисів після закінчення експерименту зросла в групі старих кролів у 2 рази, в групі молодих кролів у 1,4 рази щодо вихідного рівня, тобто різниця між ними скоротилася і склала 21 % (рис. 2).

Рис. 2. Вплив курсового введення екстракту буркуну на ПРЕ у кролів різного віку, контроль (n=5), дослід (n=10)
*- вірогідно в порівнянні з вихідним рівнем (р<0,05);
** - вірогідно в порівнянні вікових груп (р<0,05).
Отримані результати свідчать, що у тварин з віком спостерігається виснаження антиоксидантної системи та зростає потреба у забезпеченні організму додатковою кількістю антиоксидантів. Крім того, дефіцит ендогенних антиоксидантів може бути також пов’язаний із зниженням засвоєння вітамінів та інших фізіологічно-активних речовин у шлунково-кишковому тракті старих тварин.
Виявлено, що вміст водорозчинних антиоксидантів в крові старих кролів до початку експерименту був в значній мірі знижений при порівнянні з молодими (12,4 ± 1,0 мекв/л крові проти 19,3 ± 1,0 мекв/л крові) і становив 64 %. Вміст жиророзчинних антиоксидантів в крові старих тварин відносно молодих склав79,2 % (8,0 ± 0,6 мкекв/л крові проти 10,1 ± 0,8 мкекв/л крові). Активність каталази в плазмі крові 7-річних кролів (315,2 ± 21,2 мккат/л) при порівнянні з 1- річними (502,4 ± 34,1 мккат/л) складала 62 % (р<0,05).
Застосування екстракту буркуну викликало у молодих кролів суттєве підвищення вмісту водо- і жиророзчинних антиоксидантів вже через 15 днів після введення до 118 і 109 %, через 30 днів до 132 і 116 % відповідно. Відзначалося також вірогідне зростання активності каталази на протязі експерименту, що складало через 15 і 30 днів 110 і 116 %.
У старих кролів на 15 день після введення екстракту буркуну, на відміну від молодих, не відзначалося вірогідних змін вмісту жиророзчинних антиоксидантів та активності каталази в крові, а спостерігалась лише тенденція до підвищення їх рівня. Вміст водорозчинних антиоксидантів на 15 день спостереження підвищився до 113,7 % щодо вихідного рівня (р<0,01). Через 30 днів рівень зазначених показників в крові становив, а саме: вміст водо- і жиророзчинних антиоксидантів 130,6 і 112,5 % відповідно (р<0,05). При дослідженні активності каталази в печінці молодих і старих кролів після курсового введення екстракту буркуну встановлено, що активність ферменту у старих тварин підвищувалась до 132,8 % (35,2 ± 2,2 мккат/г тканини) проти контролю (26,5 ± 2,3 мккат/г тканини), а у молодих – до 128,0 % (49,4 ± 3,2 мккат/г тканини) проти контролю (38,6 ± 2,8 мккат/г тканини).
Встановлена висока антиагрегаційна активність екстракту буркуну у дослідах in vitro (на 70–80 % інгібуючи агрегацію тромбоцитів крові у порівнянні з контролем), що практично в 3 рази перевищує показники ФіБСу.
Отримані результати показників гемостазу свідчать про те, що обидва препарати володіють гіпокоагулянтними властивостями,алеекстракт буркунувикликає більш виражений гіпокоагулянтний ефект. Так, через тиждень від початку введення (доза 0,3 мл/кг) відбувається достовірне подовження тромбінового часу (ТЧ) на 30 % (р<0,05), а через два і три тижні на 77 % (р<0,001; р<0,02), в той час, як ФіБС викликає подовження ТЧ на 55 і 60 %, відповідно.
При дослідженні протромбінового часу (ПЧ)відзначалось наступне: наприкінці першого тижня введення екстракту буркуну подовження ПЧ склало 37 % (р<0,02) і 13 % (р>0,05) при введенні ФіБСу. Через два тижні ПЧ збільшилося на 67 % (р<0,02) для екстракту і на 27 % (р<0,05) для ФіБСу. Через три тижні подовження цього показника для екстракту буркуну склало 74 % (р<0,02) і 35 % (р<0,02) – для ФіБСу.
По тесту активованого парціального тромбопластинового часу (АПТЧ) спостерігалося достовірне збільшення цього показника протягом курсового введення екстракту буркуну (на 33, 53, 68 %, відповідно). У ФіБСу ці зміни були недостовірними.Вміст фібриногену після двох тижнів введення екстракту буркуну знизився на 41 % (р<0,05) і зберігався на цьому рівні через три тижні. При тритижневому введенні ФіБСу цей показник практично не відрізнявся від вихідних даних.
У серії експерименту (доза 1,0 мл/кг) зміни досліджуваних показників крові носили характер аналогічний дозуванню 0,3 мл/кг. Однак через три тижні препарат ФіБС вже вірогідно викликає подовження ПЧ на 54 % при рівнобіжному зниженні вмісту фібриногену на 42 %. Екстракт буркуну викликав збільшення АПТЧ, ПЧ, що практично відповідало попереднім даним. ТЧ через три тижні подовжився на 68 % при зниженні вмісту фібриногену на 50 % (р<0,001).
При введенні 3,0 мл/кг отримані дані зберігали тенденцію, аналогічну змінам показників попередніх серій експерименту. При цьому обидва засоба виявили статистично значиму гіпокоагулянтну дію. Встановлено, що екстракт буркуну володіє більш виразним гіпокоагулянтним ефектом у порівнянні з ФіБСом: через три тижні ТЧ подовжилося на 85 %, а при введенні ФіБСу – на 73 %. Відзначено подовження ПЧ на 87 % (екстракт буркуну) і на 61 % (ФіБС); Показник АПТЧ під впливом екстракту збільшився на 88 % проти 63 % – у ФіБСу. Вміст фібриногену зменшився на 68 і 64 %, відповідно. Через тиждень післядії у ФіБСу показники гемостазу практично відповідали вихідному рівню. Для екстракту буркуну зберігалося подовження ТЧ на 32 % (р<0,01); ТЧ і АПТЧ на 13 % і зменшення вмісту фібриногену на 61%. Через два тижні післядії ТЧ практично відповідав вихідному рівню. Подовження ПЧ і АПТЧ склало 18 і 12 % (р<0,05), відповідно, а вміст фібриногену був нижче вихідного рівня на 18 % (р>0,05). Таким чином, екстракт буркуну і ФіБС при курсовому тритижневому введенні виявляють односпрямовану гіпокоагулянтну дію. Однак, екстракт буркуну за всіма показниками виявив більш виражені гіпокоагулянтні властивості, у 1,3–1,5 рази перевищуючи показники ПЧ і АПТЧ ФіБСу (у трьох дозуваннях). 10 – кратне збільшення дози екстракту буркуну не викликало значимих зрушень досліджуваних показників, що може бути пов'язане з позитивним фармакологічним впливом на поліпшення кровообігу, активацію метаболізму, зменшення реабсорбції і гідрофільності в нірках. За даними Р.Б. Косуба (2003) відзначено стимулюючий вплив екстракту буркуну на калій- і натрій-уретичні показники. Враховуючи, що зміни зсідання можуть залежать і від стану фібринолітичної системи, досліджували показники фібринолізу. На відміну від ФіБСу екстракт буркуну при всіх дозах виявляє стимулюючу дію на фібринолітичну ланку гемостазу, що підтверджується певним скороченням часу еуглобулінового лізису (показник фібринолітичної активності збільшився практично в 1,3 рази) і зміцненням активності Хагеман-залежного фібринолізу – каолін-індукований лізис фібринових згустків скоротився на 21, 28, 29 % відповідно.
Враховуючи гіпокоагулянтні, фібринолітичні, антиагрегаційні властивості екстракту буркуну вважалось можливим використати його при лікуванні експериментальної гіфеми, припустивши, що він здатний підсилювати процес розсмоктування крові у передній камері ока. Критерієм оцінки фармакологічної активності екстракту буркуну було скорочення термінів розсмоктування гіфеми в порівнянні з контрольною патологією. В групі контрольної патології на всіх термінах розсмоктування гіфеми спостерігалося підвищення внутрішньоочного тиску (ВОТ): у 1 добу на 33 %, 5 добу – на 26 %, 9 добу – на 26 % щодо вихідного рівня. Скоріше усього це викликано заткненням дренажної системи ока клітинами крові, що захоплюються природним струмом водянистої вологи. У групах, що одержували екстракт буркуну підкон’юнктивально і підшкірно, достовірного підвищення ВОТ у першу добу не спостерігалося, на 5 добу було незначно знижено на 13,5 і на 12,0 %, на 9 добу на 14,8 і на 14,0 % відповідно. Через добу після розсмоктування кров'яного згустку ВОТ залишалося нижче вихідного рівня на 13,0 і на 12,5 % відповідно (рис. 3). Встановлено, що екстракт буркуну здатний нормалізувати мікроциркуляторні і метаболічні порушення при даній патології, внаслідок чого знижувався ВОТ.
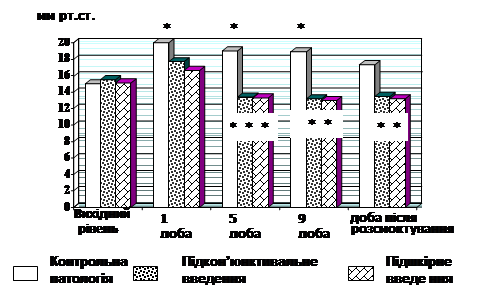

Рис. 3. Вплив екстракту буркуну на динаміку ВОТ при експериментальної гіфеми (n=10)
*- вірогідність порівняно з вихідним рівнем (р<0,05).
В усіх групах у першу добу спостерігалося практично однакове підвищення коагуляційної активності слізної рідини (СР) на 44,9; 47; 46,8 % відповідно. У контрольній групі на 5 добу вона склала 143,9 %, на 9 добу 128,4 % і через добу після розсмоктування гіфеми –115,7 % відносно вихідного рівня. У групах, що одержували екстракт буркуну підкон’юнктивально і підшкірно, на 5 добу коагуляційна активність СР знижувалась на 23,8 і 15,7 %, на 9 добу на 17,5 і 16,5 % відповідно. Через добу після розсмоктування кров'яного згустку коагуляційна активність СР не відрізнялася від вихідного рівня. Зміни фібринолітичної активності СР у динаміці в цілому носили односпрямований характер. У групі контрольної патології відзначене підвищення фібринолітичної активності через добу – на 19,0 %, 5 доба – на 42,7; 9 доба – на 37,0 %.
При підкон’юнктивальному і підшкірному введенні відзначалося більш значне збільшення фібринолітичної активності через добу – на 28,7 і 27,6 %, 5 доба – на 73,2 і 64,2 %, 9 доба – на 93,8 і 82,4 % відповідно. Через добу після розсмоктування гіфеми ці показники перевищували вихідні дані на 11,0 % (р<0,05).
Таким чином, застосування екстракту буркуну при крововиливі в передню камеру ока значно збільшує фібринолітичний потенціал СР і нормалізує її коагуляційну активність, що дозволяє скоротити терміни розсмоктування крововиливу на 5–6 днів раніше у порівнянні з контролем. Екстракт буркуну оказує однаковий лікувальний ефект при даній патології незалежно від способу введення і сприяє швидкому розсмоктуванню кров’яного зсідка з мінімальним ризиком побічного впливу на ушкоджені структури ока кроля.
ВИСНОВКИ
У дисертації наведено нове рішення актуальної наукової проблеми, що виявляється в теоретичному та експериментальному обгрунтуванні ефективності застосування водного екстракту буркуну, як комплексного рослинного біорегулятора із специфічною фармакологічною дією на систему гемостазу.
1. На підставі розроблених методів хроматографічної ідентифікації кумарину і його похідних і спектрофотометричного визначення сукупності кумаринів визначено якісний і кількісний вміст суми кумаринів в екстракті буркуну, що складає не менше 0,09 %.
2. За даними вивчення гострої токсичності встановлено, що екстракт буркуну відноситься до малотоксичних речовин (IV клас токсичності). При вивчені субхронічної токсичності у печінкових клітинах встановлено накопичення кількості рибосом, полісом, мітохондрій, зернистої ендоплазматичної сітки, глікогену, що свідчить про його активуючу дію на білоксинтезуючу та енергоутворюючу функції гепатоцитів. На тестах для природних біологічно активних речовин (дріжджовий, парабіотичний, стрихніновий, гістотоксична гіпоксия) виявлено високий рівень біологічної активності екстракту буркуну з антитоксичною спрямованістю фармакологічної дії. В залежності від дози зростали тривалість життя і виживаність лабораторних тварин. Курсове введення екстракту буркуну підвищує детоксикаційну функцію печінки: відзначено достовірне зменшення тривалості гексеналового сну на 20 %.
3. Встановлено гепатозахисну дію екстракту буркуну при моделюванні токсичного ураження печінки CCl4 . Профілактичне введення екстракту буркуну виявило антицитолітичний ефект на що вказує зниження активності АлАТ і АсАТ у 1,3 рази і виражену антиоксидантну активність – зниження ДК у 1,8 рази і МДА в 1,5 рази щодо контрольної патології. Лікувально-профілактичне введення усуває токсичний вплив CCl4 на печінку і підвищує її фізіологічні можливості. Нормалізація функціонального стану печінки під впливом екстракту буркуну пов’язана з підвищенням білоксинтетичної функції гепатоцитів, стимуляцією мікроциркуляторних процесів, а саме підвищенням клітинної резистентності.
4. Встановлено, що курсове введення екстракту буркуну молодим і старим кролям збільшує діапазон функціональної стійкості еритроцитів (осмотична та перекисна резистентність), що свідчить про мембраностабілізуючі властивості; ефективно регулює прооксидантно-антиоксидантну рівновагу за рахунок підвищення рівня водо- і жиророзчинних антиоксидантів в крові і активності каталази в плазмі та печінці; сприяє прискоренню виведення бромсульфалеїну в 1,3 рази (у молодих кролів) і 1,6 рази (у старих кролів).
5. В дослідах in vitro визначено, що екстракт буркуну має високу антиагрегаційну активність, на 70–80 % інгібуючи агрегацію тромбоцитів крові людини у порівнянні з контролем, і за даною дією практично в 3 рази перевищує референс-препарат ФіБС (27,5 %). На відміну від останнього екстракт буркуну в дозах 0,3; 1,0; 3,0 мл/кг, має більш виразні гіпокоагулянтні властивості, що характеризується достовірним подовженям показників коагуляційного гемостазу (у 1,6–1,9 рази). Під впливом екстракту буркуну знижується вміст фібриногену, що сприяє зменшенню в’язкості крові. Показник фібринолітичної активності та Хагеман-залежний фібриноліз підвищились у 1,3 рази.
6. Введення екстракту буркуну з лікувальною метою при крововиливах в передню камеру ока скорочує терміни розсмоктування на 5–6 днів у порівнянні з нелікованою групою твариннезалежно від способу введення.Екстракт буркуну значно збільшує фібринолітичну активність слізної рідини, нормалізує її коагуляційну активність і знижує внутрішньоочний тиск на 14,0–14,8 %.
ПЕРЕЛІК РОБІТ, ОПУБЛІКОВАНИХ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Фесюнова Г.С., Сотникова Е.П., Лотош Т.Д. Сравнительное изучение влияния экстракта донника и препарата ФиБС на функциональное состояние системы гемостаза (экспериментальное исследование // OfficialJournal “BiomedicalandBiosocialAnthropology” 2004.– № 3. – С. 127–130 (Матер.IV української науково-практичної конференції з між нар. уч. з клінічної фармакології: “Актуальні питання фармакології”. – Вінниця, 2004) (дисертантом виконані експериментальні дослідження, обробка та аналіз даних, узагальнення).
2. Сотникова О.П., Фесюнова Г.С, Лотош Т.Д. Експериментальне дослідження антикоагулянтних и фібринолітичних властивостей водного екстракту з трави буркуну лікарського // Одеський медичний журнал.– 2005. – № 3 (89). – С. 39–42 (дисертантом виконані літературний пошук, проведення експерименту, обробка отриманих даних, аналіз та узагальнення, написання висновків).
3. Сотникова О.П., Фесюнова Г.С, Котов А.Г. Ідентифікація і кількісне визначення суми кумаринів у водному екстракті з трави буркуну лікарського // Фармацевтичний журнал. – 2005. – № 6. – С. 70–74 (дисертантом виконані літературний пошук, виконання вимірювань, проведення комп’ютерного оформлення результатів).
4. Сотникова Е.П. Влияние экстракта донника на ультраструктуру гепатоцитов кроликов / Е.П. Сотникова, Н.Е. Думброва, Г.С. Фесюнова, Н.И. Молчанюк // Буковинський медичний вісник. – 2005. – Т.9, № 4. – С. 193–195 (дисертантом виконані літературний пошук, написання висновків, комп’ютерне оформлення мікрофото).
5. Сотнікова О.П., Фесюнова Г.С. Доклінічна оцінка антитоксичних та мембраностабілізуючих властивостей екстракту буркуну у кролів різного віку // Одеський медичний журнал. – 2006. – № 1 (93). – С. 28–31 (дисертантом виконані літературний пошук, експериментальні дослідження, обробка отриманих даних, аналіз та узагальнення).
6. Сотнікова О.П., Фесюнова Г.С., Лотош Т.Д. Вивчення гепатозахисної дії препаратів екстракту буркуну і ФіБС при моделюванні токсичного ураження печінки // Офтальмологічний журнал. –2006. – № 3 (II) (410). – С. 177–179 (дисертантом виконані експериментальні дослідження, аналіз та узагальнення).
7. Сотникова Е.П., Салдан В.И., Фесюнова Г.С. Традиционные основы тканевой терапии и перспективы развития // Экспериментальная и клиническая медицина. –2007.– №1.–С. 15–19 (дисертантом виконані літературний пошук, оформлення статті).
8. Фесюнова Г.С. Влияние экстракта донника на течение экспериментальной гифемы //Офтальмологічний журнал. – 2007. – № 3. – С. 55–60.
9. Фесюнова Г.С., Коломийчук С.Г. Вплив екстракту буркуну на вміст водо- і жиророзчинних антиоксидантів та активність каталази у кролів різного віку // Одеський медичний журнал. –2007. – № 3. –С. 31–34 (дисертантом виконані експериментальні дослідження, аналіз та узагальнення результатів).
10. Патент на корисну модель 3544, Україна, МПК 7А61К35/78. Спосіб одержання водного екстракту буркуну / О.П. Сотнікова, Г.С. Фесюнова, Г.Б. Абрамова, Т.Д. Лотош, Б.Н. Соколова, В.Й. Салдан, В.І. Іванов В.І.–№ 20040504004; Заявл. 26.05.04.; Опубл. 15.11.04, Бюл. № 11. – 6 с. (дисертантом виконані інформаційно-патентний пошук, обробка отриманих даних, участь в розробці лабораторного. регламенту виготовлення екстракту, оформлення патенту).
11. Карасёва Т.Л., Кабанова Т.А., Фесюнова Г.С. Антиагрегационная активность тканевых препаратов ФиБСа и экстракта донника в опытах invitro // Актуальні питання тканинної терапії та перспективи застосування природних біологічно активних речовин у сучасній медиціні: наук.-практ. конф. з міжнар. уч. Одеса, 17–18 вересня 2003 р. – Одеса, 2003.– С.25.
12. Фесюнова Г.С., Сотникова Е.П. Влияние Экстракта Донника и ФиБСа на коагуляционный гемостаз экспериментальных животных // Человек и лекарство: XII Росс. Нац. конгресс. Москва, 18–22 апреля 2005 г. – Москва, 2005. – С. 719.
13. Соколова Б.Н. Биологическая активность водного экстракта из травы донника лекарственного / Б.Н. Соколова, А.Б. Абрамова, Т.Д. Лотош, Г.С. Фесюнова // Нове в офтальмології: наук.-практ. конф. з міжнар. уч., присвяч. 130-річчю з дня народження акад. В.П. Філатова. Одеса, 13 травня 2005 р. – Одеса, 2005. – С. 54–55.
14. Сотникова Е.П., Лотош Т.Д., Фесюнова Г.С. Гепатозащитное действие препарата экстракта донника и ФиБСа при экспериментальном токсическом гепатите // Нове в офтальмології: наук.-практ. конф. з міжнар. уч., присвяч. 130–річчю з дня народження акад. В.П. Філатова. Одеса, 13 травня 2005 р. – Одеса, 2005. – С. 57–58.
15. Фесюнова Г.С. Влияние экстракта донника на детоксицирующую функцию печени и резистентность эритроцитов кроликов в возрастном аспекте // Проблемы старения и долголетия: матеріали IVконгреса геронтологів і геріартрів України. Київ, 11–13 жовтня 2005. – Т. 14, приложение. –С. 56–57.
16. Сотникова Е.П. Фармакологические свойства нового фитоадаптогена – экстракта донника / Е.П. Сотникова, Г.С. Фесюнова, Т.Д. Лотош, А.Б. Абрамова, Б.Н. Соколова // Вісник стоматології: Матеріали сімпозіуму “Рослинні поліфеноли та неспецифічна резистентність”. Одеса 4–5 жовтня 2006 р. – Спец. випуск. –2006. – № 3 (53). – С. 29.
17. Соколова Б.Н. Деякі фармакологічні властивості екстракту буркуну / Б.Н. Соколова, Т.Д. Лотош, Г.Б. Абрамова, Г.С. Фесюнова // Фармакологія 2006 – крок у майбутнє: III Нац. з’їзд Фармакологів України. Одеса, 17–20 жовтня 2006 р. – Одеса, 2006. – С. 159–160.
18. Фесюнова Г.С. Доклінічне вивчення нешкідливості екстракту буркуну / Г.С. Фесюнова, Т.Д. Лотош, Б.Н. Соколова, Г.Б. Абрамова, Н.І. Молчанюк // Фармакологія 2006 – крок у майбутнє: III Нац. з’їзд Фармакологів України. Одеса, 17–20 жовтня 2006 р. – Одеса, 2006. – С. 179–180.
19. Фесюнова Г.С., Сотникова Е.П., Коломийчук С.Г. Антиоксидантный статус у кроликов разного возраста при применении экстракта донника // Человек и лекарство: XIV Росс. Нац. конгресс. Москва, 16–20 апреля 2007 г. – Москва, 2007. – С. 892.
20. Пасечникова Н.В.Доклиническая оценка безвредности тканевых препаратов по В.П. Филатову / Н.В. Пасечникова, Е.П. Сотникова, В.И. Салдан, Г.С. Фесюнова // Безопасность лекарств: от разработки до медицинского применения: первая научно-практ. конф. К., 31 мая–1 июня 2007 г. – К., 2007. – С. 51–52.
АНОТАЦІЯ
Фесюнова Г.С. Основні фармакологічні ефекти кумаринвмісного засобу – водного екстракту з трави буркуну.– Рукопис.
Дисертація на здобуття наукового ступеня кандидата біологічних наук за спеціальністю 14.03.05 – фармакологія. – Одеський державний медичний університет МОЗ України, Одеса, 2008.
За допомогою методів хроматографії та спектрофотометрії ідентифіковано та кількісно визначено суму кумаринів, що входять до складу екстракту буркуну. На всіх етапах дослідження встановлено, що за фармакологічними властивостями та біорегулюючою дією екстракт буркуну значно перевищує кумаринвмісний тканинний препарат ФіБС.
Виявлено високу антиагрегаційну активність екстракту буркуну на крові людини, гіпокоагулянтні властивості за впливом на коагуляційний гемостаз експериментальних тварин. Екстракт буркуну активує фібринолітичну систему: сприяє зниженню фібриногену, чим забезпечує нормалізацію реології та мікроциркуляції крові. При моделюванні гіфеми у кролів встановлено, що застосування екстракту буркуну підвищує фібринолітичний потенціал слізної рідини, нормалізуючи її коагуляційну активність, що значно скорочує строки розсмоктування крововиливу. При цьому визначено однакову лікувальну ефективність екстракту буркуну незалежно від способу застосування: підкон’юнктивально або підшкірно.
Виявлено високий рівень біологічної активності екстракту буркуну, антитоксичну та антигіпоксичну дії. За даними електронно-мікроскопічних методів дослідження клітин печінки встановлено, що він підвищує резистентність гепатоцитів шляхом активації білоксинтезуючої та енергоутворюючої функцій. Встановлено, що екстракт буркуну підвищує детоксикаційну функцію та надає захисну дію у тварин з токсичним ураженням печінки при профілактичному та профілактично-лікувальному застосуванні. Вивчення екскреторної і мембраностабілізуючої дії екстракту буркуну показало, що він підвищує детоксикаційну функцію печінки молодих і, особливо, старих кролів і збільшує діапазон функціональної стійкості еритроцитів, що сприяє підвищенню антиоксидантного статусу організму.
Отримані результати мають істотне значення для розробки нових підходів до підвищення функціональної активності організму у віковому аспекті, для корекції системи гемостазу (в комплексній терапії тромбозів), а також структурно-функціональних порушень печінки (гепатити різної етіології).
Ключові слова: екстракт буркуну, експеримент, біологічна активність, система гемостазу, токсичний гепатит, гіфема.
АННОТАЦИЯ
Фесюнова Г.С. Основные фармакологические эффекты кумарин-содержащего средства – водного экстракта из травы донника. – Рукопись.
Диссертация на соискание научной степени кандидата биологических наук по специальности 14.03.05 – фармакология. – Одесский государственный медицинский университет МЗ Украины, Одесса, 2008.
В диссертации приведено новое решение актуальной задачи, которое заключается в теоретическом и экспериментальном обосновании эффективности применения водного экстракту донника, изготовленного по методу академика В.П. Филатова. На всех этапах исследования установлено, что по фармакологическим свойствам и биорегулирующему действию экстракт донника значительно превышает кумаринсодержащий тканевой препарат ФиБС.
С помощью методов хроматографии и спектрофотометрии идентифицированы кумарин и два оксикумарина (скополетин и умбеллиферон) и количественно определена суммакумаринов, входящих в состав экстракта донника (0,09 %).
На специальних фармакологических тестах (дрожжевой, парабиотический, стрихниновый, гистотоксическая гипоксия) для биостимуляторов из природного сырья выявлен высокий уровень биологической активности экстракта донника. В зависимости от дозы (0,2; 0,3; 0,5 мл) увеличивается продолжительность жизни и выживаемость лабораторных животных (на 11, 22 та 36 %, соответственно). Курсовое введенеие экстракта донника повышает детоксикационную функцию печени: отмечено достоверное уменьшение продолжительности гексеналового сна на 20 %.
Впервые выявлена высокая антиагрегационная активность экстракта донника invitro, на 70–80 % ингибирующая агрегацию тромбоцитов крови человека в сравнении с контролем, практически в 3 раза превышает референс-препарат ФиБС (27,5 %).
При 21-дневном введении кроликам экстракта донника в дозах 0,3;1,0; 3,0 мл/кг установлены гипокоагулянтные свойства, которые характеризуются достоверным удлинением тромбинового, протромбинового, активированного парциального тромбопластинового времени в 1,6 – 1,9 раза и активация фибринолитической системы, что сопровождается уменьшением времени эуглобулинового лизиса в 1,3 раза и усилением активности Хагеман-зависимого фибринолиза – каолин индуцированный лизис фибриновых сгустков сократился на 21, 25 и 30 % соответственно.
При моделировании гифемы у кроликов установлено, что применение экстракта донника (подкожное и подконъюнктивальное введения) повышает фибринолитический потенциал слезной жидкости, нормализует её коагуляционную активность и снижает внутриглазное давление на 2,1 мм рт.ст. (14,0 %) и 2,3 мм рт.ст. (14,8 %) соответсвенно, что позволяет сократить на 5–6 дней сроки рассасывания кровоизлияния в передней камере глаза в сравнении с группой контрольной патологии.
Ультраструктурные исследования клеток печени после 30-ти дневного введения экстракта донника выявили накопление количества рибосом, полисом, митохондрий, зернистой эндоплазматической сетки, гликогена, что свидетельствует о его активурующем действии на белоксинтезирующую и энергообразующую функции.
На модели токсического поражения печени CCl4 установленоо гепатозащитное действие экстракта донника. Профилактическое введение выявило антицитолитический эффект, на что указывает снижение активности трансаминаз в 1,3 раза и выраженную антиоксидантную активность – снижение диеновых конъюгатов в 1,8 раза и малонового диальдегида в 1,5 раза относительно контрольной патологии. Лечебно-профилактическое введение устраняет токсическое влияние CCl4 на печень и повышает её физиологические возможности. Изучение экскреторных свойств экстракта донника на 2-х возрастных группах кроликов (1 год и 7 лет) показало, что он способствует повышению детоксикационной функции печени, увеличивая выведение бромсульфалеина в 1,3 и 1,6 раза.
Мембраностабилизирующие свойства характеризовались увеличением диапазона осмотической резистентности эритроцитов и их устойчивости к перекисям (у молодых кроликов в 1,4 раза, у старых в 2 раза). Применение экстракта донника способствовало регуляции прооксидантно-антиоксидантного равновесия за счёт возрастания уровня водо- и жирорастворимых антиоксидантов и активности каталазы у молодых и, в особенности, у старых кроликов.
Полученные результаты имеют несомненное значение для разработки новых подходов к повышению функциональной активности организма в возрастном аспекте, для коррекции системы гемостаза (в комплексной терапии тромбозов), а также структурно-функциональных нарушений печени (гепатиты разной етиологии).
Ключевые слова: экстракт донника, эксперимент, биологическая активность, система гемостаза, токсический гепатит, гифема.
SUMMARY
Fesyunova G.S. The main pharmacological effects of the cumarine-containing preparation– the aqueous extract of the herb melilot.– The manuscript.
The dissertation for getting the scientific degree of the kandidate of biological sciences in speciality 14.03.05 – pharmacology – Odessa State Medical University of Health Ministry of Ukraine, Odessa, 2008
For the first time there was identified and quantitatively determined the amount of cumarines that were found in the composition extract of melilot with the help of chromatographic and spectrophotometric methods. At all stages of the research it was established that extract of melilot considerably exceeded the cumarine-containing tissue preparation FIBS by its pharmacological properties and bioregulation effect.
For the first time there was revealed a high antiaggregation activity of melilot extract (in vitro) and established its marked hypocoagulation properties in the effect on coagulation hemostasis of the experimental animals. It was found that extract of melilot activated the fibrinolytic system: it promoted reduction of fibrinogen providing normalization of rheology and blood microcirculation.In modeling hyphema in rabbits it was ascertained that application extract of melilot increased fibrinolytic potential of the lacrimal fluid by normalization of its coagulation activity that considerably reduced the period of hemorrhage resorption. The same therapeutic efficacy extract of melilot was determined independant of the method of application: subconjunctively or subcutaneously.
Special pharmacological tests for biostimulators made of natural raw materials revealed a high level of biological activity extract of melilot, antitoxic and antihypoxia effect. According to the data of electronic-microscopic methods of investigation of the hepatic cells it was established that extract of melilot increased resistance of hepatocytes by means of activation of protein-synthesis and energy- forming function.It was found those extract of melilot increased detoxication function and promoted protective effect in the animals with toxic affection of the liver in preventive and preventive-therapeutic application.The study of the excretory and membrane-stabilizing effect of melilot extract showed that it increased detoxication function of the liver of the young and especially old rabbits and widened the range of functional stability of erythrocytes promoting enhanced antioxidant status of an organism.
The results obtained are of significance for development of new approaches for increasing the functional activity of an organism in the aspect of aging, correction of the hemostasis system (in complex therapy of thrombosis) as well as structural-functional hepatic disorders (hepatites of different etiology).
Key words: extract of melilot, experiment, biological activity, hemostasis system, toxic hepatitis, hyphema.