| Скачать .docx | Скачать .pdf |
Доклад: Доклад: Лазерное лечение внутриглазной меланомы
П ервые попытки использовать интенсивное световое излучение, фокусируемое на внутриглазную меланому с целью ее разрушения, связано с именем G. Meyer–Schwickerath (1952, 1980). Однако, как показали 30–летние наблюдения автора [21], а затем и других исследователей [9, 12], рассчитывать на полную регрессию опухоли при воздействии полихроматическим светом можно лишь в случае сильной ее пигментации и небольшой степени выстояния (до 2 мм). Начало применению лазеров (на рубине, а затем на неодиме) в лечении меланом хороидеи положили офтальмологи из Украинского института глазных болезней им. Филатова (Терентьева Л.С., Линник Л.А. и др., 1969). Оказалось возможным более тонко дозировать коагуляцию тканей по площади, но проникающая способность излучения практически не возросла [6, 11, 12]. В последующем лечебное применение лазеров при внутриглазной меланоме развивалось в трех направлениях.
Фотодинамическая фоторадиационная лазерная терапия
В поисках метода не только более глубокого проникновения в ткани света, но и усиления его избирательного повреждающего действия на опухолевые клетки внимание исследователей (Dougherty T. et al., 1978) привлекла фотодинамическая терапия [15]. Принцип ее заключается в предварительном (обычно за 24 часа) введении в кровяное русло того или иного красителя в расчете на его накопление в опухолевой ткани. Тогда этот краситель вызовет свечение опухолевых клеток и повысит тем самым их чувствительность к лазерным засветам. Ассортимент фотосенсибилизаторов пока невелик. Из числа порфириновых соединений в клинической практике чаще других использовался гематопорфирин. В последнее время в США чаще применяют фотофрин. Естественно, для успешной фотодинамической терапии важно также, чтобы для облучения был выбран лазер, спектральная характеристика которого возможно полнее отвечала бы максимуму спектральной чувствительности мишени. Пока обычно это не очень удается. В частности, к красно–желтому гематопорфирину дополнительным по окраске и максимуму поглощения был бы сине–зеленый лазер. Однако излучения таких длин волн очень слабо проникают через среды и ткани глаза. Обратившись к традиционному подходу, J. Favilla et al. (1991) при предварительной сенсибилизации увеальной меланомы гематопорфирином добились полной регрессии опухоли при облучении лазером на красителях с длиной волны 620–630 нм только в 6 случаях из 19. Суммарная лечебная доза составляла в среднем около 1000 Дж/см2. Примечательно, что чем светлее была опухоль, тем выше была вероятность успеха [16]. Видимо, сильная пигментация экранирует глубокие отделы от проникновения фотонов. J. Davidorf et al. (I9S2) после 10–летнего применения метода при внутриглазных меланомах решили, что его возможности ограничиваются лишь теми случаями, когда небольшая по размеру опухоль локализуется в ткани радужки. Авторы доводили дозу до 1,72х10 6 Дж/см2 [14].
Механизм полезного действия фотодинамической терапии в настоящее время объясняют следующим образом. Молекулы опухолевых клеток под влиянием фотосенсибилизации приходят в неравновесное (возбужденное) состояние и при их облучении лазерным светом нарушается кислородный обмен: обычный кислород превращается в синглетный, который и губит клетку.
В самое последнее время с целью повышения эффективности метода в лечении злокачественных опухолей высказывается идея применения двухфотонной методики, возможной при использовании сверхтвердотельных лазеров (на базе Nd:YLF), излучающих в ближней ИК–области [30]. Значительная длина этих волн (1047 нм) хорошо согласуется с максимумом чувствительности фотосенсибилизирующего агента – фотофрина. Авторы (Wachter Е. et al., 1999), как и прежде, главное достоинство метода, при котором повышается пространственная и временная когерентность излучения, видят в избавлении от возможного термического и аблационного эффекта. Достигается это использованием сверхкоротких импульсов (100–200 фемтасекунд) при огромной мощности (наноджоули) с идеальной фокусировкой и отсутствием рассеяния. Клинических наблюдений, подтверждающих эти расчеты, пока не приводится. Теоретически при указанных параметрах должен возникать микромеханический эффект, полезность которого в онкологических лазерных операциях сомнительна.
Гипертермическая лазерная терапия
Идея использования в онкологической практике гипертермии как дополнительного метода лечения радиорезистентных опухолей появилась в 1970–е годы. Прогревание опухоли до 42–44°С, как было установлено в эксперименте, может приводить к ее спонтанному некрозу по причине ухудшения метаболизма, гипоксии, снижения рН (избирательно в опухолевых клетках). Для прогревания тканей опухоли применяли микроволновое воздействие, ультразвук, ферромагнитные поля и излучения ИК–лазеров.
В первых офтальмологических публикациях, относящихся к 1891–92 гг. [18], и во всех последующих работах [22,23], посвященных транспупиллярной лазерной термотерапии хороидальных меланом, в качестве источника прогрева использовали диодный лазер (с длиной волны 810 нм). Отмечена высокая корреляция глубины некроза опухоли с ростом температуры от 45 до 60°С и с увеличением экспозиции от 1 до 10 мин [22]. Следует, однако, иметь в виду, что при температуре 65°С уже через 10 с наступает заметный некроз склеры. В клинических наблюдениях диаметр пятна воздействия был 3 мм, экспозиция на каждое пятно по 1 мин. При средней мощности излучения около 600 мВт за один сеанс наносили до 16 пятен. Число сеансов достигало четырех.
C.L. Shields et al. (l996), применив эту методику, предложенную J.A. Oos–terhuis et al. (1995), у 17 больных с хориоидальной меланомой (при средней толщине опухоли 3 мм), наблюдали уменьшение опухоли во всех случаях. Спустя 1 мес толщина опухоли сократилась на 0,7 мм, а через 6 мес – еще на столько же. Полного регресса не наблюдали ни разу. При гипертермической терапии, в отличие от фотодинамической, эффект был значительнее у больных с пигментированными опухолями (спустя 6 мес они становились тоньше на 50%, тогда как амеланотические опухоли уменьшались лишь на 21%).
Патоморфологические исследования глаз, энуклеированных у части больных, показали, что толщина некроза варьировала от 1,3 до 3,9 мм [18]. В одном из 11 наблюдений этих авторов, несмотря на довольно высокую тотальную дозу (7300 Дж/см2 при плотности потока мощности 10 Вт/см2), признаков лучевого поражения опухолевых клеток вообще не нашли.
При высоких опухолях толщиной более 5 мм возможен положительный результат при сочетанием использовании (по методу “бутерброда”) диод–лазерных цитотоксических воздействий через зрачок и брахитерапии с помощью бета–аппликаторов с 106 Ru через склеру [22, 23].
Коагуляционная лазерная терапия
Первые попытки повысить эффективность лазерной деструкции увеальных меланом за счет перехода от гипертермического к традиционному для лазерной офтальмологии коагуляционному воздействию на опухоль не привели к сколь–либо значимым новым результатам [11, 12]. Применялась [26] комбинация импульсного воздействия Nd:Yag лазером при миллисекундной длительности импульсов и непрерывным аргоновым лазером при мощности около 1000 мВт и экспозиции 0,2 с. При этом опухоли, толщина которых превышала 2 мм, не всегда удавалось устранить полностью.
Таким образом, накапливавшийся в офтальмоонкологии опыт свидетельствовал о том, что существующая технология лазерного и других способов лечения крупных увеальных меланом (с диаметром более 6 мм, т.е. по объему порядка 150 мм3) не позволяет щадящими методами полностью разрушить опухоль, локализующуюся в заднем полюсе глаза без реальной угрозы для соседних здоровых тканей и, следовательно, без риска потерять остаточное зрение. Однако тот же опыт показывает, что имеется немало пациентов, выражающих готовность согласиться на органосохранное, в т.ч. лазерное лечение и при таких условиях. Исходя из этой предпосылки, нами с группой физиков из Государственного оптического института и офтальмологов из Военно–Медицинской Академии в 1981 г. был создан лазерный онкоофтальмокоагулятор “Ладога–Неодим” предназначенный для мощного объемнокоагулирующего транспупиллярного воздействия на крупные внутриглазные опухоли в заднем отделе глаза [1].
В качестве излучателя был использован твердотельный ИК–лазер на алюмен–иттрий гранате с неодимом (l 1,06 мкм), излучения которого достаточно сильно проникают в непрозрачные ткани, создавая в них объемный конус коагулируемого массива на глубину до 4–6 мм. Из множества апробированных режимов облучения, по данным Я.Д. Кулакова, 1998, наиболее эффективным оказался импульсно–периодический при длительности импульса порядка сотен микросекунд в квазинепрерывном режиме (около 50 Гц) при мощности импульса до 8 Вт и пятне облучения 2 мм. За один сеанс автору удавалось довести уровень поглощаемой в опухоли энергии до 1500 Дж без признаков повреждения роговицы и хрусталика или витреальных геморрагии. Повторные сеансы (от 2 до 6) при необходимости проводили с интервалами в 1,5–3 мес. [2].
Опыт лечения 122 больных со сроками наблюдения от 4 до 12 лет по материалам Я.Л. Кулакова, показал, что при толщине опухоли 3–5 мм и диаметре основания 10–15 мм удалось полностью ее разрушить в 61 случае из 73, а при толщине более 5 мм и диаметре основания более 15 мм – в 24 из 49 (в остальных отмечен продолженный рост).
В ходе лечения возникли следующие осложнения: гемофтальм в 10 случаях, отслойка сетчатки у 8 и катаракта у 6 больных. При гемофтальме и отслойке сетчатки пришлось произвести энуклеацию, а при катаракте после оперативного ее удаления лазерное тротивоопухолевое лечение продолжили. В первой подгруппе из 73 чел от метастазов умерли 6 больных, а во второй (с наиболее крупными опухолями) – из 49 умерли 11. В среднем выживаемость оказалась не ниже, чем после энуклеации [27, 28].
Коагуляционно–абляционная лазерная терапия
В фантомных экспериментах на различных моделях (из пластмассы разных цветов, на стопках черной копировальной бумаги, на тканях опухоли в энуклеированных глазах) в период 1983–88 гг. [8, 25] было изучено распределение поглощаемой тепловой энергии различных лазеров в зависимости от параметров облучения. В 1995 г. возникла идея на тех же моделях воспроизвести и замерить абляционный лазерный эффект [24]. Из рис. 1 можно видеть, что небольшой абляционный кратер в центре очага коагуляции независимо от дозы постоянно присутствует; с увеличением энергетической экспозиции расширяются оба очага (и коагуляционный, и в меньшей мере – абляционный). Чтобы усилить абляционное воздействие по глубине, требовалось применить легкую компрессию с помощью торца стекло–волоконного лазерного наконечника.
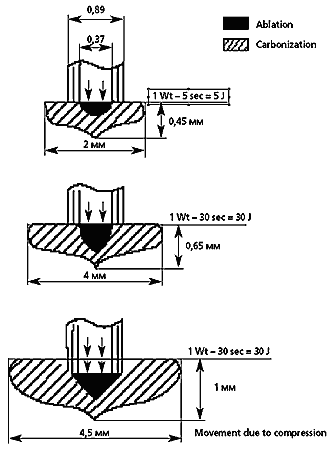
Рис. 1. Схема пространственного распределения зон коагуляции и абляции при контактном воздействии энергией диодного лазера на стопку черной копировальной бумаги.
Сходный принцип абляционного лазерного лечения был применен нами и в клинической практике, сначала при базалиомах век, а затем совместно с О.А. Марченко при меланомах хориоидеи, локализующихся в области заднего полюса глаза, в т.ч. юкстапапиллярно [29, 27, 28].
Техника вмешательства была следующей. В традиционных для витреальной хирургии “косых” меридианах через склеру в проекции плоской части ресничного тела в полость глаза вводили витреофаг и стекловолоконный наконечник световода для диодного лазера фирмы “Милон” (С.Е. Гончаров с соавт.). Все манипуляции в полости глаза проводили под контролем операционного микроскопа с конфокальным освещением при использовании хирургической контактной линзы.
Сведения о степени выстояния и объеме опухоли, полученные в предоперационном периоде при УЗ В–сканировании, позволяли планировать требуемую глубину внедрения лазерного наконечника в толщу опухоли (рис. 2) и необходимую для полного разрушения опухоли суммарную энергетическую экспозицию.
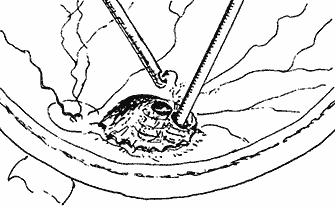
Рис. 2. Схема диод-лазерной абляции юкстапапиллярной меланомы в ходе витрэктомии.
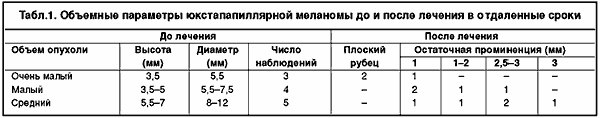
При расчетах требуемой дозы исходили из того, что для должного воздействия на 1 мм3 опухолевой ткани необходима энергия до 2 Дж. Чтобы достичь такой энергии от источника с мощностью на выходе 1 Вт, требуется экспонировать излучение в одной и той же позиции до 2 с. Отсюда следует, что при прохождении лазерного наконечника сквозь опухоль толщиной в 5 мм со скоростью 0,5 мм/с при непрерывном излучении доза энергии, поглощенной на этом пути, составит около 10 Дж. Исходя затем из сведений об объеме опухоли, можно планировать и общее время, необходимое для ее эффективного облучения. Так, при опухоли диаметром 5 мм, т.е. при ее объеме 65 мм3 время облучения должно составить 65х2 = 130 с, т.е. 2 мин., а при опухоли диаметром 7 мм, объем которой почти в 3 раза больше (180 мм3) требуемое для ее деструкции время также увеличится втрое (180х2 = 360 сек, т.е. 6 мин.). Результаты лечения по указанной методике первых 12 больных со сроками наблюдения от 1 до 3 лет представлены в табл. 1.
Система витреофага позволяла спасать зону воздействия от перегрева тканей, останавливать кровотечение, выводить из глаза детрит и очищать наконечник стекловолокна от наслоений на него депозитов.
Коагуляционно–абляционный вариант контактной лазерной деструкции внутриглазной меланомы с использованием витреофагальной технологии не только расширяет показания к операции в сравнении с таковыми для фотодинамической или гипертермической методик, но и вооружает офтальмохирурга средством борьбы с кровоизлияниями, возникающими в ходе лазеркоагулирующих операций.
В последнее время мы убедились, что еще более эффективной является комбинация, когда на первом этапе проводится брахитерапия, а затем при необходимости спустя 3–4 мес прибегают к эндоокулярной контактной лазерной деструкции оставшейся опухоли.
Приведенные в статье варианты использования лазерной энергии для разрушения внутриглазной меланомы с целью сохранения глазного яблока отнюдь не исчерпывают потенциальных возможностей метода. Представляется перспективным создание такой методики облучения, при которой в результате взаимодействия ИК–лазерной энергии и мишени последняя сможет подвергаться исключительно абляционным эффектам (без сопутствующего ожога соседних тканей), наконечник стекловолокна будет избавлен от наслоения депозитов и, наконец, энергия будет поступать равномерно. Весьма вероятно, что импульс при этом должен быть микросекундным, а режим облучения для ускорения хода операции – высокочастотным (квази–непрерывным).
Полный список литературы Вы можете найти на сайте http://www.rmj.ru
Литература:
1. Антипенко Б.М., Березин Ю.Д., Волков З.В. и др. Лазеры с различными параметрами излучения в офтальмоонкологии. – Вестн. офтальм. – 1987 № 4, – С.33–37.
2. Антипенко Б.ГЛ., Березин Ю.Д., Волков В.В. и др. Лазеры ближнего и среднего ИК–диапазонов в офтальмоонкологии // Изв. АН СССР. Сер.физическая. – 1990. Т.54. – № 10. – C.I929–I934.
3. Березин Ю.Д., Волков В.В. и др. Комбинированный лазер с длиной волны 1,06/1,32 мкм для офтальмоонкологии // Тез. докл. Всесоюзн. школы–семинара “Оптические приборы в офтальмологии”.– Л., 1989. – С.84–85.
4. Березин Ю.Д., Волков В.В., Кулаков Я.Л. и др. Лазеры среднего и ближнего ИК–диапазона в офтальмоонкология // Тез. докл. Межд. конф. “Лазеры и медицина”, часть 2. – Ташкент–Москва, – 1989. – С.74.
5. Березин Ю.Д., Волков В.В., Кулаков Я.Л. и др. Применение импульсно–периодического лазерного излучения в офтальмоонкологии // Тез. докл. VI Всесоюзн. конф. “Оптика лазеров”, 1990. Л. – С.390–391.
6. Волков В.В. Применение лазеров в офтальмологии // Изв. АН СССР. Серия физическая. – 1982. – т.46. – № 8. – С.1548–1555.
7. Волков В.В. Об основных факторах взаимодействия лазерной энергии со структурами глаза // Офтальмол. журн. – 1996. –№ 4 – С.238–243.
8. Волков В.В., Гаду А.Ф. Моделирование объемного поглощения энергии ОКГ в тканях в интересах выбора адекватного источника в лечебных целях // Тез. докл. Всесоюзн. конф. по применению лазеров в медицине. Гос. Комитет по науке и технике АН СССР. Красноярск, – 1983. – С.71–72.