| Скачать .docx | Скачать .pdf |
Реферат: Многогранность проявлений боли – единство подходов к лечению
Многогранность проявлений боли – единство подходов к лечению
Зырянов С.К., Нельга О.Н., Белоусов Ю.Б.
Одним из неспецифических признаков неблагополучия в работе органов и систем человеческого организма является возникновение боли. Боль по своей природе может быть классифицирована как острая и хроническая. Сам факт существования боли может трансформироваться из простого симптома (боль – сигнал тревоги) в сложный синдром (боль – болезнь). Феномен боли реализуется через специализированную систему и представляет собой многогранный процесс, в котором задействовано множество нейротрансмиттеров и рецепторов как периферической, так и центральной нервной системы. Патофизиологические механизмы боли разделяются на 2 типа: ноцицептивный – вследствие повреждения тканей (кожи, костей, суставов, мышц и др.) и невропатический, обусловленный поражением или вовлечением нервных структур на различных уровнях нервной системы (корешки сплетения, стволы и др.). Острая боль является нормальной реакцией на повреждение ткани и имеет огромное значение, как острый симптом, сигнал тревоги. Она требует всего комплекса диагностических процедур для определения своей причины. Хроническая боль обусловлена постоянным раздражением ноцицепторов в области имеющегося повреждения тканей, не менее очевидна ее защитная роль [1].
Для формирования представления об эпидемиологии и частоте локализации болевого синдрома интерес представляют результаты ряда исследований. Так, М. von Korf и соавт. (США) обследовали рандомизированную выборку из 1500 человек в возрасте от 18 до 75 лет, проживающих в одном из районов Сиэттла (США). Изучалась распространенность болей, длительность которых составляла 1 день и более, и болей, возникающих несколько раз в течение 1 года. Распространенность болей в течение предшествующих 6 мес. была следующей: боли в спине – 41%, головная боль – 26%, боли в животе – 17%, лицевые боли – 12%, боли в грудной клетке – 12%. В Новой Зеландии F. James и соавт. методом интервью обследовали выборку из 1498 городских жителей. Большинство опрошенных ответили, что хотя бы 1 раз в жизни их беспокоили какие–либо боли. Наиболее часто встречались суставные боли, боли в спине, головная боль (25, 3%), боли в животе (22, 5%). Изучение распространенности боли, ее характеристики и последствий воздействия на повседневную активность проведено A. Bassols и соавт. в Каталонии (северная область Испании). Методом рандомизации были выбраны 1964 взрослых жителя, стратифицированных по возрасту, полу и области проживания. Распространенность болей составила 78, 6%, статистически выше она была среди женщин. По локализации боли распределились следующим образом: боли в спине – 50, 9% (равномерно во всех возрастных группах), головная боль – 40, 2% (преимущественно у молодых женщин), боли в голенях – 36, 8% (преимущественно у пожилых), боли в бедрах – 21, 9% (молодые мужчины).
Таким образом, по оценке большинства исследователей, распространенность боли в общей популяции составляет от 7 до 64%, а распространенность хронической боли — от 7, 6 до 45%. Основной локализацией болей, бесспорно, являются спина и шея, преобладают также головная боль и суставно–мышечные боли [2].
Учитывая многогранность проявлений боли, причину возникновения и механизм развития, необходимо использовать комплексный подход в каждом конкретном случае для выбора адекватного обезболивания. Наиболее простым и доступным и для больных, и для врачей является метод фармакотерапии. В настоящее время в терапии боли применяют ненаркотические и наркотические анальгетики по трехступенчатой схеме, состоящей из последовательного применения анальгетиков с возрастающей силой действия в сочетании с адьювантной терапией по мере увеличения интенсивности боли.
Наибольшее распространение в лечении болевого синдрома получили препараты из группы нестероидных противовоспалительных средств (НПВП) и парацетамол.
Нестероидные противовоспалительные средства (НПВП) – одна из наиболее широко применяемых фармакологических групп в терапии боли. Так, в США ежегодно выписывают более 70 млн. рецептов на эти препараты, 14–20 млн. пациентов принимают НПВП длительное время. В эти цифры не входят более 26 млрд. таблеток в год, которые потребители покупают без рецепта. В Италии в 2002 г. было продано более 58, 5 млн. упаковок НПВП. В развитых странах эти препараты получают 20–30% лиц пожилого возраста. Применение НПВП постоянно увеличивается [3].
Большая «популярность» НПВП объясняется тем, что они обладают противовоспалительным, анальгезирующим и жаропонижающим эффектами и приносят облегчение больным с соответствующими симптомами (воспаление, боль, лихорадка), которые отмечаются при многих заболеваниях.
За последние 30 лет количество НПВП значительно возросло, и сегодня данная группа насчитывает большое число препаратов, отличающихся по особенностям действия и применения.
В настоящее время имеется большой арсенал НПВП (более 25 наименований), а в практической медицине используется для лечения более 1000 созданных на их основе лекарственных средств. Особенностью современных НПВП является многообразие лекарственных форм, в том числе для местного применения в виде мазей, гелей, спреев, а также свечей и препаратов для парентерального введения [4].
Парацетамол – также один из самых часто назначаемых препаратов из группы НПВП. С 1963 года парацетамол был включен в Британскую фармакопею, с тех пор он широко используется в медицинской практике как болеутоляющее и жаропонижающее средство. В настоящее время только в Европе и Северной Америке потребляется до 24 млрд. таблеток парацетамола ежегодно. В отличие от других НПВП препарат не вызывает повреждений слизистой оболочки желудочно–кишечного тракта, гемодискразии, не влияет на агрегацию форменных элементов крови и длительность кровотечения, быстро и полно всасывается в желудке и не кумулирует в организме. Наряду с этим установлено, что при легких и умеренных болях анальгезирующий эффект 500 мг парацетамола приблизительно равноэффективен 500 мг ацетилсалициловой кислоты или 200 мг ибупрофена.
В настоящее время доказано, что в соответствии с рекомендациями ВОЗ абсолютно безопасным является применение парацетамола в суточной дозе до 4 г у взрослых и 60 мг/кг у детей. К отравлению и развитию печеночной недостаточности приводит одномоментный его прием взрослыми в дозе более 10 г, детьми – 140 мг/кг.
Несмотря на наличие огромного, на первый взгляд, арсенала обезболивающих средств, лечение острого и хронического болевого синдрома представляет для практических врачей определенные трудности. Так, по результатам анкетирования более 200 врачей, проведенного в 14 городах России, возникающие проблемы связаны в 37% случаев с недостаточной эффективностью проводимой терапии, а в 31% случаев – с неудовлетворительным профилем безопасности применяемых препаратов. Возникающие трудности вполне объяснимы, учитывая тот факт, что в подавляющем большинстве случаев в первичном звене здравоохранения препаратами выбора для лечения болевого синдрома любой степени выраженности остаются НПВП, несмотря на рекомендации экспертов ВОЗ использовать эту группу препаратов в лечении легкой боли.
Наиболее изученной проблемой при назначении НПВП является их гастротоксичность. Известно, что неблагоприятные побочные реакции со стороны желудочно–кишечного тракта в виде диспепсии могут развиваться у 15–20% пациентов, регулярно принимающих НПВП. При длительном приеме язвенное поражение желудка может развиться у 5–8% пациентов, двенадцатиперстной кишки – у 3–5% пациентов. Кровотечение, перфорация язвы, нарушение проходимости ЖКТ отмечаются у 1–1, 5% пациентов. Большие желудочно–кишечные кровотечения и перфорации желудка наблюдаются у лиц, принимающих НПВП, примерно в 5 раз чаще, чем у не принимающих их. Экономический ущерб от этих осложнений достигает в США 4 млрд. долл. в год [4, 5].
Однако не менее значимыми являются кардиоваскулярные эффекты НПВП. В настоящее время установлено, что длительное применение препаратов данной группы у лиц старше 60 лет – независимый предиктор возникновения АГ (относительный риск составляет 1, 4), а у больных с артериальной гипертонией достоверно на 29% ухудшает возможности контроля уровня АД. Риск развития ХСН возрастает в 2, 2 раза, каждое пятое обострение у пациентов с декомпенсацией ХСН связано с НПВП. Возникновение данных побочных эффектов напрямую связывают с их влиянием на синтез простаноидов, что может приводить к нарушению почечного кровотока и задержке жидкости. Торможение активности простагландин–синтетазы с помощью НПВП может вызвать значительное снижение скорости клубочковой фильтрации и даже привести к развитию почечной недостаточности. НПВП являются одними из основных экзогенных причин декомпенсации ХСН, требующих госпитализации (особенно у больных пожилого и старческого возраста). Кроме того, НПВП, принимаемые больным, например, в связи с остеоартрозом, могут ослаблять терапевтическое действие иАПФ и диуретиков, применение которых является обязательным при лечении ХСН [6].
В связи с появившимися данными о сердечно–сосудистых эффектах новых НПВП внимание мировой медицинской общественности было обращено на вопрос кардиоваскулярной безопасности «старых» препаратов этой группы.
Препараты из группы «старых» НПВП обратимо ингибируют обе изоформы ЦОГ, при этом важно подчеркнуть, что это воздействие осуществляется для различных препаратов с разной степенью селективности. В связи с этим можно предполагать, что и неселективные ингибиторы ЦОГ могут оказывать определенное влияние на риск развития сердечно–сосудистых событий.
С целью определения профиля кардиоваскулярной безопасности препаратов из группы НПВП P. McGettigan и D. Henry была предпринята попытка проведения систематического обзора и мета–анализа контролируемых обсервационных исследований, посвященных данной проблеме [7]. В результате проведенного исследования удалось выяснить риск развития сердечно–сосудистых событий при применении как «старых», так и «новых» НПВП. Так, установлено, что данный показатель для ибупрофена, пироксикама и напроксена близок к 1 (1, 07, 1, 06 и 0, 97 соответственно), а применение диклофенака, индометацина и мелоксикама ассоциируется с повышением риска развития сердечно–сосудистых событий (суммарный показатель ОР для индометацина – 1, 3, для диклофенака – 1, 4, для мелоксикама – 1, 25).
Таким образом, имеющиеся в настоящее время сведения о небезопасности длительного применения НПВП приводят к необходимости поиска и разработки новых лекарственных препаратов со сходными фармакодинамическими свойствами.
Так, в частности, развивая научные исследования в области фармакотерапии боли, фармацевтические компании сфокусировались на разработке лекарственных средств, обладающих центральным механизмом обезболивающего действия или создание комбинаций уже изученных центральнодействующих анальгетиков, учитывая, что центральная регуляция признается наиболее специфическим и надежным механизмом управления болью.
Известно немало клинических исследований, подтверждающих преимущества комбинаций анальгетиков, в первую очередь опиоидов с нестероидными противовоспалительными препаратами и парацетамолом. Применение комбинации болеутоляющих средств, имеющих взаимодополняющие механизмы и временные характеристики действия, позволяет получить больший анальгетический эффект по сравнению с каждым из лекарств, входящих в комбинацию. Это преимущество в терапевтическом действии часто достигается при меньших дозах каждого из активных компонентов, потенциально улучшая переносимость и характеристики безопасности используемых анальгетиков. Такие комбинированные лекарства обладают преимуществами обезболивающего препарата, их сочетание приводит к взаимному усилению фармакологического эффекта. За рубежом комбинации парацетамола с опиоидами являются наиболее продаваемыми комбинированными обезболивающими средствами и рекомендованы ВОЗ для лечения умеренной и сильной боли.
Одной из последних разработанных фиксированных сочетаний опиоидного и неопиоидного анальгетика является комбинация трамадол/парацетамол (Залдиар, Грюненталь Гмбх). Одна таблетка препарата содержит 37, 5 мг трамадола гидрохлорида и 325 мг парацетамола. Такое соотношение обеспечивает более сильный анальгетический эффект по сравнению с каждым из входящих в комбинацию лекарств в отдельности.
Эффективность и безопасность препарата Залдиар хорошо изучены в целом ряде клинических исследований при остром и хроническом болевом синдроме. Результаты мета–анализа 3 исследований эффективности одной дозы трамадола/парацетамола с участием 1197 пациентов с выраженной и умеренной послеоперационной зубной болью показали, что использование 2 таблеток комбинации трамадола/парацетамола (суммарная доза 75/650 мг) обеспечивает более быстрое наступление аналгезии и большую ее продолжительность, чем назначение только 75 мг трамадола. Время начала обезболивающего эффекта при назначении комбинации трамадол/парацетамол, трамадола или парацетамола 650 мг составило 17, 51 и 18 минут соответственно, при этом продолжительность аналгезии была 5, 03, 2, 03 и 3, 05 часа.
Эффективность комбинации трамадол/парацетамол изучена и при краткосрочном лечении хронической боли. Добавление указанной комбинации к НПВП или селективным ЦОГ–2 ингибиторам позволяет повысить эффективность проводимой терапии при остеоартрите. Более того, добавление комбинации трамадол/парацетамол улучшает эффективность аналгезии у пожилых пациентов (старше 65 лет), а также повышает качество жизни пациентов.
10–дневный курс лечения подострой боли в спине показал сходную эффективность комбинации трамадола/парацетамола по сравнению с использованием только трамадола.
Как дополнение терапии с использованием ЦОГ–2 ингибиторов или НПВП, комбинация трамадол/парацетамол обеспечила лучшее облегчение боли, нежели добавление плацебо, в 91–дневном, рандомизированном, двойном слепом мультицентровом исследовании. Амбулаторные пациенты (средний возраст 61 год) с неадекватным контролем боли в коленном или тазобедренном суставе, несмотря на проводимую терапию рофекоксибом или целекоксибом, получали аддитивную терапию комбинацией трамадол/парацетамол 37, 5/325 мг (n=153) или плацебо (n=153). Значение оценки выраженности болевого синдрома по визуальной аналоговой шкале у пациентов, получавших дополнительно изучаемую комбинацию, было достоверно ниже, чем у получавших плацебо (41, 5 и 48, 3 мм соответственно) [2].
ОТС–препараты, содержащие нестероидные противовоспалительные средства и парацетамол, достаточно широко используются и в лечении мигренозной головной боли. В контролируемых клинических исследованиях была установлена эффективность этих средств при лечении легкой и умеренной боли, однако их влияние на тяжелый мигренозный болевой синдром в силу понятных причин не изучалось. Для лечения выраженной мигренозной головной боли в настоящее время рекомендуется применение триптанов, доказавших свою эффективность и безопасность в целом ряде исследований. Так, в частности, было установлено, что положительная динамика через 2 часа после подкожного введения суматриптана отмечалась у 79% пациентов и у 45–68% больных при пероральном введении препаратов данной группы. Однако у целого ряда пациентов использование триптанов невозможно в силу профиля безопасности данных препаратов. Так, триптаны противопоказаны у пациентов с неконтролируемой гипертензией, с наличием в анамнезе перенесенного инфаркта миокарда или инсульта. Кроме того, триптаны можно применять не более 2 раз в сутки.
Опиоиды (в частности, гидрокодон) также широко применяются в лечении острой мигренозной боли. В одном из наблюдений было продемонстрировано, что 28% назначений опиоидов связано с головной болью или мигренью. Однако до сих пор в клинических исследованиях была доказана эффективность использования при мигрени только назальной формы буторфанола и кодеин–содержащих комбинированных препаратов. И, конечно же, в клинических рекомендациях, в связи с возможностью развития зависимости к указанным препаратам, их применение при острой мигрени лимитировано по продолжительности.
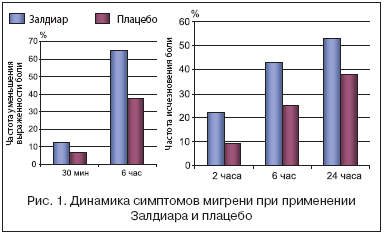
Учитывая вышеизложенное, становится понятно, что поиск эффективных и безопасных препаратов в лечении умеренной и выраженной мигренозной боли продолжается, в связи с чем были изучены и свойства комбинации трамадол/парацетамол в терапии данного заболевания в ходе рандомизированного двойного слепого, плацебо–контролируемого клинического исследования в параллельных группах [8]. Исследование проведено у взрослых пациентов, страдающих мигренозной болью (мигренозную боль оценивали согласно критериям Международного общества головной боли). Больные получали либо комбинацию трамадол/парацетамол (Залдиар) в дозе 75/650 мг соответственно, либо плацебо. Выраженность мигренозной боли и симптомов, связанных с мигренью, была оценена до приема препарата и через 0, 5, 1, 2, 3, 4, 6 и 24 часа после назначения лекарства. Всего в исследование было включено 305 пациентов, из них 154 получили изучаемую комбинацию, 151 больной – плацебо. В результате было установлено, что ответ на прием препарата был статистически достоверно выше в группе пациентов, принимавших активное вещество, нежели в группе плацебо, во все временные интервалы от 30 минут до 6 часов (12, 3 и 6, 6%; 64, 9 и 37, 7% соответственно). Через 2 часа интенсивность головной боли снизилась у 55, 8% пациентов, получивших комбинацию трамадол/парацетамол, и у 33, 8% больных, получивших плацебо (р<0.001). Болевой синдром полностью купировался статистически достоверно чаще в группе пациентов, принимавших комбинацию трамадол/парацетамол, по сравнению с плацебо через 2 часа после назначения препарата (22, 1 и 9, 3%), через 6 часов (42, 9 и 25, 2%) и через 24 часа (52, 7 и 37, 9%) (рис. 1). Назначение комбинации анальгетиков привело к статистически достоверному уменьшению через 2 часа выраженности фотофобии (отмечалась у 34, 6% пациентов в изучаемой группе, 52, 2% больных в группе плацебо) и фонофобии (34, 3 и 44, 9% соответственно). Справедливости ради необходимо отметить, что применение комбинации трамадол/парацетамол не влияет на такой симптом мигрени, как рвота через 2 часа после назначения препарата он выявлялся у 38, 5% пациентов, получавших исследуемую комбинацию, и у 29, 4% больных в группе плацебо (в данном случае статистически достоверных различий между группами выявлено не было).
Комбинация трамадол/парацетамол имеет достаточно благоприятный профиль безопасности. Как показано в ряде исследований, возникавшие в ходе приема препарата нежелательные явления носили преходящий характер и были легкой или умеренной степени выраженности. Частота их возникновения была сходна с таковой при применении только трамадола в дозе 75 мг. Наиболее часто выявлялись тошнота (21 и 21%), рвота (23 и 24%) и головокружение (5 и 5% соответственно). Частота возникновения вышеотмеченных нежелательных явлений при использовании парацетамола в дозе 650 мг составила 9, 7 и 4%, ибупрофена – 10, 7 и 3%, плацебо – 16, 10 и 4% соответственно [2].
Важным, до сих пор дискутабельным, остается вопрос формирования зависимости при применении трамадола. Изучению этой проблемы было посвящено исследование, проведенное Adams E.H. и соавт. [9], в которое были включенв 11352 пациента с хронической неонкологической болью. Период наблюдения за ними составил 1 год, формирование зависимости оценивалось по интегральному показателю – индексу зависимости, включавшему оценку использования препаратов в целях, не обозначенных в предписании врача, невозможность остановить использование лекарства, самостоятельное повышение дозы. В результате проведенной работы оказалась, что частота формирования зависимости к трамадолу не отличается от аналогичного показателя НПВП (2, 7 и 2, 5% соответственно) и была статистически достоверно выше при использовании гидрокодона (4, 9%).
В связи с накопленными данными о достаточно благоприятном профиле безопасности трамадола экспертами ВОЗ на заседании Комитета по лекарственной зависимости в марте 2006 года было принято решение не включать данный препарат в ограничительные списки лекарственных препаратов, вызывающих лекарственную зависимость, оборот которых должен контролироваться регуляторными органами [10].
Таким образом, имеющиеся на сегодняшний день данные научных исследований позволяют утверждать:
1 – использование комбинированных анальгетиков с центральным механизмом противоболевого действия является одним из путей повышения эффективности и безопасности фармакотерапии боли;
2 – применение комбинированного анальгетика трамадол/парацетамол (Залдиар) в дозе 75/650 мг при мигрени достоверно уменьшает выраженность головной боли, фотофобии и фонофобии.
Список литературы
1. Исакова М.Е. Новый перспективный анальгетик центрального действия «Залдиар» в онкологии. –РМЖ.– 2004.– Т. 12, №19.– с. 27–30.
2. Зырянов С.К., Белоусов Ю.Б. Роль комбинированных анальгетиков в фармакотерапии боли.– Фарматека.– 2006.– №5.– С. 23–27.
3. Ушкалова Е.А. Нестероидные противовоспалительные лекарственные средства – новый взгляд на эффективность и безопасность // Фарматека.– 2006.– №7 (85).– С. 31–36
4. Белоусов Ю.Б., Зырянов С.К., Гуревич К.Г. Эффективность и безопасность современных анальгетиков.–РМЖ.– 2004.– Т. 12, №5, с. 283–286.
5. Материалы ежегодного конгресса EULAR–2004. Симпозиум “Major outcomes studies with COX–2 selective inhibitors»
6. Преображенский Д.В., Сидоренко Б.А., Тарыкина Е.В., Махмутходжаев С.А. и др. Хроническая сердечная недостаточность у лиц пожилого возраста: особенности этиопатогенеза и медикаментозного лечения // Consilium medicum.– 2005.– Т. 7, №12.– С. 35–38
7. McGettigan P., Henry D. Cardiovascular risk and inhibition of cyclooxygenase. A systematic review of the observational studies of selective and nonselective inhibitors of cyclooxygenase// JAMA.– 2006.– October 4.– Vol. 296, N.13.– P. E1–E12
8. Stephen D. Silberstein, Frederick G. Freitag, Todd D. Rozen, David B. Kudrow et al. Tramadol/Acetaminophen for the treatment of acute migraine pain: findings of a randomized, placebo–controlled trial Headache 2005; 45: 1317–1327
9. Adams E.H. et al. A comparison of the abuse liability of tramadol, NSAIDs, and htdrocodone in patients with chronic pain// J. Pain Symptom Manag., 2006 May; 31(5): 465–476
10. www.who.int/medicines