| Скачать .docx |
Реферат: Методические указания Курс: Физиология человека и животных
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение высшего
профессионального образования
«НИЖЕГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ИМ. Н. И. ЛОБАЧЕВСКОГО»
Биологический факультет
Факультет физической культуры и спорта
Кафедра физиологии и биохимии человека и животных
Кафедра организации физкультурной спортивной деятельности
Ошевенский Л.В., Крылова Е.В., Уланова Е.А.
Изучение состояния здоровья человека
по функциональным показателям организма
Методические указания
Курс:
Физиология человека и животных
Раздел:
Функциональные системы
Нижний Новгород
2007
В пособии представлены методы регистрации и расчета функциональных показателей организма человека в норме и при действии дозированных физических нагрузок.
Пособие предназначено для студентов старших курсов и аспирантов биологических, спортивных и медицинских специальностей для изучения гомеостаза организма человека.
Авторский коллектив с благодарностью примет все критические замечания и конструктивные предложения, которые будут использованы с целью улучшения учебно-методической работы.
Печатные, оригинальные работы, используемые при оформлении пособия, печатаются с разрешения авторов.
Адреса для связи: E – mail kfg@bio.unn.ru
olv@bio.unn.ru
тел. (8312) 656123
Рецензент: доктор биологических наук, профессор Д.Б. Гелашвили
ВВЕДЕНИЕ
Проблема оценки текущего состояния индивидуального здоровья и его контроль имеют важное значение для человека. Высокий темп жизни, информационные перегрузки и дефицит времени оказывают все возрастающее влияние и могут являться причинами разнообразных отклонений в нормальной деятельности систем организма.
В структуре современной заболеваемости и смертности преобладают хронические неинфекционные заболевания, в первую очередь - сердечно-сосудистые и онкологические. Однако медицина в подавляющем большинстве случаев пока не в состоянии радикально излечить больного при указанной патологии.
По данным российских авторов, значительная часть студентов ВУЗов (47,6%) имеет хронические заболевания, к 5-6 курсу их количество достигает 63%.
Поэтому становится все более очевидным, что центром приложения усилий медицины должен быть, прежде всего, здоровый человек и охрана и укрепление его здоровья. Эта проблема в последние годы занимает центральное место в деятельности ВОЗ.
Одной из главных задач, обеспечивающих укрепление здоровья населения, является своевременная диагностика здоровья, его количества и качества.
Наиболее активно в последнее время развивается направление, основанное на оценке уровня здоровья с точки зрения теории адаптации. В основе этих исследований методические подходы, предложенные еще в 70-е годы. Согласно их концепции, здоровье рассматривается как способность организма адаптироваться к условиям внешней среды, а болезнь - как результат срыва адаптации. Поэтому актуальным является исследование адаптивных реакций организма, путем оценки показателей наиболее лабильных систем - системы кровообращения и вегетативной нервной системы.
Функциональная диагностика - область исследований организма, содержанием которой являются: объективная оценка, обнаружение отклонений и установление степени нарушений функции различных органов и физиологических систем организма на основе измерения физических, химических или иных объективных показателей их деятельности с помощью инструментальных или лабораторных методов исследования. В узком смысле понятие "функциональная диагностика" обозначает специализированное направление современной диагностики на основе только инструментальных функционально-диагностических исследований, которое в поликлиниках и стационарах представлено самостоятельной организационной структурой в виде оснащенных соответствующими аппаратами и приборами кабинетов или отделений функциональной диагностики со штатом специально подготовленных врачей и среднего медперсонала. Наиболее распространенными методами функциональной диагностики, являются:
- электрокардиография
- фонокардиография
- реография
- спирография
- пневмотахометрия
Целью настоящей работы является : обучение студентов и приобретение ими навыков оценки состояния здоровья человека с применением функциональных показателей систем организма в норме и при дозированной физической нагрузке.
Задача лабораторных работ - экспериментальное исследование явлений, которое сводится к исследованию и практическому применению законов природы. Это позволяет студентам глубже изучить физиологические явления и закономерности.
Требования к выполнению лабораторных работ
Выполнение каждой лабораторной работы, входящей в практикум, предусматривает следующее:
- Теоретическую подготовку.
- Допуск к выполнению работы.
- Проведение эксперимента, наблюдение и измерение.
- Математическую обработку результатов измерений.
- Отчет о выполнении лабораторной работы.
- Защиту выполненной работы
Теоретическая подготовка сводится к изучению соответствующих физиологических явлений и законов по учебникам и конспектам лекций для ответа на вопросы допуска и контрольные вопросы, изучению методики и порядка выполнения данной лабораторной работы. Подготовка проводится заранее, до выполнения лабораторной работы, так как аудиторные занятия предназначены только для допуска, проведения измерений, их обработку и защиту работы.
Допуск к работе состоит в проверке теоретической подготовленности студента к каждой работе, знания метода измерений и порядка выполнения работы.
Наблюдения и измерения - главная часть эксперимента. Они требуют от студента знания методов измерений, должного внимания и аккуратности при снятии отсчетов и записи результатов измерений
Обработка результатов измерений заключается в подстановке измеренных параметров в рабочие формулы и вычислении необходимых величин, проведении математической обработки результатов. Оценка погрешности и математическая обработка результатов производится с использованием соответствующих компьютерных программ.
Отчет о выполнении лабораторной работы. Отчет о работе оформляется индивидуально каждым студентом. В отчете должно присутствовать следующее:
1. Цель работы.
2. Приборы и принадлежности.
3. Принципиальная схема или рисунок установки.
4. Рабочие (расчетные) формулы.
5. Таблица результатов измерений и вычисленных величин с учетом математической обработки погрешностей.
6. Графики.
7. Выводы по результатам работы.
Защита выполненной работы сводится к устному или письменному ответу на контрольные вопросы и самостоятельному выводу рабочих формул, которые используются в работе.
Материалы и оборудование
Тонометр “Omron M1 Classic”, весы напольные механические “Salter 462”, динамометр кистевой “ДК-100”, ростомер, спирометр ССП (сухой портативный), секундомер, метроном, спирт этиловый медицинский, вата медицинская, марлевые салфетки.
1. Теоретический раздел
1.1. Кровообращение
Необходимым условием жизнедеятельности организма является непрерывный обмен веществ и энергии в клетках. Следовательно, они должны постоянно снабжаться питательными веществами, кислородом и освобождаться от продуктов жизнедеятельности. Эти процессы обеспечиваются циркуляцией крови. Система кровообращения включает в себя сердце и кровеносные сосуды, по которым непрерывно движется кровь.
1.1.1. Свойства и функции миокарда
Основной причиной, обеспечивающей движение крови по сосудам, является сила сокращения сердечной мышцы. Сердечная мышца состоит из двух типов мышечных волокон: типических (миокардиоцитов), которые обеспечивают сократительную функцию сердца, и атипических, образующих проводящую систему сердца, и обеспечивающих возникновение возбуждения в сердце и проведение его от места возникновения к миокарду предсердий и желудочков.
Сердечная мышца обладает физическими и физиологическими свойствами.
1.1.1.1. Физические свойства сердечной мышцы.
• Растяжимость - способность увеличивать длину без нарушения структуры под влиянием растягивающей силы. Такой силой является кровь, наполняющая полости сердца во время диастолы. От степени растяжения мышечных волокон сердца в диастоле зависит сила их сокращения в систолический период.
• Эластичность - способность восстанавливать исходное положение после прекращения действия деформирующей силы. Эластичность у сердечной мышцы является полной, т.е. она полностью возвращается в исходное положение.
• Способность развивать силу в процессе сокращения мышцы.
• Способность совершать работу при сокращении, что проявляется в перемещении крови по кровеносной системе.
1.1.1.2. Физиологические свойства сердечной мышцы.
1. Возбудимость. Уровень возбудимости сердечной мышцы в различные фазы кардиоцикла меняется. Раздражение сердечной мышцы в фазу ее сокращения (систолу) не вызывает нового сокращения, даже при действии сверхпорогового раздражителя. В этот период сердечная мышца находится в фазе абсолютной рефрактерности, ее длительность составляет 0,27 с.
В конце систолы и начале диастолы (расслабления сердечной мышцы) возбудимость начинает восстанавливаться до исходного уровня - фаза относительной рефрактерности
(0,03 с). За фазой относительной рефрактерности следует фаза экзальтации
(0,05 с), после которой возбудимость сердечной мышцы окончательно возвращается к исходному уровню (рис. 1). Следовательно, особенностью возбудимости сердечной мышцы является длительный период рефрактерности (0,3 с).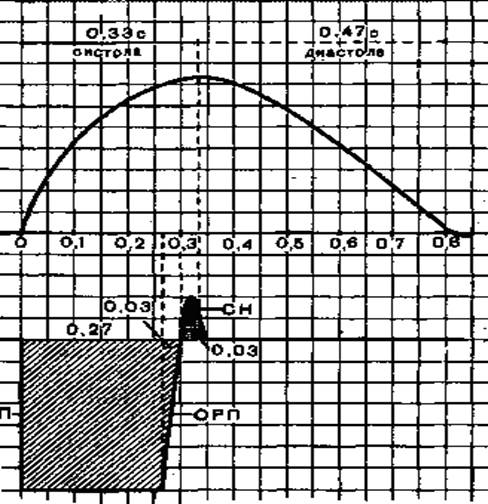
Рис.1. Соотношение кривой одиночного сокращения (А) и фаз возбудимости сердечной мышцы (Б).
АРП - фаза абсолютной рефрактерности; ОРП - фаза относительной рефрактерности; СН - фаза экзальтации. Цифрами обозначена длительность фаз сердечного цикла и возбудимости.
Фазы возбудимости сердечной мышцы определяются фазами одиночного цикла возбуждения. Мембранный потенциал покоя кардиомиоцитов имеет величину 90 мВ и формируется в основном ионами калия. Потенциал действия миокарда желудочков имеет следующие фазы (рис. 2).
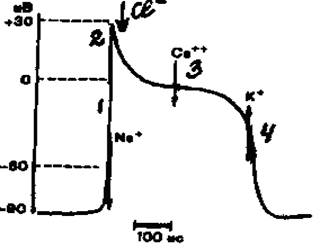
Рис. 2. Потенциал действия одиночной клетки миокарда желудочка: 1 - быстрая деполяризация; 2 - начальная быстрая реполяризация; 3 - медленная реполяризация (плато); 4 - конечная быстрая реполяризация.
Стрелками показаны преобладающие потоки ионов, ответственных за формирование различных фаз потенциала действия.
1 фаза - (быстрая деполяризация) обусловлена последовательным открытием быстрых натриевых и медленных натрий-кальциевых каналов. Быстрые натриевые каналы открываются при деполяризации мебраны до уровня -70 мВ, закрываются при деполяризации мембраны до -40 мВ. Натрий-кальциевые каналы открываются при деполяризации мембраны до -40 мВ и закрываются при исчезновении поляризации мембраны. За счет открытия этих каналов происходит реверсия потенциала мембраны до + 30-40 мВ.
2 фаза - (начальная быстрая реполяризация) обусловлена повышением проницаемости мембраны для ионов хлора.
3 фаза - (медленная реполяризация или плато) обусловлена взаимодействием двух ионных токов: медленного натрий-кальциевого (деполяризующего) и медленного калиевого (реполяризующего) через специальные медленные калиевые каналы (каналы аномального выпрямления).
4 фаза - (конечная быстрая реполяризация). Эта фаза обусловлена закрытием кальциевых каналов и активацией быстрых калиевых каналов.
Ионные каналы мембраны кардиомиоцита представлены потенциал - зависимыми белками, поэтому их активация (открытие) и инактивация (закрытие) обусловливаются определенной величиной поляризации мембраны (величиной трансмембранного потенциала).
Раздражение сердца во время диастолы вызывает внеочередное сокращение - экстрасистолу. Различают синусовую, предсердную и желудочковую экстрасистолы. Желудочковая экстрасистола отличается тем, что за ней всегда следует более продолжительная, чем обычно, пауза, называемая компенсаторной (рис. 3). Она возникает в результате выпадения очередного нормального сокращения, т.к. импульс возбуждения, возникший в сино-атриальном узле, поступает к миокарду желудочков, когда они еще находятся в состоянии рефрактерности, возникшей в период экстрасистолического сокращения. При синусовых и предсердных экстрасистолах компенсаторная пауза отсутствует.
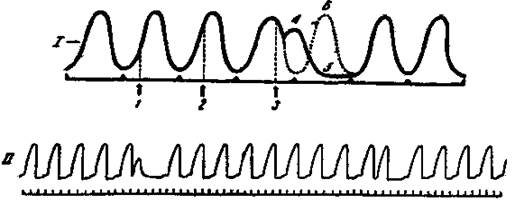
Рис. 3. Экстрасистола и компенсаторная пауза.
I - момент поступления имульсов из сино-атриального узла; 1, 2, 3 - моменты нанесения экстрараздражений; 4 - экстрасистола; 5 - компенсаторная пауза; 6 - выпавшее очередное сокращение (обозначено пунктиром).
II - кардиограмма лягушки с экстрасистолами.
2. Сократимость. Сердечная мышца реагирует на раздражители нарастающей силы по закону "все или ничего". Это обусловлено ее морфологическими особенностями. Между отдельными мышечными клетками сердечной мышцы имеются так называемые вставочные диски, или участки плотных контактов - нексусы, образованные участками плазматических мембран двух соседних миокардиальных клеток. В некоторых участках плазматические мембраны, образующие контакт, прилегают друг к другу так близко, что кажутся слившимися. Мембраны на уровне вставочных дисков обладают очень низким электрическим сопротивлением, и возбуждение распространяется от волокна к волокну беспрепятственно, охватывая миокард целиком. Поэтому сердечную мышцу, состоящую из морфологически разъединенных, но функционально объединенных мышечных волокон, принято считать функциональным синцитием.
Сердечная мышца сокращается по типу одиночного сокращения, т. к. длительная фаза рефрактерности препятствует возникновению тетанических сокращений. В одиночном сокращении сердечной мышцы выделяют: латентный период, фазу укорочения (систолу), фазу расслабления (диастолу).
Способность сердечной мышцы сокращаться только по тину одиночного сокращения обеспечивает выполнение сердцем основной гемодинамической функции - насоса. Сокращения сердца по типу тетануса делали бы невозможным ритмическое нагнетание крови в кровеносные сосуды. Именно это и происходит при фибрилляции волокон миокарда и мерцательной аритмии сердца.
Серию последовательных явлений в клетке миокарда, начинающихся с пускового механизма сокращения - потенциала действия (ПД) и завершающихся укорочением миофибрилл, называют сопряжением возбуждения и сокращения. При распространении ПД по мембране ионы кальция поступают к сократительным белкам, в основном, из межклеточного пространства и вызывают те же процессы взаимодействия актиновых и миозиновых протофибрилл, что и в скелетном мышечном волокне. Расслабление кардиомиоцита также обусловлено удалением кальция кальциевым насосом из протофибриллярного пространства в межклеточную среду.
Важным процессом в сокращении кардиомиоцита является вход ионов кальция в клетку во время ПД. Наряду с тем, что входящий в клетку кальций увеличивает длительность ПД и, как следствие, продолжительность рефракторного периода, он является важнейшим фактором в регуляции силы сокращения сердечной мышцы.
Так, удаление ионов кальция из межклеточных пространств приводит к полному разобщению процессов возбуждения и сокращения - потенциал действия остается практически в неизменном виде, а сокращения кардиомиоцита не происходит.
3. Проводимость. По сердцу возбуждение распространяется с различной скоростью: по миокарду предсердий - 0,8-1,0 м/с, по миокарду желудочков - 0,8-0,9 м/с, по различным отделам проводящей системы - 2,0-4,0 м/с. При прохождении возбуждения через атрио-вентрикулярный узел возбуждение задерживается на 0,02-0,04 с - это так называемая атрио-вентрикулярная задержка. Она обеспечивает координацию (последовательность) сокращения предсердий и желудочков и позволяет предсердиям нагнетать дополнительную порцию крови в полости желудочков до начала их сокращения.
4. Автоматизм. Сердечная мышца обладает автоматизмом - способностью возбуждаться без видимых причин, т. е. как бы самопроизвольно. Изучение автоматизма сердечной мышцы проводилось в двух направлениях:
• поиск субстрата автоматизма, т. е. тех структур, которые реализуют это свойство;
• изучение природы автоматизма, т. е. механизмов, лежащих в его основе.
По вопросу о субстрате автоматизма существовало две группы теорий:
• нейрогенная - субстратом автоматизма является нервная ткань;
• миогенная - сама сердечная мышца.
К настоящему времени установлено, что выраженной способностью к автоматии обладают мало дифференцированные атипические мышечные волокна, которые образуют так называемую проводящую систему сердца. Проводящая система включает в себя главные узлы автоматизма: сино-атриальный, расположенный в стенке правого предсердия между местом впадения верхней полой вены и правым ушком; атрио-вентрикулярный узел, расположенный в межпредсердной перегородке на границе предсердий и желудочков. В состав проводящей системы сердца входит также пучок Гиса, который начинается от атрио-вентрикулярного узла, затем разделяется на правую и левую ножки, идущие к желудочкам. Ножки пучка Гиса разделяются на более тонкие проводящие пути, заканчивающиеся волокнами Пуркинье, которые контактируют с клетками сократительного миокарда.
Способность к автоматизму различных отделов проводящей системы сердца изучалась Станниусом путем последовательного наложения лигатур на сердце . Было установлено, что в обычных условиях генератором возбуждения в сердце является сино-атриальный узел - водитель ритма (пейсмекер) I порядка. Атрио-вентрикулярный узел является водителем ритма сердца II порядка, т. к. его способность к автоматизму примерно в 2 раза меньше, чем у сино-атриального узла. Автоматизм волокон пучка Гиса еще меньше и, наконец, волокна Пуркинье обладают наименьшей способностью к автоматии. Следовательно, существует градиент автоматизма - уменьшение способности к автоматизму различных отделов проводящей системы сердца по мере их удаления от сино-атриального узла к верхушке сердца.
Природу автоматизма пытались объяснить воздействием на клетки проводящей системы сердца эндогенных и экзогенных факторов, отсюда и теории - эндогенная и экзогенная. Эндогенные факторы возникают в самом сердце:
• накопление какого-то вещества (например, ацетилхолина, молочной и угольной кислот и др.);
• изменение электрического поля сердца во время диастолы и др.
Экзогенные факторы автоматизма находятся за пределами сердца или поступают к нему извне с током крови и могут иметь также самую разнообразную природу.
Физиологической основой автоматизма сердечной мышцы является низкая скорость ее аккомодации: при действии постепенно нарастающего по силе раздражителя порог возбудимости у сердечной мышцы почти не изменяется. Микроэлектродные исследования показали, что в клетках рабочего миокарда предсердий и желудочков мембранный потенциал покоя в интервалах между возбуждениями поддерживается на постоянном уровне. В клетках же сино-атриального узла мембранный потенциал покоя нестабилен - в период диастолы происходит постепенное его уменьшение, которое называется медленной диастолической деполяризацией (МДД). Она является начальным компонентом потенциала действия пейсмекерных клеток. При достижении МДД критического уровня деполяризации возникает потенциал действия пейсмекерной клетки, который затем распространяется по проводящей системе к миокарду предсердий и желудочков. После окончания потенциала действия вновь развивается МДД (рис. 4).

Рис. 4. Потенциал действия клеток сино-атриального узла. Стрелками показана МДД.
Ионный механизм МДД состоит в том, что во время реполяризации клеточная мембрана сохраняет относительно высокую натриевую проницаемость. В результате проникновения внутрь клетки ионов натрия и уменьшения скорости выхода из клетки ионов калия возникает МДД. Уменьшение потенциала покоя до -40 мВ приводит к открытию медленных натрий-кальциевых каналов, что приводит к возникновению быстрой деполяризации. Реполяризация обеспечивается открытием калиевых каналов. В отличие от клеток водителей ритма рабочие клетки миокарда в состоянии покоя характеризуются очень низкой проницаемостью для ионов натрия, поэтому сдвигов мембранного потенциала в них не возникает.
Как видно из рис. 4, форма потенциала действия пейсмекерной клетки сино-атриального узла отличается от формы потенциала действия сократительных кардиомиоцитов. Во-первых, для пейсмекерных клеток характерно наличие МДД. Во-вторых, МДД медленно, плавно (особенно у клеток сино-атриального узла) переходит в фазу быстрой деполяризации. В-третьих, у ПД пейсмекерных клеток нет плато реполяризации. В-четвертых, у пейсмекерных клеток отсутствует овершут (потенциал превышения). В-пятых, МПП у пейсмекерных клеток значительно ниже (-55-60 мВ), чем МПП сократительных кардиомиоцитов (-90 мВ).
1.1.2. Фазовый анализ сердечного цикла
Циклом сердечной деятельности называется период от начала одной систолы сердца до начала следующей. При 75 сокращениях сердца в минуту общая продолжительность сердечного цикла равна 0,8 с. При тахикардии (учащении сердечной деятельности) длительность кардиоцикла уменьшается, при брадикардии (урежении сердечной деятельности) - увеличивается. Сердечный цикл состоит из нескольких периодов и фаз (рис. 5).
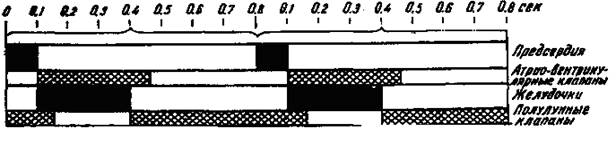
Рис. 5. Соотношение во времени различных фаз и периодов цикла сердечной деятельности.
Зачеркнутое пространство соответствует периоду систолы предсердий и желудочков; штриховка обозначает период, когда атрио-вентрикулярные и полулунные клапаны закрыты. На схеме показаны два кардиоцикла.
Систола предсердий длится 0,1 с, диастола - 0,7 с. Давление в предсердиях во время систолы повышается до 5-8 мм рт. ст.
Систола желудочков длится 0,33 с. Она состоит из двух периодов и четырех фаз. Период напряжения (0,08 с) состоит из двух фаз:
• асинхронного сокращения (0,05 с). В эту фазу происходит асинхронное (неодновременное) сокращение различных частей миокарда желудочков, при этом форма изменяется, но давление в них не увеличивается;
• изометрического сокращения (0,03 с). В эту фазу происходит изометрическое сокращение миокарда желудочков, т. е. Длина мышечных волокон не изменяется, но увеличивается их напряжение. В начале этой фазы атрио-вентрикулярные клапаны сердца закрываются, а полулунные клапаны еще не открыты, следовательно, полость желудочков замкнута.
В период напряжения давление в желудочках постепенно нарастает и когда оно становится равным 70-80 мм рт. ст. в левом желудочке и 15-20 мм рт. ст. в правом; происходит открытие полулунных клапанов аорты и легочной артерии. Наступает второй период систолы желудочков - период изгнания крови (0,25 с), который состоит также из двух фаз. Первая фаза - фаза быстрого изгнания крови (0,12 с). В это время давление в полостях желудочков продолжает быстро нарастать, что обеспечивает переход большей части крови из желудочков в аорту и легочную артерию. По мере уменьшения объема крови в желудочках нарастание давления в них замедляется, и, следовательно, уменьшается отток крови в аорту и легочную артерию. Наступает вторая фаза периода изгнания крови - фаза медленного изгнания (0,13 с), на высоте которой давление в желудочках достигает максимальных величии: 120-130 мм рт. ст. в левом и 25-30 мм рт. ст. в правом.
В конце фазы медленного изгнания крови миокард желудочков начинает расслабляться и наступает следующий этап сердечного цикла диастола желудочков (0,47 с). Давление крови в желудочках становится меньше её давления в аорте и легочной артерии, и кровь из них оттекает обратно по направлению к желудочкам. При этом кровь, затекая в карманы полулунных клапанов аорты и легочной артерии, смыкает их, перекрывая сообщение этих сосудов с полостями желудочков, что предотвращает дальнейший отток крови в желудочки. Время от начала расслабления желудочков до закрытия полулунных клапанов называется протодиастолическим периодом (0,04 с). Миокард желудочков остаётся расслабленным далее, но уже при закрытых атрио-вентрикулярных и полулунных клапанах, т.е. в условиях замкнутости полостей желудочков. Этот этап диастолы называется периодом изометрического расслабления (0,08 с). К концу этого периода давление в желудочках становится ниже, чем в предсердиях, поэтому кровь, заполняющая предсердия, открывает атрио-вентрикулярные клапаны и поступает в желудочки. Наступает период наполнения желудочков кровью (0,35 с), состоящий из трех фаз. Фаза быстрого пассивного наполнения (0,08 с), в процессе которой поступление крови в желудочки обеспечивается более высоким ее давлением в предсердиях. По мере наполнения желудочков кровью давление в них постепенно увеличивается и скорость их наполнения снижается - это фаза медленного пассивного наполнения (0,17 с). Вслед за ней наступает фаза активного наполнения (0,1 с), формируемая систолой предсердий.
Как отмечалось выше, диастола предсердий длится 0,7 с. Из них 0,3 с совпадают с систолой желудочков, а 0,4 с - с диастолой желудочков. Таким образом, в течение 0,4 с предсердия и желудочки находятся в состоянии диастолы, поэтому этот период в деятельности сердца называется общей паузой сердца. За 0,1с до окончания диастолы желудочков начинается следующая систола предсердий, и кардиоцикл повторяется снова.
1.2. Методы исследования деятельности сердца и сосудов
Во время деятельности сердца возникает ряд механических, звуковых и электрических явлений, регистрируя и анализируя которые можно характеризовать состояние сердечно-сосудистой системы у человека. К основным клиническим и физиологическим методам исследования сердечно-сосудистой системы у человека относятся:
• осмотр и пальпация области сердца и крупных сосудов;
• определение границ и конфигурации сердца;
• исследование пульса;
• аускультация (выслушивание) тонов сердца;
• определение величины кровяного давления;
• определение систолического и минутного объема сердца;
• электрокардиография;
• телеэлектрокардиография;
• фонокардиография;
• баллистокардиография;
• векторкардиография;
• динамокардиография;
• эхокардиография;
• электрокимография;
• реокардиография и другие методы.
1.2.1. Аускультация тонов сердца .
При работе сердца возникают звуковые явления, которые называются тонами сердца. Существует 4 тона сердца, два из которых (I и II) являются основными и их можно прослушать с помощью фонендоскопа, а два других (III и IV) можно только выявить с помощью специального метода - фонокардиографии.
I тон возникает во время систолы желудочков . В его формировании принимают участие следующие компоненты: напряжение мышц желудочков, закрытие атрио-вентрикулярных клапанов, открытие полулунных клапанов аорты и легочной артерии, динамический эффект крови, выбрасываемой из желудочков, вибрация стенок начальных отделов магистральных сосудов (аорта, легочная артерия). Из этих компонентов основным является захлопывание атрио-вентрикулярных клапанов. Это позволяет прослушивать первый тон и судить о состоянии атрио-вентральных клапанов - левого (митрального или двустворчатого) и правого (трехстворчатого). Наилучшим местом прослушивания двустворчатого клапана является 5 межреберье слева на 1,5-2,0 см кнутри от средне-ключичной линии, а трехстворчатого клапана - на нижнем конце грудины, у основания мечевидного отростка.
II тон называется диастолическим, т. к. возникает в начале диастолы желудочков и он обусловлен в основном закрытием полулунных клапанов аорты и легочной артерии, а также динамическим эффектом крови, при этом возникающим. По характеру II тона можно судить о функциональном состоянии полулунных клапанов. Лучшим местом прослушивания клапанов аорты является II межреберье справа у края грудины, а легочной артерии - II межреберье слева также у края грудины. Кроме того, звуковые явления, связанные с функционированием клапанов аорты, можно прослушать слева у грудины на месте прикрепления III-IV ребер (точка Боткина).
III тон возникает в результате вибрации стенок желудочков в фазу их быстрого наполнения кровью.
IV тон связан с колебаниями стенок желудочков в фазу добавочного наполнения их кровью во время систолы предсердий.
Исследование звуковых явлений, сопровождающих работу сердца, имеет большое значение. При различной патологии клапанного аппарата сердца и магистральных сосудов наблюдаются изменения характера тонов, появление шумов, по особенностям которых судят о локализации и степени поражения клапанного аппарата.
1.2.2. Исследование пульса
Артериальный пульс - колебание артериальной стенки, вызванное систолическим повышением давления в артериях. Он отражает деятельность сердца и функциональное состояние артерий. Артериальный пульс можно исследовать путем пальпации любой доступной артерии. При этом можно выявить ряд клинических характеристик пульса (частоту, быстроту, амплитуду, напряжение, ритм).
Частота пульса характеризует частоту сердечных сокращений. В состоянии покоя частота пульса колеблется от 60 до 80 в минуту. Урежение пульса (менее 60) называется брадикардия, а учащение (более 80) - тахикардия.
Быстрота пульса - это скорость, с которой происходит повышение давления в артерии во время подъема пульсовой волны и снижение во время ее спада. Различают быстрый и медленный пульс. Быстрый пульс наблюдается при недостаточности аортального клапана, когда давление в сосуде быстро падает после окончания систолы. Медленный пульс наблюдается при сужении аортального устья, когда давление в сосуде медленно нарастает во время систолы.
Амплитуда пульса - это амплитуда колебания стенки сосуда. Амплитуда пульса зависит в первую очередь от величины систолического объема сердца. На нее также влияет эластичность сосудов: при одинаковом ударном объеме амплитуда пульса тем меньше, чем больше эластичность сосуда и, наоборот.
Напряжение пульса (твердость пульса) оценивается тем усилием, которое необходимо приложить, чтобы сдавить артерию до прекращения ее колебаний. По этому признаку различают мягкий и твердый пульс.
Ритм пульса. В норме сердце сокращается достаточно ритмично. Но вместе с тем наблюдаются небольшие изменения ритма, связанные с фазами дыхания. В конце фазы выдоха частота сокращений сердца уменьшается, что связано с повышением тонуса блуждающих нервов, а во время вдоха частота несколько возрастает. Это дыхательная аритмия . Наиболее выраженные аритмии пульса наблюдаются при патологии сердца. Например, экстрасистолии или уменьшение силы сердечных сокращений сопровождаются дефицитом пульса - состоянием, при котором число пульсовых колебаний меньше числа сердечных сокращений. Это обусловлено тем, что происходит выпадение отдельных пульсовых колебаний в результате значительного уменьшения объема сердечного выброса, который не создает повышения давления крови в аорте, достаточного для распространения пульсовой волны до периферических артерий.
Для более детального анализа пульса производится его графическая регистрация, позволяющая регистрировать отдельные пульсовые волны. Запись пульса артериального сосуда получила название сфигмограммы. На сфигмограмме различают четыре части (рис. 6). Подъем волны - анакрота - возникает в систолу в результате повышения давления в артериальном сосуде и растяжения его стенки под влиянием крови, выброшенной в начале фазы изгнания. Спад волны - катакрота - возникает в начале диастолы в результате начавшегося понижения давления в сосуде. Повторный подъем волны - дикротический подъем - возникает в следующий период диастолы в результате того, что уже закрывшиеся полулунные клапаны отражают устремившуюся к сердцу кровь, что создает вторичную волну повышения давления и растяжение, стенок артерий. Четвертый компонент сфигмограммы - инцизура (углубление, выемка) формируется условиями возникновения катакроты и дикротического подъема.

Рис. 6. Синхронная запись венного и артериального пульса.
В мелких и средних венах пульсовые колебания давления отсутствуют, но в крупных венах они имеют место - венный пульс. Наиболее отчетливо он проявляется на яремной вене. Запись венного пульса называется флебограммой, на которой различают три зубца: а, с, v (рис. 6).
Зубец а возникает во время систолы правого предсердия и обусловлен повышением давления в вене и растяжением ее стенок. Это связано с тем, что во время систолы предсердий устья полых вен перекрываются сокращающимися мышечными волокнами миокарда предсердий, и отток крови из вены в предсердия приостанавливается. Зубец с возникает в систолу левого желудочка в результате действия пульсирующей сонной артерии на лежащую рядом с ней вену и повышения при этом в ней давления. Зубец v возникает в конце систолы и начале диастолы правого желудочка в результате того, что в это время предсердия наполнены кровью и ее дальнейшее поступление становится невозможным. Происходит застой крови в венах и растяжение их стенок. Дальнейшее развитие диастолы желудочков сопровождается снижением давления в вене вследствие оттока крови из предсердия в желудочки.
1.2.3. Электрокардиография
Это метод регистрации электрических потенциалов, возникающих в работающем сердце. Этот метод позволяет проследить процессы возникновения, распространения и исчезновения возбуждения в сердечной мышце.
Для отведения и записи потенциалов сердца используется много способов, но наиболее часто из них применяются: стандартные отведения, усиленные отведения от конечностей и униполярные грудные.
Стандартные отведения осуществляются при помощи двух активных электродов (биполярно). В зависимости от места расположения электродов различают три стандартных отведения:
• I отведение - электроды расположены на левой и правой руках;
• II отведение - на правой руке и левой ноге;
• III отведение - на левой руке и левой ноге.
Усиленные отведения от конечностей осуществляются также при помощи двух электродов, один из которых располагается на одной из конечностей (активный электрод), а второй (пассивный) - в точке общего контакта проводов от электродов, расположенных на двух других конечностях. Такой способ отведения дает усиление потенциала, отводимого активным электродом в 1,5 раза. В зависимости от места расположения активного электрода различают следующие способы усиленных отведений от конечностей:
• aVR - электрод располагается на правой руке;
• aVL - на левой руке;
• aVF - на левой ноге.
Униполярные (однополюсные) грудные отведения, или прекардиальные отведения по Вильсону, осуществляются таким образом, что активный электрод располагается в одной из шести точек на поверхности грудной клетки, а пассивный (общий) электрод - в точке общего контакта проводов от электродов, расположенных на конечностях по схеме стандартных отведении. Такой способ отведения позволяет наиболее точно зарегистрировать истинную величину потенциала, отводимого активным электродом. В зависимости от места расположения активного электрода, различают следующие грудные однополюсные отведения:
• V1 - электрод располагается в четвертом межреберье справа на 1 см от грудины;
• V2 - в четвертом межреберье слева на 1 см от грудины;
• V3 - в пятом межреберье слева по среднеключичной линии;
• V4 - посреди между точками V3 и V5;
• V5 - в пятом межреберье по передней аксиллярной линии;
• V6 - в пятом межреберье слева по средне аксиллярной линии.
Основная цель регистрации ЭКГ в грудных отведениях - топическая диагностика состояния различных отделов миокарда желудочков.
Форма и характеристики электрокардиограмм, записанных при различных отведениях, различны. На ЭКГ, записанной во II стандартном отведении (рис. 7) различают 5 зубцов: зубцы Р, R, Т - направлены вверх от изоэлектрической линии, а зубцы Q, S - направлены вниз. Зубец Р отражает возбуждение предсердий, а комплекс зубцов Q, R, S, Т представляет собой отражение электрических изменений, обусловленных возбуждением желудочков (желудочковый комплекс). Промежутки между зубцами называются сегментами, а совокупность зубца и расположенного рядом сегмента - интервалом.
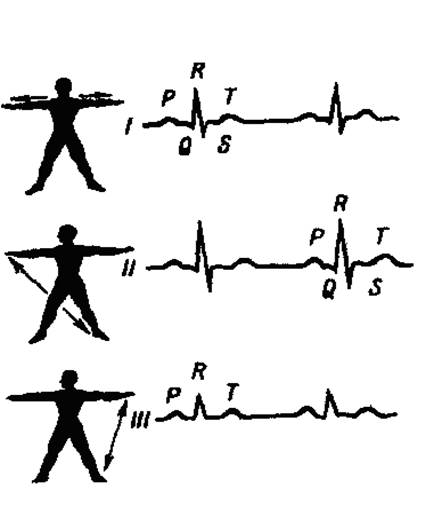
Рис. 7. Схема электрокардиограммы.
Генез (происхождение) ЭКГ. Для того чтобы понять генез ЭКГ необходимо помнить о следующем:
• общее электрическое поле сердца образуется в результате сложения полей отдельных волокон сердечной мышцы;
• каждое возбужденное волокно представляет собой электрический диполь, обладающий элементарным дипольным вектором, характеризующимся определенной величиной и направлением;
• интегральный вектор в каждый момент процесса возбуждения представляет собой результирующую этих элементарных векторов;
• дипольный вектор направлен от минуса к плюсу, т. е. от возбужденного участка к невозбужденному.
В каждый момент процесса возбуждения сердца отдельные векторы суммируются и образуют интегральный вектор. Возбуждение начинается в сино-атриальном узле, но оно на ЭКГ не отражается и поэтому записывается изоэлектрическая линия. Как только возбуждение переходит на предсердия, сразу же возникает разность потенциалов и на ЭКГ записывается восходящая часть зубца Р, отражающего возбуждение правого предсердия. Возбуждение левого предсердия отражает нисходящая часть зубца Р. В период формирования зубца Р возбуждение распространяется преимущественно сверху вниз. Это означает, что большая часть отдельных векторов направлена к верхушке сердца и интегральный вектор в этот период имеет ту же ориентацию.
Когда оба предсердия полностью охвачены возбуждением и оно распространяется по атрио-вентрикулярному узлу, на ЭКГ записывается изоэлектрическая линия (сегмент PQ). Далее возбуждение распространяется по проводящей системе желудочков, а затем распространяется на миокард желудочков. Возбуждение желудочков начинается с деполяризации левой поверхности межжелудочковой перегородки, при этом возникает интегральный вектор, направленный к основанию сердца, который формирует зубец Q. Далее, по мере распространения возбуждения на миокард правого и большую часть миокарда левого желудочка, вектор меняет направление на противоположное (т. е. к верхушке сердца) и формирует зубец R. Через стенку желудочков возбуждение распространяется от эндокарда к перикарду. В последнюю очередь возбуждается участок левого желудочка в области его основания, при этом интегральный вектор будет направлен вправо и кзади (т. е. в сторону задней стенки желудочка) и формирует зубец S. Когда желудочки полностью охвачены возбуждением и разность потенциалов между различными их отделами отсутствует, на ЭКГ записывается изоэлектрическая линия (сегмент ST). Реполяризация желудочков отражается зубцом Т, который формируется вектором, направленным вниз и влево, т.е. в сторону верхушки и левого желудочка. Процесс реполяризации миокарда желудочков протекает значительно медленнее, чем деполяризация. Скорость реполяризации в разных отделах различна: в области верхушки она наступает раньше, чем у основания, а в субэпикардиальных слоях раньше, чем в субэндокардиальных.
Таким образом, направление зубцов на ЭКГ отражает ориентацию интегрального вектора. Когда вектор направлен к верхушке сердца, на ЭКГ записываются положительные (направленные вверх). зубцы Р, R, Т. Если же вектор ориентирован к основанию, то записываются отрицательные (направленные вниз) зубцы Q и S.
1.2.3.1. Анализ ЭКГ.
При анализе электрокардиограммы оценивают: зубцы (наличие основных и дополнительных зубцов, их форму, направление, амплитуду, длительность), сегменты (их длительность и расположение но отношению к изоэлектрической линии), интервалы (их длительность и расположение по отношению к изоэлектрической линии), комплекс зубцов (их длительность).
При оценке зубцов ЭКГ большое внимание уделяется определению их длительности и амплитуды (вольтажа). Так, длительность зубца Р в норме в состоянии покоя во II стандартном отведении составляет 0,08-0,1 с, комплекса QRS - 0,06-0,09 с, а комплекса QRST - 0,36 с. Их расширение служит признаком нарушения внутрижелудочкового проведения и реполяризации желудочков.
Вольтаж зубцов в стандартных отведениях имеет значение для определения положения электрической оси сердца. В норме электрическая ось сердца совпадает с анатомической и имеет направление сзади-кпереди, сверху-вниз, справа-налево. При этом наибольшую амплитуду зубцы имеют во II отведении, т. к. оно отводит самую высокую разность потенциалов. Высокий вольтаж зубцов в I отведении свидетельствует о более горизонтальном расположении электрической оси сердца (горизонтальное или лежачее сердце), а в III - говорит о более вертикальном расположении электрической оси сердца (висячее сердце).
Оценка длительности сегментов и их расположения относительно изоэлектрической линии имеет важное значение при оценке ЭКГ. Сегмент PQ определяет положение изоэлектрической линии. В стандартных отведениях его длительность равна 0,12-0,18 с и отражает время, в течение которого происходит проведение возбуждения от предсердий к желудочкам.
Сегмент ST в норме расположен на изоэлектрической линии. При различной патологии миокарда желудочков (гипоксия, инфаркт и т.д.) этот сегмент смещается вверх или вниз от изоэлектрической линии в зависимости от места локализации пораженного участка.
По ЭКГ можно судить о частоте сердечных сокращений, локализации генератора возбуждения и очага повреждения. Например, можно установить, где в данный период расположен водитель ритма сердца (в синусном узле, предсердиях, атрио-вентрикулярном узле, правом или левом желудочке), что дает возможность, прежде всего, распознать различные виды аритмий и экстрасистол.
В зависимости от локализации источника внеочередных возбуждений различают синусовую, предсердную, атрио-вентрикулярную и желудочковую экстрасистолы. Нередко экстрасистолы имеют функциональный характер и возникают даже у практически здоровых людей при злоупотреблении крепким чаем, кофе, курением и т.д. Часто причиной экстрасистолий являются органические поражения сердца: миокардиты, ишемическая болезнь сердца, инфаркт миокарда и т.д.
Наиболее принятым представлением о генезе экстрасистолий является теория "механизма обратного входа" (re-entry), согласно которому в определенном участке миокарда возникает местное однонаправленное нарушение проводимости. К этому участку возбуждение приходит позднее окольными путями, по сравнению с другими участками миокарда, которые к этому времени уже вышли из состояния рефрактерности. Поскольку блокада проведения возбуждения в патологическом очаге является однонаправленной, возбуждение ретроградно (в направлении противоположном естественному) распространяется от него на соседние участки и возникает преждевременное возбуждение миокарда - экстрасистола.
Другим механизмом возникновения экстрасистолы может быть повышение способности к автоматии клеток проводящей системы сердца, расположенных ниже сино-атриального узла. Причиной этого может быть воспаление, гипоксия, склероз, электролитные или метаболические нарушения.
Синусовые экстрасистолы проявляются на ЭКГ полным комплексом зубцов, сегментов и интервалов, возникающих в промежутках между очередными циклами возбуждения сердца. При предсердных экстрасистолах изменяется ход возбуждения по предсердиям, в результате чего изменяется конфигурация зубца Р, желудочковый комплекс не изменяется. Атрио-вентрикулярные экстрасистолы приводят к тому, что импульс к предсердиям идет ретроградно, поэтому зубец Р отрицателен, желудочковый комплекс не изменяется. Желудочковые экстрасистолы возникают в проводящей системе желудочков, причем раньше возникает возбуждение того желудочка, в котором возник экстрасистолический импульс, а ко второму желудочку импульс приходит с опозданием, поэтому комплекс QRS при таких экстрасистолах всегда расширен (больше 0,12 с), зубец Т и сегмент S-Т расположены нестандартно по отношению к комплексу QRS. После желудочковой экстрасистолы возникает полная компенсаторная пауза за счет выпадения одного цикла сокращения желудочков в ответ на синусовое возбуждение.
В настоящее время электрокардиография является широко используемым, доступным и весьма информативным методом исследования, как в клинике, так и вне ее при обследовании здоровых людей. Для этого созданы системы дистанционной и непрерывной регистрации ЭКГ, которые используются для изучения динамики сердечного ритма при осуществлении производственной и спортивной деятельности, а также в клинике для непрерывного наблюдения за состоянием сердца у тяжелых больных. Кроме того, разработаны способы передачи ЭКГ по телефону в консультационные центры, где специалисты с помощью вычислительной техники устанавливают и уточняют диагноз.
1.2.4. Методы клинических исследований деятельности сердца
Векторкардиография.
Условную линию, соединяющую в каждый данный момент две точки, которые обладают наибольшей разностью потенциалов, принято называть электрической осью сердца. Электрическая ось сердца характеризуется определенной величиной и направлением, т. е. обладает свойствами векторной величины. Вследствие неодновременного охвата возбуждением различных отделов миокарда этот вектор в каждый момент времени изменяет свое направление. Для клинической практики оказалось полезной регистрация не только величины разности потенциалов, создаваемой сердечной мышцей, но и изменение направления электрической оси сердца. Регистрация изменений направления электрической оси сердца получила название векторэлектрокардиографии.
Эхокардиография - метод ультразвукового исследования сердца. Он основан на принципе регистрации отраженного ультразвукового сигнала. В сочетании с цифровым преобразованием отраженного ультразвукового импульса с помощью вычислительной машины он позволяет регистрировать изображение всей сердечной мышцы и ее отделов, изменение положения стенок, перегородок и клапанов камер сердца в различные фазы сердечной деятельности. Метод применяется для точного расчета систолического объема сердца и других показателей гемодинамики, связанных с работой сердца.
Реокардиография - регистрация изменений полного сопротивления (емкостного и реактивного) грудной клетки, связанных с динамикой кровенаполнения сердца и крупных сосудов в течение сердечного цикла. Этот метод применяется для фазового анализа сердечного сокращения, изучения гемодинамики в малом круге кровообращения, но главным образом для неинвазивного определения величины ударного объема сердца. По показателям ударного объема определяют ряд других гемодинамических показателей (минутного объема, объемную, скорость кровотока в аорте, мощность сердечных сокращений, периферическое сопротивление и др.).
Баллистокардиография - метод регистрации смещения тела человека в пространстве, обусловленного сокращением сердца и выбросом крови в крупные сосуды.
Динамокардиография - метод регистрации смещения центра тяжести грудной клетки, обусловленного движением сердца в грудной клетке и перемещением массы крови из полостей сердца в сосуды.
Электрокимография - метод регистрации движения контура сердечной тени на экране рентгеновского аппарата, обусловленного изменением освещенности фотоэлемента при движении сердца во время кардиоцикла.
Фонокардиография - метод графической регистрации тонов сердца посредством преобразования с помощью микрофона звуковых явлений в электрические колебания. На записях, которые выполняются таким образом, что кроме первого и второго тонов, хорошо слышимых ухом, регистрируются более слабые - третий и четвертый тоны сердца.
1.2.5. Методы измерения величины кровяного давления
Является одним из наиболее простых, но весьма информативных методов исследования сердечно-сосудистой системы. Величина кровяного давления зависит от следующих факторов:
• работы сердца, которая определяет величину систолического и минутного объема сердца;
• количества крови, циркулирующей в сосудистом русле;
• вязкости крови;
• величины просвета сосудов, определяемой тонусом сосудистой стенки.
Определение величины кровяного давления проводится двумя способами. Первый – прямой (инвазивный) способ, который осуществляется путем введения в кровеносный сосуд канюли или иглы, соединенной с помощью резиновой трубки с манометром. Этот метод используется в основном на животных в условиях эксперимента, а у человека применяется очень редко – во время операций и по клиническим показаниям. Второй – непрямой или косвенный (бескровный) способ. Он используется в двух разновидностях: способ Рива-Роччи и способ Короткова.
Способ Рива-Роччи основан на пальпации пульса, поэтому его называют пальпаторным. Методика его выполнения заключается в следующем. На обнаженное плечо накладывают манжетку, соединённую с манометром и нагнетают в нее воздух до тех пор, пока не исчезнет пульс на лучевой артерии. Затем начинают снижать давление в манжетке до появления пульса. Величина давления в манометре в момент появления пульса соответствует систолическому давлению. Недостаток этого метода заключается в том, что с его помощью можно определить только систолическое давление.
Способ Короткова основан на выслушивании (аускультаций) сосудистых тонов, поэтому этот метод называют аускультативным. С помощью этого метода можно определить систолическое и диастолическое давление.
Возникновение сосудистых тонов связано с изменением характера потока крови в сосуде. В нормальном сосуде поток крови имеет ламинарный характер и не вызывает вихревых потоков и вибрации стенок сосудов и, следовательно, акустических явлений. При пережатии сосуда кровь, проходя во время систолы этот участок сосуда, приобретает турбулентный (вихревой) характер и вызывает вибрацию стенок сосудов, что аускультативно определяется как сосудистый тон. Давление в манометре в момент появления сосудистых тонов соответствует систолическому давлению, а давление, при котором сосудистые тоны исчезают, соответствует диастолическому. Разность между систолическим и диастолическим давлением получила название пульсового давления. В норме оно равно 40-55 мм рт. ст. Уменьшение величины пульсового давления свидетельствует о снижении эластических свойств сосудистой стенки.
Величину артериального кровяного давления можно зарегистрировать графически. При анализе такой записи можно выделить волны трех типов (порядков).
Волны первого порядка (пульсовые) обусловлены деятельностью сердца. В систолу кровяное давление увеличивается, а в диастолу – уменьшается. Это изменение давления регистрируется в виде ритмических наиболее частых колебаний.
При одновременной записи артериального давления и дыхания, можно отметить, что при вдохе артериальное давление в большом круге кровообращения снижается, а при выдохе – повышается. Эти менее частые колебания называются волнами второго порядка. Их появление связано с изменением внутригрудного давления в различные фазы дыхательного цикла. В сосудах малого круга кровообращения также происходят гемодинамические изменения: во время вдоха приток крови к нему возрастает, во время выдоха – снижается.
Кроме этих двух типов волн на записи наблюдаются выраженные с различной интенсивностью самые редкие волны колебания давления – волны третьего порядка. Они обусловлены медленным изменением тонуса сосудодвигательного центра, вызывающего изменение тонуса сосудов и, как следствие, повышение или понижение кровяного давления.
1.3. Регуляция деятельности сердца и сосудов.
Различные факторы влияют на свойства сердечной мышцы (возбудимость, проводимость, сократимость, автоматизм, тонус) и, следовательно, на основные параметры деятельности сердца - частоту и силу сокращений.
Влияния на частоту сердечных сокращений называются хронотропными, на силу сокращений - инотропными, на возбудимость - батмотропными, на проводимость - дромотропными, на тонус сердечной мышцы - тонотропными влияниями. Влияния, вызывающие увеличение этих показателей называются положительными, а уменьшение - отрицательными.
1.3.1. Регуляция деятельности сердца.
Принято различать несколько форм регуляции деятельности сердца: авторегуляцию (представленную двумя ее видами - миогенным и нейрогенным) и экстракардиальную регуляцию (нервную, гуморальную, рефлекторную).
1.3.1.1. Авторегуляция сердца
Миогенная авторегуляция включает в себя гетерометрический и гомеометрический механизмы. Гетерометрический механизм опосредован внутриклеточными взаимодействиями и связан с изменением взаиморасположения актиновых и миозиновых нитей в миофибриллах кардиомиоцитов при растяжении миокарда кровью, поступающей в полости сердца. Растяжение миокардиоцитов приводит к увеличению количества миозиновых мостиков, способных соединить миозиновые и актиновые нити во время сокращения. Чем более растянут кардиомиоцит, тем на большую величину он может укоротиться при сокращении, и тем более сильным будет это сокращение. Этот вид регуляции был установлен на сердечно-легочном препарате и сформулирован в виде "закона сердца" или закона Франка-Старлинга. Согласно этому, закону, чем больше миокард растянут во время диастолы, тем больше сила последующего сокращения (систолы). Пресистолическое растяжение миокарда обеспечивается дополнительным объемом крови, нагнетаемым в желудочки во время систолы предсердии. При утомлении сердечной мышцы и длительной нагрузки (например, при гипертонии) этот закон проявляется только в том случае, если сердечная мышца растягивается значительно больше, чем обычно. Однако, величина минутного объема сердца и в этих состояниях длительное время удерживается на нормальном уровне. При дальнейшем нарастании утомления или нагрузки этот показатель уменьшается.
Гомеометрическая авторегуляция сердца связана с определенными межклеточными отношениями и не зависит от пред систолического его растяжения. Большую роль в гомеометрической регуляции играют вставочные диски - нексусы, через которые миокардиоциты обмениваются ионами и информацией. Реализуется данная форма регуляции в виде "эффекта Анрепа" - увеличение силы сердечного сокращения при возрастании сопротивления в магистральных сосудах.
Другим проявлением гомеометрической регуляции является так называемая ритмоинотропная зависимость: изменение силы сердечных сокращений при изменении частоты. Это явление обусловлено изменением длительности потенциала действия миокардиоцитов и, следовательно, изменением количества экстрацеллюлярного кальция, входящего в миокардиоцит при развитии возбуждения.
Нейрогенная авторегуляция сердца в своей основе имеет периферические внутрисердечные рефлексы. Рефлексогенные зоны (скопления рецепторов, с которых начинаются определенные рефлексы) сердца условно делятся на контролирующие "вход" (приток крови к сердцу), "выход" (отток крови от сердца) и кровоснабжение самой сердечной мышцы (расположены в устьях коронарных сосудов). При любом изменении параметров этих процессов возникают местные рефлексы, направленные на ликвидацию отклонений гемодинамики. Например, при увеличении венозного притока и увеличении давления в устьях полых вен и в правом предсердии возникает рефлекс Бейнбриджа, заключающийся в увеличении частоты сокращений сердца.
1.3.1.2. Экстракардиальная регуляция.
Гуморальная регуляция. Сердечная мышца обладает высокой чувствительностью к составу крови, протекающей через ее сосуды и полости сердца. К гуморальным факторам, которые оказывают влияние на функциональное состояние сердца, относятся:
• гормоны (адреналин, тироксин и др.);
• ионы (калия, кальция, натрия и др.);
• продукты метаболизма (молочная и угольная кислоты и др.);
• температура крови.
Адреналин оказывает на сердечную мышцу положительный хроно- и инотропный эффект. Его взаимодействие с бета-адренорецепторами кардиомиоцитов приводит к активации внутриклеточного фермента аденилатциклазы, которая ускоряет образование циклического АМФ, необходимого для превращения неактивной фосфорилазы в активную. Последняя обеспечивает миокард энергией путем расщепления внутриклеточного гликогена с образованием глюкозы. Такое же влияние на сердце (и тем же путем) оказывает глюкагон.
Гормон щитовидной железы - тироксин - обладает ярко выраженным положительным хронотропным эффектом и повышает чувствительность сердца к симпатическим воздействиям.
Положительный инотропный эффект на сердце оказывают кортикостероиды, ангиотензин, серотонин.
Избыток ионов калия оказывает на сердечную деятельность отрицательный ино-, хроно-, батмо- и дромотропный эффекты. Повышение концентрации калия в наружной среде приводит к снижению величины потенциала покоя (вследствие уменьшения градиента концентрации калия), возбудимости, проводимости и длительности ПД.
При значительном увеличении концентрации калия сино-атриальный узел перестает функционировать как водитель ритма, и происходит остановка сердца в фазе диастолы. Снижение концентрации ионов калия приводит к повышению возбудимости центров автоматии, что может сопровождаться, прежде всего, нарушениями ритма сердечных сокращений.
Умеренный избыток ионов кальция в крови оказывает положительный инотропный эффект. Это связано с тем, что ионы кальция активируют фосфорилазу и обеспечивают сопряжение возбуждения и сокращения. При значительном избытке ионов кальция происходит остановка сердца в фазе систолы, т.к. кальциевый насос миокардиоцитов не успевает выкачивать избыток ионов кальция из межфибриллярного ретикулума, следовательно, разобщения нитей актина и миозина, и расслабления миокарда не происходит.
Нервная регуляция. Нервные влияния на деятельность сердца осуществляются импульсами, которые поступают к нему по блуждающему и симпатическим нервам. Тела первых нейронов, образующих блуждающие нервы, расположены в продолговатом мозге. Их аксоны, образующие преганглионарные волокна, идут в интрамуральные ганглии, расположенные в стенке сердца. Здесь находятся вторые нейроны, аксоны которых образуют постганглионарные волокна и иннервируют сино-атриальный узел, мышечные волокна предсердий, атрио-вентрикулярный узел и начальную часть проводящей системы желудочков.
Первые нейроны, образующие симпатические нервы, иннервирующие сердце, расположены в боковых рогах пяти верхних грудных сегментов спинного мозга. Их аксоны (преганглионарные волокна) заканчиваются в шейных и верхних грудных симпатических узлах, в которых находятся вторые нейроны, отростки которых (постганглионарные волокна) идут к сердцу. Большая их часть отходит от звездчатого ганглия. Симпатическая иннервация, в отличие от парасимпатической, более равномерно распределена по всем отделам сердца, включая миокард желудочков. Братьями Э. и Г. Вебер впервые было показано, что раздражение блуждающих нервов оказывает на деятельность сердца отрицательный ино-, хроно-, батмо- и дромотропный эффекты. Микроэлектродные отведения потенциалов от мышечных волокон предсердий показали, что при сильном раздражении блуждающего нерва происходит увеличение мембранного потенциала (гиперполяризация), которое обусловлено повышением проницаемости мембраны для ионов калия, что препятствует развитию деполяризации. Гиперполяризация пейсмекерных клеток сино-атриального узла снижает их возбудимость, что приводит вначале к запаздыванию развития МДД в сино-атриальном узле, а затем и полному ее устранению, что приводит сначала к замедлению сердечного ритма, а затем к остановке сердца. Инотропный эффект связан с укорочением ПД миокарда предсердий и желудочков. Дромотропный - связан с уменьшением атрио-вентрикулярной проводимости.
Однако, слабое раздражение блуждающего нерва может вызывать симпатический эффект. Это объясняется тем, что в сердечном интрамуральном ганглии, кроме холинэргических эфферентных нейронов, находятся адренэргические, которые, обладая более высокой возбудимостью, формируют симпатические эффекты.
Вместе с тем, при одной и той же силе раздражения эффект блуждающего нерва может иногда сопровождаться противоположными реакциями. Это связано со степенью наполнения кровью полостей сердца и сердечных сосудов, т. е. с активностью собственного (внутрисердечного) рефлекторного аппарата. При значительном наполнении и переполнении сосудов и полостей сердца, раздражение блуждающего нерва сопровождается тормозными (отрицательными) реакциями, а при слабом наполнении сердца и, следовательно, слабом возбуждении механорецепторов внутрисердечной нервной сети - стимулирующими (положительными).
Исследованиями И.Ф. Циона впервые было показано, что раздражение симпатических нервов оказывает на сердечную деятельность положительные хроно-, ино-, батмо- и дромотропный эффекты. Среди симпатических нервов, идущих к сердцу, И.П. Павлов обнаружил нервные веточки, раздражение которых вызывает только положительный инотропный эффект. Они были названы усиливающим нервом сердца, который действует на сердце путем стимуляции в нем обмена веществ, т.е. трофики.
Раздражение симпатических нервов вызывает:
• повышение проницаемости мембраны для ионов кальция, что приводит к повышению степени сопряжения возбуждения и сокращения миокарда;
• ускорение спонтанной деполяризации клеток водителей ритма сердца, что приводит к учащению сердечных сокращений;
• ускорение проведения возбуждения в атрио-вентрикулярном узле, что уменьшает интервал между возбуждением предсердий и желудочков.
• удлинение ПД и увеличение его амплитуды, в результате чего больше экзогенного кальция поступает в саркоплазму и сила мышечного сокращения возрастает.
При раздражении ваго-симпатического ствола вначале проявляется парасимпатический эффект, а затем - симпатический. Это связано с тем, что постганглионарные волокна блуждающего нерва (от интрамуральных ганглиев) очень короткие и обладают достаточно высокой скоростью проведения возбуждения. У симпатического нерва постганглионарные волокна длинные, скорость проведения возбуждения меньше, поэтому эффект от его раздражения запаздывает. Однако, действие блуждающего нерва кратковременное, т. к. его медиатор - ацетилхолин - быстро разрушается ферментом холинэстеразой. Медиатор симпатических волокон - норадреналин - разрушается значительно медленнее, чем ацетилхолин, и он действует дольше, поэтому после прекращения раздражения симпатических нервов некоторое время сохраняется учащение и усиление сердечной деятельности.
Из сравнения влияний симпатического и парасимпатического нервов на деятельность сердца видно, что они являются нервами-антагонистами, т, е. оказывают противоположные эффекты. Однако, при определенных условиях раздражения парасимпатического нерва можно получить симпатикоподобный эффект, а симпатического - вагусный. В условиях деятельности целостного организма можно говорить только об их относительном антагонизме, так как они совместно обеспечивают наилучшее, адекватное функционирование сердца в различных функциональных системах. Следовательно, их влияния не антагонистические, а скорее содружественные, т. е. они функционируют как нервы-синергисты.
Рефлекторные влияния на деятельность сердца могут возникать при раздражении различных интеро- и экстерорецепторов. Но особое значение в изменении деятельности сердца имеют рефлексы, возникающие с рецепторов, расположенных в сосудистой системе, получивших название сосудистых рефлексогенных зон. Они расположены в дуге аорты, в каротидном синусе (область разветвления общей сонной артерии) и в других участках сосудистой системы. В этих рефлексогенных зонах находится множество механо, баро-, хеморецепторов, которые реагируют на различные изменения гемодинамики и состав крови.
Рефлекторные влияния с механорецепторов каротидного синуса и дуги аорты особенно важны при повышении кровяного давления. Последнее приводит к возбуждению этих рецепторов и, как следствие, повышению тонуса блуждающего нерва, в результате чего возникает торможение деятельности сердца (отрицательный хроно- и инотропный эффекты). При этом сердце меньше перекачивает крови из венозной системы в артериальную, и давление в аорте и крупных сосудах снижается.
Интенсивное раздражение интерорецепторов может рефлекторно привести к изменению деятельности сердца, вызывая либо учащение и усиление, либо ослабление и урежение сердечных сокращений. Так, например, раздражение рецепторов, брюшины (поколачивание пинцетом но животу лягушки) может привести к урежению сердечной деятельности и даже к его остановке (рефлекс Гольца). У человека кратковременная остановка сердечной деятельности также может наступить при ударе в область живота. При этом афферентные импульсы по чревным нервам достигают спинного мозга, а затем ядер блуждающих нервов, от которых по эфферентным волокнам блуждающего нерва импульсы направляются к сердцу, вызывая его остановку. К вагусным рефлексам относится и глазо-сердечный рефлекс (рефлекс Данини-Ашнера) - урежение сердечной деятельности при легком надавливании на глазные яблоки.
Корковая регуляция деятельности сердца . Изменение сердечной деятельности могут вызвать различные эмоции или упоминание о факторах, их вызывающих, что свидетельствует об участии коры больших полушарий мозга в регуляции деятельности сердца.
Наиболее убедительные данные о наличии корковой регуляции сердечной деятельности получены методом условных рефлексов. Условно-рефлекторные реакции лежат в основе предстартовых состояний спортсменов, сопровождающихся такими же изменениями деятельности сердца, как и во время соревнований.
Кора больших полушарий головного мозга обеспечивает приспособительные реакции организма не только к настоящим, но и к будущим событиям. Условно-рефлекторные сигналы, предвещающие наступление этих событий, могут вызвать изменения сердечной деятельности и всей сердечно-сосудистой системы в той мере, в какой это необходимо, чтобы обеспечить предстоящую деятельность организма.
1.3.2. Сосудистая система
1.3.2.1. Функциональная организация сосудистой системы.
Сосуды большого и малого кругов кровообращения, в зависимости от выполняемой ими функции, можно разделить на несколько групп:
• амортизирующие сосуды (сосуды эластического типа);
• резистивные сосуды (сосуды сопротивления);
• сосуды-сфинктеры;
• обменные сосуды;
• емкостные сосуды;
• шунтирующие сосуды (артерио-венозные анастомозы).
Амортизирующие сосуды. К этим сосудам относятся артерии эластического типа с большим содержанием в сосудистой стенке эластических волокон: аорта, легочная артерия, крупные артерия. Хорошо выраженные эластические свойства таких сосудов, в частности, аорты обусловливают амортизирующий эффект (эффект «компрессионной камеры»), который выражается в амортизации (сглаживании) резкого подъема артериального давления во время систолы. Во время диастолы желудочков, после закрытия аортальных клапанов, под влиянием эластических сил аорта и крупные артерии восстанавливают свой просвет и проталкивают находящуюся в них кровь, обеспечивая, тем самым, непрерывный ток крови.
Резистивные сосуды (сосуды сопротивления). К резистивным сосудам относятся средние и мелкие артерии, артериолы и прекапиллярные сфинктеры. Эти прекапиллярные сосуды, имеющие малый просвет (диаметр) и хорошо развитую гладкую мускулатуру их стенок, оказывают наибольшее сопротивление кровотоку. Это особенно относится к артериолам, которые называют «кранами» артериальной системы. Сосудам сопротивления свойственна высокая степень внутреннего (базального) тонуса, который постоянно изменяется под влиянием местных физических и химических факторов, а также под влиянием симпатических нервов. Изменение степени сокращения мышечных волокон этих сосудов приводит к изменению их диаметра и, следовательно, общей площади поперечного сечения, а значит и изменения объемной скорости кровотока. Прекапиллярные сосуды сопротивления, таким образом, влияют на отток крови из амортизирующих сосудов. Особое место среди сосудов сопротивления занимают прекапиллярные сфинктеры (сосуды-сфинктеры) – это конечные отделы прекапиллярных артериол, в стенке которых содержится больше, чем в артериоле, мышечных элементов. От функционального состояния прекапиллярных сфинктеров зависит ток крови через капилляры. Кровоток может быть настолько перекрыт, что через капилляры не проходят форменные элементы, движется только плазма («плазменные капилляры»). Если кровоток через капилляр полностью перекрывается, то капилляр перестает функционировать, он выключается из кровообращения. Таким образом, прекапиллярные сфинктеры, изменяя число функционирующих капилляров, изменяют площадь обменной поверхности. Функциональное состояние гладкомышечных клеток прекапиллярных сфинктеров находится под контролем механизмов внутренней миогенной регуляции и непрерывно изменяется под влиянием местных сосудорасширяющих метаболитов.
Обменные сосуды. К этим сосудам относятся капилляры, т. К. именно в них осуществляются обменные процессы между кровью и межклеточной жидкостью (транссосудистый обмен). Интенсивность транссосудистого обмена зависит от скорости кровотока через эти сосуды и давления, под которым находится протекающая кровь. Капилляры не способны к активному изменению своего диаметра. Он изменяется вслед за колебаниями давления в пре- и посткапиллярных резистивных сосудах, т. Е. меняется в зависимости от состояния прекапиллярных сфинктеров и посткапиллярных венул, вен.
Емкостные сосуды. Они представлены венами, которые благодаря своей высокой растяжимости способны вмещать большие объемы крови, играя, таким образом, роль депо крови. Сопротивление капиллярному кровотоку со стороны емкостных сосудов влияет на его скорость и давление, а, следовательно, на интенсивность транссосудистого обмена.
Артерио-венозные анастомозы (шунтирующие сосуды) – это сосуды, соединяющие артериальную и венозную части сосудистого русла, минуя капилляры. Различают два типа артерио-венозных анастомозов:
• соединяющие каналы замыкательного типа;
• гломерулярный или клубочковый тип.
При открытых артерио-венозных анастомозах кровоток через капилляры либо резко уменьшается, либо полностью прекращается. Таким образом, с помощью шунтирующих сосудов регулируется кровоток через обменные сосуды. При закрытии прекапиллярных сфинктеров через артерио-венозные анастомозы сбрасывается кровь из артериол в венулы. Состояние шунтов отражается и на общем кровотоке. При открытии анастомозов увеличивается давление в венозном русле, что увеличивает венозный приток к сердцу и, следовательно, величину сердечного выброса.
Функции артерио-венозных анастомозов:
• регулируют ток крови через орган;
• участвуют в регуляции общего и местного давления крови;
• регулируют кровенаполнение органа;
• стимулируют венозный кровоток;
• обеспечивают приток артериальной крови к венозной;
• обеспечивают мобилизацию депонированной крови;
• регулируют ток межтканевой жидкости в венозном русле;
• влияют на общий кровоток через изменение местного тока жидкости и крови;
• участвуют в терморегуляции.
1.3.2.2. Микроциркуляция .
Микроциркуляторной системой называется совокупность кровеносных сосудов, диаметр которых не превышает 2 мм. Процессы движения крови по сосудам этой системы называются микроциркуляцией. Микроциркуляция включает процессы, связанные с внутриорганным кровообращением, обеспечивающим тканевой метаболизм, перераспределение и депонирование крови.
В состав микроциркуляторной системы входят: терминальные артериолы и метартериолы, прекапиллярный сфинктер, собственно капилляр, посткапиллярная венула, венула, мелкие вены, артерио-венозные анастомозы.
Каждый компонент микроциркуляторной единицы выполняет определенные функции в процессе микроциркуляции. Так терминальные артериолы, метартериолы и прекапиллярный сфинктер по отношению к капиллярам выполняют транспортную функцию, они приносят кровь к капиллярам и называются приносящими сосудами. Кроме того, они, меняя величину просвета за счет сокращения или расслабления гладкомышечных элементов, регулируют скорость кровотока: увеличение сопротивления току крови (при уменьшении просвета сосуда) уменьшает скорость движения крови, уменьшение сопротивления току крови (при увеличении просвета сосуда) - увеличивает скорость кровотока. Вследствие этого меняется и давление крови в капиллярах.
Капилляры и посткапиллярные венулы называются обменными сосудами, так как в них осуществляются обменные процессы между кровью и интерстициальной жидкостью.
Венулы и вены - отводящие (емкостные) сосуды, они собирают и отводят кровь, протекающую через обменные сосуды. Сопротивление капиллярному кровотоку со стороны отводящих сосудов влияет на его скорость, величину давления в капиллярах и, следовательно, на интенсивность транссосудистого обмена.
Артерио-венозные анастомозы - с их помощью регулируется кровоток через обменные сосуды. При закрытых анастомозах кровоток через обменные сосуды увеличивается, в результате увеличения давления в артериолах и уменьшения в венуле. При открытых анастомозах кровоток уменьшается в результате уменьшения давления в артериоле и увеличения в венуле. Это сказывается на интенсивности транскапиллярного обмена.
Центральным звеном микроциркуляторной системы являются капилляры. Капилляры являются самыми тонкими и многочисленными сосудами, которые располагаются в межклеточных пространствах. Стенка капилляра состоит из трех слоев:
• слой эндотелиальных клеток;
• базальный слой, состоящий из перицитов и сплетенных между собой фибрилл;
• адвентициальный слой.
Ультраструктура стенки капилляра в различных органах имеет свою специфику (соотношение слоев между собой, характер эндотелиальных клеток и т. д.), что лежит в основе общей классификации капилляров. Выделяют три типа капилляров.
Первый тип - сплошные капилляры (соматические). Стенка капилляров этого типа образована сплошным слоем эндотелиальных клеток, в мембране которых имеются мельчайшие поры. Стенка таких капилляров мало проницаема для крупных молекул белка, но легко пропускает воду и растворенные в ней минеральные вещества. Этот тип капилляров характерен для скелетной и гладкой мускулатуры, кожи, легких, центральной нервной системы, жировой и соединительной ткани.
Второй тип - окончатые (висцеральные). В стенке капилляров этого типа имеются "окна" (фенестры), которые могут занимать до 30% площади поверхности клетки. Такие капилляры характерны для органов, которые секретируют и всасывают большой количество воды и растворенных в ней веществ, или участвуют в быстром транспорте макромолекул: клубочки почки, слизистая оболочка кишечника, эндокринные железы.
Третий тип - межклеточно-окончатые, несплошные капилляры (синусоидные). Капилляры этого типа имеют прерывистую эндотелиальную оболочку, клетки эндотелия расположены далеко друг от друга, образуя большие межклеточные пространства. Через стенку таких капилляров легко проходят макромолекулы и форменные элементы крови. Такие капилляры встречаются в костном мозге, печени, селезенке.
1.3.2.2.1. Морфологические и функциональные особенности капиллярного кровообращения.
Особенности капилляров большого круга кровообращения.
• Различные ткани организма неодинаково насыщены капиллярами: минимально насыщена костная ткань, максимально - мозг, почки, сердце, железы внутренней секреции.
• Капилляры большого круга имеют большую общую поверхность.
• Капилляры близко расположены к клеткам (не далее 50 мкм), а в тканях с высоким уровнем метаболизма (печень) - еще ближе (не далее 30 мкм).
• Они оказывают высокое сопротивление току крови.
• Линейная скорость кровотока в них низкая (0,3-0,5 мм/с).
• Относительно большой перепад давления между артериальной и венозной частями капилляра.
• Как правило, проницаемость стенки капилляра высокая.
• В обычных условиях работает 1/3 всех капилляров, остальные 2/3 находятся в резерве - закон резервации.
• Из работающих капилляров часть функционирует (дежурят), а часть - не функционируют - закон "дежурства" капилляров.
Особенности капилляров малого круга кровообращения:
• Капилляры малого круга кровообращения короче и шире по сравнению с капиллярами большого круга.
• В этих капиллярах меньше сопротивление току крови, поэтому правый желудочек во время систолы развивает меньшую силу.
• Сила правого желудочка создает меньшее давление в легочных артериях и, следовательно, в капиллярах малого круга.
• В капиллярах малого круга практически нет перепада давления между артериальной и венозной частями капилляра.
• Интенсивность кровообращения зависит от фазы дыхательного цикла: уменьшение на выдохе и увеличение на вдохе.
• В капиллярах малого круга не происходит обмена жидкости и растворенных в ней веществ с окружающими тканями.
• В легочных капиллярах осуществляется только газообмен.
Особенности коронарного кровоснабжения:
• Коронарные артерии отходят от аорты, практически сразу же за полулунными клапанами, поэтому в них очень высокое давление крови, что обеспечивает в сердце интенсивное кровообращение.
• Густая капиллярная сеть миокарда: число капилляров приближается к числу мышечных волокон.
• Кровоснабжение сердечной мышцы осуществляется в основном во время диастолы, т. к. во время систолы артериолы и капилляры пережимаются сокращающимся миокардом.
• Сосуды сердца имеют двойную иннервацию - симпатическую и парасимпатическую, но их влияния на коронарные сосуды противоположны влияниям на другие сосуды: симпатические нервные влияния расширяют коронарные сосуды, а парасимпатические - суживают.
Особенности мозгового кровообращения :
• Кровообращение головного мозга более интенсивно, чем в некоторых других органах и тканях организма.
• Мозговые артерии имеют хорошо выраженную адренэргическую иннервацию. Это дает возможность мозговым артериям изменять свой просвет в широких пределах.
• Между артериолами и венулами нет артерио-венозных анастомозов.
• Количество капилляров зависит от интенсивности метаболизма, поэтому в сером веществе капилляров значительно больше, чем в белом.
• Капилляры находятся в открытом состоянии.
• Кровь, оттекающая от мозга, поступает в вены, которые образуют синусы в твердой мозговой оболочке.
• Венозная система мозга, в отличие от других органов и тканей, не выполняет емкостной функции.
1.3.2.2.2. Механизмы транскапиллярного обмена.
Транскапиллярный (транссосудистый) обмен может осуществляться за счет пассивного транспорта (диффузия, фильтрация, абсорбция), за счет активного транспорта (работа транспортных систем) и микропиноцитоза.
Фильтрационно-абсорбционный механизм обмена между кровью и интерстициальной жидкостью. Этот механизм обеспечивается за счет действия следующих сил. В артериальном отделе капилляра большого круга кровообращения гидростатическое давление крови равно 40 мм рт. ст. Сила этого давления способствует выходу (фильтрации) воды и растворенных в ней веществ из сосуда в межклеточную жидкость. Онкотическое давление плазмы крови, равное 30 мм рт. ст., препятствует фильтрации, т. к. белки удерживают воду в сосудистом русле. Онкотическое давление межклеточной жидкости, равное 10 мм рт. ст., способствует фильтрации - выходу воды из сосуда. Таким образом, результирующая всех сил, действующих в артериальном отделе капилляра, равна 20 мм рт. ст. (40+10-30=20 мм рт. ст.) и направлена из капилляра. В венозном отделе капилляра (в посткапиллярной венуле) фильтрация будет осуществляться следующими силами: гидростатическим давлением крови, равным 10 мм рт. ст., онкотическим давлением плазмы крови, равным 30 мм рт. ст. и онкотическим давлением межклеточной жидкости, равное 10 мм рт. ст.. Результирующая всех сил будет равна 10 мм рт. ст. : (-10+30-10=10) и направлена в капилляр. Следовательно, в венозном отделе капилляра происходит абсорбция воды и растворенных в ней веществ. В артериальном отделе капилляра жидкость выходит под воздействием силы в 2 раза большей, чем она входит в капилляр в его венозном отделе. Возникающий, таким образом, избыток жидкости из интерстициальных пространств оттекает через лимфатические капилляры в лимфатическую систему.
В капиллярах малого круга кровообращения транскапиллярный обмен осуществляется за счет действия следующих сил: гидростатическое давление крови в капиллярах, равное 20 мм рт. ст., онкотическое давление плазмы крови; равное 30 мм рт. ст., онкотическое давление межклеточной жидкости, равное 10 мм рт. ст. Результирующая всех сил будет равна нулю. Следовательно, в капиллярах малого круга кровообращения обмена жидкости не происходит.
Диффузионный механизм транскапиллярного обмена . Этот вид обмена осуществляется в результате разности концентраций веществ в капилляре и межклеточной жидкости. Это обеспечивает движение веществ по концентрационному градиенту. Такое движение возможно потому, что размеры молекул этих веществ меньше пор мембраны и межклеточных щелей. Жирорастворимые вещества проходят мембрану независимо от величины пор и щелей, растворяясь в ее липидном слое (например, эфиры, углекислый газ и др.).
Активный механизм обмена - осуществляется эндотелиальными клетками капилляров, которые при помощи транспортных систем их мембран переносят молекулярные вещества (гормоны, белки, биологически активные вещества) и ионы.
Пиноцитозный механизм обеспечивает транспорт через стенку капилляра крупных молекул и фрагментов частей клеток опосредованно через процессы эндо- и экзопиноцитоза.
1.3.3. Регуляция местного кровообращения.
В области микроциркуляторного русла основной (базальный или периферический) тонус, который имеет миогенную природу, характерен, прежде всего, для артериол и прекапиллярных сфинктеров. Базальный тонус контролируется местными регуляторными механизмами, которые обеспечивают ауторегуляцию микроциркуляторного (органного) кровообращения, реализующуюся за счет активности гладких мышц самих сосудов. Это обеспечивает относительную автономность органного (микроциркуляторного) кровообращения, т. к. местные регуляторные механизмы мало зависят от общей нейро-гуморальной регуляции.
Растяжение сосуда при возрастании внутрисосудистого давления приводит к усилению его базального тонуса, уменьшению просвета сосуда и уменьшению давления крови и, следовательно, кровотока в участке русла, расположенного за ним по ходу тока крови.
В этих условиях (уменьшения кровоснабжения тканей) продукты метаболизма (угольная и молочная кислоты, АМФ, ионы калия), накапливаясь в межклеточной среде, уменьшают сократительную способность мышечных волокон сосудистой стенки, что отражается в снижении тонуса. Вследствие этого увеличивается просвет сосуда, возрастает кровоток, продукты метаболизма удаляются, сосудистый тонус повышается, и кровоток снова уменьшается.
Местная (органная) регуляция сосудистого тонуса, а, следовательно, и кровотока, более выражена по сравнению с общими нейрогуморальными механизмами в условиях относительного покоя организма. В условиях же его выраженной деятельности местная регуляция играет вспомогательную роль, а ведущая принадлежит нервной и гуморальной регуляции.
1.3.3.1. Нервная регуляция микроциркуляторной системы .
Эфферентные нервные волокна заканчиваются на гладких мышечных волокнах артериол и прекапиллярных сфинктеров, а в капиллярах - на перицитах (клетках Руже), которые передают возбуждение на эндотелиальные клетки. В ответ на это эндотелиальные клетки набухают и закрывают капилляр или уплощаются и открывают его. Набухание эндотелиальных клеток приводит к закрытию просвета капилляра в артериальном его отделе, в венозном отделе происходит только его сужение. Набухание (округление) наступает в результате накопления жидкости в клетках под влиянием нервного возбуждения, поступающего к эндотелиальной клетке через перициты. Уплощение эндотелиальной клетки происходит в результате потери ею жидкости также под влиянием перицитов. Кроме того, существует мнение, что перицит - сократительная клетка, способная, подобно мышечной клетке, активно менять просвет капилляра.
1.3.3.2. Регуляция тонуса сосудов.
Регуляция сосудов - это регуляция сосудистого тонуса, который определяет величину их просвета. Просвет сосудов определяется функциональным состоянием их гладкой мускулатуры, а просвет капилляров зависит от состояния клеток эндотелия и гладкой мускулатуры прекапиллярного сфинктера.
Гуморальная регуляция сосудистого тонуса. Эта регуляция осуществляется за счет тех химических веществ, которые циркулируют в кровеносном русле и изменяют ширину просвета сосудов. Все гуморальные факторы, которые оказывают влияние на тонус сосудов, делят на сосудосуживающе (вазоконстрикторы) и сосудорасширяющие (вазодилятаторы).
К сосудосуживающим веществам относятся:
• адреналин - гормон мозгового вещества надпочечников, суживает артериолы кожи, органов пищеварения и легких, в низких концентрациях расширяет сосуды мозга, сердца и скелетных мышц, обеспечивая тем самым адекватное перераспределение крови, необходимое для подготовки организма к реагированию в трудной ситуации;
• норадреналин - гормон мозгового вещества надпочечников по своему действию близок к адреналину, но его действие более выражено и более продолжительно;
• вазопрессин - гормон, образующийся в нейронах супраоптического ядра гипоталамуса, форму в клетках задней доли гипофиза, действует в основном на артериолы;
• серотонин - вырабатывается клетками стенки кишки, в некоторых участках головного мозга, а также выделяется при распаде кровяных пластинок;
• ангиотензин-II - образуется из ангиотензина-I под влиянием фермента ренина, вырабатываемого в почках.
К сосудорасширяющим веществам относятся:
• гистамин - образуется в стенке желудка, кишечника, других органах, расширяет артериолы;
• ацетилхолин - медиатор парасимпатических нервов и симпатических холинергических вазодилятаторов, расширяет артерии и вены;
• брадикинин - выделен из экстрактов органов (поджелудочной железы, подчелюстной слюнной железы, легких), образуется при расщеплении одного из глобулинов плазмы крови, расширяет сосуды скелетных мышц, сердца, спинного и головного мозга, слюнных и потовых желез;
• простагландины - образуются во многих органах и тканях, оказывают местное сосудорасширяющее действие;
• углекислота - расширяет сосуды мозга, кишечника, скелетной мускулатуры;
• молочная и пировиноградная кислоты - оказывают местный вазодилятаторный эффект.
Нервная регуляция сосудистого тонуса. Нервная регуляция сосудистого тонуса осуществляется вегетативной нервной системой. Сосудосуживающий эффект преимущественно оказывают волокна симпатического отдела вегетативной (автономной) нервной системы, а сосудорасширяющее - парасимпатические и, частично, симпатические нервы. Сосудосуживающее действие симпатических нервов не распространяется на сосуды головного мозга, сердца, легких и работающих мышц. Сосуды этих органов при возбуждении симпатической нервной системы расширяются. Следует также отметить, что не все парасимпатические нервы являются вазодилятаторами, например, волокна парасимпатического блуждающего нерва суживают сосуды сердца.
Сосудосуживающие и сосудорасширяющие нервы находятся под влиянием сосудодвигательного центра. Вазомоторный или сосудодвигательный центр - это совокупность структур, расположенных на различных уровнях ЦНС и обеспечивающих регуляцию кровообращения. Структуры, входящие в состав сосудодвигательного центра, расположены, в основном, в спинном и продолговатом мозге, гипоталамусе, коре больших полушарий. Сосудодвигательный центр состоит из прессорного и депрессорного отделов.
Депрессорный отдел снижает активность симпатических сосудосуживающих влияний и, тем самым, вызывает расширение сосудов, падение периферического сопротивления и снижение артериального давления. Прессорный отдел вызывает сужение сосудов, повышение периферического сопротивления и давления крови.
Активность нейронов сосудодвигательного центра формируется нервными импульсами, идущими от коры больших полушарий головного мозга, гипоталамуса, ретикулярной формации ствола мозга, а также от различных рецепторов, особенно, расположенных в сосудистых рефлексогенных зонах.
1.3.4. Регуляция системного кровообращения
Под регуляцией кровообращения понимают совокупность процессов, обусловливающих изменение основных параметров кровообращения, направленных на обеспечение той или иной приспособительной деятельности.
Параметрами кровообращения являются:
• величина кровяного давления;
• линейная скорость кровотока;
• объемная скорость кровотока;
• время кругооборота крови.
Основным из них является давление крови, т. К. именно оно определяет, в конечном итоге, процесс кровообращения. Поэтому рассматривая регуляцию системного кровообращения, следует обратить внимание, прежде всего, на регуляцию кровяного давления.
Поддержание постоянства артериального давления осуществляется но принципу саморегуляции, для обеспечения которой формируется функциональная система. Полезным приспособительным результатом данной функциональной системы является такой уровень артериального давления в организме, который обеспечивает нормальное течение метаболических процессов в тканях. В крупных артериях оно равно 120/80 мм рт. ст. Такая величина давления крови в крупных сосудах обеспечивает уровень гидростатического давления крови в капиллярах, необходимый для создания нормальных условий транскапиллярного обмена.
Величина кровяного давления зависит от следующих факторов:
• тонуса сосуда, определяющего величину его просвета;
• сопротивления току крови;
• массы циркулирующей крови;
• вязкости крови;
• работы сердца.
Изменение любого из этих факторов может привести к изменению величины кровяного давления.
Изменения уровня кровяного давления могут возникать при раздражении экстеро- и интерорецепторов, но особое значение в регуляции кровяного давления имеют барорецепторы сосудистых рефлексогенных зон.
Физиологические свойства и особенности сосудистых барорецепторов.
1. Барорецепторы обладают подчеркнутой спецификой, т. Е. они реагируют на колебания давления в строго определенных пределах. Здесь проявляется закон градуальности силы, т. Е. определенные группы рецепторов включаются в действие лишь при давлении определенной величины. Большинство барорецепторов реагируют на колебания давления в диапазоне от 70 до 140 мм рт. ст.
2. Микроэлектродная регистрация электрической активности барорецепторов позволила выявить пачечный характер импульсации, связанной с повышением давления крови в аорте и крупных артериях во время систолы сердца.
3. При быстром увеличении давления даже небольшой его прирост ведет к выраженному изменению импульсации. Медленное нарастание давления даже на большие величины ведет к меньшему изменению импульсации. Следовательно, чем круче нарастает давление, тем больший прирост импульсации наблюдается в сосудистых барорецепторах.
4. Сосудистые барорецепторы обладают способностью увеличивать импульсацию в геометрической прогрессии на одинаковую величину прироста артериального давления в зависимости от его исходного уровня. Например, на прирост давления на 10 мм рт. ст. в диапазоне 130 – 140 мм рт. ст. формируется прирост частоты импульсации на 5 имп/с. В то же время на прирост давления на те же 10 мм, но в диапазоне 180 – 190 мм рт. ст. барорецептор увеличивает импульсацию на 25 имп/с.
5. Сосудистые барорецепторы воспринимают изменяющееся давление в своем диапазоне. Если рецепторы находятся в зоне постоянного давления, то они перестают на него реагировать в результате развития адаптации. Адаптированные барорецепторы снова начинают функционировать, как только попадают в зону изменяющегося давления.
Возбуждение от барорецепторов сосудов направляется в ЦНС, прежде всего, в сосудодвигательный центр, гипоталамус, кору. На основе информации об отклонении константы кровяного давления формируется функциональная система, работа которой направлена на восстановление константы. Это может быть достигнуто включением различных аппаратов реакции: изменения ширины просвета сосудов (особенно артериол), регионального перераспределения крови, изменения работы сердца, изменения массы циркулирующей крови, ее депонирования, изменения вязкости, изменения скорости кровотока, процессов кровообразования и кроверазрушения. Одновременно происходит включение гормональной регуляции. При недостаточности саморегуляции включаются элементы поведенческой регуляции, что в конечном итоге позволяет нормализовать величину кровяного давления, т. Е. возвратить его к исходной константной величине.
1.4. Дыхание
1.4.1.
Внешнее дыхание
Внешнее дыхание осуществляется благодаря изменениям объема грудной клетки и сопутствующим изменениям объема легких. Во время вдоха объем грудной клетки увеличивается, а во время выдоха - уменьшается. В дыхательных движениях участвуют:
1. Дыхательные пути , которые по своим свойствам являются слегка растяжимыми, сжимаемыми и создают поток воздуха.
2. Респираторный отдел , представленный альвеолами. В легких имеется три типа альвеолоцитов (пневмоцитов), выполняющих разную функцию. Альвеолоциты второго типа осуществляют синтез липидов и фосфолипидов легочного сурфактанта. Общая площадь альвеол у взрослого человека достигает 80-90 м2 , т.е. примерно в 50 раз превышает поверхность тела человека.
1.4.1.1. Внутриплевральное и внутрилегочное давление
Внутриплевральное давление, или давление в герметично замкнутой плевральной полости между висцеральными и париетальными листками плевры, в норме является отрицательным относительно атмосферного. При открытых верхних дыхательных путях давление во всех отделах легких равно атмосферному. Перенос атмосферного воздуха в легкие происходит при появлении разницы давлений между внешней средой и альвеолами легких. При каждом вдохе объем легких увеличивается, давление заключенного в них воздуха, или внутрилегочное давление, становится ниже атмосферного, и воздух засасывается в легкие. При выдохе объем легких уменьшается, внутрилегочное давление повышается и воздух выталкивается из легких в атмосферу. Внутриплевральное давление обусловлено эластической тягой легких или стремлением легких уменьшить свой объем. При обычном спокойном дыхании внутриплевральное давление ниже атмосферного: в инспирацию - на 6-8 см вод. ст., а в экспирацию - на 4-5 см вод. ст. Прямые измерения показали, что внутриплевральное давление в апикальных частях легких ниже, чем в прилегающих к диафрагме базальных отделах легких. В положении стоя этот градиент практически линейный и не изменяется в процессе дыхания. Важным фактором, влияющим на эластичность и растяжимость легких, является поверхностное натяжение жидкости в альвеолах. Спадению альвеол препятствует антиателектатический фактор, или сурфактант , выстилающий внутреннюю поверхность альвеол, препятствующий их спадению, а также выходу жидкости на поверхность альвеол из плазмы капилляров легкого. Синтез и замена поверхностно-активного вещества - сурфактанта происходит довольно быстро, поэтому нарушение кровотока в легких, воспаление и отеки, курение, острая кислородная недостаточность (гипоксия) или избыток кислорода (гипероксия), а также различные токсические вещества, в том числе некоторые фармакологические препараты (жирорастворимые анестетики), могут снизить его запасы и увеличить поверхностное натяжение жидкости в альвеолах. Все это ведет к их ателектазу, или спадению. В профилактике и лечении ателектазов определенное значение имеют аэрозольные ингаляции лекарственных средств, содержащих фосфолипидный компонент, например лецитин, который способствует восстановлению сурфактанта.
1.4.1.2. Вентиляция легких и легочные объемы
Величина легочной вентиляции определяется глубиной дыхания и частотой дыхательных движений. Количественной характеристикой легочной вентиляции служит минутный объем дыхания (МОД) – объем воздуха, проходящий через легкие за 1 минуту. В покое частота дыхательных движений человека составляет примерно 16 в 1 минуту, а объем выдыхаемого воздуха – около 500 мл. Умножив частоту дыхания в 1 минуту на величину дыхательного объема, получим МОД, который у человека в покое составляет в среднем 8 л/мин. Максимальная вентиляция легких (МВЛ) – объем воздуха, который проходит через легкие за 1 минуту во время максимальных по частоте и глубине дыхательных движений. Максимальная вентиляция возникает во время интенсивной работы, при недостатке содержания О2 (гипоксия) и избытке СО2 (гиперкапния) во вдыхаемом воздухе. В этих условиях МОД может достигать 150 – 200 л в 1 минуту. Объем воздуха в легких и дыхательных путях зависит от конституционально-антропологических и возрастных характеристик человека, свойств легочной ткани, поверхностного натяжения альвеол, а также силы, развиваемой дыхательными мышцами.
Для оценки вентиляционной функции легких, состояния дыхательных путей, изучения паттерна (рисунка) дыхания применяются различные методы исследования: пневмографию, спирометрию, спирографию, пневмоскрин. С помощью спирографа можно определить и записать величины легочных объемов воздуха, проходящих через воздухоносные пути человека. При спокойном вдохе и выдохе через легкие проходит сравнительно небольшой объем воздуха. Это дыхательный объем (ДО), который у взрослого человека составляет примерно 500 мл. При этом акт вдоха проходит несколько быстрее, чем акт выдоха. Обычно за 1 минуту совершается 12- 16 дыхательных циклов. Такой тип дыхания обычно называется «эйпноэ» или «хорошее дыхание». При форсированном (глубоком) вдохе человек может дополнительно вдохнуть еще определенный объем воздуха. Этот резервный объем вдоха (Ровд) – максимальный объем воздуха, который способен вдохнуть человек после спокойного вдоха. Величина резервного объема вдоха составляет у взрослого человека примерно 1,8-2,0 л. После спокойного выдоха человек может при форсированном выдохе дополнительно выдохнуть еще определенный объем воздуха. Это резервный объем выдоха (Ровыд), величина которого составляет в среднем 1,2 – 1,4 л. Объем воздуха, который остается в легких после максимального выдоха и в легких мертвого человека, - остаточный объем легких (ОО). Величина остаточного объема составляет 1,2-1,5 л. У аборигенов высокогорья из-за бочкообразной грудной клетки сохраняются более высокие величины этого показателя, благодаря чему удается сохранить в организме необходимое содержание СО2 , достаточное для регуляции дыхания в этих условиях. Различают следующие емкости легких:
1. Общая емкость легких (ОЕЛ) – объем воздуха, находящегося в легких после максимального вдоха – все четыре объема;
2. Жизненная емкость легких (ЖЕЛ) включает в себя дыхательный объем, резервный объем вдоха, резервный объем выдоха. ЖЕЛ – это объем воздуха, выдохнутого из легких после максимального вдоха при максимальном выдохе. ЖЕЛ = ОЕЛ – остаточный объем легких. ЖЕЛ составляет у мужчин 3,5 – 5,0 л, у женщин – 3,0 – 4,0 л;
3. Емкость вдоха (Ед.) равна сумме дыхательного объема и резервного объема вдоха, составляет в среднем 2,0 – 2,5 л;
4. Функциональная остаточная емкость (ФОЕ) – объем воздуха в легких после спокойного выдоха. В легких при спокойном вдохе и выдохе постоянно содержится примерно 2500 мл воздуха, заполняющего альвеолы и нижние дыхательные пути. Благодаря этому газовый состав альвеолярного воздуха сохраняется на постоянном уровне.
Воздух, находящийся в воздухоносных путях (полость рта, носа, глотки, трахеи, бронхов и бронхиол), не участвует в газообмене, и поэтому пространство воздухоносных путей называют вредным или мертвым дыхательным пространством. Во время спокойного вдоха объемом 500 мл в альвеолы поступает только 350 мл вдыхаемого атмосферного воздуха. Остальные 150 мл задерживаются в анатомическом мертвом пространстве. Составляя в среднем треть дыхательного объема, мертвое пространство снижает на эту величину эффективность альвеолярной вентиляции при спокойном дыхании. В тех случаях, когда при выполнении физической работы дыхательный объем увеличивается в несколько раз, объем анатомического мертвого пространства практически не влияет на эффективность альвеолярной вентиляции. При некоторых патологических состояниях – при анемии, легочной эмболии или эмфиземе могут возникать очаги – зоны альвеолярного мертвого пространства. В подобных зонах легких не происходит газообмена.
1.4.2. Газообмен и транспорт газов
Газообмен О2 и СО2 через альвеолярно-капиллярную мембрану происходит с помощью диффузии, которая осуществляется в два этапа. На первом этапе диффузионный перенос газов происходит через аэрогематический барьер, на втором – происходит связывание газов в крови легочных капилляров, объем которой оставляет 80-150 мл при толщине слоя крови в капиллярах всего 5-8 мкм. Плазма крови практически не препятствует диффузии газов, в отличие от мембраны эритроцитов. Структура легких создает благоприятные условия для газообмена: дыхательная зона каждого легкого содержит около 300 млн. альвеол и примерно такое же число капилляров, имеет площадь 40-140 м2 , при толщине аэрогематического барьера всего 0,3 – 1,2 мкм. Особенности диффузии газов количественно характеризуются через диффузионную способность легких. Для О2 диффузионная способность легких – это объем газа, переносимого из альвеол в кровь в 1 минуту при градиенте альвеолярно-капиллярного давления газа, равном 1 мм рт. ст. Движение газов происходит в результате разницы парциальных давлений. Парциальное давление – это та часть давления, которую составляет данный газ из общей смеси газов. Пониженное давление Од в ткани способствует движению кислорода к ней. Для СО2 градиент давления направлен в обратную сторону, и СО2 с выдыхаемым воздухом уходит в окружающую среду. Изучение физиологии дыхания фактически сводится к изучению этих градиентов и того, как они поддерживаются. Градиент парциального давления кислорода и углекислого газа это сила, с которой молекулы этих газов стремятся проникнуть через альвеолярную мембрану в кровь. Парциальное напряжение газа в крови или тканях – это сила, с которой молекулы растворимого газа стремятся выйти в газовую среду. На уровне моря атмосферное давление составляет в среднем 760 мм рт. ст., а процентное содержание кислорода – около 21%. В этом случае рО2 в атмосфере составляет: 760 х 21/100=159 мм рт.ст. При вычислении парциального давления газов в альвеолярном воздухе следует учитывать, что в этом воздухе присутствуют пары воды (47 мм рт. ст.). Поэтому это число вычитают из значения атмосферного давления, и на долю парциального давления газов приходится (760-47) =713 мм рт. ст. При содержании кислорода в альвеолярном воздухе, равном 14 %, его парциальное давление будет 100 мм рт. ст. При содержании двуокиси углерода, равном 5,5%, парциальное давление СО2 составит примерно 40 мм рт.ст. В артериальной крови парциальное напряжение кислорода достигает почти 100 мм рт.ст., в венозной крови – около 40 мм рт.ст., а в тканевой жидкости, в клетках – 10-15 мм рт.ст. Напряжение углекислого газа в артериальной крови составляет около 40 мм рт.ст., в венозной – 46 мм рт.ст., а в тканях – до 60 мм рт.ст. Газы в крови находятся в двух состояниях: физически растворенном и химически связанном. Растворение происходит в соответствии с законом Генри, согласно которому количество газа, растворенного в жидкости, прямо пропорционально парциальному давлению этого газа над жидкостью. На каждую единицу парциального давления в 100 мл крови растворяется 0,003 мл О2 или 3 мл/л крови. Газообмен кислорода между альвеолярным воздухом и кровью происходит благодаря наличию концентрационного градиента О2 между этими средами. Транспорт кислорода начинается в капиллярах легких, где основная масса поступающего в кровь О2 вступает в химическую связь с гемоглобином (Hb). Гемоглобин способен избирательно связывать О2 и образовывать оксигемоглобин (НbО2 ). Один грамм гемоглобина связывает 1,36 – 1,34 мл О2 а в 1 литре крови содержится 140-150 г гемоглобина. На 1 грамм гемоглобина приходится 1,39 мл кислорода. Следовательно, в каждом литре крови максимально возможное содержание кислорода в химически связанной форме составит 190 – 200 мл О2 или 19 об% - это кислородная емкость крови. Кровь человека содержит примерно 700 – 800г гемоглобина и может связывать 1л кислорода. Под кислородной емкостью крови понимают количество О2 которое связывается кровью до полного насыщения гемоглобина. Изменение концентрации гемоглобина в крови, например, при анемиях, отравлениях ядами изменяет ее кислородную емкость. При рождении в крови у человека более высокие значения кислородной емкости и концентрации гемоглобина. Насыщение крови кислородом выражает отношение количества связанного кислорода к кислородной емкости крови, т.е. под насыщением крови подразумевается процент оксигемоглобина по отношению к имеющемуся в крови гемоглобину. В обычных условиях насыщение О2 составляет 95-97%. При дыхании чистым кислородом насыщение крови О2 достигает 100%, а при дыхании газовой смесью с низким содержанием кислорода процент насыщения падает. При 60-65% О2 наступает потеря сознания. Зависимость связывания кислорода кровью от его парциального давления можно представить в виде графика, где по оси абсцисс откладывается рО2 в крови, по ординате – насыщение гемоглобина кислородом. Этот график – кривая диссоциации оксигемоглобина, или сатурационная кривая, показывает, какая доля гемоглобина в данной крови связана с О2 при том или ином его парциальном давлении, а какая – диссоциирована, т.е. свободна от кислорода. Кривая диссоциации имеет S-образную форму. Плато кривой характерно для насыщенной О2 (сатурированной) артериальной крови, а крутая нисходящая часть кривой – венозной, или десатурированной, крови в тканях. Сродство кислорода к гемоглобину и способность отдавать О2 в тканях зависит от метаболических потребностей клеток организма и регулируется важнейшими факторами метаболизма тканей, вызывающими смещение кривой диссоциации. К этим факторам относятся: концентрация водородных ионов, температура, парциальное напряжение углекислоты и соединение, которое накапливается в эритроцитах – это 2,3-дифосфоглицератфосфат (ДФГ). Уменьшение рН крови вызывает сдвиг кривой диссоциации вправо, а увеличение рН крови – сдвиг кривой влево. Вследствие повышенного содержания СО2 в тканях рН также меньше, чем в плазме крови. Величина рН и содержание СО2 в тканях организма изменяют сродство гемоглобина к О2 . Их влияние на кривую диссоциации оксигемоглобина называется эффектом Бора (Х. Бор, 1904). При повышении концентрации водородных ионов и парциального напряжения СО2 в среде сродство гемоглобина к кислороду снижается. Этот «эффект» имеет важное приспособительное значение: СО2 в тканях поступает в капилляры, поэтому кровь при том же рО2 способна освободить больше кислорода. Образующийся при расщеплении глюкозы метаболит 2,3-ДФГ также снижает сродство гемоглобина к кислороду. Углекислый газ в крови находится в трех фракциях: физически растворенный, химически связанный в виде бикарбонатов и химически связанный с гемоглобином в виде карбогемоглобина. В венозной крови углекислого газа содержится всего 580 мл. При этом на долю физически растворенного газа приходится 25 мл, на долю карбогемоглобина – около 45 мл, на долю бикарбонатов – 510 мл (бикарбонатов плазмы – 340 мл, эритроцитов – 170 мл). В артериальной крови содержание угольной кислоты меньше. Эритроциты переносят в 3 раза больше СО2 чем плазма. Белки плазмы составляют 8 г на 100 см3 крови, гемоглобина же содержится в крови 15 г на 100 см3 . Большая часть СО2 транспортируется в организме в связанном состоянии в виде гидрокарбонатов и карбаминовых соединений, что увеличивает время обмена СО2 .
1.4.3. Регуляция внешнего дыхания
В соответствии с метаболическими потребностями дыхательная система обеспечивает газообмен О2 и СО2 между окружающей средой и организмом. Эту жизненно важную функцию регулирует сеть многочисленных взаимосвязанных нейронов ЦНС, расположенных в нескольких отделах мозга и объединяемых в комплексное понятие "дыхательный центр". При воздействии на его структуры нервных и гуморальных стимулов происходит приспособление функции дыхания к меняющимся условиям внешней среды. Структуры, необходимые для возникновения дыхательного ритма, впервые были обнаружены в продолговатом мозге. Перерезка продолговатого мозга в области дна IV желудочка приводит к прекращению дыхания. Поэтому под главным дыхательным центром понимают совокупность нейронов специфических дыхательных ядер продолговатого мозга. Дыхательный центр управляет двумя основными функциями: двигательной, которая проявляется в виде сокращения дыхательных мышц, и гомеостатической, связанной с поддержанием постоянства внутренней среды организма при сдвигах в ней содержания О2 и СО2 . Двигательная, или моторная, функция дыхательного центра заключается в генерации дыхательного ритма и его паттерна. Благодаря этой функции осуществляется интеграция дыхания с другими функциями. Под паттерном дыхания следует иметь в виду длительность вдоха и выдоха, величину дыхательного объема, минутного объема дыхания. Гомеостатическая функция дыхательного центра поддерживает стабильные величины дыхательных газов в крови и внеклеточной жидкости мозга, адаптирует дыхательную функцию к условиям измененной газовой среды и другим факторам среды обитания.
1.4.3.1. Локализация и функциональные свойства дыхательных нейронов
В передних рогах спинного мозга на уровне СIII – СIV располагаются мотонейроны, образующие диафрагмальный нерв. Мотонейроны, иннервирующие межреберные мышцы, находятся в передних рогах на уровнях ТII – ТX (ТII – ТVI - мотонейроны инспираторных мышц, TVII –TX - экспираторных). Установлено, что одни мотонейроны регулируют преимущественно дыхательную, а другие - преимущественно позно-тоническую активность межреберных мышц. Нейроны бульбарного дыхательного центра располагаются на дне IV желудочка в медиальной части ретикулярной формации продолговатого мозга и образуют дорсальную и вентральную дыхательные группы. Дыхательные нейроны, активность которых вызывает инспирацию или экспирацию, называются соответственно инспираторными и экспираторными нейронами. Между группами нейронов, управляющими вдохом и выдохом, существуют реципрокные отношения. Возбуждение экспираторного центра сопровождается торможением в инспираторном центре и наоборот. Инспираторные и экспираторные нейроны, в свою очередь, делятся на "ранние" и "поздние". Каждый дыхательный цикл начинается с активизации "ранних" инспираторных нейронов, затем возбуждаются "поздние" инспираторные нейроны. Также последовательно возбуждаются "ранние" и "поздние" экспираторные нейроны, которые тормозят инспираторные нейроны и прекращают вдох. Современные исследования показали, что в продолговатом мозге нет четкого деления на инспираторный и экспираторный отделы, а есть скопления дыхательных нейронов с определенной функцией. Спонтанная активность нейронов дыхательного центра начинает появляться к концу периода внутриутробного развития. Возбуждение дыхательного центра у плода появляется благодаря пейсмекерным свойствам сети дыхательных нейронов продолговатого мозга. По мере формирования синаптических связей дыхательного центра с различными отделами ЦНС пейсмекерный механизм дыхательной активности постепенно теряет свое физиологическое значение. В Варолиевом мосту находятся ядра дыхательных нейронов, образующих пневмотаксический центр. Считается, что дыхательные нейроны моста участвуют в механизме смены вдоха и выдоха и регулируют величину дыхательного объема. Дыхательные нейроны продолговатого мозга и Варолиева моста связаны между собой восходящими и нисходящими нервными путями и функционируют согласованно. Получив импульсы от инспираторного центра продолговатого мозга, пневмотаксический центр посылает их к экспираторному центру продолговатого мозга, возбуждая последний. Инспираторные нейроны тормозятся. Разрушение мозга между продолговатым мозгом и мостом удлиняет фазу вдоха. Гипоталамические ядра координируют связь дыхания с кровообращением. Определенные зоны коры больших полушарий осуществляют произвольную регуляцию дыхания в соответствии с особенностями влияния на организм факторов внешней среды и связанными с этим гомеостатическими сдвигами.
1.4.3.2. Рефлекторная регуляция дыхания
Нейроны дыхательного центра имеют связи с многочисленными механорецепторами дыхательных путей и альвеол легких и рецепторов сосудистых рефлексогенных зон. Благодаря этим связям осуществляется весьма многообразная, сложная и биологически важная рефлекторная регуляция дыхания и ее координация с другими функциями организма. Различают несколько типов механорецепторов: медленно адаптирующиеся рецепторы растяжения легких, ирритантные быстро адаптирующиеся механорецепторы и J-рецепторы - "юкстакапиллярные" рецепторы легких. Медленно адаптирующиеся рецепторы растяжения легких расположены в гладких мышцах трахеи и бронхов. Эти рецепторы возбуждаются при вдохе, импульсы от них по афферентным волокнам блуждающего нерва поступают в дыхательный центр. Под их влиянием тормозится активность инспираторных нейронов продолговатого мозга. Вдох прекращается, начинается выдох, при котором рецепторы растяжения неактивны. Рефлекс торможения вдоха при растяжении легких называется рефлексом Геринга - Брейера. Этот рефлекс контролирует глубину и частоту дыхания. Он является примером регуляции по принципу обратной связи. После перерезки блуждающих нервов дыхание становится редким и глубоким. Ирритантные быстро адаптирующиеся механорецепторы, локализованные в слизистой оболочке трахеи и бронхов, возбуждаются при резких изменениях объема легких, при растяжении или спадении легких, при действии на слизистую трахеи и бронхов механических или химических раздражителей. Результатом раздражения ирритантных рецепторов является частое, поверхностное дыхание, кашлевой рефлекс, или рефлекс бронхоконстрикции. J-рецепторы - "юкстакапиллярные" рецепторы легких находятся в интерстиции альвеол и дыхательных бронхов вблизи от капилляров. Импульсы от J-рецепторов при повышении давления в малом круге кровообращения, или увеличении объема интерстициальной жидкости в легких (отек легких), или эмболии мелких легочных сосудов, а также при действии биологически активных веществ (никотин, простагландины, гистамин) по медленным волокнам блуждающего нерва поступают в дыхательный центр - дыхание становится частым и поверхностным (одышка).
Чихание. Раздражение рецепторов слизистой оболочки полости носа, например, пылевыми частицами или газообразными наркотическими веществами, табачным дымом, водой вызывает сужение бронхов, брадикардию, снижение сердечного выброса, сужение просвета сосудов кожи и мышц. Различные механические и химические раздражения слизистой оболочки носа вызывают глубокий сильный выдох - чихание, способствующее стремлению избавиться от раздражителя. Афферентным путем этого рефлекса является тройничный нерв.
Кашель возникает при раздражении механо- и хеморецепторов глотки, гортани, трахеи и бронхов. При этом после вдоха сильно сокращаются мышцы выдоха, резко повышается внутригрудное и внутрилегочное давление (до 200 мм рт. ст.), открывается голосовая щель, и воздух из дыхательных путей под большим напором высвобождается наружу и удаляет раздражающий агент. Кашлевой рефлекс является основным легочным рефлексом блуждающего нерва.
Рефлексы с проприорецепторов дыхательных мышц
От мышечных веретен и сухожильных рецепторов Гольджи, расположенных в межреберных мышцах и мышцах живота, импульсы поступают в соответствующие сегменты спинного мозга, затем в продолговатый мозг, центры головного мозга, контролирующие состояние скелетных мышц. В результате происходит регуляция силы сокращений в зависимости от исходной длины мышц и оказываемого им сопротивления дыхательной системы. Рефлекторная регуляция дыхания осуществляется также периферическими и центральными хеморецепторами, что изложено в разделе гуморальной регуляции.
1.4.3.3. Гуморальная регуляция дыхания
Главным физиологическим стимулом дыхательных центров является двуокись углерода. Регуляция дыхания обусловливает поддержание нормального содержания СО2 в альвеолярном воздухе и артериальной крови. Возрастание содержания СО2 в альвеолярном воздухе на 0,17% вызывает удвоение МОД, а вот снижение содержания О2 на 39-40% не вызывает существенных изменений МОД. При повышении в замкнутых герметических кабинах концентрации СО2 до 5-8% у обследуемых наблюдалось увеличение легочной вентиляции в 7-8 раз. При этом концентрация СО2 в альвеолярном воздухе существенно не возрастала, так как основным признаком регуляции дыхания является необходимость регуляции объема легочной вентиляции, поддерживающей постоянство состава альвеолярного воздуха. Деятельность дыхательного центра зависит от состава крови, поступающей в мозг по общим сонным артериям. В 1890 г. это было показано Фредериком в опытах с перекрестным кровообращением. У двух собак, находившихся под наркозом, перерезали и соединяли перекрестно сонные артерии и яремные вены. При этом голова первой собаки снабжалась кровью второй собаки и наоборот. Если у одной из собак, например у первой, перекрывали трахею и таким путем вызывали асфиксию, то гиперпноэ развивалось у второй собаки. У первой же собаки, несмотря на увеличение в артериальной крови напряжения СО2 и снижение напряжения О2 , развивалось апноэ, так как в ее сонную артерию поступала кровь второй собаки, у которой в результате гипервентиляции снижалось напряжение СО2 в артериальной крови. Двуокись углерода, ионы водорода и умеренная гипоксия вызывают усиление дыхания. Эти факторы усиливают деятельность дыхательного центра, оказывая влияние на периферические (артериальные) и центральные (модулярные) хеморецепторы, регулирующие дыхание. Артериальные хеморецепторы находятся в каротидных синусах и дуге аорты. Они расположены в специальных тельцах, обильно снабжаемых артериальной кровью. Аортальные хеморецепторы на дыхание влияют слабо, и имеют большее значение для регуляции кровообращения. Артериальные хеморецепторы являются уникальными рецепторными образованиями, на которые гипоксия оказывает стимулирующее влияние. Афферентные влияния каротидных телец усиливаются также при повышении в артериальной крови напряжения двуокиси углерода и концентрации водородных ионов. Стимулирующее действие гипоксии и гиперкапнии на хеморецепторы взаимно усиливается, тогда, как в условиях гипероксии чувствительность хеморецепторов к двуокиси углерода резко снижается. Артериальные хеморецепторы информируют дыхательный центр о напряжении О2 и СО2 в крови, направляющейся к мозгу. Центральные хеморецепторы расположены в продолговатом мозге латеральнее пирамид. Перфузия этой области мозга раствором со сниженным рН резко усиливает дыхание, а при высоком уровне рН дыхание ослабевает, вплоть до апноэ. То же происходит при охлаждении или обработке этой поверхности продолговатого мозга анестетиками. Центральные хеморецепторы, оказывая сильное влияние на деятельность дыхательного центра, существенно изменяют вентиляцию легких. Установлено, что снижение рН спинномозговой жидкости всего на 0,01 сопровождается увеличением легочной вентиляции на 4 л/мин. Центральные хеморецепторы реагируют на изменение напряжения СО2 в артериальной крови позже, чем периферические хеморецепторы, так как для диффузии СО2 из крови в спинномозговую жидкость и далее в ткань мозга необходимо больше времени. Гиперкапния и ацидоз стимулируют, а гипокапния и алкалоз – тормозят центральные хеморецепторы. Совокупность дыхательных нейронов следовало бы рассматривать как созвездие структур, осуществляющих центральный механизм дыхания. Таким образом, вместо термина «дыхательный центр» правильнее говорить о системе центральной регуляции дыхания, которая включает в себя структуры коры головного мозга, определенные зоны и ядра промежуточного, среднего, продолговатого мозга, Варолиева моста, нейроны шейного и грудного отделов спинного мозга, центральные и периферические хеморецепторы, а также механорецепторы органов дыхания. Своеобразие функции внешнего дыхания состоит в том, что она одновременно и автоматическая, и произвольно управляемая.
1.4.4. Дыхание в измененных условиях
В различных условиях среды обитания системы нейрогуморальной регуляции дыхания и кровообращения функционируют в тесном взаимодействии как единая кардиореспираторная система. Особенно четко это проявляется при интенсивной физической нагрузке и в условиях гипоксии - недостаточном снабжении организма кислородом. В процессе жизнедеятельности в организме возникают различные виды гипоксии, имеющие эндогенную и экзогенную природу.
1.4.4.1. Дыхание при физической нагрузке
Во время выполнения физической работы мышцам необходимо большое количество кислорода. Потребление О2 и продукция СО2 возрастают при физической нагрузке в среднем в 15 - 20 раз. Обеспечение организма кислородом достигается сочетанным усилением функции дыхания и кровообращения. Уже в начале мышечной работы вентиляция легких быстро увеличивается. В возникновении гиперпноэ в начале физической работы периферические и центральные хеморецепторы как важнейшие чувствительные структуры дыхательного центра еще не участвуют. Уровень вентиляции в этот период регулируется сигналами, поступающими к дыхательному центру главным образом из гипоталамуса, лимбической системы и двигательной зоны коры большого мозга, а также раздражением проприорецепторов работающих мышц. По мере продолжения работы к нейрогенным стимулам присоединяются гуморальные воздействия, вызывающие дополнительный прирост вентиляции. При тяжелой физической работе на уровень вентиляции оказывают влияние также повышение температуры, артериальная двигательная гипоксия и другие лимитирующие факторы.
Наблюдаемые при физической работе изменения дыхания обеспечиваются сложным комплексом нервных и гуморальных механизмов. Однако из-за индивидуально лимитирующих факторов биомеханики дыхания, особенностей экологического портрета человека, не всегда удается при выполнении одной и той же нагрузки полностью объяснить точное соответствие вентиляции легких уровню метаболизма в мышцах.
1.4.4.2. Дыхание при гипоксии
Гипоксией (кислородной недостаточностью) называется состояние, наступающее в организме при неадекватном снабжении тканей и органов кислородом или при нарушении утилизации в них кислорода в процессе биологического окисления. Исходя из этого достаточно точного определения гипоксии, все гипоксические состояния целесообразно разделить на экзогенные и эндогенные. Экзогенная гипоксия развивается в результате действия измененных (в сравнении с обычными) факторов внешней среды. Эндогенная гипоксия возникает при различных физиологических и патологических изменениях в различных функциональных системах организма. Реакция внешнего дыхания на гипоксию зависит от продолжительности и скорости нарастания гипоксического воздействия, степени потребления кислорода (покой и физическая нагрузка), индивидуальных особенностей организма и совокупности генетически обусловленных свойств и наследственных морфофункциональных признаков (экопортрет коренных жителей высокогорья и популяции различных этнических групп). Наблюдаемая в условиях кислородной недостаточности первоначальная гипоксическая стимуляция дыхания приводит к вымыванию углекислоты из крови и развитию дыхательного алкалоза. Гипоксия сочетается с гипокапнией. В свою очередь, это способствует увеличению рН внеклеточной жидкости мозга. Центральные хеморецепторы реагируют на подобный сдвиг рН в цереброспинальной жидкости мозга резким снижением своей активности. Это вызывает настолько существенное торможение нейронов дыхательного центра, что он становится нечувствительным к стимулам, исходящим от периферических хеморецепторов. Наступает своеобразная гипоксическая "глухота". Несмотря на сохраняющуюся гипоксию, постепенно гиперпноэ сменяется непроизвольной гиповентиляцией, что в определенной мере способствует также сохранению физиологически необходимого количества углекислоты. Реакция на гипоксию у коренных жителей высокогорья и у горных животных практически отсутствует, и, по мнению многих авторов, у жителей равнин гипоксическая реакция также исчезает после продолжительной (не менее 3-5 лет) их адаптации к условиям высокогорья. Основными факторами долговременной акклиматизации к условиям высокогорья являются; повышение содержания углекислоты и понижение содержания кислорода в крови на фоне снижения чувствительности периферических хеморецепторов к гипоксии, увеличения плотности капилляров и относительно высокого уровня утилизации тканями О2 из крови. У горцев также возрастают диффузионная способность легких и кислородная емкость крови за счет роста концентрации гемоглобина. Одним из механизмов, позволяющих горцам в условиях гипоксии повысить отдачу кислорода тканям и сохранить углекислоту, является способность повышенного образования у них метаболита глюкозы - 2,3-дифосфоглицерата. Этот метаболит снижает сродство гемоглобина к кислороду.
1.4.4.3. Дыхание при высоком атмосферном давлении
Во время водолазных и кессонных работ человек находится под давлением выше атмосферного на 1 атм. На каждые 10м погружения. В этих условиях увеличивается количество газов, растворенных в крови, и особенно азота. При быстром подъеме водолаза на поверхность физически растворенные в крови и тканях газы не успевают выделиться из организма и образуют пузырьки – кровь «закипает». Кислород и углекислый газ быстро связываются кровью и тканями. Особую опасность представляют пузырьки азота, которые разносятся кровью и закупоривают мелкие сосуды (газовая эмболия), что сопровождается тяжелыми повреждениями ЦНС, органов зрения, слуха, сильными болями в мышцах и в области суставов, потерей сознания. Такое состояние, возникающее при быстрой декомпрессии, называется кессонной болезнью. Пострадавшего необходимо вновь поместить в среду с высоким давлением, а затем постепенно производить декомпрессию. Вероятность возникновения кессонной болезни может быть значительно снижена при дыхании специальными газовыми смесями, например гелиево-кислородной. Гелий почти нерастворим в крови, он быстрее диффундирует из тканей.
1.4.5. Негазообменные функции воздухоносных путей и легких
Воздухоносные пути: полость носа, носоглотка, гортань, трахея, бронхи помимо газотранспортной, выполняют целый ряд других функций. В них происходит согревание, увлажнение, очищение воздуха, регуляция его объема за счет способности мелких бронхов изменять свой просвет, а также рецепция вкусовых и обонятельных раздражителей. Эндотелиальные клетки слизистой оболочки полости носа выбрасывают за сутки до 500 – 600 мл секрета. Этот секрет участвует в выведении из дыхательных путей инородных частиц и способствует увлажнению вдыхаемого воздуха. Слизистая оболочка трахеи и бронхов продуцирует в сутки до 100 – 150 мл секрета. Их выведение осуществляется реснитчатым эпителием трахеи и бронхов. Каждая клетка мерцательного эпителия имеет около 200 ресничек, которые совершают координированные колебательные движения частотой 800-1000 в 1 минуту. Наибольшая частота колебаний ресничек наблюдается при температуре 37° С, снижение температуры вызывает угнетение их двигательной активности. Вдыхание табачного дыма и других газообразных наркотических и токсических веществ вызывает торможение активности мерцательного эпителия. Слизистая оболочка трахеи выделяет такие биологически активные вещества, как пептиды, серотонин, дофамин, норадреналин. Альвеолоциты 1-го порядка вырабатывают поверхностно-активное стабилизирующее вещество сурфактант, о котором упоминалось выше. Снижение продукции сурфактанта приводит к ателектазу – спадению стенок альвеол и выключению определенной доли легкого из газообмена. Подобные нарушения системы дыхания возникают при изменении микроциркуляции и питания легкого, курении, воспалении и отеке, при гипероксии, длительном применении жирорастворимых анестетиков, продолжительной искусственной вентиляции легких и ингаляции чистого кислорода. Нарушения секреторной функции бронхиальных желез и М-холинорецепторов бронхиальной мускулатуры приводит к бронхоспазму, связанному с повышением тонуса кольцевой мускулатуры бронхов и активным выделением жидкого секрета бронхиальных желез, затрудняющему поступление воздуха в легкие. При раздражении β2 -адренорецепторов, например, адреналином, а не норадреналином, взаимодействующим с отсутствующими в мускулатуре бронхов α-адренорецепторами, возникает снижение тонуса бронхов и их расширение. Легкие выполняют фильтрационно-защитную функцию. Альвеолярные макрофаги фагоцитируют попавшие к ним пылевые частицы, микроорганизмы и вирусы. В бронхиальной слизи содержатся также лизоцим, интерферон, протеазы, иммуноглобулин и другие компоненты. Легкие являются не только механическим фильтром, очищающим кровь от разрушенных клеток, сгустков фибрина и других частиц, но и метаболизируют их с помощью своей ферментативной системы. Легочная ткань принимает участие в липидном и белковом обмене, синтезируя фосфолипиды и глицерин и окисляя липопротеазами эмульгированные жиры, жирные кислоты и глицериды до углекислого газа с выделением большого количества энергии. Легкие синтезируют белки, входящие в состав сурфактанта.
В легких синтезируются вещества, относящиеся к свертывающей (тромбопластин) и противосвертывающей (гепарин) системам. Гепарин, растворяя тромбы, способствует свободному кровообращению в легких.
Легкие принимают участие в водно-солевом обмене, удаляя за сутки 500 мл воды. В то же время легкие могут поглощать воду, которая поступает из альвеол в легочные капилляры. Вместе с водой легкие способны пропускать крупномолекулярные вещества, например, лекарственные препараты, которые вводятся непосредственно в легкие в виде аэрозолей или жидкостей через интубационную трубку.
В легких подвергаются биотрансформации, инактивации, детоксикации, ферментативному расщеплению и концентрации различные биологически активные вещества и лекарственные препараты, которые затем выводятся из организма. Так, в легких подвергаются инактивации: ацетилхолин, норадреналин, серотонин, брадикинин, простагландины E1, E2, F. Ангиотензин I превращается в легких в ангиотензин II.
1.4.6. Патологические типы дыхания
Паттерн дыхания существенно меняется при нарушении функции структур мозга, участвующих в регуляции процесса дыхания, а также в условиях гипоксии, гиперкапнии и при их сочетании.
Различают несколько типов патологического дыхания.
Гаспинг, или терминальное редкое дыхание, которое проявляется судорожными вдохами-выдохами. Оно возникает при резкой гипоксии мозга или в период агонии.
Атактическое дыхание, т.е. неравномерное, хаотическое, нерегулярное дыхание. Наблюдается при сохранении дыхательных нейронов продолговатого мозга, но при нарушении связи с дыхательными нейронами Варолиева моста.
Апнейстическое дыхание. Апнейзис – нарушение процесса смены вдоха на выдох: длительный вдох, короткий выдох и снова – длительный вдох.
Дыхание типа Чейна-Стокса: постепенно возрастает амплитуда дыхательных движений, потом сходит на нет и после паузы (апноэ) вновь постепенно возрастает. Возникает при нарушении работы дыхательных нейронов продолговатого мозга, часто наблюдается во время сна, а также при гипокапнии.
Дыхание Биота проявляется в том, что между нормальными дыхательными циклами «вдох-выдох» возникают длительные паузы – до 30 с. Такое дыхание развивается при повреждении дыхательных нейронов Варолиева моста, но может появиться в горных условиях во время сна в период адаптации.
При дыхательной апраксии больной не способен произвольно менять ритм и глубину дыхания, но обычный паттерн дыхания у него не нарушен. Это наблюдается при поражении нейронов лобных долей мозга.
При нейрогенной гипервентиляции дыхание частое и глубокое. Возникает при стрессе, физической работе, а также при нарушениях структур среднего мозга.
Все виды паттернов дыхания, в том числе и патологические, возникают при изменении работы дыхательных нейронов продолговатого мозга и Варолиева моста. Наряду с этим могут развиваться вторичные изменения дыхания, связанные с различной патологией или воздействием на организм экстремальных факторов внешней среды. Например, застой крови в малом круге кровообращения, гипертензия малого круга или амнезия вызывают учащение дыхания (тахипноэ). Дыхание типа Чейна-Стокса часто развивается при сердечной недостаточности.
2. Методический и практический раздел
2.1. Методы функциональной диагностики
2.1.1. Исследование первичных показателей.
Измерение пульса;
Измерение АД: диастолическое, систолическое, пульсовое, среднединамическое;
Измерение минутного объема крови;
Измерение периферического сопротивления;
Измерение ЖЕЛ;
Измерение веса;
Измерение роста;
Динамометрия кисти;
Исследование показателей при проведении тестовых воздействий:
Проба Мартинета – оценка способности к восстановлению после физ. Нагрузки;
Проба с приседанием – характеристика функциональной полноценности сердечно-сосудистой системы;
Проба Флака – позволяет оценить функцию сердечной мышцы;
Проба Руфье – переносимость динамической нагрузки; коэффициент выносливости);
Оценка вегетативного статуса:
Индекс Кердо – степень влияния на сердечно-сосудистую систему вегетативной нервной системы;
Активная ортопроба – уровень вегетативно-сосудистой устойчивости;
Ортостатическая проба – служит для характеристики функциональной полноценности рефлекторных механизмов регуляции гемодинамики и оценки возбудимости центров симпатической иннервации;
Глазосердечная проба – используется для определения возбудимости парасимпатических центров регуляции сердечного ритма;
Клиностатическая проба – характеризует возбудимость центров парасимпатической иннервации.
2.1.2. Описание методик
Подсчет пульса. Измерить частоту сердечных сокращений на лучевой артерии в покое в положении сидя. Показатель нормы: 60 – 80 уд. В мин.
Диастолическое или минимальное давление (ДД). Его высота в основном определяется степенью проходимости прекапилляров, частотой сердечных сокращений и степенью эластичности кровеносных сосудов. ДД тем выше, чем больше сопротивление прекапилляров, чем ниже эластическое сопротивление крупных сосудов и чем больше ЧСС. В норме у здорового человека ДД равно 60—80 мм рт. ст. После нагрузок и различного рода воздействий ДД не меняется или несколько понижается (до 10 мм рт. ст.). Резкое снижение уровня диастолического давления во время работы или, напротив, его повышение и медленный (более 2 мин) возврат к исходным значениям расценивается как неблагоприятный симптом. Показатель нормы: 60 – 89 мм. рт. ст.
Систолическое, или максимальное давление (СД) . Это весь запас энергии, которым фактически обладает струя крови в данном участке сосудистого русла. Лабильность систолического давления зависит от сократительной функции миокарда, систолического объема сердца, состояния эластичности сосудистой стенки, гемодинамического удара и ЧСС. В норме у здорового человека СД колеблется от 100 до 120 мм рт. ст. При нагрузке СД увеличивается на 20—80 мм рт. ст., а после ее прекращения возвращается к исходному уровню в течение 2—3 мин. Медленное восстановление исходных значений СД рассматривается как свидетельство недостаточности сердечно-сосудистой системы. Показатель нормы: 110-139 мм. рт. ст. При оценке изменений систолического давления под влиянием нагрузки сопоставляют полученные сдвиги максимального давления и частоты сердечных сокращений с этими же показателями в покое:
(1) СД = (СДр – СДп)/СДп*100%;
(2) ЧСС = (ЧССр – ЧССп)/ ЧССп*100%, где
СДр, ЧССр – систолическое давление и частота сердечных сокращений при работе;
СДп, ЧССп – те же показатели в покое.
Такое сопоставление позволяет охарактеризовать состояние сердечно-сосудистой регуляции. В норме она осуществляется за счет изменений давления (1 больше 2), при сердечной недостаточности регуляция идет за счет увеличения ЧСС (2 больше 1).
Пульсовое давление (ПД). В норме у здорового человека составляет около 25-30% величины минимального давления. Механокардиография позволяет определить истинную величину ПД, равную разности между боковым и минимальным давлением. При определении ПД с помощью аппарата Рива-Роччи оно оказывается несколько завышенным, так как в этом случае его величина вычисляется вычитанием из максимального давления величины минимального
ПД = СД – ДД.
Среднединамическое давление (СДД). Является показателем согласованности регуляции сердечного выброса и периферического сопротивления. В комплексе с другими параметрами дает возможность определять состояние прекапиллярного русла. В случаях, когда определение АД осуществляется по Н.С. Короткову, СДД можно рассчитать по формулам:
(1) СДД = ПД/3+ ДД
(2) СДД = ДД + 0,42 * ПД.
Величина СДД, рассчитанная по формуле (2), несколько выше. Показатель нормы: 75-85 мм рт. ст.
Минутный объем крови (МО) . Это количество крови, перекачиваемое сердцем за минуту. По МО судят о механической функции миокарда, которая отражает состояние системы кровообращения. Величина МО зависит от возраста, пола, массы тела, температуры окружающего воздуха, интенсивности физической нагрузки. Показатель нормы: 3,5 – 5,0л. Норма МО для состояния покоя имеет довольно широкий диапазон и существенно зависит от методики определения: Наиболее простой способ определения МО, позволяющий ориентировочно определить его величину, определение МО по формуле тара:
СО = 90,97 + 0,54 * ПД – 0,57 * ДД – 0,61В;
МО = СО * ЧСС, где
СО – систолический объем крови, мл; ПД – пульсовое давление, мм рт. ст; ДД – минимальное давление, мм рт. ст.; В – возраст, в годах.
Периферическое сопротивление (ПС) . Обусловливает постоянство среднего динамического давления (или его отклонения от нормы). Рассчитывается по формулам:
ПС = СДД*1330*60/МО
где СДД – среднее динамическое давление, мм рт. ст.;
1330 — коэффициент для перевода мм рт. ст. в дины;
60 — число секунд в минуте.
ПС = 3*СДД/СИ
где СИ — сердечный индекс, равный в среднем 2,2 ±0,3 л/мин-м2
.
Периферическое сопротивление выражается либо в условных единицах, либо в динах. Показатель нормы: 30 – 50 усл. Ед. Изменение ПС при работе отражает реакцию прекапиллярного русла, зависящую от объема циркулирующей крови.
Жизненная емкость легких (ЖЕЛ).
Для сухого спирометра стрелку устанавливают на «0» измерительной шкалы. Взяв в рот мундштук, протертый предварительно спиртом, производят максимальный вдох и выдыхают воздух через спирометр.
Водяной спирометр заполнить водой до нулевой отметки. Стрелку спирометра поставить в нулевое положение, для чего открыть пробку и опустить крышку спирометра. Взяв в рот мундштук, протертый предварительно спиртом, производят максимальный вдох и выдыхают воздух через спирометр.
Исследование повторить три раза и определить среднее значение.
2.1.3. Показатели тестовых воздействий.
Оценка функциональных резервов.
Проба Мартинета – оценка способности к восстановлению после физической нагрузки; Проба с приседанием – характеристика функциональной полноценности сердечно-сосудистой системы;
Проба Флака – позволяет оценить функцию сердечной мышцы;
Проба Руфье – переносимость динамической нагрузки; коэффициент выносливости;
1. Проба Мартинета (упрощенная методика) используется при массовых исследованиях, позволяет оценивать способность сердечно-сосудистой системы к восстановлению после физической нагрузки. В качестве нагрузки в зависимости от контингента обследуемых могут применяться 20 приседаний за 30 с и приседания в том же темпе в течение 2 мин. В первом случае период длится 3 мин, во втором – 5 мин. Перед нагрузкой и спустя 3 (или 5) мин после ее окончания у испытуемого измеряется ЧСС, систолическое и диастолическое давление. Оценка пробы проводится по величине разности исследуемых показателей до и после нагрузки: при разности не более 5 — «хорошо»; при разности от 5 до 10 — «удовлетворительно»; при разности более 10 — «неудовлетворительно».
2. Проба с приседанием. Служит для характеристики функциональной полноценности сердечно-сосудистой системы. Методика проведения: у человека до нагрузки двукратно подсчитывается ЧСС и АД. Затем обследуемый выполняет 15 приседаний за 30 с либо 60 приседаний за 2 мин. Сразу по окончании нагрузки подсчитывают пульс и измеряют давление. Процедура повторяется через 2 мин. При хорошей физической подготовке обследуемого проба в том же темпе может быть продлена до 2 мин. Для оценки пробы применяют показатель качества реакции:
Пкр = (ПД2 – ПД1)/(ЧСС2 – ЧСС1), где
ПД2 и ПД1 – пульсовое давление до и после нагрузки; ЧСС2 и ЧСС1 — частота сердечных сокращений до и после нагрузки.
3. Проба Флака. Позволяет оценить функцию сердечной мышцы. Методика проведения: обследуемый в течение максимально возможного времени поддерживает в U-образной трубке ртутного манометра диаметром 4мм давление 40мм рт. ст. Проба проводится после форсированного вдоха при зажатом носе. Во время ее проведения каждые 5С определяется ЧСС. Оценочным критерием является степень учащения пульса по отношению к исходному, и продолжительность поддержания давления, которое у тренированных людей не превышает 40-50с. По степени учащения пульса за 5С различаются следующие реакции: не более 7 уд. — хорошая; до 9 уд. — удовлетворительная; до 10 уд. — неудовлетворительная. До и после пробы у испытуемого измеряется АД. Нарушение функций сердечно-сосудистой системы ведет к снижению артериального давления иногда на 20 мм рт. ст. и более. Оценка пробы производится по показателю качества реакции:
Пф = (СД1 – СД2)/СД1, где
СД1 и СД2 – систолическое давление исходное и после пробы.
При перегрузке сердечно-сосудистой системы значение ПКР превышает 0,10 – 0,25 отн. Ед. системы.
8. Проба Руфье (переносимость динамической нагрузки)
Обследуемый находится в положении стоя в течение 5 минут. За 15 секунд подсчитывается пульс Р1, после чего выполняется физическая нагрузка 30 приседаний за минуту. Повторно подсчитывается пульс за первые (Р2) и последние (Р3) 15 секунд первой минуты восстановления. При подсчете пульса обследуемый должен стоять. Вычисляемый показатель сердечной деятельности ПСД является критерием оптимальности вегетативного обеспечения сердечно-сосудистой системы при выполнении физической нагрузки малой мощности
Ир = [(Р1 + Р2 + Р3) – 200] / 10
Трактовка пробы: при Ир менее 5 проба выполнена на «отлично»; при Ир менее 10 проба выполнена на «хорошо»; при Ир менее 15 – «удовлетворительно»; при Ир более 15- «плохо».
Проведенные нами исследования, позволяют считать, что у здоровых обследуемых Ир не превышает 12, а больные, имеющие синдром нейроциркулярной дистонии, как правило, имеют Ир более 15. Таким образом, периодический контроль за Ир дает врачу достаточно информативный критерий оценки адаптационного потенциала сердечно-сосудистой системы.
5. Бельгийский тест. Реакция сердечно-сосудистой системы на нагрузку:
В течение полутора минут надо сделать 20 наклонов с опусканием рук. Сосчитать пульс за 10 с. Трижды: до наклонов (Р1), сразу после них (Р2) и через 1 мин (РЗ). Рассчитать показатель, характеризующий работу сердечно-сосудистой системы по формуле: (Р1 + Р2 + РЗ — 33) / 10. Если полученный результат находится в пределах:
· 0-0,3 — отличная оценка;
· 0,31-0,6 — хорошая;
· 0,61-0,9 — средняя;
· 0,91-1,2 — нежелательная;
· более 1,2 — плохая, при которой следует обратиться к врачу.
9. Коэффициент выносливости . Используется для оценки степени тренированности сердечно-сосудистой системы к выполнению физической нагрузки и определяется по формуле:
КВ = (ЧСС* СД* 10) / ПД. ,
где ЧСС — частота сердечных сокращений, уд./мин; ПД — пульсовое давление, мм рт. ст. Показатель нормы: 16 усл. Ед. Увеличение KB, связанное с уменьшением ПД, является показателем детренированности сердечно-сосудистой системы.
7. Определение коэффициента эффективности кровообращения (КЭК) .
КЭК = (CД – ДД) · ЧСС.
В норме КЭК = 2600. При утомлении он возрастает.
10. Индекс Робинсона. Используется для оценки уровня обменно-энергетических процессов в миокарде.
ИР = ЧСС*СД/100
Низкий – более 111, ниже среднего – 110-95, средний – 94-85, выше среднего – 84-70, высокий – менее 70.
11. Индекс Скибинского. Используется для оценки состояния кардиореспираторной системы, определение состояние системы обеспечения кислородом. Сделайте три глубоких вдох – выдох, затем максимально глубокий вдох и задержите дыхание на максимально возможное время. Зафиксируйте время инспираторной задержки (с).
ИС = ЖЕЛ (мл)*Т сек (время задержки дыхания)/ЧСС (уд/мин)
| Оценка состояния кардиореспираторной системы |
Значение индекса |
| Крайне неудовлетворительно Неудовлетворительно Удовлетворительно Хорошо Очень хорошо |
<500 600-1000 1100-2000 2100-4000 >4000 |
2.1.4. Оценка вегетативного статуса
1. Индекс Кердо. Степень влияния на сердечно-сосудистую систему вегетативной нервной системы
ВИ = (1-ДД/ЧСС)*100
• ДД - диастолическое давление, мм рт.ст.;
• ЧСС - частота сердечных сокращений, уд./мин.
Показатель нормы: от – 10 до + 10% Трактовка пробы: положительное значение - преобладание симпатических влияний, отрицательное значение - преобладание парасимпатических влияний.
2. Активная ортопроба (уровень вегетативно-сосудистой устойчивости ). Проба относится к числу функциональных нагрузочных проб, позволяет оценить функциональные возможности сердечно-сосудистой системы, а также состояние ЦНС. Снижение переносимости ортостатических проб (активности и пассивной) часто наблюдается при гипотонических состояниях при заболеваниях, сопровождающихся вегетативно-сосудистой неустойчивостью, при астенических состояниях и переутомлении. Пробу следует проводить сразу после ночного сна. До начала пробы обследуемый должен 10 минут спокойно лежать на спине, без высокой подушки. По истечении 10 минут у обследуемого в положении лежа трижды подсчитывается частота пульса (счет в течение 15с) и определяют величину артериального давления: максимального и минимального. После получения фоновых величин испытуемый быстро встает, принимает вертикальное положение и стоит в течение 5 минут. При этом ежеминутно (во второй половине каждой минуты) просчитывается частота и измеряется артериальное давление. Ортостатическая проба (ОИ - ортостатический индекс) оценивается по формуле, предложенной Бурхардом-Киргофом:
ОИ = СД лежа/CД стоя* ДД стоя /ДД лежа* ЧСС стоя /ЧСС лежа
Трактовка пробы: в норме ортостатический индекс составляет 1,0 - 1,6 относительных единиц. При хроническом утомлении ОИ=1,7-1,9, при переутомлении ОИ=2 и более.
3. Ортостатическая проба
. Служит для характеристики функциональной полноценности рефлекторных механизмов регуляции гемодинамики и оценки возбудимости центров симпатической иннервации.
У обследуемого после 5-минутного пребывания в положении лежа регистрируют частоту сердечных сокращений. Затем по команде обследуемый спокойно (без рывков) занимает положение стоя. Пульс подсчитывается на 1-й и 3-й минуте пребывания в вертикальном положении, кровяное давление определяется на 3-й и 5-й минуте. Оценка пробы может осуществляться только по пульсу или по пульсу и артериальному давлению.
| Оценка ортостатической пробы |
|||
| Показатели |
Переносимость пробы |
||
| хорошая |
удовлетворительная |
неудовлетворительная |
|
| Частота |
Учащение не более чем на 11 уд. |
Учащение на 12-18 уд. |
Учащение на 19 уд. и более |
| Систолическое |
Повышается |
Не меняется |
Снижается в пределах |
| Диастолическое |
Повышается |
Не изменяется или несколько повышается |
Повышается |
| Пульсовое |
Повышается |
Не изменяется |
Снижается |
| Вегетативные |
Отсутствуют |
Потливость |
Потливость, шум в ушах |
Возбудимость центров симпатической иннервации определяется по степени учащения пульса (СУП), а полноценность вегетативной регуляции по времени стабилизации пульса. В норме (у молодых лиц) пульс возвращается к исходным значениям на 3 минуте. Критерии оценки возбудимости симпатических звеньев по индексу СУП представлены в таблице ниже.
| Возбудимость |
Степень учащения пульса % |
| Нормальная: |
18,5-27,7 27,8-36,9 |
4. Глазосердечная проба
. Используется для определения возбудимости парасимпатических центров регуляции сердечного ритма. Проводится на фоне непрерывной регистрации ЭКГ, во время которой надавливают на глазные яблоки обследуемого в течение 15с (в направлении горизонтальной оси орбит). В норме надавливание на глазные яблоки вызывает замедление сердечного ритма. Учащение ритма трактуется как извращение рефлекса, протекающего по симпатикотоническому типу. Можно осуществить контроль частоты сердечных сокращений пальпаторно. В этом случае пульс подсчитывается за 15с до проведения пробы и во время надавливания.
Оценка пробы:
урежение пульса на 4 - 12 уд. в мин – нормальная;
урежение пульса на 12 уд. в мин – резко усиленная;
урежения нет – ареактивная;
учащения – извращенная.
5. Клиностатическая проба
. Характеризует возбудимость центров парасимпатической иннервации.
Методика поведения: исследуемый плавно переходит из положения стоя в положение лежа. Подсчитывают и сравнивают частоту пульса в вертикальном и горизонтальном положениях. Клиностатическая проба в норме проявляется замедлением пульса на 2-8 уд.
Оценка возбудимости центров парасимпатической иннервации:
| Возбудимость |
Степень замедления пульса при клиновидной пробе, % |
| Нормальная: |
|
| слабая |
До 6,1 |
| средняя |
6,2 - 12,3 |
| живая |
12,4 - 18,5 |
| Повышенная: |
|
| слабая |
18,6 - 24,6 |
| заметная |
24,7 - 30,8 |
| значительная |
30,9 - 37,0 |
| резкая |
37,1 - 43,1 |
| очень резкая |
43,2 и более |
6. Проба Летунова.
Определение характера адаптации организма на разнонаправленную нагрузку по особенностям восстановительного периода. Проба состоит из трех нагрузок, выполняемых в определенном порядке с короткими интервалами отдыха:
1. 20 приседаний за 30 секунд. Нагрузка приравнивается к разминке.
2. 15-секундный бег на месте в максимальном темпе, имитируя скоростной бег.
3. 3-минутный (для женщин - 2-минутный) бег на месте в темпе 180 шагов в минуту, имитация работы на выносливость.
В покое определяется ЧСС и АД. Затем обследуемый выполняет первую нагрузку, после чего в установленном порядке в течение трехминутного восстановительного периода вновь регистрируют пульс и АД поминутно. Затем выполняется вторая нагрузка. Восстановительный период - 4 мин. (измерение ЧСС и АД) и далее третья нагрузка, после чего в течение 5 мин исследуется пульс и АД.
Оценка результатов пробы производится по типу ответной реакции: (нормотонический, гипотонический, гипертонический, дистонический и реакция со ступенчатым подъемом максимального АД), а также по времени к характеру восстановления пульса и АД.
Нормотонический тип реакции характеризуется параллелизмом в изменении ЧСС и пульсового давления за счет адекватного повышения максимального АД и снижения минимального АД. Такая реакция свидетельствует о правильной приспособляемости сердечно-сосудистой системы к нагрузкам и наблюдается в состоянии хорошей подготовленности. Иногда в начальные периоды тренировки может иметь место замедление восстановления ЧСС и АД.
Астенический или гипотонический тип характеризуется чрезмерным учащением ЧСС при незначительном подъеме АД и оценивается как неблагоприятный. Такая реакция наблюдается в состоянии перерыва в тренировках в связи с болезнью, травмой.
Гипертонический тип характеризуется чрезмерным повышением ЧСС и АД на нагрузку. Изолированное повышение минимального АД свыше 90 мм рт. ст. также следует расценивать как гипертоническую реакцию. Восстановительный период затягивается. Гипертоническая реакция встречается у гиперреакторов, либо у лиц с гипертонической болезнью, либо при переутомлении и перенапряжении.
Дистонический тип реакции
или феномен "бесконечного тона" характеризуется тем, что практически не удается определить минимальное АД. Если феномен "бесконечного тона" выявляется лишь после 15-секундного максимального бега и минимальное АД восстанавливается в течение трех минут, то к отрицательной оценке его следует относиться с большой осторожностью.
Реакция со ступенчатым подъемом максимального АД - когда оно на второй и третьей минутах восстановительного периода выше, чем на первой минуте, в большинстве случаев свидетельствует о патологических изменениях в системе кровообращения.
1 Результаты исследования записать в протокол.
2 Начертить графически тип ответной реакции.
3 Дать заключение о функциональном состоянии сердечно-сосудистой системы.
Результаты исследования ( проба Летунова)
| Показатели |
Исходные показатели |
20 приседаний |
15 с макс. бега |
3-минутный бег |
|||||||||
| Время отдыха, мин. |
|||||||||||||
| 1 |
2 |
3 |
1 |
2 |
3 |
4 |
1 |
2 |
3 |
4 |
5 |
||
| ЧСС |
|||||||||||||
| СД |
|||||||||||||
| ДД |
|||||||||||||
7. Исследование дермографизма (дерма - кожа, графика - рисование). Проводят тупым предметом с небольшим усилием по коже груди прямую линию. Отмечают появление следовой реакции в виде розовой полосы через 2-3 сек. (нормальный тонус обоих отделов вегетативной нервной системы). В других случаях возможно длительное сохранение белой полосы (превалирование симпатического отдела) или появление ярко-красной полосы (преобладание парасимпатического отдела), или появление отечности в месте исследования.
2.2. Оценка уровня здоровья (по Апанасенко Г.Л.)
С учетом физиологических закономерностей, проявляющихся в зависимости от степени развития физического качества общей выносливости (экономизация функций и расширение физиологических резервов) на основании ряда исследований Г.Л. Апанасенко была разработана экспресс-система оценки уровня здоровья . Она состоит из ряда простейших показателей, которые ранжированы и каждому рангу присвоен соответствующий балл. Общая оценка здоровья определяется суммой баллов и позволяет распределить всех практически здоровых лиц на 5 уровней здоровья, соответствующих определенному уровню аэробного энергетического потенциала.
Чем выше уровень здоровья, тем реже выявляются признаки хронических неинфекционных заболеваний и эндогенных факторов риска.
Для оценки уровня здоровья, измеряются в состоянии покоя:
· жизненная ёмкость легких (ЖЕЛ),
· частота сердечных сокращений (ЧСС),
· артериальное давление (АД),
· масса тела,
· длина тела,
· динамометрия кисти.
Затем выполняется функциональная проба (проба Мартинета). Учитывается время восстановления ЧСС в течение 3 мин.
На основании полученных данных рассчитываются следующие индексы:
Массовый индекс :
Масса тела, кг/(Рост, м2 ), кг / м2
1. Жизненный индекс:
ЖЕЛ, мл/(Масса тела, кг), мл / кг
2. Силовой индекс:
Сила кисти, кг/ Масса тела, кг, %
3. Индекс Робинсона:
(ЧССпок , уд/мин) * (АДсист )/ 100, усл.ед.
4. Функциональная проба (проба Мартинета )
Проба выполняется следующим образом:
· После 3-4 мин отдыха в положении сидя, испытуемый измеряет ЧСС за 10 с, умножив затем полученное число на шесть.
· Выполняется 20 приседаний за 30 с, т.е. в темпе одно приседание за 1,5 с.
· Сразу же после выполненной нагрузки измеряется ЧСС за 6 секунд в положении стоя. Затем полученное число умножается на десять.
· Испытуемый по 10-секундным отрезкам времени в течение 3-х минут измеряет частоту пульса. Фиксируется (в минутах и секундах) момент, когда пульс стал равен исходному уровню. Умножая подсчитанное количество ударов на цифру шесть, обследуемый, получает количество сердечных сокращений за одну минуту, пример (таблица 1).
Полученные результаты по всем перечисленным выше показателям оцениваются в баллах по таблицам 1 и 2, и записываются в сводный протокол результатов. Суммируя баллы, по всем пяти показателям и сопоставляя их со шкалой, испытуемый определяет уровень своего физического здоровья - низкий (1), ниже среднего (2), средний (3), выше среднего (4), высокий (5).
Таблица 1
Оценка уровня физического здоровья мужчин
(по Апанасенко, Науменко, 1988)
| Показатель |
низкий |
ниже |
средний |
выше |
высокий |
| Индекс массы тела |
< =18,9 |
19,0-20,0 |
20,1-25,0 |
25,1-28,0 |
> 28, 0 |
| Баллы |
-2 |
-1 |
0 |
-1 |
-2 |
| Жизненный индекс |
< = 50 |
51-55 |
56-60 |
61-65 |
> 65 |
| Баллы |
-1 |
0 |
1 |
2 |
3 |
| Силовой индекс |
< =60 |
61-65 |
66-70 |
71-80 |
>80 |
| Баллы |
-1 |
0 |
1 |
2 |
3 |
| Индекс Робинсона |
>=111 |
110-95 |
94-85 |
84-70 |
<70 |
| Баллы |
-2 |
-1 |
0 |
3 |
5 |
| Время восстановления ЧСС |
>=180 |
179-120 |
119-90 |
89-60 |
<60 |
| Баллы |
-2 |
1 |
3 |
5 |
7 |
| Общая оценка уровня |
< = 3 |
4-6 |
7-11 |
12-15 |
16-18 |
Таблица 2.
Оценка уровня физического здоровья женщин
(по Апанасенко, Науменко, 1988)
| Показатель |
низкий |
ниже |
средний |
выше |
высокий |
| Индекс массы тела |
< = 16,9 |
17,0-18,6 |
18,7-23,8 |
23,9-26,0 |
>26, 0 |
| Баллы |
-2 |
-1 |
0 |
-1 |
-2 |
| Жизненный индекс |
< = 40 |
41-45 |
46-50 |
51-56 |
>56 |
| Баллы |
-1 |
0 |
1 |
2 |
3 |
| Силовой индекс |
< = 40 |
41-50 |
51-55 |
56-60 |
>60 |
| Баллы |
-1 |
0 |
1 |
2 |
3 |
| Индекс Робинсона |
>=111 |
110-95 |
94-85 |
84-70 |
<70 |
| Баллы |
-2 |
-1 |
0 |
3 |
5 |
| Время восстановления ЧСС |
>=180 |
179-120 |
119-90 |
89-60 |
<60 |
| Баллы |
-2 |
1 |
3 |
5 |
7 |
| Общая оценка уровня |
< = 3 |
4-6 |
7-11 |
12-15 |
16-18 |
Таблица 3
Пример протокола обследования показателей восстановления
| № |
Ф. И. О. |
Покой, 10 с |
1 - я минута |
2-я минута |
3-я минута |
|||||||||||||||
| 10 |
20 |
30 |
40 |
50 |
60 |
10 |
20 |
30 |
40 |
50 |
60 |
10 |
20 |
30 |
40 |
50 |
60 |
|||
| 1. |
Иванов Сергей |
15 |
24 |
20 |
18 |
17 |
16 |
15 |
15 |
15 |
15 |
15 |
15 |
15 |
15 |
15 |
15 |
15 |
15 |
15 |
| 2. |
Сидоров Анатолий |
16 |
24 |
20 |
19 |
18 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
| 3. |
Соловьев Петр |
16 |
25 |
23 |
20 |
19 |
18 |
17 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
| 4. |
Петров Юрий |
18 |
27 |
24 |
20 |
19 |
18 |
18 |
18 |
18 |
18 |
18 |
18 |
18 |
18 |
18 |
18 |
18 |
18 |
18 |
| 5. |
Соколов Андрей |
15 |
25 |
21 |
20 |
19 |
17 |
15 |
15 |
15 |
15 |
15 |
15 |
15 |
15 |
15 |
15 |
15 |
15 |
15 |
| 6. |
Сидоренко Дмитрий |
16 |
22 |
20 |
20 |
19 |
18 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
| 7. |
Козлов Григорий |
13 |
22 |
21 |
20 |
18 |
16 |
14 |
13 |
13 |
13 |
13 |
13 |
13 |
13 |
13 |
13 |
13 |
13 |
13 |
| 8. |
Стрелецкая Оксана |
14 |
24 |
20 |
19 |
18 |
16 |
14 |
14 |
14 |
14 |
14 |
14 |
14 |
14 |
14 |
14 |
14 |
14 |
14 |
| 9. |
Кузнецова Вероника |
16 |
26 |
23 |
20 |
19 |
18 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
16 |
рекомендуемая Литература
Агаджанян И.А. Функции организма в условиях гипоксии и геперкапнии. М.: Медицина, 1986. 270 с.
Адо А.Д. Методологические принципы построения современной теории патологии //Философские и санитарно-гигиеническйе аспекты учения о здоровье и болезни. М.: Медицина, 1975. С.94-136.
Алфеев И.Я. Исследования математических формул, предназначенных для определения физической крепости организма // Воєн.-мед.журн. ноябрь, 1909.
Амосов Н.М. Регулирование жизненных функций и кибернетика. Киев: Наукова думка, 1964. 116 с.
Амосов Н.М., Бендет Я.А. Физическая активность и сердце. Киев: Здоров'я, 1984. 230 с.
Анохин П.К. Очерки по физиологии функциональных систем. М.: Медицина, 1975. 447 с.
Апанасенко Г.Л. Физическое развитие: Методология и практика поиска критериев оценки // Гигиена и санитария. 1981. № 12. С.51-53.
Аланасенко Г.Л. Физическое развитие детей и подростков. Киев: Здоров'я, 1985а. 80 с.
Апанасенко Г.Л. К проблеме трактовки механизмов восстановления после физической нагрузки // Теория и практика физ.культуры. 1985. № 6. С.49-52.
Апанасенко Г.Л. О возможности количественной оценки здоровья человека // Гигиена и санитария. 1985. № 6. С.55-58.
Апанасенко Г.Л., Науменко Р.Г. Соматическое здоровье и максимальная аэробная способность индивида // Теория и практика физкультуры. 1988. № 4. С.29-31.
Апанасенко Г.Л. Термодинамическая концепция профилактики хронических неинфекционных заболеваний //Терапевт . арх. 1990. Т. 62, № l2. С. 56-59.
Апанасенко Г. Л . – Эволюция биоэнергетики и здоровья человека – С.-Пб: МГП «Петрополис», 1992. 123 с.
Аринчин В.Н. Оценка функционального состояния сердца у детей в онтогенезе // Вопр.охраны материнства и детства. 1983. № 2. С.21-23.
Аршавский И.А. Физиологические механизмы и закономерности индивидуального развития. М.; Наука, 1981. 282 с.
Бауэр Э.С. Теоретическая биология. Л.: ВИЭМ, 1935. 206 с.
Банкиров П.И. Учение о физическом развитии человека. М.: Изд-во МГУ, 1962. 340 с.
Брехман И.И . Валеология — наука о здоровье. М.: ФиС, 1990. 208 с.
Васильева В.Е., Демин Д.Ф. Врачебный контроль и ЛФК. М.: ФиС, 1968. 300 с.
Вернадский В.И. Философские мысли натуралиста. М.: Наука, 1988. 567 с.
Геселевич В.А. Медицинский справочник тренера. М.: ФиС, 1981. 250 с.
Казначеев В.П., Баевский Г.И. Индивидуальные особенности адаптационных реакций человека и проблема донозологической диагностики // Тез. докл. Всесоюз. конф. „Адаптация и проблемы обшей патологии". Новосибирск: Б.и., 1974. Т.2. С.9-13.
Меерсон Ф.З. Адаптация, стресс, профилактика. М.: Наука, 1981. 278 с.
Панин Л.Е. Энергетические аспекты адаптации. Л.: Медицина, 1978. 190 с.
Парин В.В., Баевский P.M., Волков Ю.Н. и др. Космическая кардиология. Л.: Медицина,
Шварц В.Б., Хрущев С.В . Медико-биологические аспекты спортивной ориентации и отбора. М.: ФиС, 1984. 150 с.
Шмальгаузен И.И. Организм как целое в индивидуальном и историческом развитии. М.; Наука, 1982. 383 с.
Шмидт Р., Тевс Г, Физиология человека. М.: Мир, 1996.
Шредингер Э. Что такое жизнь (с точки зрения физика). М.: Атомиздат, 1972. 87 с.
Штефко B.C., Островский А.Д. Схема клинической диагностики конституциональных типов. М.; Л.: Госмедиздат, 1929. 79 с.
Щедрина А.Г. Онтогенез и теория здоровья: Методологические аспекты. Новосибирск: Наука. Сиб.отд-ние, 1989. 136 с.