| Скачать .docx |
Реферат: Катодные процессы с водородной деполяризацией
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Российский Государственный Университет нефти и газа
им. И. М. Губкина
Кафедра
Реферат
на тему: «Катодные процессы с водородной деполяризацией»
В ыполнила: студентка МИ-07-1
Самсонова А.Н
Проверил: Васильев А.В.
Москва,2010г
Содержание
1.Электрохимическая коррозия……………………………...2
2.Явление поляризации. Основные факторы, влияющие на коррозионный процесс……………………………………….4
3.Коррозионные процессы с водородной деполяризацией
3.1. Термодинамическая возможность коррозии металлов с водородной деполяризацией…………………………………7
3.2.Схема катодного процесса водородной деполяризации.8
3.3.Особенности коррозии металлов с водородной деполяризацией………………………………………………10
4.Список используемой литературы………………………..12
1. Электрохимическая коррозия.
Электрохимическая коррозия представляет самопроизвольное разрушение металлических материалов вследствие электрохимического взаимодействия их с окружающей электролитически проводящей средой. При этом ионизация ионов атомов металла и восстановление окислительного компонента коррозионной среды протекает не в одном акте и их скорости зависят от величины электродного потенциала металла. Электрохимическая коррозия наиболее распространена. И имеет место при взаимодействии металлов с жидкими электролитами. Такими как водой, водными растворами солей, кислот и щелочей, расплавленными солями и щелочами. И является гетерогенной электрохимической реакцией электролитов. И является гетерогенной электрохимической реакцией электролитов с металлами. [1]
В соответствии с современными представлениями о протекании электрохимических реакций этот процесс в общих чертах можно описать следующим способом:
При погружении металла в раствор электролита поверхность металла адсорбирует молекулы воды. На границе фаз возникает слой, состоящий из нейтральных частиц: атомов металла и связанных с ними в комплексы молекул воды, которой в равной степени принадлежит как самому металлу, так и раствору электролита. В поверхностной фазе возможно перераспределение электронной плотности с образованием положительно заряженных ионов и электронов. В состав положительного заряженных ионов входят и частицы металлов, и молекулы воды, а заряд иона более или менее равномерно распределен по всему иону. В общем виде этот процесс можно выразить уравнением:
![]()
Это уравнение описывает анодное направление электрохимической реакции (анодный процесс). Поскольку в рассматриваемой системе металл обладает только электронной проводимостью, а раствор только ионной, то образовавшиеся при ионизации металла ионы могут быть удалены из зоны реакции только в объем электролита, а электроны в объем металла.
Противоположным анодному является катодное направление(катодный процесс), связанное с таким перераспределением зарядов в граничном слое, при котором из ионов электролита и электронов металла образуются электрически нейтральные частицы, например
![]()
Анодный и катодный процесс это два направления одной и той же реакции, протекающей в поверхностной фазе на границе металла (проводника I-ого рода) и электролитом (проводником II-ого рода). Строго говоря, именно поверхностную фазу нужно рассматривать как электрод. Хотя в практической электрохимии под этим вопросом следует понимать металл, погруженный в раствор электролита.[2]
Первой и основной причиной электрохимической коррозии является термодинамическая неустойчивость металла в данных коррозионных условиях.
Примерами электрохимической коррозии металлов являются:
· Ржавление различных металлических конструкций и изделий в атмосфере(металлических станков и оборудования заводов, стальных мостов, каркасов зданий и т.д.);
· Коррозия наружной металлической обшивки судов в речной и морской воде;
· Ржавление стальных сооружений гидросооружений;
· Ржавление стальных трубопроводов в земле:
· Разрушение баков и других аппаратов растворами кислот, солей, щелочей на химических и других заводах;
· Коррозионные потери металла при кислотном травлении окалины;
· Коррозионные потери металлических деталей при нагревании их в расплавленных солях и щелочах;
· И др.
2. Явление поляризации. Основные факторы, влияющие на коррозионный процесс.
В большинстве случаев приходится отвечать на вопросы, связанные с развитием коррозионного поражения во времени: как долго может работать металлоконструкция в конкретной среде? На какие параметры и как следует повлиять, чтобы продлить срок службы оборудования? Поэтому основной кинетической характеристикой является скорость коррозии. Чтобы оценить влияние различных факторов, обуславливающих скорость, с которой система стремится к равновесию (т.е. коррозирует), необходимо знать равновесное состояние системы. Когда через электрод протекает ток в любом направлении, равновесное состояние электрода нарушается. Потенциал такого электрода изменяется в зависимости от величины внешнего тока и его направления. Направление изменения таково, что препятствует смещению равновесия и, следовательно, протеканию тока независимо от того, приложен ли он извне или создается в самом элементе. Изменение тока, вызываемое протекающим током, называется поляризацией.
Причины, вызывающие поляризацию
В зависимости от причин вызывающих поляризацию, различают три ее вида:
· Концентрационную поляризация;
· Активационная поляризация;
· Омическое падение напряжения.
Рассмотрим причины, которые вызывают непосредственно катодную поляризацию, т. е. отставания процесса ассимиляции электронов от поступления на катодные участки электронов, являются:
1. Замедленность катодной деполяризационной реакции
D + пе [Dne],
которая определяется соответствующим значением энергии активации этой реакции QK, приводит к возникновению электрохимической поляризации ![]() , называемой перенапряжением реакции катодной деполяризации.
, называемой перенапряжением реакции катодной деполяризации.
2. Замедленность диффузии деполяризатора из объема
электролита к катодной поверхности или продукта катодной деполяризационной реакции в обратном направлении, которая приводит
к концентрационной поляризации катода. ![]() Более
Более
подробно явления катодной поляризации будут рассмотрены ниже для наиболее часто встречающихся катодных процессов кислородной и водородной деполяризации
Перенапряжение водорода.
Перенапряжение водорода на катодных участках данного металла является преобладающим видом поляризации, контролирующей скорость коррозии многих металлов в деатированной воде или неокислительных средах. Понятие перенапряжения водорода включает лишь активационную поляризацию, соответствующую реакции
![]()
Причины понижения значений перенапряжения водорода для металла:
1.Повышение температуры (возрастает i0 ). Для металлов, которые корродируют с выделением водорода,- это один из факторов, объясняющих повышение коррозии по мере возрастания температуры.
2.Шероховатость поверхности . На пескоструйной поверхности перенапряжение водорода ниже, чем на полированной. Наблюдаемый эффект объясняется тем, что шероховатая поверхность имеет большую истинную поверхность и большую каталитическую активность.
3.Понижение плотности тока .
Было предположено, что медленной стадией реакции выделения водорода на железе будут:
![]() ;
;
Для металлов с высоким перенапряжением водорода, например Hg и Pb, замедленной стадией, по-видимому будет:
![]() ;
;
Для многих металлов при высоких плотностях тока, замедленная стадия разряда также является контролирующей реакцией. Такой реакцией может быть следующая:
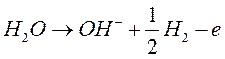 .
.
Скорость образования Н2 из Надс зависит от каталитических свойств поверхности электрода. На хорошем катализаторе, например Pt илиFe,- низкое перенапряжение водорода, а на плохом, например Hg или Pb,- высокое.
Повышенная концентрация водорода на поверхности способствует внедрению атомов водорода в металлическую решетку, что вызывает водородную хрупкость (потерю пластичности) и, кроме того создает в некоторых сплавах железа высокие внутренние напряжения, достаточные, чтобы вызвать самопроизвольное растрескивание (водородное растрескивание).
3.Коррозионные процессы с водородной деполяризацией.
Процессы коррозии металлов, у которых D = Н+, т. е. катодная деполяризация осуществляется водородными ионами по реакци с выделением водорода, называют процессами коррозии металлов с водородной деполяризацией.[3]
1. Термодинамическая возможность коррозии металлов с водородной деполяризацией
С водородной деполяризацией корродируют металлы, соприкасающиеся с растворами кислот, например стальные железнодорожные цистерны, в которых перевозят кислоты, металлические баки и различные аппараты на химических заводах, металлическое оборудование травильных отделений прокатных цехов и цехов гальванических покрытий, в которых осуществляется кислотное травление окалины и ржавчины, травимые в кислотах металлические изделия. просекание процесса коррозии металла с водородной деполяризацией возможно, если ![]() .
.
Коррозия металлов с водородной деполяризацией в большинстве случаев имеет место в электролитах, соприкасающихся с атмосферой, парциальное давление водорода в которой ![]() . Следовательно, при определении термодинамической возможности протекания коррозионных процессов с водородной деполяризацией обратимый потенциал водородного электрода в этих электролитах следует рассчитывать, учитывая реальное парциальное давление водорода в воздухе. При насыщении электролита водородом или повышенном содержании этого газа в соприкасающейся с электролитом атмосфере при расчетах следует учитывать соответствующее парциальное давление водорода.
. Следовательно, при определении термодинамической возможности протекания коррозионных процессов с водородной деполяризацией обратимый потенциал водородного электрода в этих электролитах следует рассчитывать, учитывая реальное парциальное давление водорода в воздухе. При насыщении электролита водородом или повышенном содержании этого газа в соприкасающейся с электролитом атмосфере при расчетах следует учитывать соответствующее парциальное давление водорода.
Коррозия металлов с преобладанием водородной деполяризации имеет место:
1) при достаточной активности водородных ионов в растворе
(например, коррозия железа, цинка и многих других металлов в растворах, серной и соляной кислот);
2) при достаточно отрицательных значениях потенциала металла вследствие очень отрицательного значения ![]() (например, коррозия магния в воде и растворах NaCl) или очень низкой активности ионов
(например, коррозия магния в воде и растворах NaCl) или очень низкой активности ионов ![]() в электролите (например, коррозия свинца, олова и других металлов в щелочных и железа fr сильнощелочных растворах).
в электролите (например, коррозия свинца, олова и других металлов в щелочных и железа fr сильнощелочных растворах).
2.Схема катодного процесса водородной деполяризации
 Катодный процесс водородной деполяризации в кислых средах состоит из следующих стадий (рис, 174):
Катодный процесс водородной деполяризации в кислых средах состоит из следующих стадий (рис, 174):
1) диффузии и миграции гидратированных ионов водорода ![]() к катодным участкам поверхности корродирующего металла;
к катодным участкам поверхности корродирующего металла;
2) разряда водородных ионов:
![]()
3) растворения и диффузии части Надс -атомов в металле;
4)рекомбинации (молизации) водородных атомов:
![]()
или электрохимической десорбции:
![]()
5) диффузии и переноса конвекцией водорода от катодных участков в, глубь раствора, а затем его диффузии в воздух;
6) образования и отрыва пузырька водорода от поверхности
металла: ![]()
В щелочных растворах, в которых концентрация ионов Н+Н2
О крайне мала, коррозия металлов с выделением водорода идет за счет восстановления водорода из молекул воды: ![]() и появляется дополнительная к перечисленным выше стадия отвода ионов ОН~ в глубь раствора. В большинстве случаев коррозии металлов с водородной деполяризацией при высокой концентрации ионов Н+Н20 в растворе концентрационная поляризация вследствие замедленности переноса водородных ионов к катодным участкам незначительна. Это обусловлено большой подвижностью, водородных ионов, наличием дополнительного перемешивания раствора у катода выделяющимся газообразным водородом и дополнительным переносом водородных ионов к катоду миграцией. В нейтральных растворах или при очень больших скоростях коррозии ионная концентрационная поляризация становится
и появляется дополнительная к перечисленным выше стадия отвода ионов ОН~ в глубь раствора. В большинстве случаев коррозии металлов с водородной деполяризацией при высокой концентрации ионов Н+Н20 в растворе концентрационная поляризация вследствие замедленности переноса водородных ионов к катодным участкам незначительна. Это обусловлено большой подвижностью, водородных ионов, наличием дополнительного перемешивания раствора у катода выделяющимся газообразным водородом и дополнительным переносом водородных ионов к катоду миграцией. В нейтральных растворах или при очень больших скоростях коррозии ионная концентрационная поляризация становится
а) замедленность катодной реакции, которая приводит к возникновению
перенапряжения водорода;
б) концентрационная поляризация по молекулярному водороду вследствие замедленности процесса – отвода образующегося молекулярного водорода с поверхности металла, которая наблюдается до насыщения приэлектродного слоя электролита водородом, когда становится возможным выделение его в виде пузырьков, в которых ![]() .[4]
.[4]
3 .Особенности коррозии металлов с водородной деполяризацией
Замедленность катодного процесса заметно влияет на скорость
коррозии металлов с водородной деполяризацией, а во многих
случаях это влияние является главным.
Наиболее затрудненными стадиями катодного процесса,а часто и всего коррозионного процесса, в зависимости от условий коррозии являются разряд водородных ионов и диффузия водорода (диффузионно-кинетический контроль). Относительное значение первой стадии увеличивается с ростом катодной плотности тока (преобладание кинетического контроля).
Особенности коррозии металлов с водородной деполяризацией
следующие:
1) несколько меньшая, чем при коррозии с кислородной деполяризацией, зависимость от перемешивания электролита (сравнительная незначительность ионной при заметной газовой концентрационной поляризации), особенно, в растворах кислот;
2) большая зависимость от рН раствора, так как с уменьшением рН
![]() становится положительнее, перенапряжение в кислых растворах снижается, а в щелочных растет;
становится положительнее, перенапряжение в кислых растворах снижается, а в щелочных растет;
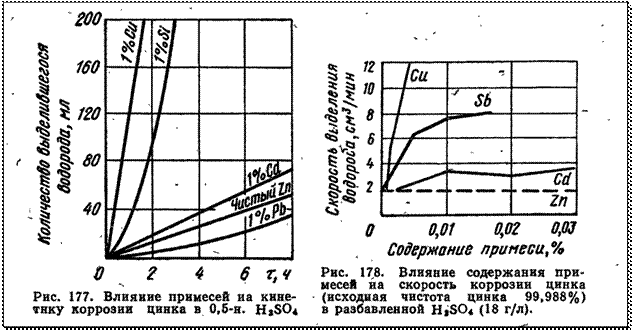
3) большая зависимость от природы и содержания катодных примесей или структурных составляющих сплава: чем ниже перенапряжение водорода на катодных примесях или структурных составляющих сплава и чем больше их содержание, тем больше скорость коррозионного процесса (рис. 177 и 178);
4) большая зависимость скорости коррозии от адсорбции на корродирующем металле различных веществ, влияющих на строение двойного электрического слоя и величину перенапряжения водорода на металле;
5) протекание процесса с ускорением, т. е. с увеличением скорости коррозии во времени (см. рис. 177); это связано с тем, что прохождение катодной реакции разряда водородных ионов облегчается в результате увеличения числа микрокатодов на поверхности корродирующего металла за счет обнажения новых катодных участков по мере растворения металла (рис. 179);
6) большая возможность появления водородной хрупкости металлов. [5]
Список использованной литературы:
1. Жук Н.П. «Курс теории коррозии и защиты металлов»,учебное пособие для вузов- издательство: ООО ТИД «Альянс»,2006 г.-472 стр.
2. Медведева М.Л «Основы электрохимической коррозии и защиты оборудования при транспорте и хранения нефти»,Москва,2004г-80 стр
3. Медведева М.Л. «Коррозия и защита оборудования при переработке нети и газа», Москва-2005г-311 стр
4. Улиг Г. «Коррозия металлов», издательство «Металлургия»-1968г.-308 стр
5. Юхневич Р «Техника борьбы с корозией»,издательство «Химия»-1980г-224стр
[1] Жук Н.П. Курс теории коррозии и защиты металлов: Учебное пособие для вузов-2-е издание/М:ООО ТИД «Альянс»,2006 г-472 стр.(148стр)
[2] Медведева М.Л. «Основы электрохимической коррозии и защиты оборудования при транспорте и хранения нефти и газа», 2004г.
[3] Улиг Г. «Коррозия металлов (основы теории и практики), издательство «Металлургия», 1968, с.308 (51 стр.)
[4] Жук Н.П. «Курс теории коррозии и защиты металлов»,учебное пособие для вузов-издательство:ООО ТИД «Альянс»,2006 г.-472 стр.
[5] Жук Н.П. «Курс теории коррозии и защиты металлов»,учебное пособие для вузов-издательство:ООО ТИД «Альянс»,2006 г.-472 стр.(260стр)