| Скачать .docx |
Реферат: Затвердевание сплавов Строение жидкого металла Термодинамические стимулы и кинетические возможности
Министерство образования и науки Украины
Донбасский государственный технический университет
Кафедра ОМД
КОНТРОЛЬНАЯ РАБОТА
по дисциплине "Металловедение"
на тему:
"Затвердевание сплавов. Строение жидкого металла. Термодинамические стимулы и кинетические возможности процесса затвердевания. Влияние переохлаждения и примесей на процесс кристаллизации"
Алчевск 2009
1. Жидкое и твёрдое состояние
Все вещества могут находиться в трёх агрегатных состояниях: твёрдое, жидкое и газообразное. Переход между ними сопровождается скачкообразным изменением свободной энергии, энтропии, плотности и других физических свойств.
Реализация агрегатного состояния вещества зависит от температуры (Т ) и давления (Р ), при которых оно находится.
В газах межмолекульные расстояния большие, молекулы не взаимодействуют друг с другом. У газа отсутствует объём и форма.
Жидкости и твёрдые тела имеют постоянный, собственный объём (т. к. атомы взаимодействуют друг с другом).
В жидкости происходят малые колебания атомов вокруг равновесных положений и частые перескоки из одного равновесного положения в другое. Жидкое состояние характеризуется ближним порядком в расположении атомов. Жидкости характерна некоторая зависимость в расположении атомов; характерное свойство жидкости – текучесть. Ближний порядок динамически неустойчив. С повышением температуры размеры объемов с ближним порядком (фазовых флуктуаций), уменьшаются.
Атомы в твердом теле совершают только малые колебания около своих равновесных положений. Это приводит к правильному чередованию атомов в пространстве на одинаковых расстояниях для сколь угодно далеко удаленных атомов, т.е. существует дальний порядок в расположении атомов; образуется кристаллическая решетка. Твердому телу характерна стабильная, постоянная форма.
2. Термодинамические условия кристаллизации
Переход металла из жидкого состояния в твёрдое (кристаллическое) называется кристаллизацией.
Кристаллизация (или плавление) протекает в условиях, когда система переходит к термодинамическому более устойчивому состоянию с меньшей свободной энергией.
Энергетическое состояние системы, характеризуется термодинамической функцией F, называемой свободной энергией (это только часть системы):
F = U – TS,
где U – полная энергия;
T – абсолютная температура К0 ;
S – энтропия (характеризует степень порядка; чем больше беспорядок, тем больше энтропия).
Изменение свободной энергии жидкого и твердого состояний в зависимости от температуры показано на рис. 1.

Рисунок 1. Изменение свободной энергии металла в жидком (FЖ ), в твердом (FТ ) состоянии в зависимости от температуры
Система с большой свободной энергией менее устойчива, и, следовательно, стремится перейти к устойчивому состоянию с минимальной свободной энергией. Выше температуры ТП устойчив жидкий металл (при Т1 →Fж <Fт ), имеющий меньший запас свободной энергии, ниже этой температуры устойчив твердый металл (при Тк → Fт < Fж ).
При ТП величины свободных энергий жидкого и твердого состояний равны: Fж = Fт . Температура ТП – равновесная температура кристаллизации (плавления) вещества, при которой обе фазы (жидкая и твердая) могут (Fж = Fт) существовать одновременно и бесконечно долго. Процесс кристаллизации при этой температуре не начинается.
Кристаллизация начнется, при создании специальных условий, когда возникнет разность свободных энергий Δf, то есть вследствие уменьшения свободной энергии твердого металла по сравнению жидким.
Следовательно, процесс кристаллизации может протекать только при переохлаждении металла ниже ТП .
Разность между температурами ТП и Тк , при которых может протекать кристаллизация, носит название степени переохлаждения:
Δ Т = ТП – Т к
где Т к – фактическая температура кристаллизации.
Кристаллизация может характеризоваться термическими кривыми охлаждения (рис. 2). Рассмотрим процесс кристаллизации чистых металлов с разной скоростью охлаждения.
Скорость V1 – очень медленное охлаждение, степень переохлаждения ΔТ1 – невелика, кристаллизация протекает при температуре близкой к равновесной ТП .
На кривой охлаждения имеется горизонтальная площадка, образование которой объясняется выделением скрытой теплоты кристаллизации, несмотря на отвод теплоты при охлаждении.
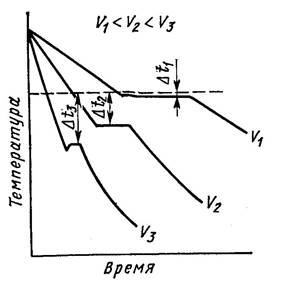
Рисунок 2. Кривые охлаждения при кристаллизации металла
С увеличением скорости охлаждения (V2 , V3 ) степень переохлаждения возрастает, кристаллизация протекает при температуре значительно ниже равновесной ТП . Для металлов степень переохлаждения обычно 10–300 С.
Процесс кристаллизации, как установил Д.К. Чернов, начинается с образования кристаллических зародышей (центров кристаллизации) и продолжается в процессе роста их числа и размеров. Таким образом, процесс кристаллизации состоит из двух элементарных процессов: 1-й – зарождение зародышей, 2-й – их рост. В первоначальный момент кристаллы растут свободно, имея правильную форму; однако при столкновении растущих кристаллов их правильная форма нарушается.

Рисунок 3. Схема кристаллизации металла

Рисунок 4. Кинетическая кривая кристаллизации
3. Самопроизвольное образование зародышевых центров
Наиболее сложным в процессе кристаллизации является представление по зарождению центров кристаллизации. С понижением температуры степень ближнего порядка в жидкости и размер таких микрообъемов возрастают. При температуре близких к Тк (ТП ), в жидком металле возможно образование небольших группировок, в которых атомы упакованы так же, как и в кристаллах. Такие группировки называют фазовыми (или гетерофазными) флуктуациями. Эти флуктуации превращаются в зародыши (центры кристаллизации).
Возникающие зародыши могут быть различной величины. Рост зародышей возможен, если они достигли определенной величины, начиная с которой их рост ведет к уменьшению свободной энергии (рис. 5).
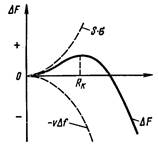
Рисунок 5. Изменение свободной энергии металла при образовании зародышей кристалла в зависимости от их размера
Изменение свободной энергии:
ΔFобщ = – VΔf + Sσ
где V – объем зародыша,
Δf – разность (Fж – Fт ) металла,
S – суммарная величина поверхности кристаллов,
σ – поверхностное натяжение.
В процессе кристаллизации свободная энергия системы, с одной стороны уменьшается за счет перехода жидкого металла в твердый на VΔf, а с другой стороны, возрастает в результате образования поверхности раздела с избыточной поверхностной энергией, равной Sσ.
Минимальный размер зародыша Rк , способного к росту при данных температурных условиях, называется критическим размером зародыша (зародыш – критический или равновесный): Rк = 2σ/Δf.
С увеличением степени переохлаждения Rк уменьшается (за счет увеличения Δf) (рис. 6), и следовательно возрастает число зародышей (центров) кристаллизации и скорость образования этих зародышей.

Рисунок 6. Изменение свободной энергии металла при образовании зародышей кристалла в зависимости от степени переохлаждения
Рост кристаллов (зародышей) происходит поступлением из жидкости двумерного зародыша на поверхность кристалла, или присоединением атомов к ступенькам винтовой дислокации и другим деферентам.
4. Влияние переохлаждения на процесс кристаллизации
Скорость процесса кристаллизации и строение металла после затвердевания зависят от числа зародышей ч.з. (центров кристаллизации), возникающих в единицу времени и в единице объема, то есть от скорости образования зародышей [1/см3 ×с] и скорости роста с.р. зародышей (увеличения линейных размеров растущего зародыша в единицу времени (мм/с).
Чем больше скорость образования зародышей и чем больше скорость их роста, чем выше эти факторы, тем быстрее протекает процесс кристаллизации.
При ТП – ч.з. и с. р. равны нулю, и поэтому процесс кристаллизации не происходит.
С увеличением степени переохлаждения ч.з. и с.р. возрастают, при определенной ΔТ достигают максимума, после чего снижаются (рис. 7).

Рисунок 7. Зависимость параметров кристаллизации ч.з. и с.р. от степени переохлаждения
В условиях когда ΔТ1 < ΔТ2 < ΔТ3 будет получено:
при ΔТ1 – крупное зерно;
ΔТ2 – чуть мельче;
ΔТ3 – максимальное измельчение структуры.
С увеличением ΔТ скорость образования зародышей, а следовательно, их число возрастают быстрее, чем скорость роста, это объясняется диффузиционными процессами, которые замедляются при низких температурах (больших Δ Т).
Чем больше скорость образования зародышей (ч.з. ) и меньше скорость их роста, тем меньше размер кристалла (зерна), выросшего из зародыша, структура металла будет мелкозернистой.
Величина зерна определяется:
S = 1,1 (с.р. /ч.з. )3/4
При малой ΔТ число зародышей мало, получено будет крупное зерно.
С увеличением ΔТ число зародышей возрастет (скорость образования зародышей) и размер зерна металла уменьшается.
Зерно металла (его размер) влияет на пластичность и вязкость. Чем меньше размер зерна, тем выше эти свойства у металлов.
6. Гетерогенное образование зародышей. Влияние примесей на процесс кристаллизации
Часто источником образования зародышей являются всевозможные твердые частицы (примеси – неметаллические включения, окислы и т.д.). Частицы примеси должны иметь одинаковую кристаллическую решетку с затвердевающим металлом, параметры решетки могут отличаться не более чем на 9%.
Наличие примесей приводят и уменьшают размер Rк , работы его образования, затвердевание жидкости начинается при меньшем ΔТ, чем при самопроизвольном зарождении.
Чем больше примесей, тем больше центров кристаллизации, тем мельче получается зерно (гетерогенное образование зародышей).
Примеси делятся:
1) влияющие на число зародышей (взвешенные примеси);
2) изменяющие свободную энергию системы (растворенные примеси в жидком металле – при затвердевании осаждаются в виде тонкого слоя на поверхности растущего кристалла, что приводит к уменьшению поверхностной энергии);
Модифицирование – использование специально вводимых в жидкий металл примесей (модификаторов) для получения мелкого зерна по описанному выше механизму.
Эти примеси не изменяют химического состава сплава, но измельчают зерно, улучшая свойства металла.
Виды примесей:
1) тугоплавкие соединения (влияют на число центров кристаллизации – ТiC, VC, VN, NbC, Al2 O3 – нитриды, карбиды, оксиды – кристаллизуются в первую очередь); для стали применяют – Al, V, Ti;
2) поверхность активные модификаторы: для никелевых и железных сплавов – В (бор), для чугуна Мg (магний).
7. Форма кристаллических образований
Реально протекающий процесс кристаллизации усложняется действием различных факторов, таких как: скорость и направление отвода тепла, наличие нерастворившихся частиц, конвекционные потоки жидкости, степень переохлаждения и так далее.
Кристаллы, образующиеся в процессе затвердевания металла, могут иметь различную форму. Чаще в процессе кристаллизации образуются разветвленные, или древовидные, кристаллы, получившие название дентритов (рис. 8).

Рисунок 8. Схема дендритного кристалла (а) и роста дендритов (б)
В направлении отвода тепла кристалл растет быстрее, чем в другом направлении. Это приводит к тому, что первоначально образуются длинные ветви – оси первого порядка. Одновременно на ребрах осей первого порядка зарождаются и растут перпендикулярные к ним такие же ветви второго порядка и так далее.
Кристаллы дендритной формы можно видеть непосредственно на поверхности отливки в виде характерного рельефа или на поверхности усадочной раковины, в местах недостаточного подвода жидкости. Правильная форма дендритов искажается в результате столкновения и срастания частиц на поздних стадиях процесса.
Дендритное строение типично для литого металла. Если условия благоприятны, охлаждение медленное, то могут вырасти огромного размера, дендриты. В усадочной раковине 100-т слитка был обнаружен дендрит длиной 39 см («Кристалл Чернова») (рис. 9). Чем быстрее охлаждение при кристаллизации, тем меньше размеры (высота) дендрита и меньше расстояние между ветвями второго порядка.
В зависимости от скорости охлаждения жидкого металла зерна могут иметь равноосную (глобулярную) и столбчатую (вытянутую) форму.
Литература
1. Лахтин Ю.М., Леонтьева В.П. Материаловедение. М., 1972, 1980
2. Гуляев А.П. Металловедение. М., 1986
3. Антикайн П.А. Металловедение. М., 1972