| Похожие рефераты | Скачать .docx | Скачать .pdf |
Курсовая работа: Применение радионуклидов в ядерной медицине
Применение радионуклидов в ядерной медицине
Введение
Достижения в области физики атомного ядра оказывают очень большое влияние на развитие почти всех отраслей человеческого знания. Овладение атомной энергией дало в руки ученых самых разнообразных специальностей новые средства и способы научного исследования. Неизмеримо выросли возможности научного познания. Научная медицина с самого своего зарождения черпает в физике и химии новые идеи и средства для предупреждения болезней и борьбы с ними. Стоит напомнить, например, что открытие в конце прошлого века рентгеновских лучей привело к тому, что теперь без рентгеновского аппарата не обходится даже небольшое лечебное учреждение. Исключительное значение имеет для медицины использование атомной энергии. Эта отрасль науки обогатилась новыми, весьма ценными методами изучения жизненных процессов, диагностики и лечения болезней.
Областью массового использования радионуклидов является ядерная медицина. На ее нужды расходуется более 50 % годового производства радионуклидов во всем мире. Как известно, в состав живого организма входят, помимо 5 основных элементов (кислорода, водорода, углерода, азота и кальция), еще 67 элементов периодической системы Менделеева, поэтому в настоящие время трудно представить клинику у нас или за рубежом, в которой при установлении диагноза заболевания не использовались бы различные радиоактивные препараты и меченные ими соединения. Радионуклиды применяются в ядерной медицине в основном в виде радиофармацевтических препаратов (РФП) для ранней диагностики заболеваний различных органов человека и для целей терапии. Радиофармацевтическим препаратом (РФП) называется химическое соединение, содержащие в своей молекуле определенный радиоактивный нуклид, разрешенное для введения человеку с диагностической или лечебной целью. Отличительной особенностью диагностического РФП при этом является отсутствие фармакологического эффекта. Облучение в медицине направлено на исцеление больного. Однако нередко дозы оказываются неоправданно высокими. Пациент должен получать минимальную дозу при обследовании. В связи с этим одной из важнейших задач, стоящих перед разработчиками РФП, является снижение доз облучения пациентов во время проведения различных исследований с использованием радионуклидов, то есть выбор таких радионуклидов и меченных ими соединений, применение которых позволяет получать необходимую диагностическую информацию при минимально возможных дозах облучения пациентов.
Систематически радионуклиды для медицинских целей стали применять с начала 40-х годов. Именно тогда была установлена строгая закономерность распределения радиоактивного йода при различных патологических состояниях щитовидной железы. В дальнейшем, использование соединений, меченных радиоактивными нуклидами, позволило определить локализацию и размеры первичных опухолей, выявить распространение опухолевых процессов, контролировать эффективность лекарственного лечения. Благодаря большому разнообразию радионуклидов и меченных ими препаратов в настоящее время можно изучать практически любую физиологическую и морфологическую системы организма человека: сердечно-сосудистую и кроветворную, мочевыделительную и водно-солевого обмена, дыхательную и пищеварительную, костную и лимфатическую и т.п.
1. Радиоактивность и радиоактивные изотопы
Радиоактивные изотопы и соединения, меченные радиоактивными изотопами, широко применяются в самых разных областях человеческой деятельности. Промышленность и технологический контроль, сельское хозяйство и медицина, средства связи и научные исследования — охватить весь спектр применения радиоактивных изотопов практически невозможно, хотя все они возникли чуть более, чем за 100 лет.
Радиоактивность ( radioactivity) — это обозначение удивительного явления природы, открытого Беккерелем в конце XIX века, суть которого заключается в самопроизвольном спонтанном превращении атомных ядер некоторых элементов в другие, которое сопровождается выделением трёх видов "лучей".
Природу лучей установили быстро: α-лучи — это двукратно ионизированные атомы гелия, β-лучи — это электроны, γ-лучи — это жесткое коротковолновое электромагнитное излучение. Элементы, способные к таким превращениям стали называться радиоактивными, т.е. способными к этому превращению. В зависимости от типа излучения, радиоактивные атомы стали определять соответственно как α, β или γ излучатели или источники. Правда, вскоре было установлено, что некоторые радиоактивные атомы излучают сразу два (а возможно, и три) вида лучей, поэтому такая классификация дополняется пояснениями — это "чистый" α-излучатель или имеется сопутствующее γ-излучение.
К первоначальным трём типам ядерных превращений (α, β и γ — радиоактивный распад) добавились новые, однако, общие закономерности для всех остались неизменными. В конце ХХ века было рекомендовано термин "изотоп" заменить на "нуклид" и, соответственно, "радиоактивный изотоп" на "радионуклид".[3]В 1808 английский ученый натуралист Джон Дальтон впервые ввел определение химического элемента как вещества, состоящего из атомов одного вида. В 1869 химиком Д.И.Менделеевым была открыт периодический закон химических элементов.
Одна из трудностей в обосновании понятия элемента как вещества, занимающего определенное место в клетке периодической системы, заключалась в наблюдаемой на опыте нецелочисленности атомных весов элементов. В 1866 английский физик и химик – сэр Вильям Крукс выдвинул гипотезу, что каждый природный химический элемент представляет собой некоторую смесь веществ, одинаковых по своим свойствам, но имеющих разные атомные масс, однако в то время такое предположение не имело еще экспериментального подтверждения и поэтому прошло мало замеченным. Важным шагом на пути к открытию изотопов стало обнаружение явления радиоактивности и сформулированная Эрнстом Резерфордом и Фредериком Содди гипотеза радиоактивного распада: радиоактивность есть не что иное, как распад атома на заряженную частицу и атом другого элемента, по своим химическим свойствам отличающийся от исходного.
В результате возникло представление о радиоактивных рядах или радиоактивных семействах, в начале которых есть первый материнский элемент, являющийся радиоактивным, и в конце – последний стабильный элемент. Анализ цепочек превращений показал, что в их ходе в одной клеточке периодической системы могут оказываться одни и те же радиоактивные элементы, отличающиеся лишь атомными массами. Фактически это и означало введение понятия изотопов.В настоящее время известно 106 химических элементов. Из них только 81 элемент имеет как стабильные, так и радиоактивные изотопы. Для остальных 25 элементов известны только радиоактивные изотопы. В общей сложности в настоящее время доказано существование около 1700 нуклидов, причем число изотопов, известных для отдельных элементов, колеблется от 3 (для водорода) до 29 (для платины). Из этих нуклидов только 271 нуклид стабилен, остальные радиоактивные. Около 300 из них находят или могут найти практическое применение в различных сферах человеческой деятельности. Основные источники производства радионуклидов для ядерной медицины следующие: ядерные реакторы, ускорители заряженных частиц, как правило, циклотроны и радионуклидные генераторы (как вторичный источник). В мировом объеме производства радионуклидов громадная его часть -–на ускорителях заряженных частиц, которые в большинстве своем являются циклотронами различных типов и уровней. Этот факт обычно связывают с большим количеством исследовательских их доступностью в самые первые годы развития ядерной медицины на рубеже 40-х и 50-х годов, а также с дешевизной производства на них большинства радионуклидов. К середине 80-годов ежегодная наработка радионуклидов только для ядерной медицины на реакторах всего мира достигла в стоимостном выражении 500 млн. долларов.
Однако за последние два десятилетия обнаруживается существенный рост в использовании ускорителей заряженных частиц для указанных целей, который обьясняется более приемлемыми ядерно-физическими характеристиками получаемых с их помощью нейтронодефицитных радионуклидо.[4]
Радиация по самой своей природе вредна для жизни. Малые дозы облучения могут «запустить» не до конца еще установленную цепь событий, приводящую к раку или к генетическим повреждениям. При больших дозах радиация может разрушать клетки, повреждать ткани органов и явиться причиной скорой гибели организма.
Повреждения, вызываемые большими дозами облучения, обыкновенно проявляются в течение нескольких часов или дней. Раковые заболевания, однако, проявляются спустя много лет после облучения – как правило, не ранее чем через одно – два десятилетия. А врожденные пороки развития и другие наследственные болезни, вызываемые повреждением генетического аппарата, по определению появляются лишь в следующем или последующем поколениях: это дети, внуки и более отдаленные потомки индивидуума, подвергшегося облучению. За единицу активности (радиоактивности) радиоактивного вещества в Международной системе СИ принята скорость радиоактивного распада, равная 1 распаду в секунду, которая получила название беккерель — Бк (в английской версии Bq). Устаревшая, но по-прежнему используемая единица активности кюри — Ки (в английской версии Ci) — это активность препарата, эквивалентная активности 1 г металлического радия-226 и равная 3,7х1010 распадов в секунду, т.е. 3,7х1010 Бк.
Радиоактивный распад — это превращение ядра атома радиоактивного элемента, которое сопровождается выделением продуктов такого превращения. Например, электронный захват представляет собой поглощение электрона ядром с выделением г-кванта, и такой тип "радиоактивного распада" более точно следует называть "ядерным превращением". Впрочем, оба термина используются в литературе на равных, несмотря на предпочтительность "ядерного превращения".Природная радиоактивность обусловлена радиоактивными изотопами естественного происхождения, присутствующими во всех оболочках земли — литосфере, гидросфере, атмосфере и биосфере. Сохранившиеся на нашей планете радиоактивные элементы условно могут быть разделены на три группы:
1. радиоактивные изотопы, входящие в состав радиоактивных семейств, родоначальниками которых являются уран (U238 ), торий (Th232 ) и актиний–уран (AcU235 );
2. генетически не связанные с ними радиоактивные элементы: калий (К40 ), кальций (Ca48 ), рубидий (Rb87 ) и др;
3. радиоактивные изотопы, непрерывно возникающие на земле в результате ядерных реакций, под воздействием космических лучей. Наиболее важные из них — углерод (С14 ) и тритий (Н3 ).Естественные радиоактивные вещества широко распространены во внешней среде. Это в основном долгоживущие изотопы с периодом полураспада 108 –1016 лет. В процессе распада они испускают a- и b-частицы, а также g-лучи.Радиоактивные изотопы имеют широкий спектр применения.Метод меченых атомов для исследования биологических процессов в организме основан на том, что химические свойства всех изотопов одинаковы, а обнаружить радиоактивный (меченый) атом очень легко. Метод применяется в биологии, физиологии, медицине. Радиоактивные изотопы — источники излучений. Эти изотопы применяются в медицине для постановки диагноза и лечения злокачественных опухолей. Радиоактивные изотопы применяются в сельском хозяйстве для селекции.
2. Радионуклидная диагностика
Радионуклидная диагностика – один из видов лучевой диагностики, основанный на внешней радиометрии излучения, исходящего из органов и тканей после введения радиофармацевтических препаратов непосредственно в организм пациента. Это метод функциональной визуализации, позволяющий качественно и количественно оценить наличие функционирующей ткани в исследуемом органе. Особенности технологий ядерной медицины - распознавание патологического процесса на молекулярном уровне, в ряде случаев на доклинической стадии. Технологии радионуклидной диагностики являются функциональными и физиологичными (т.е. не влияющими на течение нормального или патологического процесса жизнедеятельности органа и системы, который они отражают).
Радионуклидная диагностика основана на дистанционной радиометрии и использовании радиофармпрепаратов (РПФ), отличительная черта которых – способность накапливаться и распределяться в исследуемом органе в зависимости от наличия функционирующей ткани и отражать динамику протекающих в органе процессов. Когда радиоактивный изотоп вводят в организм человека, появляется возможность с помощью счетчика измерить создаваемое излучение и определить локализацию, количество и характер распределения введенного изотопа. Подобная информация неоценима для диагностики ряда медицинских нарушений. Благодаря высокой чувствительности счетчиков, определяющих излучение, в организм человека вводят очень небольшое количество радиоактивных веществ. Поэтому подобные обследования проводят при довольно низких дозах облучения тканей, что одновременно означает необходимость введения очень небольшой массы радиопрепарата. Во многих происходящих в организме процессах, особенно включающих взимодействие с гормонами или витаминами, нормальное равновесие веществ легко нарушить. Радиоактивное же обследование редко когда требует введения более чем 1 мкг (одна миллионная часть грамма) вещества, путь которого в организме необходимо проследить, что не приведет к нарушению указанного выше нормального равновесия. Это ценное качество радиоизотопного метода, которое используют при проведении медицинских и биологических исследований. Радионуклидная диагностика – это метод диагностики основанный на введении пациенту радиофармакологического препарата (РФП), обладающего следующими свойствами: 1.тропностью (сродством) к исследуемому органу или ткани (например, участие в метаболизме исследуемой ткани) 2. наличие радиоактивной метки, позволяющей определить динамику и количество накопившегося РФП с помощью внешнего датчика.Радиофармацевтическим препаратом называется химическое соединение, предназначенное для введения человеку с диагностической или лечебной целью и содержащее в своей молекуле определенный радиоактивный нуклид. Он вводится в организм вместе с фармацептическими препаратами, при помощи инъекции, заглатывания или ингаляции. Это не больно и безопасно, а эффект феноменален: слабое радиоизлучение, идущее из организма, дает точнейшую информацию о различных органах и возможных патологиях; получение подобной информации другими способами требует дорогостоящих исследований или хирургического вмешательства, либо вовсе невозможно. Уникальность метода состоит в том, что радиоизлучение идет изнутри органа, а не транслируется извне, как при использовании рентгена, компьютерной томографии или отображения магнитного резонанса (излучателем является не внешнее устройство, а т.н. радиоизотоп - радиоактивная часть вводимого в организм препарата) . Это позволяет исследовать интересующий орган на более высоком уровне: полученная картина отображает не только анатомические аномалии, как в вышеупомянутых случаях, но и биологические процессы.Ядерная медицина использует гамма-лучи, подобные х-излучению, используемому в рентгеноскопии. Слабое излучение, идущее из исследуемого органа, фиксируется специальной камерой, которая устанавливается в нескольких сантиметрах от тела пациента. Это занимает несколько минут, камеры работают бесшумно, не беспокоя обследуемого, а получаемая информация может оказаться незаменимой в целом ряде случаев: при исследовании работы сердца и кровообращения в головном мозге, в исследованиях клеток головного мозга, адекватности работы почек, легких и желудка, усвояемости витаминов и исследования плотности костной ткани. Ядерная медицина позволяет обнаружить мельчайшие костные переломы до того, как они станут заметны при помощи рентгена. Она также может идентифицировать рак и возможность его излечимости, локализовать эпилептические схватки, болезнь Паркинсона и Альцхеймера, последствия сердечного приступа и состояние трансплантированных органов.В конце 20-х годов ХХ века впервые были использованы меченые соединения в клинической практике. Тогда Блюмгарт и Вейз в 1927 г. опубликовали работы по использованию газа радона для определения гемодинамики у больных с сердечной недостаточностью. Появление в распоряжении у медиков радиоактивно меченных атомов открыло целую область, известную как радиоизотопная медицина и уже вступившую в качестве новой специальности в свои законные права.
Новая область медицины основана на использовании радиоактивных изотопов. Химические свойства изотопа идентичны с таковыми обычного соответствующего элемента. Имея слишком много или слишком мало нейтронов в ядре, некоторые из изотопов являются радиоактивными, т. е. испускают излучение, которое можно обнаружить с помощью чувствительного прибора, например счетчика Гейгера или сцинтилляционного счетчика. Излучение может состоять из гамма- или альфа -лучей, или из лучей обоих видов. Существуют определенные изотопы, которые используют в радиоизотопной медицине. Выбор радиоактивного нуклида осуществляется со следующими требованиями: низкая радиотоксичность, приемлемый период полураспада (от нескольких минут до нескольких часов), удобное для регистрации гамма – излучение. Радиоактивный нуклид, который тем или иным способом был введен в структуру препарата, выполняет роль его маркера. Излучения радионуклида становятся переносчиками координированной информации от исследуемого пациента к информационно-измерительному комплексу.
Физическая характеристика излучений радионуклида решающим образом предопределяет объем и глубину залегания подлежащего исследованию участка тела. В этом случае радиоактивное излучение, исходящее из организма пациента, в неявном виде несет сведения о функциональном состоянии различных физиологических механизмов и структурно-топографических особенностях различных органов и систем. Наблюдая за особенностями распределения радиоактивного препарата во времени (динамику распределения), либо в выбранном объеме тела (органа), или в целом организме, мы получаем возможность судить о функциональном состоянии органов и систем.
Изучая же характер пространственного распределения, мы приобретаем сведения о стуктурно-топографических особенностях той или иной части тела, органа или системы. Поэтому по своим функциональным свойствам РПФ могут быть разделены на физиологически тропные и инертные. Из чего следует, что первые являются оптимальным средством для проведения структурно – топографических исследований, каждое из которых проводится, начиная с момента установления более или менее стабильного распределения РФП в исследуемом органе или системе. Вторые, которые часто называют индикаторами ” транзита ”, используются главным образом для исследования методами гамма – хронографии.
При этом высокая удельная активность препарата и приемлемая энергия гамма – квантов, испускаемых радионуклидом – меткой, гарантируют хорошие пространственное разрешение, а быстрый распад радионуклидов позволяет проводить серию динамических наблюдений через минимальный интервал времени при отсутствии органного фона от предшествовавшего радионуклидного обследования. Хорошей иллюстрацией использования радиоактивных веществ в медицине является закономерность распределения радиоактивного йода при различных заболеваниях щитовидной железы, проведенные в 1939 г. Гамильтоном.
Известно, что щитовидная железа непременно захватывает весь йод, попадающий в организм, независимо от пути проникновения. Пациенту было предложено принять внутрь раствор 131I, радиоактивность которого была предварительно сосчитана счетчиком Гейгера и принята за 100%. Тем же счетчиком проводились измерения радиоактивности в области щитовидной железы через 2 часа, через 4 часа и через сутки после введения радиоактивного йода.
Таким образом, была эмпирически определена норма накопления препарата в щитовидной железе. Если накопление произошло быстрее, то имеем дело с гиперфункцией щитовидной железы, а если накопление шло медленнее, чем в норме, то с гипофункцией. Этот пример использования радиоактивного индикатора в клинических целях наглядно демонстрирует сущность и возможности радионуклидной диагностики.
Несмотря на использование более совершенных регистраторов излучения, современных радиофармпрепаратов и радиоактивных меток, принцип регистрации и оценки накопления индикатора именно в функционирующей ткани остается неизменным. Радиобиологи утверждают, что малые дозы ионизирующего излучения увеличивают среднюю продолжительность жизни в популяции и стимулируют умственные способности. Люди, работающие в области применения радионуклидов, отличаются неординарностью и быстротой мышления. Поэтому радионуклидная диагностика всегда находилась на передовых рубежах медицинской науки и техники.
Важным этапом развития радионуклидной диагностики стало техническое переоснащение регистрирующей аппаратуры, замена счетчиков Гейгера, характеризующимися длительным временем ионизации и деионизации (т.е. «мертвым» временем), на сцинтилляционные датчики.
Сцинтилляционный датчик представляет собой кристалл соли галогена и щелочного металла (чаще соль KI), активированного 3-х валентным таллием. В середине 50-х годов, с развитием атомной промышленности, появилась возможность производить в достаточных количествах различные радионуклиды, что привело к расширению ассортимента органотропных радиофармпрепаратов. В это же время совершенствовались и радиометрические приборы. Так появилась возможность ввести радиоактивную метку в гиппуровую кислоту, которая традиционно использовалась для определения функционального состояния канальцевого аппарата почек. Для определения функции почек гиппуровую кислоту вводили пациенту и наблюдали динамику ее появление в моче. При введении меченого гиппурана и внешней радиометрии раздельно каждой из почек к датчику двухканального радиометра присоединяли самописец, который регистрировал изменение радиоактивности во времени. Получали две кривые, которые представляли собой суммарный график накопления и выведения препарата каждой из почек – ренограммы. Изменение формы и высоты кривых характеризовали ту или иную патологию.
Описанная методика представляет собой классический случай динамического, так называемого функционального, исследования. Следующим этапом в развитии радионуклидной визуализации стало создание сканера. Было предложено измерять радиоактивность, перемещая датчик радиометра по прямой линии вдоль исследуемого органа, останавливаясь на определенное время счета через равные значения расстояния, при этом получался линейный срез. Далее датчик перемещался на одно значение расстояния перпендикулярно предыдущему передвижению и снова двигался параллельно первой прямой. Подобное движение повторялось последовательно до получения полного изображения проекции органа. Такая совокупность линейных срезов или сканов получила название сканограммы, а метод – сканирование. Создание новых приборов стимулировало создание новых радиофармпрепаратов. Появилась возможность для визуализации на сканере различных органов: щитовидной железы с 131I, печени c 197Au, почек c 169Yb, сердца c 201Tl, легких c 133Xe, поджелудочной железы с 75Se, и т.д. При отсутствии ультразвуковой диагностики и компьютерной томографии радионуклидное сканирование являлось единственным методом визуализации очагового поражения органов и тканей.
Большинство из перечисленных радиофармпрепаратов имело повышенную радиотоксичность, в основном из-за большего периода полураспада (max у 75Se – 121 день). Оптимальным для проведения исследования являлся бы препарат с наименьшим периодом полураспада, идеально несколько часов или минут. Такие препараты практически не могли быть использованы на практике, т.к. для того, чтобы доставить необходимую для введения дозу от производителя до пользователя, приходится вывозить дозы препарата превышающие предельно допустимые уровни во много раз. Эта, на первый взгляд, не имеющая решения проблема была снята с помощью использования генераторов радиоактивных изотопов. Принцип работы генератора основывается на том, что распад некоторых нестабильных элементов заканчивается не образованием стабильного изотопа, а созданием дочернего, нового нестабильного элемента.
В медицинской диагностической практике используются чаще всего две генераторные пары 113Sn – 113mIn и 99Mo – 99mTc. В Росси чаще работают с радиоактивным изотопом 99mTc, имеющим идеальный для сцинтиграфии моноэнергетический спектр гамма излучения 140 кэВ и период полураспада - 6 часов. Для его получения используется 99Mo – период полураспада ~ 7 суток. Технологически 99MoО42– прочно соединяется с сорбентом – окисью алюминия и опускается в стеклянную колонку, заполненную стерильным физиологическим раствором. При этом оксид молибдена (99MoО42–) остается жестко присоединенным к сорбенту, и в результате ?– - распада превращается в водорастворимый оксид технеция (99mTcО42–), который оказывается в растворе в виде пертехнетата натрия – Na+(99mTcO4)–. В медицинское учреждение привозят генератор с находящимся внутри защитного контейнера молибденом 99MoО42–, из которого в течение недели и более, непосредственно на рабочем месте, можно получать соединения технеция 99mTc с периодом полураспада всего 6 часов.
Таким образом, создаются условия для минимальной лучевой нагрузки на пациента. Период полураспада радиоактивной метки всего 6 часов, т.е., если бы препарат вообще не выводился из организма, то через 6 часов его осталась половина, через 12 часов ?, через 18 – 1/8 и через сутки 1/16 часть от введенной дозы – значения близкие к естественному фону.
С учетом биологического выведения препарата (в случае с исследованием почек биологическое полувыведение – 15 минут) лучевые нагрузки на пациента невелики и в большинстве исследований не превышают облучение при флюорографии. [7]Технеций является радионуклидной меткой, общей для различных радиофармпрепаратов. Многие фирмы, в том числе и в России, производят леофилизированные химические наборы для приготовления технециевых радиофармпрепаратов. Большинство из них требует только добавления перхенетата, который после растворения леофилизата жестко соединяется с химическим веществом, тропным для того или иного органа.
Таблица 1
Коллективная эффективная доза и возможный риск отдаленных последствий.
| Вид обследования | Доза, чел-зв./год. | Возможное число дополнительных смертей, случай/год. |
| Рентгенография | 1,03*105 | 1700 |
| Рентгеноскопия | 2,12*105 | 3500 |
| Флюрография | 0,68*105 | 1120 |
| РФП | 0,09*105 | 132 |
| Всего | 3,92*105 | 6452 |
В конце 60-х, начале 70-х годов бурное развитие технологии создания крупных кристаллов, химии полимеров и радиоэлектроники позволили создать качественно новый вид радиометрического прибора – гамма-камеру (см. приложения 1). Проблема заключалась в том, что для ее создания требовался кристалл KI большего диаметра, с тщательно отполированными параллельными стенками, полностью изолированный от воздушной среды. Соль KI является исключительно гигроскопичной, при контакте с воздухом впитывает находящиеся там пары воды, и теряет свои оптические свойства.
Сложность заключалась в создании и напылении на кристалл прозрачной полимерной пленки, коэффициент преломления которой был бы равен коэффициенту преломления кристалла. Поверх кристалла на специальной смазке (для полного оптического контакта) устанавливались фотоэлектронные умножители для регистрации сцинтилляционных вспышек. При попадании гамма-частицы кристалл засвечивается целиком, но с разной интенсивностью, наибольшей в месте попадания частицы. Несложная плечевая электронная схема опроса ФЭУ позволяет определить координаты попадания частицы и вывести их на дисплей прибора. Изображения полученные на гамма-камере получили название сцинтиграмм, а метод – сцинтиграфии.
На первых гамма-камерах регистрация количества частиц происходила за счет длительного «запоминающего» свечения люминофора дисплея. С развитием компьютерной техники все гамма-камеры снабжались компьютерами, где сразу же были созданы программы обработки изображения. Бурное развитие компьютерной техники в 80-е годы привело к созданию новых систем обработки сцинтиграмм, в частности к созданию эмиссионного компьютерного томографа.
Эмиссионный компьютерный томограф представляет собой гамма-камеру, детектор которой имеет возможность вращаться вокруг стола с пациентом, делая несколько кадров под различными углами наклона.
Компьютерная программа реконструирует срезы в любом направлении и любой толщины и дает возможность получить объемное изображение исследуемого органа.
Новейшим достижением развития радионуклидной диагностики стало создание позитронного эмиссионного томографа (ПЭТ). Регистрирующее устройство – детекторы позитронного эмиссионного томографа – по принципу действия мало, чем отличается от регистрирующего устройства обычной 2-х детекторной гамма-камеры. Сам же позитрон сразу же после излучения аннигилирует с электроном, испуская при этом два фотона, двигающихся строго в противоположных направлениях. Регистрируются только те частицы, которые одновременно попали в идентичные координаты обоих детекторов. Это позволяет значительно увеличить разрешающую способность прибора при введении меньших доз радиофармпрепарата., Небольшой период полураспада не позволяет перевозить позитронные радиофармпрепараты на большие расстояния. На позитронном эмиссионном томографе можно исследовать сложные процессы метаболизма, диагностировать новообразования и т.д. (см. приложение 2).
3. Лечение с помощью радиоактивных элементов
Помимо диагностики, ядерная медицина выполняет лечебные функции. Она эффективно используется при лечении некоторых видов рака (лимфомы), раковых болей в костях и базедовой болезни (с использованием радиоактивного йодина). Количество радиоактивного материала, используемого в ядерной медицине, очень мало, поэтому риск облучения не превышает риска от обычной рентгеноскопии. Не следует забывать, что организм человека непрерывно подвергается радиоизлучению от естественных и искусственных источников: воздуха, воды, почвы, скал. Радиоактивны даже атомы человеческого тела, а также многие промышленные товары (например, детекторы дыма, цветные телевизоры, светящиеся знаки "выход" и люминесцентные диски наручных часов). Способ и место применения радиоактивных материалов в ядерной медицине строго нормированы, для диагностического исследования в среднем используется радиоактивная доза в 300 микроБЭР. Это равняется среднему уровню фоновой радиации для жителей США и других развитых стран.
Один из самых ранних случаев ядерной медицины относится к 1946г., когда для исследования щитовидной железы в составе т.н. "атомного коктейля" был впервые применен радиоактивный йод. Радиация уничтожила раковые клетки! Широко распространенное клиническое использование ядерной медицины началось в начале 1950-ых. Первый сканер для ядерной диагностики был введен Бенедиктом Кассеном в 1951 г. В дополнение к лечению рака щитовидной железы, радиоактивный йод, в значительно меньших дозах, использовался чтобы исследовать функционирование щитовидной железы и диагностировать связанные с ней заболевания. По мере углубления научных знаний об основных биохимических процессах развивались методы использования радиоактивных версий определенных элементов, чтобы "проследить" эти метаболические процессы, и это стало вехой в развитии диагностической медицины. В 1960-ых годах наблюдался беспрецедентный рост популярности ядерной медицины как самостоятельной специализации. К 1970-ым ядерная медицина получила доступ к большей части органов, включая печень, локализацию опухоли головного мозга, и исследования желудочно-кишечного тракта. В 1971 американская Медицинская Ассоциация официально признала ядерную медицину как медицинскую специальность. В 1980-ых были разработаны радиоактивные медицинские препараты для таких критических диагнозов как сердечная болезнь и рак. Основным методом лечения онкологических заболеваний является лучевой метод.Как самостоятельный метод может применяться при лечении рака кожи, нижней губы, слизистых оболочек полости рта, гортани, рака шейки матки, лимфосарком, злокачественных опухолей носоглотки, миндалин, лимфогранулематоза. Однако при этих локализациях возможны разные сочетания и применение других методов в зависимости от распространения процесса. При других локализациях и гистологических формах злокачественных опухолей лучевое лечение сочетается с хирургическими и химиотерапевтическими методами.Метод предусматривает применение различных источников ионизирующего излучения. Облучение является не только ведущим методом консервативного лечения многих опухолей, но применяется как важный компонент комбинированного лечения. В качестве основного и радикального метода лучевая терапия применяется для лечения ранних стадий рака кожи, губы, языка, гортани, шейки матки. Неоперабельным больным лучевую терапию назначают в сочетании с лекарственным лечением. Используют различные источники облучения.Лучевое лечение осуществляется рентгеновскими лучами и гамма-лучами радиоактивных элементов. Достижения современной физики позволили значительно усовершенствовать метод лучевого лечения, оснастив лечебные учреждения аппаратами сверхвысокого напряжения, дающими жесткие лучи высокой проникающей активности (бетатрон, линейные ускорители). Искусственные радиоактивные элементы, заменив дорогостоящий радий, позволили широко внедрить этот наиболее эффективный вид лучевого лечения. Такие аппараты имеют мощный заряд радиоактивного изотопа кобальта. Радиоактивным цезием заряжены короткофокусные гамма-установки. Лечение радиоактивными изотопами производится не только воздействием заряда на расстоянии (дистанционного), но и путем непосредственного введения радиоактивного элемента в ткань опухоли или около нее в виде радиоактивных игл, зерен или жидких изотопов. В настоящее время разработаны шланговые аппараты, позволяющие производить внутриполостное облучение. Например, облучение шейки, цервикального канала матки при поражении их раковым процессом. [2]Широко внедрено лечение жидкими изотопами: радиоактивным йодом при раке щитовидной железы, радиоактивным фосфором при лечении костной системы и при заболевании кроветворной системы.Сочетание наружного облучения с внутритканевым или внутриполостным, рентгенотерапии с телегамматерапией часто повышает эффективность лечения. Такой метод лучевого лечения называется сочетанно-лучевой терапией. Методика лучевого лечения, а также величины разовых и суммарных очаговых доз определяются задачами лечения, локализацией, распространением опухолей и ее гистологической структур.Дистанционные методы лучевой терапии осуществляются статической и подвижной гамма-терапией, которая проводится установками типа "Луч" и "Рокус". Гамма-излучение образуется при торможении электронов (бетатрон, линейный ускоритель). Контактные методы облучения. К ним относятся внутриполостная, радиохирургическая, аппликационная, близкофокусная рентгенотерапия, метод избирательного накопления изотопа.
Сочетанные методы лучевой терапии. Осуществляются сочетанием одного из способов дистанционного и контактного облучения.
Рентгенотерапия: статическая (открытыми полями через свинцовую решетку), подвижная - ротационная, маятниковая, тангенциальная.
Применение указанных методов зависит от локализации и морфологической структуры опухоли, стадии заболевания и общего состояния больного. Все виды ионизирующих излучений (альфа- и бета-частицы, нейтроны, протоны, рентгеновское или гамма-излучение) вызывают однотипное, но различное по степени ионизации действие.
Биологическая эффективность зависит от вида излучения, плотности ионов, распределения их вдоль пути пробега ионизирующей частицы. Радиобиологический эффект зависит от площади облучения, дозы и вида излучения, фактора времени, метода терапии и индивидуальной чувствительности больного.Измерение величины рентгеновского или гамма-излучения производят экспозиционной дозой Р (рентген) и поглощенной дозой (рад). В клетке ионизирующее излучение действует на молекулу ДНК, что приводит к гибели клетки. Ионизирующее излучение в результате радиолиза воды оказывает токсическое воздействие с нарушением всех видов обмена.
Терапевтическая активность лучевого лечения во многом зависит от стадии митотического цикла. Высокой радиочувствительностью обладают гематосаркомы, эмбриональные опухоли (семиномы), мелкоклеточный низкодифференцированный рак. Радиочувствительны плоскоклеточный рак кожи, рак ротоглотки, пищевода, мочевого пузыря. Средней чувствительностью обладают сосудистые и соединительнотканные опухоли, низкой - аденокарциномы молочной железы, почек, печени, поджелудочной железы, ободочной кишки. Очень низкой чувствительностью обладают опухоли из нервной и мышечной тканей (рабдомиосаркомы, леомиосаркомы).
В зависимости от режимов облучения различают:
· одномоментное облучение;
· непрерывное облучение (доза 5000-6000 рад);
· фракционно-дробное облучение при дистанционной гамма-терапии.
· Лучевая терапия противопоказана при:
· общем тяжелом состоянии больного;
· обширном поражении опухолью с распадом, кровотечением, прорастанием в сосуды, полые органы, множественными метастазами;
· активном туберкулезе легких, инфаркте миокарда, сердечно-сосудистой недостаточности, диабете;
· выраженной анемии, лейкопении;
· острых или хронических лучевых повреждениях.
Лечение опухолей производят естественными и искусственными радиоактивными элементами. Из естественных элементов наибольшее применение нашел радий (продукт промежуточного распада урана). Из искусственных радиоактивных элементов применяются радиоактивное золото, радиоактивный фосфор, радиоактивный йод. Радиоактивные изотопы используются в виде аппликаций, сделанных из пластмассы, содержащей соответствующий изотоп, и нанесенных на пораженную ткань при помощи специальных платиновых игл.Лучевое лечение может быть радикальным, если применяется полная доза облучения, и паллиативным при небольшой дозе.
Лечение с помощью радиоактивного йода требуется для контроля за возможными изменениями в органах и системах, связанными с болезнью щитовидной железы.Радиоактивный йод (I131) - радиоактивная форма йода, которая используется для того, чтобы обследовать и лечить различные заболевания щитовидной железы человека.
Йод - это элемент, необходимый для нормальной работы щитовидной железы. Она расположена у основания шеи, по передней поверхности, и участвует в процессах обмена практически всех жизненно важных органов и систем организма. Подобно обычному йоду, радиоактивный йод проникает и накапливается в клетках щитовидной железы. Это позволяет использовать его в тестировании, диагностике и лечении заболеваний щитовидной железы. Лечебный эффект основан на радиоактивности I131, который облучает изнутри всю железу бета- и гамма-излучением. 90% терапевтического эффекта обусловлено именно бета-излучением с пробегом радиоактивных частиц в 2-3 мм. Радиоактивность уничтожает как клетки железы (остатки самой ткани), так и опухолевые клетки, распространившиеся за её пределы. Лечение проходит практически безболезненно.
Данное лечение назначается пациентам, подвергшимся оперативному удалению щитовидной железы. После операции тиреоидные гормоны не назначаются. Через 4 недели больному вводится радиойод. Возможные остатки ткани щитовидной железы и опухолевые клетки обладают способностью захватывать йод и накаливают его. Через сутки после приёма капсулы радиойода на специальном аппарате, представленном на фотографии ниже, с области шеи получают информацию о наличии или отсутствии функционирующей ткани. Сразу же производится обследование на гамма-камере с целью визуального определения места возможного расположения ткани. Если тест положительный, то в дальнейшем необходимо проведение радиойодтерапии. Последняя также проводится по данным других обследований о распространенности Вашего заболевания (ультразвуковым, рентгенологическим, лабораторным).Прием радиоактивного йода обычно осуществляется через рот, путем проглатывания обычного вида и размеров желатиновых капсул, содержащих сам радиоактивный элемент. Капсулы без вкуса и запаха проглатываются, не разжевывая, и запиваются одним - двумя стаканами воды (не сока). В исключительных случаях, возможно, Вам будет предложена жидкая форма радиойода с аналогичными характеристиками. В этом случае после приема необходимо хорошо прополоскать полость рта водой, а последнюю сразу выпить. Если Вы носите съемные зубные протезы, скорее всего Вас будут просить удалить их перед приемом жидкого йода. Широко применяется в терапевтической медицине радиоактивный газ ксенон. Кроме общеизвестного его использования, как анестетика при хирургических операциях, газ применяется при обследованиях мозга. Ксенон сильно поглощает рентгеновское излучение и помогает найти места поражения. При этом он совершенно безвреден. Поэтому ксеноном пользуются при рентгеноскопических обследованиях головного мозга. Радиоактивный изотоп элемента №54, ксенон-133, используют при исследовании функциональной деятельности легких и сердца. Проводятся исследования для использования ксенона в качестве лекарства.
Экперименты показали, что инертный газ ксенон помогает уменьшить последствия инсультов, мозговых травм и других поражений, которые вызывают омертвение нервных тканей. Как обнаружили биофизики из Имперского колледжа в Лондоне, ксенон способен блокировать работу рецепторов, управляющих нервными клетками, и предотвратить их гибель. Специфическое действие ксенона было обнаружено в ходе испытаний новых средств анестезии. Профессор Имперского колледжа Мервин Мейз, работающий анестезиологом в госпитале Челси и Вестминстера (Лондон) считает, что это поможет создать эффективные средства для борьбы с поражениями нервной системы. Хотя такой метод не позволяет восстановить нервные клетки, но он позволит сохранить их и создать условия для последующего лечения. Профессор Ник Френк, обнаруживший это действие ксенона, считает, что этот инертный газ неплохой кандидат на роль лекарственного средства, поскольку он входит в наше природное окружение и не токсичен.
Имперский колледж выступил учредителем компании Protexeon, которая займется разработкой клинических применений ксенона совместно с фирмой Air Products and Chemicals Inc.Ксенон применяется при лечении наркомании. Использование ксеноновой терапии позволяет сократить срок снятия абстинентного синдрома (болезненное состояние, появляющееся при употреблении наркотиков и алкоголя) в 1,5 – 2 раза по сравнению с применяемыми в настоящее время методами. Процент лиц, не употребляющих наркотики после прохождения полного курса ксеноновой терапии (включая реабилитацию) и находящихся под наблюдением в течение одного года, составил не менее 50% (на базе около 60 больных). Пациент становится практически здоровым человеком. Применение ксенона в комплексной терапии опийной наркомании позволяет успешно преодолевать негативные и болезненные проявления абстинентного синдрома, при этом:
· уменьшает проявления вегетативных нарушений;
· купирует болевой синдром;
· нормализует сон у больных, даже в варианте монотерапии или с минимальной фармакологической нагрузкой;
· в 1.5-2 раза уменьшает время снятия абстинентного синдрома, значительно уменьшает фармакологическую нагрузку.
Применение данного метода позволяет эффективно лечить не только абстинентный синдром, но и постабстинентное состояние при опийной наркомании, особенно у больных, имеющих нарушения функции печени и непереносимость специфических фармпрепаратов, используемых при терапии наркотической зависимости.
Широкое применение газ ксенон получил в анестезиологии.Ученые медики давно искали оптимальный вариант анестетика возможность проведения полноценного и безопасного наркоза. Первое сообщение в наркотических свойствах ксенона принадлежит наличие русскому ученому Н.В.Лазареву. В 1946 году он экспериментально подтвердил наличие у ксенона наркотических свойств.
10 ноября 2004 года, через 58 лет после сообщения Лазарева, в Томском НИИ онкологии прошла показательная операция для анестезиологов России. Ведущий анестезиолог страны Николай Буров и его томские коллеги продемонстрировали, как можно вместо обычного наркоза использовать газ ксенон. В операционной Томского НИИ онкологии необычно много врачей. Они приехали учиться в Томск из разных регионов России. На операционном столе – женщина. Хирурги-онкологи проводят удаление молочной железы. Операция, казалось бы, одна из немногих, только наркоз используется с применением ксенона. Именно академик Николай Буров стал основоположником ксенонового наркоза. Понадобилось 8 лет, чтобы газ попал в операционные.
Развитие ксеноновой анестезии долгое время сдерживали дефицит, дороговизна и отсутствие директивных фармакопейных документов. Но и признанный в начале ХIХ века общий наркоз из хлороформа или закиси азота с эфиром больные переносили плохо.Однако недавно немецкие ученые из Университета Ульма (University of Ulm) сумели создать устройство, позволяющее использовать газ повторно. Отработанная наркозная смесь закачивается под давлением в сосуд, где охлаждается до нуля градусов, объясняет Томас Арцт. При этом кислород и азот остаются в виде газов, а ксенон снижается, и его легко выделить из смеси и пустить в ход по второму кругу. Наши ученые изобрели другой способ повторного использования ксенона, но об этом Ксенон расскажет чуть позже.
Помимо безопасности для окружающей среды, медики отмечают, что ксенон в качестве наркозного средства почти не дает побочных эффектов (но только у взрослых), сокращает период нахождения больных в реанимации после тяжелых операций, в том числе операций на сердце. Кроме того, ксенон не вредит здоровью медперсонала так сильно, как другие газы, используемые для наркоза.
В настоящее время анестезиологи почти отказались от взрывоопасных и токсичных веществ, таких как эфир и циклопропан. Вместо них используются галогенизированные углеводороды, которые тем не менее оказывают негативное влияние на воздух в операционной, а, попадая в атмосферу, вызывают парниковый эффект и разрушают озоновый слой. Только в Германии во время хирургических операций в окружающую среду ежегодно выделяется 40 миллионов литров галогенизированных углеводородов.
Исполнилось 105 лет с момента открытия инертного газа ксенона (1898) и 50 лет его первого клинического применения в качестве средства для наркоза (1951). Ограниченные запасы ксенона (Хе) в мире и высокая стоимость газа являлись в прошлые годы главными причинами замедленного его распространения в клинической анестезиологии. Не менее важной задачей остается задача реального снижения стоимости медицинского ксенона, цена на который достигает ныне шести долларов. Даже при бережном расходе этого газа на двухчасовую анестезию потребуется 15-20 литров ксенона (75 - 120 долларов).
Однако, бурный рост промышленного производства и научно-технического процесса второй половины ХХ века привели к тому, что уже не дефицит и высокая стоимость ксенона стали сдерживать клиническое применение ксенона, а отсутствие нормативно-правовой базы для его широкого использования. Этот вопрос не решен пока во всех странах, за исключением России. Нами впервые в мире выполнен весь комплекс доклинических и клинических испытаний ксенона в соответствии с высокими требованиями Фармкомитета и приказом министра здравоохранения РФ от 8.10.1999 г № 363 инертный газ ксенон (Хе) разрешен к медицинскому применению в качестве средства для наркоза.
Таким образом, Россия стала первой страной мира, в которой успешно заложена нормативно-правовая основа для ксеноновой анестезии и созданы реальные условия для более широкого клинического применения этого великолепного анестетика. Увеличено годовое производство ксенона в стране и созданы запасы этого газа в достаточных объемах. Успешно налаживается производство наркозной и газоаналитической аппаратуры по ксеноновой анестезии, составлены и утверждены учебный план и программа тематического усовершенствования по технологии ксенон-сберегающей анестезии на базе кафедры анестезиологии и реаниматологии РМАПО. Издана первая в мире монография «Ксенон в анестезиологии».М.Пульс.2000. С применением ксенона в клинической практике открывается новая страница в истории отечественной анестезиологии.
У ксеноновой анестезии имеется потенциальный резерв снижения стоимости за счет применения способа рециклинга (газ, выдыхаемый из наркозного аппарата, утилизируется путем адсорбции специальным устройством (блок адсорбера), который после заполнения подвергается температурной десорбции, очищенный ксенон возвращается потребителю для повторного использования, что резко снижает стоимость и дефицит ксеноновой анестезии), чего нет у перечисленных анестетиков. Кроме того, окислы закиси азота и радикалы углерода при использовании галогеносодержащих жидких анестетиков, рассеиваются в окружающей среде и представляют экологическую опасность.
Ксенон может быть применен в качестве средства анестезии при различных хирургических операциях, болезненных манипуляциях, снятия болевого приступа и лечения болевых синдромов. Он применяется в масочном или и в эндотрахеальном варианте как в виде мононаркоза, так и в виде комбинированной анестезии в сочетании с различными внутривенными седативными средствами, наркотическими и ненаркотическими аналгетиками, нейроплегиками, транквилизаторами, ганглиолитиками и другими средствами. Практически ксенон может применяться в качестве анестетика в тех же ситуациях, что и закись азота: в общей хирургии, урологии, травматологии, ортопедии, неотложной хирургии, особенно у больных с сопутствующими заболеваниями сердечно-сосудистой системой, находящихся в группе высокого риска.
Незаменим ксенон при операция в нейрохирургии центральной и периферической нервной системы в особенности при использовании микрохирургической техники когда необходим словесный контакт с пациентом для дифференциации чувствительных и двигательных пучков при операциях на нервных стволах, в детской хирургии в масочном и эндотрахеальном вариантах, в акушерстве и оперативной гинекологии (оперативное родоразрешение, аборты, расширенные операции в гинекологии, диагностические исследования, обезболивание родов), при болезненных манипуляциях, перевязках, биопсиях, обработке ожоговой поверхности, с лечебной целью при снятии болевого приступа (при травматическом шоке, при стенокардии, инфаркте миокарда, почечной и печеночной колике), а также при моторной афазии, лечении дизартрии, снятия эмоционального стресса и других функциональных неврологических расстройств.
Ксенон может быть использован как в варианте мононаркоза при сохранении спонтанного дыхания, так и в сочетании с различными внутривенными средствами анестезии.
Противопоказаний к ксенону не установлено, однако, применение ксенона в качестве анестетика, возможно лишь при наличии сертифицированной аппаратуры и специалиста врача-анестезиолога-реаниматолога, прошедшего специальную подготовку по «технологии ксенон – сберегающей анестезии»
4. Инновации в сфере использования радиоактивных элементов в медицине
4.1 Понятие инновации
Инновация — нововведение в области техники, технологии, организации труда или управления, основанное на использовании достижений науки и передового опыта, обеспечивающее качественное повышение эффективности производственной системы или качества продукции.
Понятие инновация относится как к радикальным, так и постепенным (инкрементальным) изменениям в продуктах, процессах и стратегии организации (инновационная деятельность). Исходя из того, что целью нововведений является повышение эффективности, экономичности, качества, удовлетворенности клиентов организации, понятие инновационности можно отождествлять с понятием предприимчивости — бдительности к новым возможностям улучшения работы организации (коммерческой, государственной, благотворительной).
Всякое инновационное развитие – это не только основной инновационный процесс, но и развитие системы факторов и условий, необходимых для его осуществления. Переход России на инновационный путь развития важен и для научно-технической сферы, и для повышения конкурентоспособности отечественной экономики. При этом развитие инновационной сферы было провозглашено на государственном уровне в качестве важнейшей стратегической задачи.
Потребность в инновациях возникает под воздействием как внешних, так и внутренних факторов. К внешним относятся: конкурентная борьба, задачи завоевания новых рынков, изменение политической, демографической, правовой ситуации и пр.; к внутренним: неблагоприятные условия труда, рост производственных затрат.
4.2 Элемент с радиоактивным веществом и способ его производства
Настоящее изобретение относится к радиотерапии. Конкретнее, изобретение относится к радиоактивным источникам в брахитерапии и способам подготовки этих источников.Брахитерапию предложено использовать для лечения различных состояний, включая артриты и рак, например рак груди, мозга, печени, яичников и в особенности рак простаты у мужчин. Радиоактивный источник находится вблизи участка тела, подвергаемого лечению. Достоинством последнего является то, что высокая доза радиации достигает участка лечения, а окружающие и здоровые ткани при этом получают сравнительно малые дозы радиации.
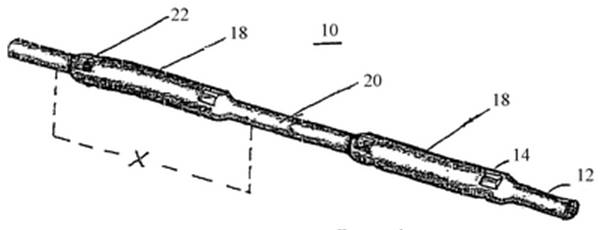
Рис. 1.Элемент с радиоактивным веществом.
Представленное изобретение, как показано на рис.1. является элементом 10 с радиоактивным веществом для использования в брахитерапии. Элемент 10 с радиоактивным веществом включает удлиненный биоабсорбируемый носитель 12 с размещенными в нем через промежутки радиоактивными источниками 14. В одном варианте осуществления представленного изобретения элемент 10 с радиоактивным веществом образуется формованием. Далее, в представленном изобретении рассматривается, что носитель 12 является, в основном, сплошным.Как показано на рис.3.1. носитель 12 включает множество участков 18 размещения зерен и промежуточных участков 20. Носитель 12 может определять наличие одного или более отверстий 22, образованных в результате процесса формования в соответствии с представленным изобретением, в которых расположены маленькие стержни. Эти стержни находятся на любом из концов участков 18 размещения зерен, чтобы сохранять и регулировать положение радиоактивных источников 14 внутри носителя 12.Элементы с радиоактивным веществом в соответствии с данным изобретением могут быть использованы для лечения различных заболеваний, включая рак головы и шеи (включая рак полости рта, губ и языка), опухоли мозга, опухоли легких, опухоли шейки матки, вагинальные опухоли и рак простаты. Они могут использоваться как первичное лечение (например, при лечении рака простаты или неоперабельных опухолей) или для лечения остаточных явлений после удаления первичной опухоли. Они могут быть использованы совместно с другими методами лечения или при завершении других курсов лечения, например лучевой терапии, химиотерапии или гормонотерапии. [8]
4.3 Устройство для разделения радиоактивных элементов, обладающих различной способностью к образованию амальгам
Изобретение относится к устройствам для разделения и глубокой очистки радиоактивных элементов, обладающих различной способностью к образованию амальгам, и может найти применение в радиохимической промышленности для выделения радиоактивных изотопов, используемых в медицине, в аналитической химии для выделения анализируемого элемента. Изобретение содержит полупротивоточное устройство для разделения радиоактивных элементов, обладающих различной способностью к образованию амальгам, методом цементации одного из элементов, электролизную, разделительную и регенерационные ячейки, расположенные вертикально одна под другой, снабженные мешалками, расположенными на одном валу, емкость для сбора регенерированной ртути и транспортирующим шнеком, плотно посаженным в трубу и вращающимся вместе с трубой, а ртуть перемещается из ячейки в ячейку через гидрозатворы под действием силы тяжести. Техническим результатом заявленного изобретения является работа дистанционно управляемого устройства в условиях радиационно-защитных камер.
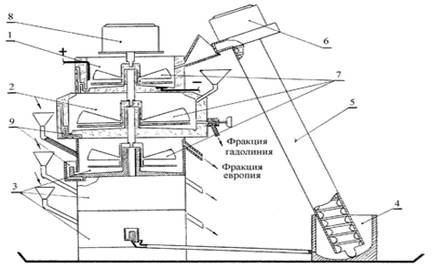
Рис.2.Устройство для разделения радиоактивных элементов
Устройство для разделения радиоактивных элементов, обладающих различной способностью к образованию амальгам, представленное на чертеже, состоит из электролизной ячейки 1, разделительной ячейки 2, регенерационных ячеек 3, емкости для сбора ртути 4, транспортирующего шнека 5, привода шнека 6, мешалок 7, с электроприводом 8 и гидрозатворов 9.Образование амальгамы натрия происходит в электролизной ячейке под действием электрического тока. Анодом служит платиновое кольцо, расположенное в растворе натриевой щелочи, постоянно протекающей через ячейку, ртуть является катодом. Дозирование ртути в электролизную ячейку осуществляется транспортирующим шнеком, плотно посаженным в трубу и вращающимся вместе с трубой с помощью отдельного привода. При вращении шнека ртуть поднимается по винтовой канавке и поступает в электролизную ячейку. Концентрация образующейся амальгамы в ячейке регулируется скоростью вращения шнека и силой тока.
Амальгама натрия заданной концентрации из электролизной ячейки перетекает через гидрозатвор в разделительную ячейку, расположенную под электролизной. В разделительную ячейку заливают водный раствор разделяемых элементов такого состава, при котором амальгама натрия восстанавливает только один элемент, оставляя другой в ионном виде. Образовавшаяся в результате этого процесса амальгама поступает через гидрозатвор в регенерирующие ячейки, расположенные под разделительной ячейкой.
Из регенерационных ячеек очищенная ртуть поступает в сборник ртути и далее шнеком в электролизную ячейку. Таким образом, элемент, обладающий большей способностью к образованию амальгамы, выводится из системы с регенерирующим раствором в отдельную фракцию. Второй разделяемый элемент остается в неподвижной водной фазе в разделительной ячейке и по окончании процесса извлекается из нее. [9]
Заключение
Применение радиоактивных элементов оказывает огромное значение в достижениях современной медицины. Радиоактивные элементы нашли широкое применение как в диагностике, так и в лечении различных заболеваний.
В настоящее время с помощью радионуклидной диагностики можно исследовать практически любой орган или ткань организма, а некоторые из них несколькими способами. При четко поставленной задаче и непрерывно действующей обратной связи между врачом-радиологом и врачами клинических отделений, возможности радионуклидной диагностики практически безграничны, а помощь в постановке сложных диагнозов неоценима. В развитых странах удвоение числа радионуклидных обследований происходит каждые 3 – 5 лет.
В немалой мере этому способствует внедрение в медицинскую практику этих стран исследований РФП 99 m Tc, а также короткоживущих циклотронных радио нуклидов (67 Ga, 111 In, 113 I, 201 Tl)и ультракороткоживущих позитроноизлучающих радионуклидов (11 C,13 N, 15 O, 18 F).Число обследованных с помощью методов радионуклидной диагностики составило в расчете на 1000 человек населения в Канаде – 59, в США – 32, в Австрии – 18, в Японии и Швеции – 15, в Англии – 10, и в России – 7 [8]В США в 1990 году было проведено 10 млн. диагностических процедур с радионуклидами.
Количество процедур по изучению перфузии Миокарда с 201 Tl увеличилось с 700 000 в 1988 году до 1 000 000 в 1989 году и до 1 300 000 в 1990 году.В нашей стране до последнего времени РФП с 99 m Tc применялись только у 15% пациентов, тогда как меченные 131 I и 198 Au препараты, создающие значительные дозы облучения - у 80%. В коллективной дозе, вызванной применением радионуклидов в диагностике в нашей стране, препараты на основе 131 I обеспечивают 20 – 30% облучения почек и печени, 40 – 50% облучения всего тел. В настоящее время радиоактивные генераторы практически вытеснили другие радиоактивные изотопы из клинической практики.
Развитие химии радиофармпрепаратов идет по пути создания новых наборов для 99mTc. За прошедшие несколько лет в России прошли клинические испытания и допущены к применению препараты Российского производства: 99mTc-макротех – для исследования легочного кровотока, 99mTc-теоксим – для исследования перфузии головного мозга, 99mTc-технетрил – для исследования перфузии миокарда.
Практически завершены клинические испытания препарата 99mTc-глюкорат, который является маркером некроза и может быть использован для визуализации инфарктных зон сердца. Использование радиофармацевтики лицензировано администрацией США. Предусмотрены программы по обучению физиков, фармацевтов и радиохимиков, работающих в этой области. На данный момент в США существует около 5 000 центров ядерной медицины, производящих порядка 18 млн. процедур ежегодно. Примерно столько же процедур выполняется центрами ядерной медицины, существующими в других странах мира. Их количество непрестанно растет. Благодаря тесному сотрудничеству ученных разных стран мировая медицина добилась существенного прогресса в области применения радиоактивных элементов.
Список используемых источников
1. Куренков, Н.В. Радионуклиды в ядерной медицине [Текст] : справочное издание / Н.В. Куренков, Ю.Н. Шубин ; под общ ред. Н.В. Куренкова. – Обнинск.: ФЭИ, 1998. – 163с.
2. Звонов, И.А. Лучевые нагрузки от радиофармацевтики[Текст] / И.А. Звонов, - М.: Атоминформ, 1999. – 237с.
3. Трофимова, Т.И. Справочник по физике[Текст] : справочное издание / Т.И.Трофимов, - М.: Издательский дом «Дрофа», 2001. -208с.
4. Жданов, В.М. Тайны разделения изотопов[Текст] / В.М. Жданов. – М.: МИФИ, 2004. – 38с.
5. Чазова, Е.И. Неотложные состояния и экстренная медицинская помощь [Текст] : справочное издание / Е.И. Чазова. - М.: Медицина, 1997. – 78с.
6. Воробьёва, А.И. Справочник практического врача [Текст] : справочное издание / А.И.Воробьёв. – М.: Медицина, 2001. – 107с.
7. Яблоков, В.А. Миф о безопасности малых доз радиации [Текст] / В.А. Яблоков // Гражданская инициатива. – 2000. – №1. – С. «23–25.
8. Пат. 2277953 Российская Федерация, МПК A 61 N 5/10, A 61 M 36/00. Элемент с радиоактивным веществом и способ его производства [Текст] / Рэйпач Майкл, Хелл Кевин, Рид Джей. ; заявитель и патентообладатель МЕДИ-ФИЗИКС, ИНК. – 2003112010/14 ; заявл. 01.11.2001 ; опубл. 20.06.2006, Бюл. №17. – 20 с. : ил.
9. Пат. 2294314 Российская Федерация, МПК C 01 G 56/00, C 01 А 17/00. Устройство для разделения радиоактивных элементов, обладающих различной способностью к образованию амальгам [Текст] / Андрейчку Н.Н., Андреев В.П., Лебедев В.М; заявитель и потентообладатель Федеральное государственное унитарное предприятие "Государственный научный центр Российской Федерации - Научно-исследовательский институт атомных реакторов". – 2005103870/06 ; заявл. 14.02.2005 ; опубл. 27.02.2007, Бюл. №6. – 6 с. : ил.
Приложение
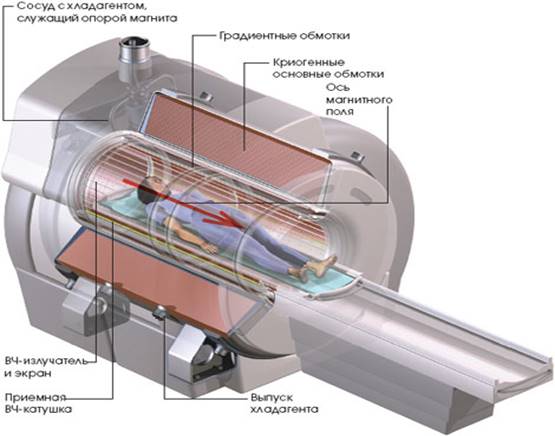
Рис. 3. Позитронно-эмиссионный томограф (ПЭТ)
Похожие рефераты:
Ядерная опасность. Семипалатинский полигон
Безопасность жизнедеятельности и охрана труда
Общие вопросы радионуклидной диагностики
Экологические катастрофы и их последствия
Ядерная безопасность в постсоветском Казахстане
Ядерные исследования в странах Латинской Америки
Радиационная безопасность при эксплуатации и ремонте оборудования Курской АЭС
Порядок переработки животных в условиях чрезвычайных ситуаций
Миграция радионуклидов стронция-90 в почвах различных типов Павлодарской области
Таможенный контроль делящихся и радиоактивных материалов
Аккумулирование радионуклидов растениями лесных фитоценозов
Особенности работы счетчиков излучения
Теория безопасности жизнедеятельности
Химия, элементы таблицы Менделеева
Проблемы захоронения радиоактивных отходов в геологических формациях
Анализ методики проведения санитарно-экологического состояния объекта